Оформление лаборат. работ по химии. Инструкция по технике безопасности при работе студентов в лаборатории химии Формы отчётов по лабораторным работам
 Скачать 0.65 Mb. Скачать 0.65 Mb.
|
Сложные неорганические соединения делятся на следующие классы: ___________________________________________________________________________________________________________________________________________________________________________________________.Оксиды – это __________________________________________________________________ ____________________________________________________________________________________. Оксиды бывают солеобразующие и несолеобразующие. Солеобразующие оксиды делят на _____________________________________________________________________________________ Гидроксиды – это _______________________________________________________________ ____________________________________________________________________________________. Основания – это ________________________________________________________________ ____________________________________________________________________________________. С точки зрения электролитической диссоциации общие свойства оснований обусловлены ионами____________________ NaOH = _____________________ (кислотность равна___________) Mg(OH)2 ⇄ ____________________ (кислотность равна_____) Основания делят на ___________________________________________________________________ Водные растворы оснований изменяют окраску индикаторов. В присутствии оснований универсальная индикаторная бумага окрашивается в _________________ цвет, фенолфталеин становится ____________________, метиловый оранжевый − ______________________. Кислоты – это __________________________________________________________________ ____________________________________________________________________________________. С точки зрения электролитической диссоциации общие свойства кислот обусловлены ионами _____________________. H2CO3 ⇄ ______________________ (основность кислоты равна___________). По наличию или отсутствию атомов кислорода в молекуле кислоты делят на __________________ ____________________________________________________________________________________. В растворах кислот некоторые индикаторы меняют свою окраску: лакмус становится __________________, универсальная индикаторная бумага –________________, метиловый оранжевый – __________________. Амфолиты (амфотерные гидроксиды) – это _________________________________________ ____________________________________________________________________________________. Соли – это _____________________________________________________________________ _____________________________________________________________________________________ Средние соли – _______________________________________________________________________ ____________________________________________________________________________________. Уравнения диссоциации средних солей можно записать следующим образом: K3PO4 = _______________________________ NH4Cl = _______________________________ Название солей по международной номенклатуре: K3PO4 – _____________________________________________________________________________ NH4Cl – _____________________________________________________________________________ Кислые соли – ________________________________________________________________________ ____________________________________________________________________________________. Уравнение диссоциации кислых солей: NaHCO3 = ___________________________________ Название соли по международной номенклатуре __________________________________________ ____________________________________________________________________________________. Основные соли – _____________________________________________________________________ ____________________________________________________________________________________. Диссоциация основной соли выражается уравнением: MgOHCl = __________________________________ Название соли по международной номенклатуре __________________________________________ ____________________________________________________________________________________. Смешанные соли – ____________________________________________________________________ ____________________________________________________________________________________. Диссоциация смешанной соли выражается уравнением MgNO3Cl = __________________________________ Название соли по международной номенклатуре __________________________________________ ____________________________________________________________________________________. Двойные соли – ______________________________________________________________________ ____________________________________________________________________________________. Диссоциация двойной соли выражается уравнением: NaKSO4 = ____________________________________ Название соли по международной номенклатуре___________________________________________ ____________________________________________________________________________________. Экспериментальная часть Опыт 1. Получение оксидов Напишите уравнения реакций получения гидроксида меди (II) и оксида меди (II): 1.___________________________________________________________________________________ 2.___________________________________________________________________________________. Запишите наблюдения: 1.__________________________________________________________________________________ 2.___________________________________________________________________________________ Вывод: (какой способ получения оксида использовали) __________________________________ _____________________________________________________________________________________ _____________________________________________________________________________________ _____________________________________________________________________________________ ____________________________________________________________________________________. Опыт 2. Свойства кислотных оксидов и получение кислых солей Напишите уравнения реакций, которые последовательно наблюдаете при пропускании диоксида углерода (из аппарата Киппа) через раствор гидроксида кальция: образование углекислого газа, образование средней соли, а затем кислой соли: 1.___________________________________________________________________________________ 2.___________________________________________________________________________________ 3.___________________________________________________________________________________. Запишите наблюдения: 1.___________________________________________________________________________________ 2.___________________________________________________________________________________ 3.___________________________________________________________________________________. Напишите названия полученных солей______________________________________________ ____________________________________________________________________________________. Вывод: (какое свойство кислотных оксидов изучили, какой способ получения кислой соли использовали)__________________________________________________________________________ ___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________. Опыт 3. Получение оснований Напишите уравнение реакции взаимодействия натрия с водой ____________________________________________________________________________________. Что наблюдаете при добавлении фенолфталеина? ___________________________________ _____________________________________________________________________. Вывод: (какой способ получения основания использовали)___________________________________ ___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________. Опыт 4. Свойства кислот Напишите уравнение реакций взаимодействия карбоната кальция с соляной или разбавленной азотной кислотой: _____________________________________________________________________________________ Запишите наблюдения: _________________________________________________________. Вывод: (какое химическое свойство кислот наблюдали)_____________________________________ __________________________________________________________________________________________________________________________________________________________________________ _________________________________________________________________________________________________________________________________________________________________________. Опыт 5. Получение и свойства амфотерных гидроксидов Напишите уравнения реакций получения гидроксида цинка (II) и уравнения, доказывающие его амфотерность: 1.___________________________________________________________________________________ 2.___________________________________________________________________________________ 3.___________________________________________________________________________________ Запишите наблюдения: 1.___________________________________________________________________________________ 2.___________________________________________________________________________________ 3.___________________________________________________________________________________ Вывод: (каким способом получали гидроксид и какие свойства амфотерных гидроксидов наблюдали)_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________. Опыт 6. Получение и свойства средних солей Напишите уравнения реакций средних солей: 1.___________________________________________________________________________________ 2.___________________________________________________________________________________ 3.___________________________________________________________________________________. Запишите наблюдения: 1.___________________________________________________________________________________ 2.___________________________________________________________________________________ 3.__________________________________________________________________________________. Напишите названия полученных солей: 1.___________________________________________________________________________________ 2.___________________________________________________________________________________ 3.__________________________________________________________________________________. Вывод: (какие свойства солей наблюдали, почему реакции идут до конца?)______________________ ___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________. Опыт 8. Получение основных солей Напишите уравнения реакций получения основной соли (назовите ее) и её взаимодействие с щёлочью и кислотой: 1.___________________________________________________________________________________ 2.___________________________________________________________________________________ 3.___________________________________________________________________________________. Запишите наблюдения: 1.___________________________________________________________________________________ 2.___________________________________________________________________________________ 3.___________________________________________________________________________________ Вывод: (какой способ получения основной соли использовали, какие свойства основных солей наблюдали)____________________________________________________________________________ _____________________________________________________________________________________ ______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________. МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ ФГБОУ ВПО «Уфимский государственный нефтяной технический университет» Кафедра «Прикладная химия и физика» Дисциплина «Химия» ОТЧЕТ по лабораторной работе № ___ на тему: «Определение молекулярной массы эквивалента карбоната кальция» Выполнил студент группы__________ ______________ И.О. Фамилия (Подпись, дата) Принял преподаватель кафедры ПХиФ ______________ И.О. Фамилия (Подпись, дата) Цель работы: - определить молекулярную массу эквивалента карбоната кальция весовым методом на основе закона эквивалентов. Теоретическая часть Абсолютная атомная масса – _____________________________________________________ ____________________________________________________________________________________. Моль ________________________________________________________________________ ____________________________________________________________________________________. Число Авогадро Na показывает____________________________________________________ ____________________________________________________________________________________. Относительная атомная масса ___________________________________________________ ____________________________________________________________________________________. Молекулярная масса ___________________________________________________________ ____________________________________________________________________________________. Молярная масса _______________________________________________________________ ____________________________________________________________________________________. К фундаментальным (стехиометрическим) относятся законы химии:____________________ _____________________________________________________________________________________ ____________________________________________________________________________________. Эквивалентом называется некая реальная или условная частица ________________________ ____________________________________________________________________________________. Число эквивалентности равно_____________________________________________________ ____________________________________________________________________________________. Единицей измерения количества эквивалентов является______________________________. Величина, обратная числу эквивалентности, называется ______________________________, которая показывает___________________________________________________________________. Например, масса эквивалента кислорода равна ___________ г/моль. Для газообразных веществ молярный объём эквивалента вещества называется _____________________________________так, молярный объём эквивалента кислорода равен ________ л/моль. Закон эквивалентов:_____________________________________________________________ _____________________________________________________________________________________ ____________________________________________________________________________________. Для реакции А+В=С+Д закон эквивалентов записывается так: ____________________________________________________________________________________. Экспериментальная часть Определение молярной массы эквивалента карбоната кальция проводится по реакции: ________________________________________________________________________________ Записи в ходе эксперимента: 1. Вес пустой фарфоровой чашки m1, г (________) 2. Вес фарфоровой чашки с мрамором до реакции m2, г (_________) 3. Вес фарфоровой чашки с мрамором после реакции (после сушки) m3, г (_________) 4. Объём соляной кислоты 5 мл 5. Концентрация соляной кислоты 2 н, моль/л Обработка результатов: 1. Рассчитайте вес мрамора до реакции m4 = m2 – m1, г ________________________________________________________________________________. 2. Рассчитайте вес мрамора после реакции m5 = m3 – m1, г ________________________________________________________________________________. 3. Рассчитайте вес прореагировавшего мрамора m6 = m4 – m5, г ________________________________________________________________________________. 4. Найдите массу соляной кислоты, вступившей в реакцию m(HCl) (по уравнению), г: ______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________. 5. Найдите молекулярную массу эквивалента карбоната кальция: МЭ (СaCO3) = _________________________________________ 6. Рассчитайте абсолютную и относительную ошибки опыта: Δ MЭ = ׀Мтеор. – Мэксперим.׀ 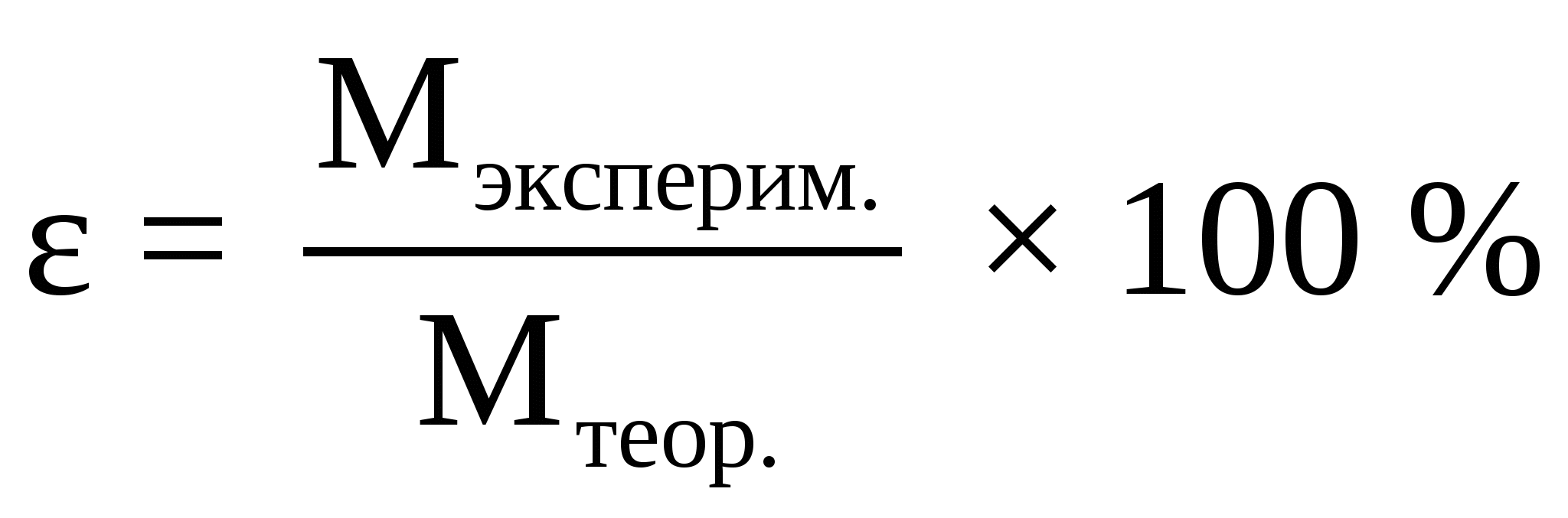 |
