Интенсивная терапия заболеваний, сопровождающаясянарушением кровообращения
 Скачать 300.68 Kb. Скачать 300.68 Kb.
|
ЧАСТО ВСТРЕЧАЮЩИЕСЯ ОШИБКИ ТЕРАПИИПри инфаркте легкого у больных с ТЭЛА нецелесообразно применение кровоостанавливающих средств, поскольку кровохарканье появляется на фоне тромбоза или тромбоэмболии. Не следует также назначать сердечные гликозиды при острой правожелудочковой недостаточности, поскольку эти препараты не влияют изолированно на правые отделы сердца и не уменьшают постнагрузку на правый желудочек. Дигитализация, однако, вполне оправдана у пациентов с тахисистолической формой мерцательной аритмии, нередко являющейся причиной тромбоэмболии. При подозрении на ТЭЛА госпитализация пациента обязательна. ПРОФИЛАКТИКА ТЭЛА Решающее значение в профилактике ТЭЛА имеет тщательное выявление факторов риска (возраст > 40 лет, ожирение, прием эстрогенов, варикозная болезнь, длительная иммобилизация, наличие онкопатологии и др.), а также ранняя диагностика скрытых ТГВ и ТЭЛА. Высокий риск ТЭО существует у пациенток, получающих химиотерапию по поводу злокачественных новообразований. Так, в исследовании von Tempelhoff G. (1999) была выявлена 10% частота ТГВ на фоне химиотерапии, проводимой по поводу злокачественных новообразований яичников. Для диагностики ТЭО в зарубежной литературе предлагается следующий диагностический алгоритм: Клиническая оценка; Выявление факторов риска; Ультразвуковая допплерография вен нижних конечностей (УЗДГ); Оценка уровня фибрина D-димера; Легочная сцинтиграфия; По показаниям – венография и ангиография легочных сосудов. Выявленный при УЗДГ тромбоз глубоких вен нижних конечностей в 30% случаев приводит к ТЭЛА или проксимальному ТГВ (т. е. тромбозу глубоких вен бедра) в ближайшие 3 месяца. Летальность при ТЭЛА, развившейся на фоне ТГВ, достигает 10%. Поэтому наличие проксимального ТГВ является крайне тревожным фактом. Естественно, что пациенты данной категории требуют особого внимания при выборе метода профилактики периоперационных ТЭО. Следует отметить, что ценность определения уровня фибрина D-димера у беременных невелика и имеет низкую информативность. Эффективность существующих методов тромбопрофилактики различна и в порядке убывания может быть представлена следующим образом: низкомолекулярные гепарины (НМГ) – пероральные антикоагулянты – простой, или нефракционированный, гепарин (НФГ) – компрессия нижних конечностей – декстраны – аспирин – плацебо. Установка кава-фильтров показана у пациентов с рецидивирующей ТЭЛА на фоне длительной антикоагулянтной терапии. В то же время, по данным некоторых исследований, показатели 2-летней летальности существенно не различаются у пациентов c проксимальным ТГВ, установленным фильтром и антикоагулянтной терапией по сравнению с пациентами, получавшими только антикоагулянтную терапию. 6-я консенсусная конференция по антитромботической терапии утвердила два основных метода профилактики ТЭО: назначение НМГ и антикоагулянтов непрямого действия. Из последней группы препаратов в настоящее время наиболее популярен варфарин. Преимущества низкомолекулярных гепаринов. Создание НМГ ознаменовало качественно новый этап в профилактике тромбоэмболий. Важной чертой всех НМГ является то, что они обладают значительно более слабой антикоагулянтной активностью, чем НФГ и, вместе с тем, более выраженным антитромботическим эффектом. НМГ предотвращают венозные тромбозы и тромбоэмболии в дозах, при которых все параметры коагуляции (АЧТВ и др.) практически не изменяются. В связи с этим профилактику с использованием НМГ можно проводить без лабораторного контроля. Метаанализ 59 рандомизированных контролируемых исследований, посвященных сравнению антитромботического действия НМГ и НФГ, выявил снижение частоты ТЭО на 29% и, соответственно, снижение летальности у пациентов, получавших низкомолекулярные гепарины. Основная особенность НМГ состоит в том, что они, в отличие от НФГ, преимущественно ингибируют активированный Х фактор (анти-Ха активность), а не тромбин. От этого в значительной степени зависит способность вызывать геморрагические осложнения и гепарин-индуцированную тромбоцитопению. Чем ниже анти-Ха эффект, тем более значительны эти осложнения. По этим параметрам лучшими из НМГ являются фраксипарин и близкий к нему клексан. Убедительных данных о преимуществе одного НМГ перед другим на сегодняшний день нет. Хотя, по данным нескольких метаанализов, фраксипарин является единственным НМГ, который существенно превосходит НФГ как при асимптоматическом, так и при клинически значимом ТГВ. Существует стандартная схема назначения фраксипарина с профилактической целью, согласно которой он вводится подкожно за 2–12 ч. до операции в дозе 0,3 мл при массе тела пациента до 80–90 кг и 0,6 мл пациентам большей массы. Повторная доза назначается через 10–12 ч. после операции, а затем 1 раз в сутки в течение 7–10 дней. Ретроспективный анализ 14.106 женщин во время беременности, родов и в раннем послеоперационном периоде за 1990–1999 гг., в том числе 157 женщин групп риска, получавших тромбопрофилактику НМГ, выявил всего 2 случая ТГВ (1,3%) и ни одного ТЭЛА. Кроме того, на фоне профилактического назначения НМГ не было выявлено увеличения объема кровопотери в родах. В другом исследовании не было выявлено ни одного ТЭО у 484 пациенток в возрасте от 14 до 84 лет, перенесших операции по поводу злокачественных и доброкачественных новообразований органов малого таза и получавших фраксипарин в дозе 0,3 мл один раз в сутки. Есть сообщение об успешном профилактическом применении клексана у 2339 пациенток, перенесших гинекологические операции. В данном исследовании не было выявлено ни одного случая ТГВ и ТЭЛА, частота периоперационных геморрагических осложнений составила 0,3%. Выбор оптимальных режимов профилактики – мнения достаточно противоречивы. Так, в Европе принято назначать антикоагулянты до операции, а в Северной Америке – после нее. В качестве «пороговой» массы тела, при которой пациент нуждается в коррекции исходной дозы 0,3 мл, различные специалисты называют 90, 80, 70 и даже 60 кг. Научно обоснованных аргументов в пользу того или иного подхода нам обнаружить не удалось. Есть мнение, что профилактика должна проводиться до полной мобилизации пациента. Другие специалисты считают, что профилактика должна быть продолжена, пока в крови сохраняется высокий уровень тромбина. У пациентов высокого риска необходимо применять антикоагулянты в течение 25–40 дней. Тромбопрофилактика и регионарная анестезия. Определенные проблемы связывают с проведением эпидуральной (ЭА) и спинальной анестезии (СА) у пациентов, получающих НМГ с целью тромбопрофилактики. В то же время, на протяжении последних 10–12 лет, когда НМГ стали широко использоваться в Европе, не было отмечено увеличения числа эпидуральных гематом у пациентов, оперированных в условиях нейроаксиальной анестезии. Мы считаем, что не следует отказываться от методов регионарной анестезии у пациентов, получающих НМГ с целью тромбопрофилактики, тем более что продленная ЭА сама по себе существенно снижает частоту послеоперационных тромбоэмболических осложнений. Ниже приведены данные, основанные на метаанализе 22 рандомизированных контролируемых исследований. Частота тромбоэмболических осложнений при различных методах послеоперационного обезболивания (метаанализ Kehlet и Holte, 2001, 22 рандомизированных исследования) 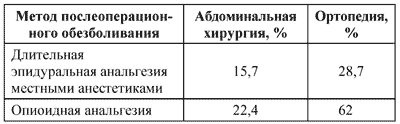 Наиболее безопасной методикой является одномоментная СА. Рекомендации по безопасному проведению ЭА и СА у пациентов, получающих антикоагулянты, приведены в статье, посвященной осложнениям регионарной анестезии. Экономический эффект адекватной тромбопрофилактики. ТГВ и ТЭЛА являются осложнениями, существенно увеличивающими общую стоимость лечения. В связи с этим адекватная тромбопрофилактика выгодна и с фармакоэкономических позиций. Только в 2000 г. в США дополнительные расходы, связанные с лечением ТГВ, составили 60.019 долларов на одного пациента, а в совокупности они достигли 389 миллионов долларов. Перспективы снижения расходов связаны с разработкой прогностической модели, позволяющей своевременно выявлять пациентов повышенного риска, нуждающихся в раннем назначении НМГ с целью профилактики. ЛЕЧЕБНЫЙ НАРКОЗ Наряду с эпиидуральной анестезией для послеоперационного обезболивания может использоваться также известная методика лечебного наркоза (Б. В. Петровский, С. И. Ефуни), препараты опия и их синтетические заменители в комбинации с фенотиазинами. Лечебный наркоз выгоден у лиц с расстройством центральной нервной системы, когда есть необходимость выключить кору. Однако лечебный наркоз, обладая слабым обезболивающим эффектом, требует комбинации с анальгетиками, кроме того, при проведении лечебного наркоза необходимо тщательное наблюдение врача или обученного среднего персонала за правильностью потока газов и дыханием пациента, чтобы вовремя устранить возможные осложнения. Лечебный наркоз продолжительностью 35—40 минут проводится дробно, с последующей ингаляцией увлажненного кислорода. Как известно, опиаты, уменьшая восприятие болевых ощущений, обладают рядом неблагоприятных свойств: понижают возбудимость дыхательного и кашлевого центров, вызывают урежение и уменьшение глубины дыхания, что приводит к снижению легочной вентиляции. Кроме того, под влиянием опиатов повышается тонус сфинктера мочевого пузыря и усиливаются сокращения желчевыводящих путей. Все эти побочные свойства опиатов неблагоприятно влияют на течение послеоперационного периода, особенно у пожилых ослабленных больных, и заставляют прибегать к различного рода комбинациям обезболивающих средств, чтобы уменьшить дозу опиатов. В послеоперационной палате пациента укладывают на согретую функциональную кровать в горизонтальном положении на спине, дренажи, подсоединяют к отсасывающему устройству, с помощью которого осуществляется постоянная аспирация отделяемого из полости. После полного пробуждения от наркоза немедленно проводится обезболивание одним из описанных методов, устанавливается ингаляция увлажненным кислородом и наблюдение за гемодинамическими показателями и дыханием пациента. Каждые 30 минут измеряют артериальное давление, подсчитывают частоту пульса и дыхания, данные заносят в график. По клиническим показаниям проводится исследование кислотно-щелочного равновесия и его коррекция, продолжается возмещение кровопотери. При удовлетворительных гемодинамических показателях через 2 часа после наркоза больному можно придать возвышенное положение (осторожно! чтобы не вызвать ортостатический коллапс), что улучшает вентиляцию легких. В первые сутки особое внимание следует уделять обезболиванию, возмещению кровопотери и восстановлению адекватного дыхания. X. ТЕСТОВЫЕ ЗАДАЧИ 1. Адренэргические бета-рецепторы преобладают преимущественно в:
2. К естественным катехоламинам относятся:
3. Оценка состояния гемодинамики проводится на основании:
4. В каком из случаев определение объема крови представляется полезным:
5. Отек мозга нередко развивается:
6. Отек легких развивается при:
7. Электрическая дефибрилляция может оказаться неэффективной, если:
8. Трансфузионная реакция во время переливания крови под наркозом проявляется:
9. При острой кровопотере для вводного наркоза предпочтителен:
10. Внезапная остановка сердца на операционном столе может развиться вследствие:
11. Артериальная гипотензия во время адекватной анестезии может быть обусловлена:
12. Лечение олигурии при геморрагическом шоке заключается:
13. Эффективность противошоковых мероприятий можно оценить по:
14. Показанием к открытому массажу при остановке сердца является:
15. При остановке применяется сочетание препаратов:
16. При проведении наружного массажа ладони следует располагать на:
17. Тяжесть течения послереанимационного периода обусловлена:
18. Инфекционно-токсический шок может развиться при:
|
