К онтроль качества клинических лабораторных исследований. Внутрилабораторный контроль качества клинических лабораторных исследований. Построение контрольных карт. Критерии оценки контрольной карты. Правила Вестгарда
 Скачать 2.79 Mb. Скачать 2.79 Mb.
|
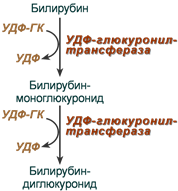
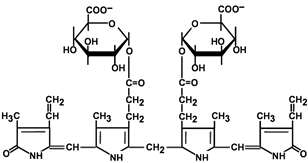
Особенности интерпретации данных исследования общего IgE:1. Повышение уровня общего IgE может быть вызвано не только атопией, но и целым рядом других заболеваний, в том числе глистными инвазиями, иммунодефицитными состояниями, бронхопульмональным аспергиллезом и др. 2. Нормальный уровень общего IgE в сыворотке крови не отрицает наличия сенсибилизации. Примерно у трети больных атопическими заболеваниями уровень общего IgE может находиться в пределах нормы (30-100 кЕ/л). 3. При сенсибилизации к одному (нескольким) аллергенам содержание общего IgE может быть в пределах нормы, а специфического - повышено. 4. Концентрация общего IgE в сыворотке крови может быть в пределах нормы при неатопических состояниях неиммунной природы, хронической рецидивирующей крапивнице и ангионевротическом отеке. 5. Верхняя граница нормы общего IgE (100 кЕ/л) у лиц, проживающих в регионах, эндемичных по гельминтозам, может быть выше обычной. 6. Обнаружение аллерген-специфического IgE (к какому-либо аллергену или антигену) выявляет только сенсибилизацию и еще не доказывает, что именно данный аллерген является причиной симптомов заболевания. Особенности интерпретации исследования специфических IgE:1. Отрицательный результат исследования на специфический IgE может быть обусловлен стратегией скрининга - отсутствием теста на данный аллерген. Отсутствие специфического IgE в сыворотке периферической крови не исключает возможности участия в патогенезе IgE-зависимого механизма аллергической реакции, так как возможен местный синтез IgE, или связывания синтезированного IgE тканями, что может происходить без изменения концентрации специфического IgE в периферической крови. 2. Антитела других классов, особенно IgG (IgG4), специфичные к аллергену, в определенных случаях могут быть причиной ложноотрицательных результатов. 3. Высокий уровень аллерген-специфического IgЕ характеризует наличие высокого уровня сенсибилизации только по отношению к конкретному изучаемому аллергену. 4. При высоких концентрациях общего IgE чаще могут возникать ложноположительные результаты исследований на специфические IgE, так как в таких условиях повышается вероятность связывания неспецифических IgE с аллергеном. 5. Идентичные количественные результаты определения специфического IgE для разных аллергенов не означают их одинакового клинического значения. 6. Окончательное заключение и интерпретация лабораторных данных должны быть сделаны специалистом-аллергологом на основании сопоставления результатов лабораторных исследований с клинической картиной и данными аллергологического анамнеза. При аллергических реакциях I типа (анафилактических): определение аллергенспецифических IgE (редко IgG4) методами иммуноферментного анализа (ИФА), иммунохемолюминесцентного (ИХЛ) анализа. микроскопия материала из локализации – наличие повышенного числа эозинофилов (в общем анализе также) базофильные тесты Шелли (с проточной цитометрией) определение альфа и бета форм триптазы крови (маркер дегрануляции тучных клеток). При аллергических реакциях II типа (цитотоксических) определение аллергенспецифических IgG и IgM (иммунные цитопении) проводят с помощью: реакции преципитации в геле; пробы Кумбса; теста связывания комплемента. При аллергических реакциях III типа (иммунокомплексных): определение содержания циркулирующих иммунных комплексов; определение содержания IgG и IgM; оценка реакции аллергенспецифической активации базофилов (базофильные тесты); определение содержания компонентов комплемента и С1 ингибитора методом ИФА. При аллергических реакциях IV (замедленного) типа: тест трансформации лимфоцитов (при аллергии к антибиотикам пенициллинового ряда, сульфаниламидам, карбамазепину, НПВС); тест торможения миграции макрофагов; проточная цитометрия для определения специфических субпопуляций Т-лимфоцитов; тесты цитотоксичности лимфоцитов (при аллергии на сульфаниламиды); тесты для определения микросомальной продукции антител, вызванной лекарствами, с использованием иммуноблоттинга (при аллергии к галотану, противосудорожным препаратам, сульфаниламидам). Для выявления медиаторов патохимической стадии аллергических реакций рекомендуется проведение следующих исследований: тест высвобождения гистамина и лейкотриенов после инкубации с аллергеном; 3. Ситуационная задача. Мужчина 28 лет, женат 5 лет, детей не имеет. Исследование спермы: количество – 3 мл, цвет – молочно-белый, запах – обычный, мутность – значительная, консистенция – жидкая, количество сперматозоидов в 1 мл – 40 млн. Кинезистограмма: через 1 час подвижность 10%. Вопрос: Данные показатели можно характеризовать: Предполагаемый ответ: А. гипоспермия; Б. астенозооспермия – ответ (снижение активности сперматозоидов); В. некрозооспермия Г. гипопитуитаризм; Д. варикоцеле. Билет №19 1. Диагностика заболеваний щитовидной железы. Диагностика гипертиреоза. Диагностика гипотиреоза. Диагностика аутоиммунного тиреоидита и других аутоиммунных заболеваний щитовидной железы Анализ жалоб. Жалобы пациентов с заболеваниями ЩЖ можно разделить на 2 основные группы. Первая связана с увеличением железы и сдавлением окружающих органов, Вторая обусловлена нарушением функции ЩЖ (гипо- или гипертиреоз). Само увеличение железы приводит к появлению жалоб на наличие опухолевидного образования на шее, чувство инородного тела при глотании, «неловкость» в области шеи при движениях, застегивании воротника, осиплость голоса, сухой кашель. Осмотр позволяет установить наличие зоба, характер его поражения (диффузный или узловой) и его локализацию, консистенцию, подвижность при глотании. Обязательно проводится пальпация РЛУ (все группы лимфоузлов шеи, под- и надключичные лимфоузлы). При загрудинном зобе часто видно набухание вен шеи и передней поверхности грудной клетки, одутловатость лица и шеи. Классификация размеров зоба (ВОЗ, 1994) 0 Зоба нет. Пальпаторно размеры каждой доли не превышают размеров дистальной фаланги большого пальца исследуемого. I Размеры зоба больше дистальной фаланги большого пальца исследуемого, зоб пальпируется, но не виден. II Зоб пальпируется и виден на глаз. Инструментальная диагностика УЗИ. УЗИ является одним из ведущих методов диагностики заболеваний ЩЖ. Метод позволяет с большой точностью определить размеры ЩЖ, расположение, рассчитать ее объем, характер поражения и степень кровоснабжения. В норме объем ЩЖ у женщин не превышает 18 мл, у мужчин — 25 мл. После определения положения и объема ЩЖ оценивают ее контуры и эхогенность, которая может быть пониженной или повышенной, однородной или неоднородной. При обнаружении объемных образований оценивают их размеры, контуры, эхогенность и эхоструктуру каждого, а также особенности кровоснабжения самой железы и найденных образований. Также оценивается состояние РЛУ и взаимосвязи выявленных новообразований и ЩЖ с окружающими структурами. Средняя эхогенная плотность ткани здоровой ЩЖ приблизительно равна 15,5 Ед и аналогична эхогенной плотности ткани двуглавой мышцы плеча. Ультразвуковые признаки неизмененной ЩЖ: – типичное расположение; – четкие ровные контуры; – нормальные размеры; – средняя эхогенность; – однородность или неоднородность эхо-структуры. Рентгенография шеи и средостения с контрастированием пищевода. Позволяет оценить степень распространения зоба за грудину, выявить отклонение и/или сдавление пищевода и трахеи, оценить степень и распространенность изменений, обнаружить рентгеноконтрастные кальцификаты. КТ и МРТ шеи и средостения. Обладают большой разрешающей способностью, позволяют оценить тип патологического процесса в ЩЖ и выявить признаки инвазии в окружающие структуры, однако, в силу высокой стоимости, а также наличия более простых и высокоинформативных методов исследования широкого распространения не получили. Тонкоигольная аспирационная биопсия (ТАБ). Под УЗ-контролем широко используется для морфологической предоперационной диагностики. ТАБ заключается в выполнении пункции узлового образования под УЗ-контролем и аспирации его содержимого. Материал после получения сразу переносится на предметные стекла, фиксируется и окрашивается. Интраоперационная морфологическая диагностика. Она включает срочное цитологическое и гистологическое исследование препаратов удаленной ЩЖ. Методы широко используются в специализированных хирургических стационарах для дифференциальной диагностики высоко дифференцированных форм рака ЩЖ и доброкачественных опухолей, что определяет объем оперативного вмешательства. Плановое гистологическое исследование — завершающий этап морфологической диагностики, имеющий более высокую чувствительность и специфичность по сравнению со срочными исследованиями. Точность метода значительно повышается при использовании иммуногистохимических методик с наборами антител к различным онкомаркёрам. Лабораторная диагностика. Для оценки тиреоидного статуса и степени нарушения секреции определяют концентрации общего и связанного Т3, Т4, ТТГ, ТРГ и кальцитонина в сыворотке крови методами иммуноферментного и иммунохемилюминисцентного анализа. В диагностике аутоиммунных заболеваний ЩЖ применяют определение уровня антител к различным компонентам тканей железы: антител к ТГ, ТПО и рецепторам ТТГ теми же методами. Диагностика ГИПЕРтиреоза Гипертиреоз – это заболевание, вызванное переизбытком тиреоидных гормонов в организме. Тиреоидные гормоны (Т3, Т4) вырабатываются щитовидной железой для регуляции метаболических процессов. Гипертиреоз, как и гипотиреоз, чаще встречается у женщин, чем у мужчин. Жалобы и анамнез: Жалобы на: нервозность; потливость; сердцебиение; повышенную утомляемость; повышенный аппетит и, несмотря на это, похудание; общую слабость; эмоциональную лабильность; одышку; нарушение сна, иногда бессонницу; плохую переносимость повышенной температуры окружающей среды; диарею; дискомфорт со стороны глаз - неприятные ощущения в области глазных яблок, дрожь век; нарушения менструального цикла. В анамнезе: наличие родственников, страдающих заболеваниями щитовидной железы; частые острые респираторные заболевания; локальные инфекционные процессы (хронический тонзиллит). Этапы диагностики: 1. Исследование функциональной активности ЩЖ проводится на основании определения содержания тиреоидных гормонов в крови: свТ4 и свТ3 (свободного), базального уровня ТТГ. Концентрация ТТГ при тиреотоксикозе должна быть низкой (< 0.1 мЕ/л), содержание в сыворотке свТ4 и свТ3 повышено (уровень А). У некоторых больных отмечается снижение уровня ТТГ без одновременного повышения концентрации тиреоидных гормонов в крови (уровень А). Такое состояние расценивается как ―субклинический тиреотоксикоз, если только оно не обусловлено иными причинами (приемом лекарственных препаратов, тяжелыми нетиреоидными заболеваниями). Нормальный или повышенный уровень ТТГ на фоне высоких показателей свТ4 может указывать на ТТГ-продуцирующую аденому гипофиза, либо избирательную резистентность гипофиза к тиреоидным гормонам. 2. Исследование иммунологических маркеров. Антитела к рТТГ выявляются у 99-100% больных аутоиммунным тиреотоксикозом (уровень В). В процессе лечения или спонтанной ремиссии заболевания антитела могут снижаться, исчезать (уровень А) или менять свою функциональную активность, приобретая блокирующие свойства (уровень Д). ―Классические» антитела – антитела к ТГ и ТПО выявляются у 40-60% больных аутоиммунным токсическим зобом (уровень В). При воспалительных и деструктивных процессах в ЩЖ не аутоиммунной природы антитела могут присутствовать, но в невысоких значениях (уровень С). Рутинное определение уровня антител к ТПО и ТГ для диагностики ДТЗ не рекомендуется (уровень В). Определение антител к ПТО и ТГ проводится только для дифференциального диагноза аутоиммунного и неаутоиммунного тиреотоксикоза 3. Методы визуализации: УЗИ, цветное допплеровское картирование, сцинтиграфия ЩЖ, рентгенологическое исследование, компьтерная и магнитно-резонансная томография . С помощью УЗИ определяется объем и эхоструктура ЩЖ. В норме объем ЩЖ у женщин не должен превышать 18 мл, у мужчин 25 мл. Эхогенность железы средняя, структура равномерная. Эхогенность железы при аутоиммунном тиреотоксикозе равномерно снижена, эхоструктура обычно однородная, кровоснабжение усилено (уровень В). При наличии узлового/многоузлового зоба выявляются образования в ЩЖ. УЗИ проводится всем пациентам с тиреотоксикозом. Диагностика ГИПОтиреоза Гипотиреоз – дефицит тиреоидных гормонов в организме. Вторичный гипотиреоз – клинический синдром, развивающийся вследствие недостаточной продукции ТТГ при отсутствии первичной патологии самой ЩЖ, которая бы могла привести к снижению ее функции. По патогенезу гипотиреоз может быть первичным (вследствие патологии самой ЩЖ) или вторичными (вследствие дефицита ТТГ). Более 99% всех случаев гипотиреоза у взрослых приходится на первичный приобретенный гипотиреоз. Наиболее часто гипотиреоз развивается вследствие хронического аутоиммунного тиреоидита, а также ятрогенный (послеоперационный). Гипотиреоз Этиология Основные заболевания Первичный (заболевания ЩЖ) - Аутоиммунный тиреоидит Хирургическое удаление ЩЖ Терапия радиоактивным йодом 131I Гипотиреоз при подостром, послеродовом, «безболевом» тиреоидите Тяжелый йодный дефицит Аномалии развития ЩЖ (дисгенезия и эктопия). Вторичный (гипоталамогипофизарная патология) - Крупные опухоли гипоталамо-гипофизарной области Травматическое или лучевое повреждение гипофиза Сосудистые нарушения Инфекционные, инфильтративные процессы Нарушение синтеза ТТГ и/или тиреолиберина. Жалобы: слабость; зябкость; вялость; сонливость; «беспричинная» прибавка массы тела; парестезии; запоры; выпадение волос; нарушение менструального цикла (часто меноррагия) и репродуктивной функции; судороги. При физикальном осмотре у пациентов с выраженным и длительным дефицитом тиреоидных гормонов могут быть характерные внешние проявления: отмечается общая и периорбитальная отечность, одутловатое лицо бледно-желтушного оттенка, скудная мимика. В подавляющем большинстве случаев гипотиреоз является первичным, т. е. обусловленным поражением щитовидной железы. Вторичный гипотиреоз встречается значительно реже, он связан с патологией гипоталамогипофизарной области. Достаточно редко встречается тканевой или периферический гипотиреоз, обусловленный резистентностью тканей к тиреоидным гормонам или нарушением транспорта, метаболизма и действия тиреоидных гормонов. Отдельно выделяют врождѐнные формы гипотиреоза, уровень поражения при которых также может быть первичным, центральным, периферическим. 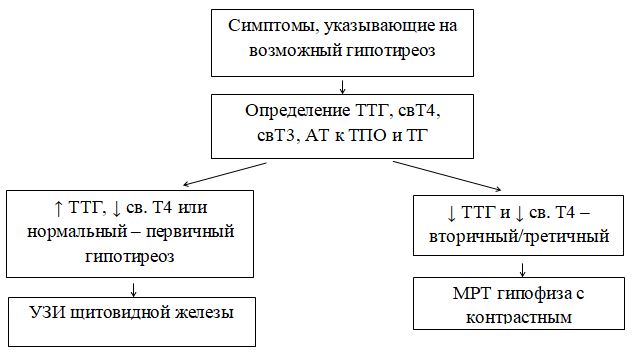 Диагностика первичного гипотиреоза Современная лабораторная диагностика гипотиреоза основана на определении уровня ТТГ и св. Т4. Приоритет тестирования в диагностике гипотиреоза отдается, прежде всего, определению ТТГ. Определение Т3 для диагностики гипотиреоза не имеет дополнительного значения. По результатам исследования выделяют две формы гипотиреоза: манифестный (ТТГ повышен, св. Т4 снижен) и субклинический (ТТГ повышен, св. Т4 норма). Диагностика вторичного гипотиреоза Развитие вторичного гипотиреоза может быть связано с патологией гипофиза вследствие разрушения опухолью, оперативным вмешательством, облучением или нарушением кровообращения, либо с патологией гипоталамогипофизарной области. Вторичный гипотиреоз редко бывает изолированным. Как правило, он сопровождается дефицитом других тропных гормонов гипофиза, в частности АКТГ, ФСГ, пролактина и соответствующими клиническими проявлениями. В ряде случаев вторичный гипотиреоз может сопровождаться клиникой несахарного диабета вследствие недостаточности АДГ. Диагностика вторичного гипотиреоза основана на определении пониженного уровня св. Т4. Уровень ТТГ при вторичном гипотиреозе может быть пониженным, нормальным или даже превышать верхнюю границу нормы, при этом его биологическая активность будет снижена. У больных в общем и биохимическом анализе крови может наблюдаться нормо- или гипохромная анемия, в ряде случаев В12-дефицитная анемия. Повышение уровня холестерина, ЛПНП, триглицеридов, увеличение уровня креатинина, гипонатриемия, гипоосмолярность, снижение клубочковой фильтрации, повышение содержания в крови ферментов (креатининфосфокиназы, аспартат-трансаминазы, лактатдегидрогеназы). Аутоимунный тиреоидит Жалобы и анамнез: В течение первых лет жалобы и симптомы, как правило, отсутствуют. С течением времени могут появиться жалобы на отечность лица, конечностей, сонливость, депрессивное состояние, слабость, быструю утомляемость, у женщин – нарушение менструального цикла. Необходимо учитывать, что гипотиреоз развивается не у всех пациентов, примерно у 30% может быть только носительство антител к щитовидной железе. Лабораторные исследования: Гормональный профиль: исследование ТТГ, свТ3, свТ4, антитела к тиреопероксидазе, антитела к тиреоглобулину 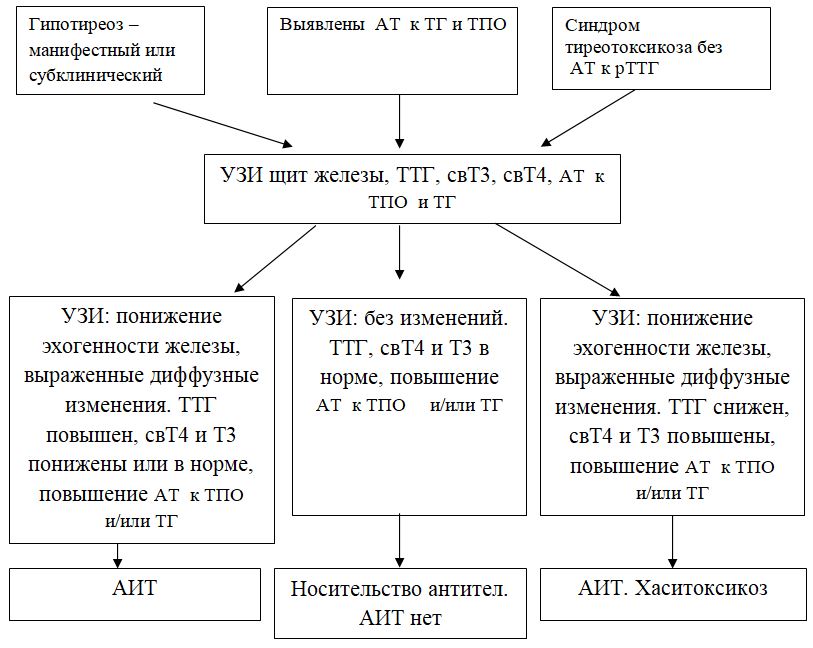 2. Иммунная система при опухолевых заболеваниях. Участие иммунной системы в противоопухолевой защите организма. Опухоль-ассоциированные антигены. Иммунный ответ при опухолевом росте. Изменения иммунореактивности онкологических больных. Лабораторная иммунодиагностика опухолевых заболеваний. https://practical-oncology.ru/articles/34.pdf Взаимодействие иммунной системы со злокачественной опухолью представляет собой тонкий баланс между процессами иммунной активации и иммунной супрессии. Двойственный характер взаимодействия иммунной системы и опухоли в настоящее время рассматривается как динамический процесс иммуноредактирования. Важную роль в иммунном ответе на опухоль играют различные популяции клеток врожденного и адаптивного иммунитета: NK-, Т-, NKT-клетки, макрофаги и дендритные клетки. Эти популяции являются гетерогенными и содержат в своем составе, как клетки с противоопухолевой активностью, так и регуляторные (супрессорные) клетки, способствующие опухолевой прогрессии. Ключевой проблемой онкоиммунологии, как и иммунологии в целом, является понимание того, как иммунная система отличает «свое» от «чужого», обеспечивая защиту организма от патогенных микроорганизмов и чужеродных агентов, и как эти механизмы реализуются при возникновении опухоли и в процессе ее дальнейшего роста. Иммунная система: Во-первых, она может защищать хозяина от вирус-индуцированных опухолей, ограничивая или прекращая вирусную инфекцию Во-вторых, своевременная элиминация патогенов и быстрое прекращение воспаления предупреждает образование воспалительного очага, благоприятного для развития опухоли. В-третьих, иммунная система может идентифицировать и устранять опухолевые клетки, на основе распознавания опухолеспецифических антигенов на клетках конкретных тканей. Этот процесс идентификации трансформированных клеток и элиминации их прежде, чем сформируется опухоль, и называется иммунологическим надзором Роль иммунной системы в развитии злокачественных опухолей у человека подтверждается увеличением частоты их появления у больных первичными иммунодефицитами (ПИДЧ, врожденных), а также у пациентов, подвергавшихся трансплантации различных органов и получавших иммунодепрессивную терапию, которая значительно ослабляет противоопухолевый иммунитет, что позволяет возникшим опухолевым клеткам пролиферировать. Двойственный характер взаимодействия иммунной системы и опухоли в настоящее время рассматривается как динамический процесс иммуноредактирования, состоящий из трех фаз: элиминации, равновесия и ускользания. В период элиминации клетки врожденного и адаптивного иммунитета разрушают возникающие клетки опухоли задолго до клинического проявления болезни. В фазе равновесия некоторые опухолевые клетки не разрушаются, и этап элиминации может перейти в фазу равновесия, в период которой иммунологические механизмы сдерживают дальнейшее развитие опухоли. Если опухоль «ускользает» от иммунологического распознавания и разрушения, она прогрессирует из фазы равновесия в фазу «ускользания» и становится клинически очевидной. Опухоль, в свою очередь, обладает различными механизмами, способными разрушать иммунологическую защиту. Антигены опухолевых клеток Опухолевые клетки экспрессируют широкий спектр поверхностных антигенов, многие из которых являются мишенями клеток иммунной системы. В настоящее время их разделяют на три группы: опухолеспецифические (ОСА), опухолеассоциированные (ОАА) и онкофетальные антигены (ОФА). ОСА не экспрессируются на нормальных клетках и могут представлять собой или белки онкогенных вирусов, или белки, являющиеся результатом соматических мутаций, возникающих при появлении опухоли и в процессе ее роста. Некоторые из этих мутантных белков могут восприниматься иммунной системой, как чужеродные. Для лечения рака идеальным является антиген, продуцирующийся только самой раковой клеткой и находящийся внутри неё или на ней и в максимально большом количестве. Для целого ряда опухолевых антигенов были разработаны терапевтические моноклональные антитела. Примеры: (указанные антитела используются для таргетной терапии (подавляют)) HER2/neu выделяется у приблизительно 20 % больных карциномой молочной железы. Антитело: Трастузумаб EGFR, выделяется в 80 % карцином толстой кишки. Антитело: Цетуксимаб VEGF, антиген метастазированной колоректальной карциномы. Антитело: Бевацизумаб CAMPATH 1-антиген, хронический лимфолейкоз. Антитело: Алемтузумаб HLA-DR, острый лимфобластный лейкоз, хронический лимфолейкоз, неходжкинские лимфомы. Антитело: аполизумаб. ОАА являются или дифференцировочными, или аберрантно экспрессированными нормальными белками, или белками, возникшими в результате посттрансляционной модификации. Так как ОАА являются нормальными белками, их антигенность зависит или от аномальных уровней экспрессии, или от ситуаций, когда они могут обойти механизмы естественной иммунологической толерантности. Третью категорию антигенов составляют ОФА, которые в норме экспрессируются в семенниках, яичниках плода и трофобластах. Нетипичная экспрессия этих антигенов на опухолевых клетках делает их привлекательной мишенью для иммунотерапии. Опухолевые антигены могут локализоваться на поверхности опухолевых клеток в комплексе с молекулами MHC I или II класса, и распознаваться спонтанно возникающими активированными CD8+ и CD4+ Т-клетками. Такие спонтанно возникшие активированные Т-клетки, а также антитела к опухолевым антигенам часто обнаруживаются у пациентов с различными вариантами злокачественных опухолей - при меланоме, раке толстой кишки, лейкозах, раке молочной железы и других нозологических формах рака. Клетки, участвующие в противоопухолевом иммунном ответе Важную роль в противоопухолевом иммунном ответе играют различные популяции иммунных клеток врожденного и адаптивного иммунитета: NK-, Т-, NKT-клетки, дендритные клетки (ДК) и макрофаги (Мф). Для развития эффективного противоопухолевого иммунного ответа необходимо в первую очередь распознавание опухоли иммунной системой. Для этого требуется привлечение антигенпредставляющих (АПК) клеток в опухолевое микроокружение, распознавание ими опухолевых антигенов и миграция в дренирующие лимфоузлы, и активация антигенспецифических Т-клеток. Активированные Т-клетки должны затем мигрировать в опухолевый узел под действием соответствующих хемокинов. Локальная функция Т-клеток регулируется различными миелоидными субпопуляциями, среди которых различают четыре основных типа клеток: опухолеассоциированные макрофаги (ОАМ) 1 типа (М1Мф), ОАМ 2 типа (М2Мф), дендритные клетки (ДК) 1 типа (ДК1) и CD103+ ДК 2 типа (ДК2). Значительную роль в защите организма от чужеродных агентов и поддержании тканевого гомеостаза играют макрофаги (Мф). Костномозговые моноцитарные предшественники, проникая в соответствующие ткани, дифференцируются в зрелые Мф и поляризуются в подтипы с различным фенотипом в зависимости от особенностей микроокружения. Мф в настоящее время упрощенно разделяют на два основных типа: классически активированные М1Мф и альтернативно активированные протуморогенные, М2Мф. М1Мф продуцируют провоспалительные цитокины (IL-6, IL-12, IL-23 и TNF-α), а также способны представлять опухолевые антигены. Они определяются в опухолевом узле, как правило, на ранних стадиях развития опухоли и их основными функциями являются стимуляция воспаления, фагоцитоз и противоопухолевая активность. Главными эффекторными лимфоцитами врожденного иммунитета являются NK-клетки. Они обеспечивают защиту от вирусных инфекций и некоторых других патогенов на ранних стадиях иммунного ответа и участвуют в контроле опухолевого роста и метастазирования. Инфильтрация опухоли этими лимфоцитами во многих случаях коррелирует с благоприятным прогнозом заболевания. Предполагается также, что NK-клетки способны распознавать и уничтожать стволовые опухолевые клетки. Эффекторная функция NK-клеток связана, главным образом, с их цитолитической активностью, однако, благодаря секретируемым ими цитокинам и хемокинам, они могут также усиливать воспалительный процесс и регулировать последующий Т-клеточный ответ, влияя не только на его силу, но и на качество. Основными клеткам-эффекторами адаптивного противоопухолевого иммунитета являются цитотоксические CD3+ CD8+ Т-клетки (Т-киллеры). Во многих клинических исследованиях инфильтрация опухоли CD3+ и CD8+ Т-лимфоцитами позитивно коррелировала с продолжительностью жизни пациентов. Уникальной популяцией Т-лимфоцитов являются NKT-клетки. Благодаря своей способности быстро продуцировать достаточные количества различных цитокинов (Th1, Th2, Th3 и/или Th17), они обеспечивают связь между врожденным и адаптивным звеньями иммунитета. Помимо Т-клеточного рецептора NKT-клетки экспрессируют некоторые маркеры NK-клеток и Т-клеток памяти. NKT-клетки участвуют в регуляции иммунных реакций при самых различных заболеваниях: аутоиммунных, аллергических, инфекционных и при злокачественных новообразованиях. В настоящее время установлено существование двух основных типов NKT-клеток: инвариантные (экспрессируют инвариантную α цепь Т-клеточного рецептора Vα24) – NKT-клетки I типа (iNKT) и NKT-клетки, не экспрессирующие Vα24 – NKT клетки II типа. NKT-клетки I типа в подавляющем большинстве случаев проявляют противоопухолевую активность, которая во многом зависит от их способности продуцировать IFNγ. При этом они, как правило, играют роль стимуляторов активности других клетокэффекторов, таких как NK- и CD8+ Т-лимфоциты, хотя могут оказывать и прямое цитотоксическое действие на опухолевые клетки. IFNγ, продуцируемый iNKT- и NK-клетками, играет также важную роль в подавлении опухолевого ангиогенеза. В 1995 году Sakaguchi и соавт. идентифицировали популяцию CD4+ Т-клеток, характеризующихся высокой постоянной экспрессией маркера CD25 (высоко-аффинного рецептора IL-2 – IL-2Rα) и защищающих экспериментальных животных от развития аутоиммунных заболеваний. В дальнейшем было установлено, что важную роль в развитии и функционировании этих клеток играет транскрипционный фактор FOXP3. В настоящее время этот внутриклеточный маркер наряду с молекулой CD25 наиболее часто используется для определения популяции регуляторных CD4+ Т-клеток (Трег). Большинство FOXP3-экспрессирующих Трег генерируются в период развития Т-клеток в тимусе и являются стабильной популяцией, в то же время некоторые FOXP3+ Т-клетки дифференцируются из наивных Т-клеток в периферических тканях, в частности, в опухолевом микроокружении. Они могут подавлять пролиферативную и функциональную активность различных иммунокомпетентных клеток, включая CD4+ и CD8+ Т-клетки (таким образом благоприятно влияя на развитие некоторых опухолей в случае гиперподавления Т-клеток, но не при всех опухолях). Несмотря на способность иммунной системы распознавать и разрушать опухолевые клетки, опухоль преодолевает защитные силы организма, растет и метастазирует. Это обусловлено существованием многочисленных негативных молекулярных и клеточных механизмов, которые препятствуют развитию эффективного противоопухолевого иммунного ответа и обеспечивают «ускользание» опухоли от иммунологического надзора. Механизмы ускользания от иммунологического надзора: (А) редукция иммунного распознавания и стимуляции иммунных клеток в результате снижения или потери экспрессии высоко иммуногенных антигенов, или нарушения механизмов представления антигенов, или отсутствия костимулирующих молекул. (B) усиление активности механизмов резистентности к цитотоксическим эффекторам иммунитета, или повышение экспрессии генов, ответственных за выживаемость клеток и генов факторов роста. (С) формирование иммуносупрессивного микроокружения опухоли в результате: (a) продукции цитокинов (например, VEGF, TGF-β) и метаболических факторов (например, аденозин, PGE2), (b) индукции/привлечения клетоксупрессоров (например, регуляторных Т-клеток и миелоидных супрессорных клеток, М2Мф), или (c) индукции адаптивной иммунной резистентности, путем взаимодействия соответствующих лигандов с ингибиторными рецепторами (например, CTLA-4, PD-1, Tim-3) клеток-эффекторов противоопухолевого иммунитета. Лабораторная диагностика, опухолевые маркеры: Раковый эмбриональный антиген (РЭА) представляет собой белково-полисахаридный комплекс, который обнаруживается при раке толстой кишки и в норме в кишечнике плода, поджелудочной железе и печени. Содержание в крови повышено у больных раком толстой кишки, но специфичность относительно низкая, поскольку положительный результат также получают у заядлых курильщиков и у пациентов с циррозом, язвенным колитом и другими формами рака (например, раком молочной железы, поджелудочной железы, мочевого пузыря, яичников и шейки матки). Мониторинг уровня РЭА может быть полезен при оценке степени рецидива после иссечения опухоли, если изначально у пациента уровень РЭА был повышен, а также для уточнения прогноза в зависимости от стадии. Альфа-фетопротеин в норме образуется в гепатоцитах плода; он также присутствует в сыворотке пациентов с первичной гепатоцеллюлярной карциномой, несеминомными герминогенными опухолями и часто – с эмбриональными карциномами яичников или семенников. Определение уровня часто полезно для оценки прогноза и, реже, для диагностики. Бета-субъединица человеческого хорионического гонадотропина (бета-ХГЧ), которую определяют с помощью иммунологического анализа, представляет собой основной клинический маркер у женщин с гестационными трофобластическими опухолями (ГТО) – рядом заболеваний, включающих пузырный занос, неметастатические ГТО и метастатические ГТО – и примерно у двух третей мужчин с эмбриональной карциномой семенников или хорионкарциномой. Бета субъединицу измеряют, поскольку она является специфичной для ХГЧ. Этот маркер присутствует в небольших количествах у здоровых людей. Его уровень повышается в период беременности. Простат-специфический антиген (ПСА), гликопротеин, обнаруживаемый в проницаемых эпителиальных клетках предстательной железы, определяется в низких концентрациях в сыворотке крови здоровых мужчин. С использованием адекватного верхнего предела нормы анализ с использованием моноклональных антител выявляет повышенный уровень ПСА в сыворотке крови примерно у 90% пациентов с распространенным раком предстательной железы, даже в отсутствие определяемой метастатической болезни. Этот анализ чувствительнее, чем анализ с простатической кислой фосфатазой. Однако, поскольку уровень ПСА повышается и при других состояниях (например, доброкачественная гиперплазия предстательной железы, простатит, недавнее инструментальное вмешательство на мочеполовой системе), он менее специфичен. ПСА можно использовать для мониторинга рецидивов после диагностики и лечения рака предстательной железы. СА 125 полезен в клинической практике для скрининга, диагностики и мониторинга терапии рака яичников, хотя при любом перитонеальном воспалительном процессе и некоторых других видах рака уровень его может повышаться. Бета-2-микроглобулин часто повышается при множественной миеломе и при некоторых лимфомах. В основном используется для оценки прогноза. CA 19-9 изначально был разработан для выявления рака толстой кишки, но оказался более чувствителен для определениярака поджелудочной железы. Он в основном используется при принятии решения относительно выбора терапии у пациентов с распространенным раком поджелудочной железы. CA 19-9 также может повышаться при других опухолях ЖКТ, особенно при раке желчных протоков, а также при некоторых доброкачественных новообразованиях желчных протоков и холестатических нарушениях. CA 15-3 и CA 27-29 повышаются у большинства пациентов с метастатическим раком молочной железы. Их уровень также может повышаться и при других состояниях. Эти маркеры в основном используют для мониторинга ответа на терапию. Хромогранин А используется как маркер карциноида и других нейроэндокринных опухолей. Чувствительность и специфичность для нейроэндокринных опухолей может превышать 75%, и диагностическая точность выше для диффузных, чем для локализованных опухолей. Уровень этих маркеров может повышаться при других видах рака, таких как рак легких и предстательной железы, а также при некоторых доброкачественных нарушениях (например, при первичной гипертензии, хронических заболеваниях почек, хроническом атрофическом гастрите). Тироглобулин образуется в щитовидной железе, его уровень может повышаться при различных нарушениях ее функции. Он в основном используется как маркер после тиреоидэктомии для выявления рецидива рака щитовидной железы и для мониторинга ответа на терапию метастатического рака щитовидной железы. TA-90 является высокоиммуногенной субъединицей опухолеспецифического антигена в моче, который присутствует в 70% случаев меланом, сарком мягких тканей и карцином молочной железы, толстой кишки и легких. В некоторых исследованиях показано, что уровень ТА-90 можно использовать для достаточно точного прогноза выживаемости и выявления субклинической болезни после хирургического удаления меланомы. Иммунологические исследования включают также изучение клеточных и гуморальных параметров иммунной системы: Определение клеточного иммунитета (CD3+, CD4+, CD8+, CD16+, CD20+), а также идентификация активационных маркеров лимфоцитов (CD25+, CD38+ и CD95+) проводится с использованием моноклональных антител при подсчете с помощью флуоресцентного микроскопа либо методом проточной цитометрии. Гуморальное звено иммунитета оценивается путем определения основных сывороточных иммуноглобулинов IgG, IgA, IgM, ЦИК мелких и крупных величин в сыворотке периферической крови ИФА-методом. 3. Ситуационная задача. Пациенту Н., 25 лет, необходимо переливание крови по медицинским показаниям. В лабораторию поступил биоматериал данного пациента и бланк-заказ на выполнение исследования: группа крови, Rh-фактор. Вопрос:Интерпретируйте полученный в карте результат. Предполагаемый ответ: 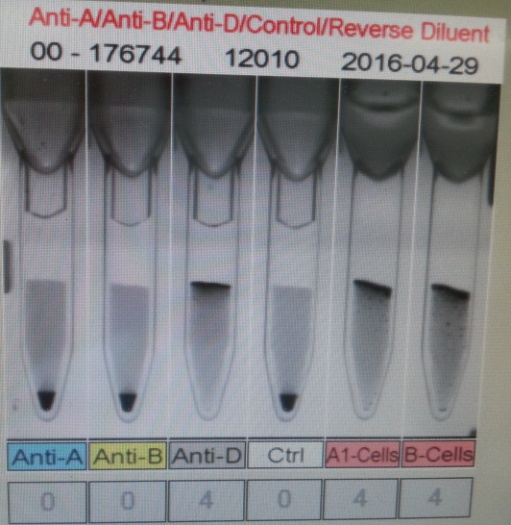 А. 0αβ(I) Rh+ - ответ (нет антигена А и В, есть резус, есть антитела к А1 и В) Б. Аβ(II) Rh- В. Вα(III) Rh+ Г. АВ0(IV) Rh- Билет №20 1.Образование, транспорт и выделение желчных пигментов. Роль печени и кишечника в обмене желчных пигментов. Клиническое значение определения билирубина, его фракций и продуктов обмена. Дифференциальная диагностика желтух (гипербилирубинемий). Образование, транспорт и выделение желчных пигментов. Роль печени и кишечника в обмене желчных пигментов. За сутки у человека распадается около 9 г гемопротеинов, в основном это гемоглобин эритроцитов. Эритроциты в норме живут 90-120 дней, после чего лизируются в клетках ретикулоэндотелиальной системы – макрофагах селезенки (главным образом), купферовских клетках печени и макрофагах костного мозга. При разрушении эритроцитов в кровеносном русле высвобождаемый гемоглобин образует комплекс с белком-переносчиком гаптоглобином (фракция α2-глобулинов крови) и также переносится в клетки РЭС селезенки, печени и костного мозга. Синтез билирубина В клетках РЭС гем в составе гемоглобина окисляется молекулярным кислородом. В реакциях последовательно происходит разрыв метинового мостика между 1-м и 2-м пиррольными кольцами гема с их восстановлением, отщеплением железа и белковой части и образованием оранжевого пигмента билирубина. Высвобождаемое железо может либо запасаться в клетке в комплексе с ферритином, либо выделяться наружу и связываться с трансферрином. 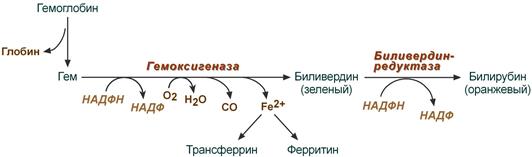 Реакции распада гемоглобина и образования билирубина Билирубин – токсичное, жирорастворимое вещество, способное разобщать окислительное фосфорилирование в клетках. Особенно чувствительны к нему клетки нервной ткани. 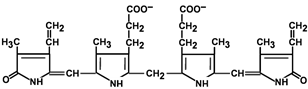 Строение билирубина Выведение билирубина Из клеток ретикуло-эндотелиальной системы билирубин попадает в кровь. Здесь он находится в комплексе с альбумином плазмы, в гораздо меньшем количестве – в комплексах с металлами, аминокислотами, пептидами и другими малыми молекулами. Образование таких комплексов не позволяет выделяться билирубину с мочой. Билирубин в комплексе с альбумином называется свободный (неконъюгированный) или непрямой билирубин. 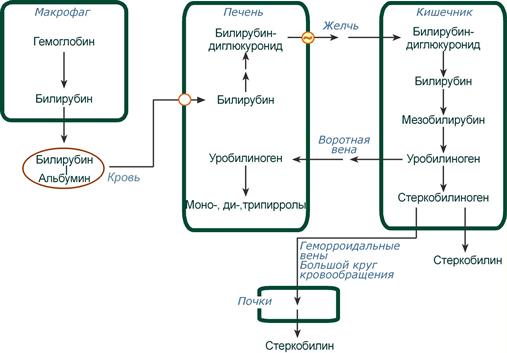 Этапы метаболизма билирубина в организме Из сосудистого русла в гепатоциты билирубин попадает с помощью белка-переносчика (транспортный белок органических анионов) или по механизму флип-флоп. Далее при участии цитозольного связывающего белка лигандина (Y-протеин) билирубин транспортируется в ЭПР, где протекает реакция связывания билирубина с УДФ-глюкуроновой кислотой, при этом образуются моно- и диглюкурониды. Кроме глюкуроновой кислоты, в реакцию конъюгации могут вступать сульфаты, фосфаты, глюкозиды. Билирубин-глюкуронид получил название связанный (конъюгированный) или прямой билирубин.
После образования билирубин-глюкурониды АТФ-зависимым переносчиком секретируются в желчные протоки и далее в кишечник, где при участии бактериальной β-глюкуронидазы превращаются в свободный билирубин. Одновременно, даже в норме (особенно у взрослых), некоторое количество билирубин-глюкуронидов может попадать из желчи в кровь по межклеточным щелям. Таким образом, в плазме крови обычно присутствуют две формы билирубина: свободный (непрямой), попадающий сюда из клеток РЭС (80% и более всего количества), и связанный (прямой), попадающий из желчных протоков (в норме не более 20%). Термины "связанный", "конъюгированный", "свободный", "несвязанный" отражают взаимодействие билирубина и глюкуроновой кислоты (но не билирубина и альбумина!). Термины "прямой" и "непрямой" введены, исходя из возможности химической реакции билирубина с диазореактивом Эрлиха. Связанный билирубин реагирует с реактивом напрямую, без добавления дополнительных реагентов, т.к. является водорастворимым. Несвязанный (жирорастворимый) билирубин требует добавочных реактивов, реагирует не прямо. Превращение в кишечнике В кишечнике билирубин подвергается восстановлению под действием микрофлоры до мезобилирубина и мезобилиногена (уробилиногена). Часть уробилиногена всасывается и с кровью портальной вены попадает в печень, где либо распадается до моно-, ди- и трипирролов, либо окисляется до билирубина и снова экскретируется. При этом при здоровой печени в общий круг кровообращения и в мочу мезобилирубин и уробилиноген не попадают, а полностью задерживаются гепатоцитами. Оставшаяся в кишечнике часть пигментов ферментами бактериальной флоры толстого кишечника восстанавливается до стеркобилиногена. Далее малая часть стеркобилиногена может всасываться и катаболизировать в печени, подобно уробилиногену, незначительное количество стеркобилиногена через геморроидальные вены попадает в большой круг кровообращения, отсюда в почки и в мочу. После окисления на воздухе из стеркобилиногена образуется стеркобилин мочи, однако основное количество стеркобилиногена достигает нижних отделов толстого кишечника и выделяется. В прямой кишке и на воздухе стеркобилиноген окисляется в стеркобилин, окрашивая кал, аналогично уробилиноген, появляющийся в моче при патологии печени, окисляется в уробилин. Клиническое значение определения билирубина, его фракций и продуктов обмена. |