К онтроль качества клинических лабораторных исследований. Внутрилабораторный контроль качества клинических лабораторных исследований. Построение контрольных карт. Критерии оценки контрольной карты. Правила Вестгарда
 Скачать 2.79 Mb. Скачать 2.79 Mb.
|
|
Дополнительные исследования: Апобелки С технической точки зрения, определение уровня апоB и апоA1 обладает некоторыми преимуществами. Доступны качественные иммунохимические методики, которые легко применяются на традиционных автоматических анализаторах. Качество проводимого анализа высокое. Метод не требует взятия крови натощак и не чувствителен к умеренно высоким уровням ТГ. Апобелок B. АпоB является основным апобелком из группы атерогенных липопротеидов, включающей ЛОНП, ЛПП и ЛНП. Концентрация апоB в значительной степени отражает количество этих частиц в плазме. Это особенно важно в случае высокой концентрации в крови мелких плотных частиц ЛНП. В нескольких проспективных исследованиях было показано, что уровень апоB является прогностическим показателем риска, эквивалентным уровню ХС-ЛНП. Основным недостатком этого показателя является то, что он не был включен в алгоритм определения общего ССР и не фигурировал в контролируемых клинических исследованиях в качестве основной мишени терапии. Данные мета-анализа, недавно проведенного группой изучения факторов риска, указывают на отсутствие каких-либо преимуществ апоB перед ХС-неЛВП или традиционными соотношениями липидных фракций. Апобелок A1. АпоA1 является основным белком ХС-ЛВП и хорошо отражает уровень ХС-ЛВП в крови. Каждая частица ЛВП может нести на себе от 1 до 5 молекул апоA1. Плазменный уровень апоA1 < 120 мг/дл у мужчин и < 140 мг/дл у женщин соответствуют низкому содержанию ХС-ЛВП. Соотношения между атерогенными липопротеидами и ХСЛВП (ОХС/ХС-ЛВП, ХС-неЛВП/ХС-ЛВП, апоB/ апоA1) дают в целом сходную информацию, являются ценными показателями для оценки степени риска, но в диагностических целях и при выборе мишеней терапии они должны оцениваться по отдельности. Липопротеид(а) Липопротеин (а) – это макромолекулярный комплекс липопротеина низкой плотности и белка аполипопротеина (а), являющийся индикатором значительно повышенного риска раннего атеросклероза и связанных с ним заболеваний (ишемической болезни сердца, инсульта и заболеваний периферических сосудов). В нескольких исследованиях было установлено, что Лп(а) является дополнительным маркером ССР; генетические исследования доказали его причинную роль в патофизиологии атеросклероза и аортального стеноза. Лп(а) обладает общими свойствами с ЛНП, однако содержит в своем составе уникальный белок апобелок (а) (апо(а)), который структурно отличается от других апобелков. Плазменный уровень Лп(а) в значительной степени генетически предопределен. Чтобы оценить риск развития ранних и тяжелых форм ИБС, ЦВБ и заболеваний периферических сосудов, а также их осложнений – инфаркта миокарда (ИМ), ишемического и геморрагического инсульта и острой артериальной непроходимости. Для выяснения причин ранних форм ИБС, ЦВБ и заболеваний периферических сосудов (в возрасте до 45 лет), особенно при отсутствии "традиционных" факторов риска. Для выяснения причины тяжелого течения ИБС, ЦВБ и заболеваний периферических сосудов: множественного поражения коронарных сосудов, значительного стеноза и вовлечения сосуда на большом протяжении, особенно при отсутствии "традиционных" факторов риска. Чтобы определить вероятность развития рестеноза после ангиопластики и аортокоронарного шунтирования. Чтобы определить причину неэффективности гиполипидемической терапии. 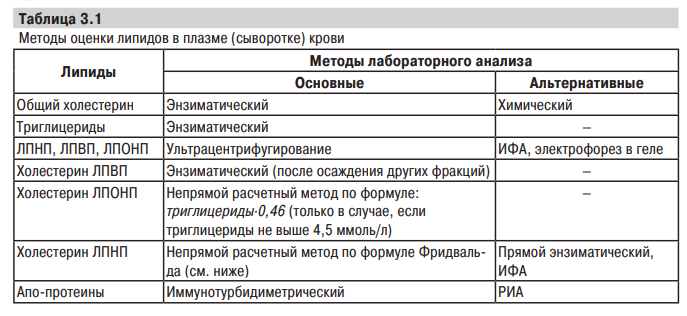 Содержание общего холестерина, а также основных фракций липопротеидов в плазме или сыворотке крови обычно определяется с помощью методов химического или ферментативного (энзиматического) анализа. Строго говоря, последний включает химические подходы к анализу содержания вещества в образце. Так, по мнению экспертов CDC (Center for Disease Control, США), метод оценки содержания общего холестерина Абеля — Кендалла, базирующийся на спектрофотометрическом измерении конечных продуктов реакции Либермана — Бурхарда (гидролиза эстерифицированного холестерина), является своеобразным золотым стандартом. Кроме того, унифицированными методами определения холестерина также являются методы, основанные на реакции с уксусным альдегидом (метод Ильки), реакции с хлорным железом (метод Златкиса — Зака), реакции с хлорным железом после экстрагирования изопропанолом. В основе ферментативного метода лежит способность холестериноксидазы деградировать холестерин, в результате чего образуются холестенон и перекись водорода. Последние, в свою очередь, могут быть определены сравнительно простыми методами: холестенон — спектрофотометрически по изменению светопоглощения при длине волны 240 нм, а перекись водорода — методами, которые используются при определении глюкозы. Сложность ферментативного метода определения холестерина обусловливается дефицитом соответствующих ферментов, которые трудно очистить от каталазы, разрушающей перекись водорода, а также тем, что фермент активен лишь в отношении свободного холестерина, поэтому эфиросвязанный холестерин должен быть предварительно гидролизирован. Кроме того, к одним из наиболее важных факторов, оказывающих негативное влияние на точность измерения содержания общего холестерина, является высокий уровень триглицеридов. Некоторые образцы крови могут содержать частицы, обогащенные триглицеридами, величина которых достаточна для способствования рассеиванию света. При использовании монохроматических спектрофотометров этот феномен часто рассматривается как поглощение. Концентрацию общих липидов в сыворотке крови определяют также методом Свана в модификации Баумана (окрашенные судаковым черным липиды количественно извлекаются из сыворотки крови и определяются фотометрически) и турбидиметрическим методом (метод Уэрги), в основу которого положено измерение оптической плотности жировой эмульсии, образуемой при взаимодействии серной кислоты с n-диоксановым экстрактом липидов сыворотки крови. Для разделения смеси липидов используют методы тонкослойной хроматографии. Для измерения содержания триглицеридов также используют химические (экстракция и восстановление фосфолипидов на твердых сорбентах с последующей сапонификацией высвобождаемого глицерина в триглицериды) и ферментативные методы анализа. Последние базируются на четырех последовательных реакциях: конвертации триглицеридов в глицерин и СЖК с помощью специфической липазы, конвертации глицерина и АТФ в глицерол3-фосфат и аденозиндифосфат (АДФ) с помощью глицеролкиназы, оксидативной конверсии глицерол-3-фосфата. Унифицированными методами определения содержания триглицеридов являются ферментативный метод, а также химические методы определения глицерина, который окисляют йодной кислотой до формальдегида, дающего с хромотроповой кислотой темно-фиолетовое окрашивание, а с ацетил-ацетоном— желтое. Методы оценки содержания холестерина ЛПВП Первоначально липопротеиды, обладающие электрофоретической подвижностью β и пре-β, осаждаются гепарином в присутствии солей марганца и удаляются центрифугированием, при этом хиломикроны всплывают, образуя пленку. В растворе остаются только α-липопротеиды, в которых содержание холестерина определяют любым из описанных методов, например, ферментативным с последующей спектрофотометрией или экстракционным методом с помощью реакции с хлорным железом после экстракции изопропанолом. Вместе с тем, в настоящее время преимуществом пользуются прямые методы измерения содержания ЛПВП. К их реальным преимуществам можно отнести, прежде всего, небольшой объем проб, необходимый для проведения анализа, незначительную интерференцию с билирубином, аскорбиновой кислотой и гемоглобином, а также с триглицеридами (< 12 ммоль/л в образце), возможность использования автоматического анализатора, широкий диапазон измерений. Чаще всего используют метод иммуносепарации, в основе которого лежит образование иммунных комплексов со всеми липопротеидами за исключением ЛПВП. Для идентификации и измерения последних используют высокоточный ферментный метод (Durrington P.N., 1989). Методы оценки содержания холестерина ЛПНП Обычно расчет плазменного содержания ЛПНП производится непрямым расчетным методом по формуле Фридвальда (Friedewald W.T. et al., 1972): Холестерин ЛПНП (мг/дл)=общий холестерин–общий холестерин ЛПВП–триглицериды/5 Холестерин ЛПНП (ммоль/л)=общий холестерин–холестерин ЛПВП–триглицериды/2,2 Эти формулы справедливы при всех уровнях плазменного содержания триглицеридов <500 мг/дл (5,5 ммоль/л) (Friedewald W.T. et al., 1972). Исходя из того, что ЛПНП — это количество холестерина за вычетом холестерина, содержащегося в ЛПОНП и в ЛПВП, количество холестерина в ЛПОНП равно триглицеридам/5, так как концентрация холестерина в ЛПОНП составляет примерно 1 /5 общего количества липидов. Эта формула применяется в случаях, когда у пациента, обследуемого натощак, содержание триглицеридов <400 мг/дл. В полученные параметры ЛПНП входит холестерин, содержащийся в ЛППП, и ЛП (a) (Durrington P.N., 1989). Ультрацентрифугирование Метод ультрацентрифугирования заключается в разделении липопротеидов на фракции при центрифугировании в течение 24–48 ч после предварительного окрашивания последних суданом черным. Скорость вращения ротора центрифуги должна составлять не менее 40 тыс. оборотов в минуту (Попов А.В. и соавт., 1975). К недостаткам данного способа относятся необходимость использования значительного числа реактивов, дополнительного оборудования, а также длительность анализа. Кроме того, этот способ также не является количественным, плохо воспроизводим, а разделение на фракции происходит по сложно определяемому параметру — плавучей плотности Метод спектроскопии оптического смешения Метод спектроскопии оптического смешения заключается в предварительном отделении липопротеидов крови от других белков плазмы с помощью высокоскоростного ультрацентрифугирования в течение 24–48 ч, просвечивании образца липопротеидов в кювете лазерным излучением и измерении спектра рассеянного излучения вблизи длины волны лазерного излучения, математической обработке полученного при измерении физического сигнала (спектра) — I (λ) с помощью ЭВМ, определении фракционного состава липопротеидов по размерам (радиусам) — N(R) (Климов А.Н. и др., 1982). Недостатком данного способа является необходимость предварительного отделения липопротеидов плазмы от других белков крови, для чего используется дорогостоящее оборудование и в связи с этим увеличивается общая длительность анализа до 25–50 ч. Преципитация Традиционно методом преципитации на протяжении многих лет проводили измерение содержания ЛПВП. Метод базируется на осаждении всех частиц, за исключением ЛПВП, после центрифугирования и отделения осадка. В надосадочной жидкости производили измерение ЛПВП. Основной недостаток метода — высокая доля ручной работы, что ограничивало применение автоматизированных систем анализа, негативно отражалось на стоимости исследования и способствовало повышению вариабельности полученных данных. Кроме того, необходимо отметить, что определение методом преципитации ЛПВП ограничено довольно значительным влиянием интерференций, вызванных главным образом триглицеридами, которые в высоких концентрациях препятствуют осаждению преципитата. Другие методы: https://www.researchgate.net/profile/Alexander_Berezin/publication/279536047_Glava-3/links/559654cb08ae99aa62c764c6/Glava-3.pdf?origin=publication_list 2. Аллергические заболевания. Методы лабораторного исследования при аллергических заболеваниях. Значение лабораторно-клинических исследований при аллергии. Под аллергией сегодня принято понимать проявление повышенной чувствительности иммунной системы организма к аллергену (антигену) при повторном с ним контакте, что клинически характеризуется повреждением в первую очередь тех тканей организма, через которые проникает аллерген: слизистой оболочки бронхов, пищевого канала, носовой полости, кожи, конъюнктивы. К наиболее часто встречающимся аллергическим заболеваниям относятся: аллергический ринит и риноконъюнктивит, атопический дерматит, аллергия на лекарства, пищевая аллергия. Аллергенами называют антигены и гаптены, способные индуцировать аллергические реакции. Аллергенными свойствами могут обладать вещества самой различной природы: от простых соединений до сложных — белковых и белково-полисахаридных комплексов. Все аллергены делят на две большие группы: Эндоаллергены, образующиеся внутри организма (ими могут быть клетки, поврежденные инфекцией, химическими, физическими и иными воздействиями); Экзоаллергены — вещества, воздействующие на человека извне. В свою очередь экзоаллергены делятся на две большие группы: аллергены инфекционной и неинфекционной природы. Иммунная система организма реализует гуморальные и клеточные реакции как защитные, направленные на поддержание иммунного гомеостаза, но в некоторых случаях может вызывать повреждение собственных клеток, тканей. Такие реакции, по исторически сложившейся традиции, называют аллергическими, или реакциями гиперчувствительности. Тем не менее, даже в случаях развития повреждения аллергические реакции также рассматриваются как защитные, способствующие ограничению распространения (локализации) попавшего в организм аллергена и его последующего удаления (элиминации) из организма. Сегодня выделяют три стадии истинной аллергической реакции: Иммунная стадия — длится от момента первичного контакта, иммунной системы с аллергеном до развития сенсибилизации. Патохимическая стадия — включается при повторном контакте иммунной системы со специфическим аллергеном и характеризуется высвобождением большого количества биологически активных веществ. Патофизиологическая стадия — характеризуется нарушением функционирования клеток и тканей организма вплоть до их повреждения под влиянием биологически активных веществ, выделенных иммунной системой во время патохимической стадии. Наиболее широко в настоящее время используется классификация реакций гиперчувствительности по Джеллу и Кумбсу (1964), которая предусматривает четыре типа. I тип — анафилактический. При первичном контакте организма с АГ в месте его проникновения АГ захватывается антигенпредставляющими клетками (АПК - В-лимфоцитами, дендритными клетками) и подвергается процессингу с последующей презентацией его преимущественно T-хелперу 2-ого типа. Активированный Th2 продуцируя определенные цитокины (ИЛ-3, ИЛ-4, ИЛ-5 и др.) стимулирует пролиферацию базофилов и дифференцировку В-лимфоцитов в плазматические клетки с переключением их на продукцию IgE (реагинов), прикрепляющиеся Fc-фрагментом к Fcε-рецепторам базофилов и тучных клеток. Повторное введение АГ вызывает его связывание с антителами и дегрануляцию базофилов и тучных клеток с выбросом медиаторов воспаления, прежде всего гистамина. Клинически это проявляется бронхиальной астмой, ринитом, конъюнктивитом, крапивницей, ангионевротическом отеком Квинке, кожным зудом, диареей, увеличением количества эозинофилов в крови и в секретах. [5][7] II тип — цитотоксический. Расположенный на мембране клетки АГ (входящий в её состав либо адсорбированный) распознается антителами IgG и IgM. После этого происходит разрушение клетки путём а) иммуноопосредованного фагоцитоза (в основном макрофагами при взаимодействии с Fc-фрагментом иммуноглобулина), б) комплемент-зависимого цитолиза или в) антитело-зависимой клеточной-опосредованной цитотоксичности (разрушение NK-лимфоцитами при взаимодействии с Fc-фрагментом иммуноглобулина). В качестве клинических примеров аллергических реакций II типа можно привести аутоиммунную гемолитическую анемию, аутоиммунный тиреоидит, аллергический лекарственный агранулоцитоз, тромбоцитопению, нефротоксический нефрит и др. III тип — иммунокомплексный. Антитела классов IgG, IgM образуют с растворимыми антигенами иммунные комплексы, способные откладываться при недостатке их элиминации на стенке сосудов, базальных мембранах (отложение происходит не только механически, но и в силу наличия на этих структурах Fc-рецепторов), с последующей активацией системы комплемента, высвобождением лизосомальных ферментов, образованием кининов, супероксид-анион радикалов, высвобождением гистамина, серотонина, повреждением эндотелия сосудов (васкулит) и к агрегации тромбоцитов со всеми последующими событиями, приводящими к повреждению тканей. [7] Примером реакций III типа являются сывороточная болезнь, местные реакции по типу феномена Артюса, экзогенные аллергические альвеолиты (легкие фермера, легкие голубеводов и др.), гломерулонефрит, некоторые варианты лекарственной и пищевой аллергии, аутоиммунная патология. [5] Вышеназванные типы гиперреактивности относятся к гиперчувствительности немедленного типа (ГНТ). [7] IV тип — гиперчувствительность замедленного типа (ГЗТ). При недостаточной эффективности гуморального механизма (например, при внутриклеточном расположении возбудителя) или в том случае, когда в роли АГ выступают чужеродные клетки, либо клетки собственных тканей, АГ которых изменены (например, гаптеном), в период иммунологической стадии при первичном контакте с АГ и в результате презентации его АПК (макрофагами, дендритными клетками) Т-клеткам происходит созревание преимущественно Т-лимфоцитов 1-ого типа (Th1). Вторичное взаимодействие сенсибилизированного Т-лимфоцита 1-ого типа со специфическим антигеном приводит к образованию им целого набора провоспалительных цитокинов и привлечению клеток моноцитарно-макрофагального ряда приводящих к ГЗТ с образованием гранулем, а при вирусной нагрузке к трансформации Th0 в цитотоксических Т-лимфоцитов. Примером гиперчувствительности замедленного типа являются аллергический контактный дерматит, реакция отторжения аллотрансплантата, туберкулез, лепра, бруцеллез, микозы, протозойные инфекции, некоторые аутоиммунные заболевания. [5] Отдельно выделяют гиперчувствительность V типа (стимулирующую) — аутосенсибилизацию, обусловленную антителами к антигенам клеточной поверхности. При реализации реакций этого типа повреждения клеток не наступает, а, напротив, происходит активация функции клеток. Особенностью этих реакций является то, что в них участвуют антитела, не обладающие комплементсвязывающей активностью. [5] Если такие антитела направлены против компонентов клеточной поверхности, участвующих в физиологической активации клетки, например, против рецепторов физиологических медиаторов, то они будут вызывать стимуляцию данного типа клеток. Например, взаимодействие антител с антигенными детерминантами, входящими в структуру рецептора тиреоидстимулирующего гормона, приводит к реакции, аналогичной действию самого гормона: к стимуляции тиреоидных клеток и продукции тиреоидного гормона. Фактически, такие антитела относятся к аутоиммунным антителам. Этот иммунный механизм лежит в основе развития болезни Грейвса — диффузного токсического зоба. Диагностика аллергических заболеваний проводится в несколько этапов: сбор аллергологического анамнеза; общее клинико-лабораторное обследование (общий анализ крови, мочи и т.д.); специфическая клиническая аллергодиагностика (проведение кожных аллергических проб и/или провокационных тестов с аллергенами); аллергологическое и иммунологическое лабораторное обследование (определение уровня специфических IgE, и др.). Специфическая клиническая аллергодиагностика: Элиминационный тест (Тест основан на оценке состояния пациента после прекращения контакта с аллергеном) Кожные тесты (Постановка кожных тестов является диагностическим методом выявления специфической сенсибилизации организма путем введения через кожу аллергена и оценки величины и характера развитого при этом отека или воспалительной реакции.) Провокационные тесты (нанесение аллергена на слизистую с оценкой реакции) Преимуществами методов лабораторной диагностики, применяемых в аллергологии, являются: - безопасность для пациента; - отсутствие противопоказаний; - возможность проведения исследований в любом, в том числе раннем детском возрасте, в период обострения, при высокой степени сенсибилизации; - выявление реакции на большое число аллергенов за 1 исследование; - отсутствие влияния измененной реактивности кожи; - проведение исследования возможно на фоне лечения. Основными задачами лабораторной диагностики аллергии являются: - установление сенсибилизации к аллергенам (специфическая аллергодиагностика); - определение типа (типов) аллергической реакции (специфическая аллергодиагностика); - выявление характера и степени иммунных нарушений (иммунодиагностика); - характеристика патогенетических изменений в организме, типичных для данного аллергического заболевания (клиническая лабораторная диагностика); - установление неиммунных (псевдоаллергических) механизмов заболевания путем исключения иммунных. Основные показания для назначения лабораторных методов аллергодиагностики: - Ранний детский возраст - Пациенты с высокой степенью сенсибилизации - Непрерывно рецидивирующее течение заболевания без периодов ремиссии - Невозможность отмены антигистаминных и других препаратов - Поливалентная сенсибилизация, когда нет возможности провести тестирование in vivo сразу со всеми предполагаемыми аллергенами в ограниченные сроки обследования - Измененная реактивность кожи (например, у пожилых) - Ложноположительный или ложноотрицательный результат при кожном тестировании - Уртикарный дермографизм В свою очередь, иммунологические тесты в аллергодиагностике условно могут быть разделены на две основные группы: - неспецифические (направленные на выявление общих изменений иммунной системы при аллергии); - специфические (определение участвующих в иммунологической фазе аллергической реакции антител и клеток). Неспецифические тесты выявляют характер и степень иммунных нарушений, в частности определение субпопуляций Т- и В-лимфоцитов, уровня иммуноглобулинов, комплемента, ЦИК, медиаторов аллергического воспаления и цитокинов, в большей степени участвующих в иммунном ответе на аллергены: IL-4 (активация продукции IgE), IL-10, IL-5, интерферона-γ и др. Через 6-18 ч после реакции с аллергеном на сенсибилизированных лимфоцитах усиливается экспрессия рецепторов к IL-2, уровень которой можно оценить с помощью моноклональных антител к CD25-антигену. С этой же целью можно определять наличие на лимфоцитах других молекул активации - CD69, CD71. Известно, что при стимуляции лимфоцитов аллергенами усиливается выделение IL-5, IL-4, интерферона-γ, но не IL-2 и фактора некроза опухолей-α. Например, клиническая картина аллергического ринита зачастую не вызывает сомнений, особенно в случае сезонности симптомов. Однако именно лабораторное обследование будет играть решающую роль, если пациенты склонны к частым простудным заболеваниям, или имеет место вазомоторный ринит, или во время беременности появление симптомов ринита беременных совпадает со временем цветения растений либо имитирует бытовую аллергию. В таких случаях необходимы следующие лабораторные исследования: - клинический анализ крови (при аллергическом рините обнаруживают повышенное количество эозинофилов); - мазок-отпечаток со слизистой носа (в котором также можно наблюдать эозинофилию); - определение общего и аллерген-специфического IgE в сыворотке крови, повышающихся при аллергическом рините. Если данные исследования не дадут ожидаемых результатов, причины ринита следует пересмотреть. Методы: - метод иммунохемилюминисцентного анализа (ИХМ) – общий иммуноглобулин Е (IgE), (радиоиммунный не применяется из-за опасности изотопов, однако несомненное преимущество радиоактивных меток в отсутствии влияния их на афинность реакции антиген-антитело) - метод иммуноферментного анализа (ИФА), или новомодные аллергочипы (позволяют детектировать сотню аллергенов на одного пациента из одного образца) – специфические иммуноглобулины Е (IgE) - метод иммуноблоттинга (ИБ) – основан на реакции антиген-антитело на нитроцеллюлозных пластинах, определяет небольшой спектр специфических иммуноглобулинов Е, применяется реже. - базофильные тесты Шелли: 1. Непрямой - Этот тест основан на изучении морфологических изменений базофилов в результате взаимодействия сыворотки больного и специфического аллергена. Краситель нейтральный красный избирательно окрашивает гранулы базофилов в кирпично-красный цвет, что позволяет их отличать от других клеток. Реакцию наблюдают под микроскопом с иммерсионной системой. Неизмененные базофилы имеют округлую форму; гранулы, окрашенные краской, располагаются внутри клетки. Положительная реакция проявляется в деформации клеток, образовании псевдоподий, усиленном движении гранул и в редких случаях – выходом гранул из клетки с разрывом ее. В каждом препарате насчитывают 40 базофилов, вычисляют процент морфологически измененных клеток и в опыте, и в контроле. Условно выделяют 3 степени реакции: слабую (процент измененных базофилов в опыте превышает таковой в контроле на 10%), умеренную (на 15%), резко положительную (на 20% и более). Во всех случаях имеются в виду результаты контроля с наивысшей неспецифической реакцией базофилов. 2. Прямой - Данный тест основан на изучении морфологических изменений базофилов периферической крови пациента с аллергическим заболеванием при взаимодействии со специфическим аллергеном. Оценка реакции проводится аналогично оценке при непрямом базофильном тесте. Реакция высвобождения гистамина (по P.Scov и соавт.) из базофилов периферической крови человека основана на учете процента высвобождения гистамина после обработки базофильных клеток специфическими аллергенами. Данные методы выявляют только состояние сенсибилизации, т.е. наличие антител при немедленном типе гиперчувствительности свидетельствует о том, что у обследуемого имел место контакт с данным аллергеном. Указанные тесты не могут являться бесспорным доказательством того, что на данный аллерген разовьется аллергическая реакция, так как для возникновения и проявления аллергической реакции недостаточно лишь наличия сенсибилизации и аллергена. Необходим еще ряд дополнительных условий. Методы лабораторной диагностики рассматривают в качестве дополнительных мер, позволяющих уточнить сомнительные результаты тестирования in vivo. Постановка диагноза должна основываться в основном на данных аллергоанамнеза, осмотра больного, результатах постановки кожных проб и провокационных тестов, а также данных общеклинического обследования пациента. - Проточная цитофлуориметрия в исследовании дегрануляции базофилов (модификация теста Шелли с базофилами) – тест активации базофилов (ТАБ) имитирует ситуацию контакта аллергена с клетками крови и позволяет зафиксировать изменения, провоцируемые аллергеном. Принцип метода — выделенные лейкоциты или цельную кровь пациента инкубируют в присутствии изучаемого аллергена и Ко-стимулирующих (праймирующих) факторов — ИЛ3, гепарин, С5а в течение 15-30 минут; останавливают реакцию; клетки окрашивают специфическими антителами, затем анализируют на проточном цитофлуориметре. Используют как минимум 2 контроля: негативный, где клетки инкубируют только в присутствии праймирующего фактора, и позитивный в котором базофилы активируют антителами к IgE или его рецептору или синтетическим стимулятором fMLP. При цитометрическом анализе ТАБ необходимо решить две проблемы: идентифировать популяцию базофилов и зарегистрировать факт активации клеток. Для идентификации базофилов используют различные антитела, такие как анти-IgE, антиCD123 (рецептор ИЛ3), анти-CCR3, анти-CRTH2, анти-CD45. Иногда используют дополнительные маркеры для исключения других клеток, которые могут экспрессировать перечисленные молекулы. Например, CD3 — для исключения Th2, которые также как и базофилы экспрессируют рецептор простагландина D2 CRTH2 или HLA-DR, т.к. базофилы негативны по этой молекуле. Для подтверждения факта активации базофилов исследуют степень поверхностной экспрессии некоторых молекул. Описано увеличение экспрессии CD45, CD11b и CD11c на базофилах при активации in vitro и снижение CD62L и интенсивности флуоресценции базофилов, несущих IgE. В настоящее время в качестве маркеров активации все чаще используют маркер дегрануляции CD63 и активационную молекулу CD203c; идут разработки использования CD13, CD164 и CD107a. CD63 — белок с молекулярной массой 53 kDa, экспрессируется не только базофилами, но и моноцитами, макрофагами и тромбоцитами. Экспрессия этого маркера хорошо коррелирует с дегрануляцией и высвобождением гистамина, поэтому CD63 считается классическим маркером дегрануляции базофилов. Эта молекула расположена на мембране базофильных гранул и при дегрануляции в результате слияния гранул с цитоплазматической мембраной оказывается на поверхности клетки. При активации базофилов экспрессия CD63 увеличивается на 100% (Рисунок 1). |
