К онтроль качества клинических лабораторных исследований. Внутрилабораторный контроль качества клинических лабораторных исследований. Построение контрольных карт. Критерии оценки контрольной карты. Правила Вестгарда
 Скачать 2.79 Mb. Скачать 2.79 Mb.
|
|
3. Ситуационная задача. Относительно здоровый пожилой мужчина прошел текущее обследование. Единственное отклонение от нормы – повышенная активность щелочной фосфатазы сыворотки крови – 400 Е/л. Вопрос: Такое повышение активности фермента может быть связано: Предполагаемый ответ: А. с доброкачественной гипертрофией предстательной железы; Б. сахарным диабетом; В. язвенной болезнью желудка; Г. вирусным гепатитом; Д. остеодеструкцией при метастазах в костную ткань. Билет 16 1) Кинетика ферментативных реакций. Специфичность действия ферментов. Классификация ферментов. Типы катализируемых реакций. Клинико-диагностическое значение определения активности отдельных ферментов. Кинетика изучает изменение скорости ферментативной реакции во времени в зависимости отряда факторов. Концентрация фермента – прямо пропорциональна скорости реакции. Чем выше концентрация фермента, тем выше скорость реакции, она будет максимальной, когда ферменты полностью свяжутся в фермент-субстратный комплекс. Концентрация субстрата – также прямо пропорциональна скорости ферментативной реакции. С повышение концентрации субстрата будет повышаться и скорость реакции, пока не достигнет максимальной. Температура – так как ферменты белковые вещества, то они чутко реагируют на изменение температуры среды, проявляя оптимальную активность в ограниченных пределах. Для ферментов это 35 –450С. При температуре более 450С активность ферментов снижается, а при 70-800С происходит тепловая денатурация молекулы фермента, т. е. фермент инактивируется. При температуре ниже 350С происходит снижение активности фермента, но она восстанавливается при возвращении к оптимальной температуре. При повышении температуры на 100С скорость реакции возрастает в 2 раза. Это происходит до определенного уровня – температурного оптимума – 450С. рН среды – каждый фермент проявляет свою максимальную активность только при определенных значениях рН среды: пепсин – 1.5 – 2.5, трипсин – 6.8 – 7.4, гастриксин – 4.5 – 5.5. При отклонении от оптимума рН наблюдается снижение активности фермента, а при значительных изменениях рН - происходит инактивация фермента. Активаторы – вещества повышающие скорость ферментативной реакции. Например, ионы хлора активируют амилазу слюны, протоны водорода – пепсин. Ингибиторы – вещества способные снижать скорость реакции, путем угнетения действия ферментов. Например, ионы меди тормозят действие амилазы слюны. Процесс действия ингибитора называется - ингибирование. Ингибирование бывает: необратимое, т. е. фермент полностью теряет свою активность, что связано с нарушением его структуры. Это вызывают сильные кислоты, щелочи, спирты, яды. Обратимое - оно происходит только в период непосредственного взаимодействия фермента и ингибитора, после удаления ингибитора активность фермента вновь возвращается. Обратимое ингибирование делится на конкурентное и неконкурентное. Конкурентное ингибирование наблюдается, когда ингибитор и субстрат имеют сходные структуры и конкурируют за связывание с активным центром фермента. Поскольку конкурентный ингибитор связывается обратимо с ферментом, то при увеличении концентрации субстрата увеличивается вероятность связывания фермента и субстрата, и ингибирование таким образом можно преодолеть. Неконкурентное ингибирование наблюдается, когда ингибитор и фермент не сходны по структуре и ингибитор присоединяется к регуляторному центру фермента. В данном типе ингибирования влияние ингибитора не может быть преодолено повышением концентрации субстрата. Специфичность действия ферментов Ферменты обладают более высокой специфичностью действия по сравнению с неорганическими катализаторами. Различают специфичность по отношению к типу химической реакции, катализируемой ферментом, и специфичность по отношению к субстрату. Эти два вида специфичности характерны для каждого фермента. Специфичность по отношению к субстрату– это предпочтительность фермента к субстрату определенной структуры в сравнении с другими субстратами. Различают 4 вида субстратной специфичности ферментов: Абсолютная специфичность– способность фермента катализировать превращение только одного субстрата. Например – глюкокиназа фосфорилирует только глюкозу, аргиназа расщепляет только аргинин, уреаза – мочевину. Относительная специфичность– фермент катализирует превращение нескольких субстратов, имеющих один тип связи. Например – липаза расщепляет сложноэфирную связь в триацилглицеролах. Относительная групповая специфичность– фермент катализирует превращение нескольких субстратов, имеющих один тип связи, но требуется наличие определенных функциональных групп, входящих в состав субстратов. Например, все протеолитические ферменты расщепляют пептидную связь, но пепсин – образованную аминогруппами ароматических аминокислот, химотрипсин – образованную карбоксильными группами этих же аминокислот, трипсин – пептидную связь, образованную карбоксильной группой лизина, аргинина. Стереохимическая специфичность– фермент катализирует превращение только одного стереоизомера. Например, бактериальная аспартатдекарбоксилаза катализирует декарбоксилирование толькоL-аспартата и не действует наD-аспарагиновую кислоту. Специфичность по отношению к реакции Каждый фермент катализирует одну реакцию или группу реакций одного типа. Часто одно и то же химическое соединение выступает как субстрат для разных ферментов, причем каждый из них катализирует специфическую для него реакцию, приводящую к образованию разных продуктов. Специфичность по типу реакции лежит в основе единой классификации ферментов. Всего в современной классификации ферментов выделяют шесть их классов, а именно: Оксидоредуктазы – энзимы, выступающие катализаторами в различных окислительно-восстановительных реакциях, происходящих в клетках. В данный класс входит 22 подкласса. Трансферазы – класс ферментов с 9 подклассами. В него входят энзимы, обеспечивающие реакции транспорта между разными субстратами, ферменты, принимающие участие в реакциях взаимопревращения веществ, а также обезвреживания различных органических соединений. Гидролазы – энзимы, разрывающие внутримолекулярные связи субстрата посредством присоединения к нему молекул воды. В данном классе насчитывается 13 подклассов. Лиазы – класс, в составе которого находятся только сложные ферменты. В нем насчитывается семь подклассов. Энзимы, относящиеся к данному классу, выступают катализаторами в реакциях разрыва С-О, С-С, С-N и прочих типов органических связей. Также ферменты класса лиазы участвуют в обратимых биохимических реакциях отщепления негидролитическим путем. Изомеразы – энзимы, выступающие катализаторами в химических процессах изомерных превращений, происходящих в одной молекуле. Как и к предыдущему классу к ним относятся только сложные ферменты. Лигазы, иначе именуемые синтетазами – класс, включающий шесть подклассов и представляющий энзимы, катализирующие процесс соединения двух молекул под воздействием АТФ. Типы ферментативных реакций Тип "пинг-понг" – фермент сначала взаимодействует с субстратом А, отбирая у него какие либо химические группы и превращая в соответствующий продукт. Затем к ферменту присоединяется субстрат В, получающий эти химические группы. Примером являются реакции переноса аминогрупп от аминокислот на кетокислоты - трансаминирование. Тип последовательных реакций – к ферменту последовательно присоединяются субстраты А и В, образуя "тройной комплекс", после чего осуществляется катализ. Продукты реакции также последовательно отщепляются от фермента. Тип случайных взаимодействий – субстраты А и В присоединяются к ферменту в любом порядке, неупорядоченно, и после катализа так же отщепляются. Липаза – фермент, принимающий участие в расщеплении жиров, поступающих в кишечник вместе с пищей. Наиболее важной для диагностики является панкреатическая липаза. N – 0-417 МЕ/л. Активность панкреатической липазы увеличивается в плазме крови при: Панкреатите любого происхождения. Новообразованиях поджелудочной железы. ГГТ – гаммаглютамилтрансфераза, фермент, принимающий участие в «строительстве» белковых молекул. Катализирует реакцию переноса глютамилового остатка на аминокислоту. В больших количествах содержится в печени, почках, поджелудочной железе, желчных ходах. Определение ГГТ особенно важно при диагностике малосимптомных гепатитов, а также при наблюдении за течением хронических заболеваний печени. Биологическим материалом является сыворотка крови. N – 0.6 - 6.36 ммоль/ч*л. Увеличение активности ГГТ наблюдается при: Механической желтухе (застойная), холестазе. Желче-каменной болезни. Остром вирусном гепатите (активность повышается после падения активности АТ). Хроническом гепатите. Циррозе печени. Инфаркте миокарда (по истечению 4 суток заболевания и держится 2-3 недели, вследствие усиления восстановительных процессах в мышце сердца и печени). Возрастает под влиянием алкоголя (является чувствительным тестом для выявления хронического алкоголизма). Уменьшение активности ГГТ наблюдается при декомпенсированном циррозе печени. ХЭ – холестераза, фермент, расщепляющий эфиры холина. ХЭ представлена двумя видами фермента: ацетилхолинэстераза – участвует в проведении нервного импульса и содержится в нервной ткани, эритроцитах. холинэстераза – продуцируется печенью. Уровень активности ХЭ используется как показатель синтетической активности печени. При выраженном повреждении паренхимы печени активность ХЭ значительно уменьшается. Низкая активность фермента указывает на тяжелое течение заболевания. Нормализация активности фермента свидетельствует об улучшении функции печени. N – 160-340 ммоль/л*ч. Уменьшение активности ХЭ наблюдается при: механической желтухе, холецистите; желчекаменной болезни; циррозе печени; остром гепатите (значительное снижение); инфаркте миокарда; миеломе; Увеличение активности ХЭ наблюдается при: тяжелых заболеваниях почек (нефриты, нефротический синдром); язвенной болезни желудка; ожирении, сахарном диабете. КК – креатинкиназа, фермент принимающий участие в энергетическом обмене клеток мышечной, нервной тканей. Катализируя реакцию образования и распада креатинфосфата. Молекула КК состоит из двух субъединиц – В и М, при комбинации которых образуются три изофермента: КК-ММ – мышечный. КК-МВ – сердечный. КК-ВВ – мозговой. В плазме здорового человека КК-ММ-98%, КК-МВ-2%, а КК-ВВ отсутствует. N – 0 – 1.2 ммоль/л*ч. Увеличение активности КК в сыворотке крови наблюдается: в раннем периоде инфаркта миокарда (в 10-30 раз через 2-3 часа); при поражении мышечной ткани (травме, мышечной дистрофии, тяжелой физической нагрузке); шизофрении, эпилепсии. ЛДГ – лактатдегидрогеназа, фермент катализирующий превращение молочной кислоты в пируват и наоборот. ЛДГ олигомер, состоящий из 4 субъединиц, представленных – Н и М. В плазме выявлено 5 изоферментов: ЛДГ-1-(4Н), локализован в мышце сердца ЛДГ-2-(3Н1М), эритроциты, тромбоциты, сердце. ЛДГ-3-(2Н2М), в поджелудочной железе. ЛДГ-4-(1Н3М), тромбоциты, легкие. ЛДГ-5-(4М), локализован в клетках печени, скелетной мускулатуре. N – 0.8 – 4.0 ммоль/л Увеличение активности ЛДГ в сыворотке крови наблюдается при: инфаркте миокарда (через 12-14 часов после начала ИМ); недостаточности функции сердечно-сосудистой и легочной систем; гемолитической анемии; воспалительных заболеваний печени (особенно острых форм); повреждении мышц; 2) Наследственные, врожденные и приобретенные иммунодефицитные состояния. Врожденные иммунодефициты и их классификация. Основные иммуногенетические механизмы формирования врожденных иммунодефицитов. Иммунодефицит - это нарушение структуры и функции какого-либо звена целостной иммунной системы, потеря организмом способности сопротивляться любым инфекциям и восстанавливать нарушения своих органов. Кроме того, при иммунодефиците замедляется или вообще останавливается процесс обновления организма. Приобретенный иммунодефицит ( вторичная иммунологическая недостаточность ) является результатом воздействия факторов внешней среды на клетки иммунной системы. К наиболее полно изученным факторам приобретенного иммунодефицита относятся облучение, фармакологические средства и синдром приобретенного иммунодефицита (СПИД) человека, вызванный вирусом иммунодефицита человека (ВИЧ). Первичные иммунодефициты (ПИД) с преимущественным нарушением синтеза антител представляют собой генетически детерминированные заболевания, характеризующиеся нарушением процесса антителообразования в ответ на перенесенную инфекцию или вакцинацию. I. Недостаточность гуморального звена иммунитета (системы В-лимфоцитов): 1. Агаммаглобулинемия, сцепленная с полом (б-нь Брутона) 2. Дисгаммаглобулинемии: а. селективный дефицит IgA б. дефицит нммуноглобулинов с повышенным уровнем IgM (гипер-IgM-синдром) в. дефицит субклассов IgG в сочетании или без недостаточности IgA г. общая вариабельная иммунологическая недостаточность (ОВИН) II. Недостаточность клеточных иммунных реакций (системы Т-лимфцитов): 1. Гипоплазия вилочковой и паращитовидной желез (синдром Ди-Джорджа) 2. Лимфоцитарная дисгенезия (с-м Незелофа, французский тип ИДС) III. Комбинированные ИДС (тяжелая комбинированная иммунологическая недостаточность – ТКИН): 1. Ретикулярная дисгенезия 2. Наследственный алимфоцитоз (швейцарский тип ИДС) 3. Дефицит молекул МНС-II класса (синдром "голых" лимфоцитов) 4. Синдром Вискотта-Олдрича 5. Атаксия-телеангиэктазия (с-м Луи-Бар) IV. Недостаточноть фагоцитоза: 1. Нарушение хемотаксиса, миграции н дегрануляции: а. синдром Чедиака-Хигаси б. гипер IgE синдром в. дефицит GP 110 г. дефект связывания актина Дефект эндоцитоза п внутриклеточного распада: а. хроническая гранулематозная болезнь б. ферментопатии нейтрофильных гранулоцнтов (дефицит миелопероксидазы, НАДН-оксидазы, глютатионпероксидазы. гдюкозо-6-фосфатдегидрогеназы) 3. Дефекты опсонизацин и поглощения а. дефекты опсонизации б. дефицит тафтсина в. отсутствие мембранных гликопротеинов LAF-1, CD 18, GP 150, Мас-1 и др. V. ПИД при наследственных аномалиях обмена: 1. Дефицит аденозиндезамнназы (АДА) 2. Дефицит пуриннуклеотидфосфорилазы (ПНФ) VI. Нарушения в системе интерлейкинов и кооперации клеток в иммунном ответе: Множественный дефицит Т-клеточных цитокинов Недостаточность продукции ИЛ-2 VII. Врожденные дефекты системы комплемента: Дефицит ингибитора С1 Дефицит компонентов классического пути активации и др. VIII. Патология местного иммунитета К общим проявлениям иммунодефицитов относятся: - инфекционный синдром (гнойно- септические процессы связаны с нарушениями преимущественно гуморального иммунитета, оппортунистические вирусные, грибковые и протозойные заболевания - с дефектами клеточного иммунитета); - желудочно- кишечные расстройства (нарушения всасывания, дефицит IgA, инфекции желудочно- кишечного тракта); - опухоли иммунной системы; - аллергический и аутоиммунный синдромы (атопии, аутоиммунные гемолитические анемии); - частое сочетание с пороками развития (при врожденных иммунодефицитах); - гематологические изменения (снижение количества лимфоцитов и нейтрофилов, эозинофилия, анемия, тромбоцитопения). 3. Ситуационная задача. Мужчина 39 лет последние 2 года отмечает увеличение веса на 13,5 кг с преимущественным отложением жировой ткани на туловище и лице, появление в областиживота полос бордового цвета и депигментированных, шелушащихся пятен на спине. Лицо приобрело насыщенный красный цвет. При исследовании крови выявлено: содержание кортизола превышает норму в 1,5 раза. Выделение свободного кортизола с мочой превышает норму в 5,5 раза. МРТ гипофиза выявила наличие аденомы. Вопрос: Наиболее вероятный диагноз: Предполагаемый ответ: А. болезнь Адиссона; Б. синдром Кушинга гипофизарного происхождения; В. гипофизарная эндокринопатия; Г. питуитаризм; Д. метаболический синдром. Билет №17 1. Сахарный диабет. Классификация. Патогенез сахарного диабета 1 и 2 типа, других типов диабета. Нарушение углеводного, липидного, белкового обмена при сахарном диабете. Лабораторная диагностика нарушений обмена глюкозы, диагностика сахарного диабета. Сахарный диабет (СД) – это группа метаболических заболеваний, характеризующихся хронической гипергликемией, которая является результатом нарушения секреции инсулина, действия инсулина или обоих этих факторов. Хроническая гипергликемия при СД сопровождается повреждением, дисфункцией и недостаточностью различных органов, особенно глаз, почек, нервов, сердца и кровеносных сосудов. Абсолютная инсулиновая недостаточность – конц. инсулина в крови ниже нормы (характерно для СД1). Относительная инсулиновая недостаточность – конц. инсулина в крови в норме или выше, из-за компенсаторного выброса дополнительного инсулина при наличии инсулинорезистентности других тканей (характерно для СД2). КЛАССИФИКАЦИЯ СД (ВОЗ, 1999): (1) СД 1 типа - деструкция β-клеток поджелудочной железы, обычно приводящая к абсолютной инсулиновой недостаточности. Выделяют: 1. Иммуноопосредованный (аутоиммунный, за счет иммунных механизмов); 2. Идиопатический (за счет другой неясной причины, но теми же симптомами и проявлением). (2) СД 2 типа - наблюдается нарушение действия инсулина и/или секреции инсулина. Причины: 1. Инсулинорезистентность; 2. Нарушение секреции инсулина. (3) Другие специфические типы СД (симптоматический, вторичный диабет): 1. Генетические нарушения функции бета-клеток; 2. Генетические нарушения биологического действия инсулина; 3. Болезни поджелудочной железы (хронический и рецидивирующий панкреатит); 4. Эндокринопатии (при синдроме Кушинга, акромегалии, феохромоцитоме); 5. Вызванный лекарствами или химическими веществами (циклоспорин, тиазидные диуретики); 6. Инфекции (врожденная краснуха или ЦМВ, другие); 7. Редкие иммунные формы диабета (аутоантитела к рецепторам инсулина); 8. Различные генетические синдромы, сочетающиеся с диабетом (например, при с. Дауна). (4) Диабет беременных (гестационный) - любые состояния с нарушением углеводного обмена (в том числе нарушенная толерантность к глюкозе), диагностированные при беременности. Выделение гестационного СД в отдельный тип обусловлено повышенным риском перинатальной смертности и врожденных уродств при нарушениях углеводного обмена у беременных. Обычно проходит после рождения. Патогенез СД1 Ведущим звеном патогенеза СД1 является деструкция β-клеток поджелудочной железы и, как следствие, абсолютная инсулиновая недостаточность. Клинически явный (манифестный) диабет возникает при разрушении 85-90% β-клеток. По механизму запуска гибели островковых клеток СД1 разделяется на идиопатический и аутоиммунный, где второй встречается в 10 раз чаще, чем первый. Аутоиммунная форма СД1 ассоциируется с внутренними (генетическими, в системе HLA) и внешними (провоцирующими) факторами, которые в комбинации друг с другом «запускают» иммунные реакции повреждения островкового аппарата. Патогенез СД2 Ведущим звеном патогенеза СД2 является инсулинорезистентность (недостаточная чувствительность инсулинзависимых тканей к инсулину), сопровождающаяся относительной инсулиновой недостаточностью даже на фоне компенсаторной гиперинсулинемии. Наследование СД2 полигенное, однако, в отличие от наследственной предрасположенности к СД1, оно не имеет связи с генетическими аномалиями в системе HLA. Совместное влияние генетического фактора предрасположенности и хронического действия внешнего фактора (гиподинамия, ожирение, курение, и тп) постепенно приводит к развитию СД2. Предполагается, что инсулинорезистентность обусловливается либо уменьшением числа рецепторов инсулина в определенных тканях-мишенях (мышцы, жировая ткань, печень), либо нарушениями пострецепторных взаимодействий в инсулинзависимых тканях. Со стороны островкового аппарата ответом на инсулинорезистентность является компенсаторное усиление секреции инсулина, что в течение определенного промежутка времени позволяет преодолевать имеющуюся инсулиновую резистентность и препятствовать развитию стойкой гипергликемии. Однако хроническая гиперинсулинемия уменьшает число рецепторов на клетках-мишенях (развивается десенситизация), в результате чего инсулинорезистентность усиливается. β-клетки постепенно утрачивают способность реагировать на гипергликемию, т.е. продуцируют количество инсулина, недостаточное для полной нормализации уровня глюкозы, имеющего постоянную тенденцию к возрастанию из-за существующей (и при этом нарастающей) инсулинорезистентности. Именно так возникает относительный дефицит инсулина на фоне компенсаторной гиперинсулинемии. Длительное активное компенсаторное функционирование β-клеток сопровождается их декомпенсацией, в результате чего в поздней стадии СД2 инсулиновая недостаточность переходит из относи-тельной в абсолютную, что диктует необходимость применения инсулинотерапии (как и при СД1). 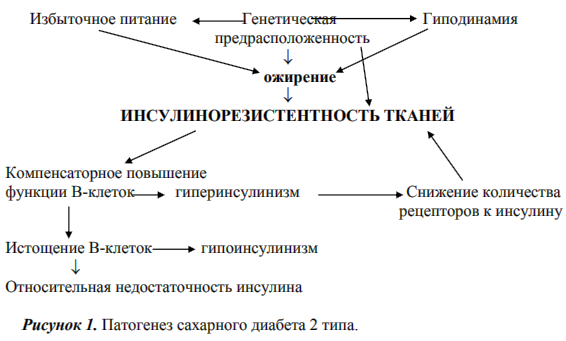  Патогенез других форм СД: диабет и его симптомы являются здесь вторичным проявлением на фоне какого-либо нарушения регуляции или структуры поджелудочной железы. Например, при эндокринопатиях – гиперпродукция контринсулярных гормонов приводит к хронической гипергликемии, при генетических аномалиях – нарушение продукции и секреции инсулина б-клетками, ее транспорта в клетки и т.д., при болезнях поджелудочной железы или инфекциях в связи с хроническим воспалением или другой патологией уменьшается ее секреторная функция и т.д. Все это постепенно приводит к уменьшению концентрации инсулина в крови (абсолютная инсулиновая недостаточность), что по проявлениям больше похоже на СД1. Нарушение метаболизма при СД: Углеводный обмен. Из-за абсолютного или относительного дефицита инсулина снижается поступление глюкозы в инсулинзависимые ткани (мышечную, жировую), что сопровождается их энергетическим голоданием. Для противодействия тканевому энергодефициту в организме активизируются процессы, направленные на повышение уровня глюкозы в крови: 1). Возрастает секреция глюкагона, блокирующего сахароснижающий эффект инсулина. При выраженном кетоацидозе, соответствующем максимальному напряжению углеводного обмена, усиливается также секреция других контринсулярных гормонов – катехоламинов, кортизола и СТГ. 2) В печени и мышцах ослабляется синтез и активируется распад гликогена. 3) В кишечнике повышается активность глюкозо-6-фосфатазы, что соспровождается усилением всасывания пищевой глюкозы в кровь; 4) Усиливается глюконеогенез в печени и, в меньшей степени, в почках. При этом активируются процессы гликогенолиза (в печени и мышцах), протеолиза (в основном в мышцах) и липолиза (в жировой ткани), которые поставляют субстраты для образования глюкозы. Результатом всех этих изменений является гипергликемия, провоцирующая как острые, так и хронические (поздние) осложнения СД. Белковый обмен. Активация глюконеогенеза при СД сопровождается усилением распада белка (в особенности в мышечной ткани) и отрицательным азотистым балансом. При этом в крови и моче регистрируется возрастание уровней мочевины и аминокислот. Избыточный катаболизм белка затрудняет нормальное течение пластических, в том числе и регенераторных, процессов. С этим связывается факт плохого заживления тканей после их травматизации у больных СД. Отклонения в белковом обмене негативно сказываются и на функционировании иммунной системы, в частности на образовании регулирующих иммунный ответ медиаторов белковой природы и антител. Это объясняет ослабление резистентности к инфекции больных СД. Жировой обмен. Возрастание липолиза и угнетение липогенеза, возникающих в результате дефицита инсулина и избытка контринсулярных гормонов (главным образом, глюкагона), мобилизуют свободные жирные кислоты (СЖК) из депо в жировой ткани. Это сопровождается гиперлипидемией и избыточным поступлением в печень СЖК, что провоцирует ее жировую инфильтрацию. Печень переключает метаболизм поступающих СЖК с процесса реэтерификации на их окисление с целью поддержания энергетического обмена в условиях внутриклеточного дефицита глюкозы. При этом образуется большое количество ацетил-КоА, который в условиях торможения липогенеза (из-за дефицита НАДФ+ и торможения цикла Кребса) активно превращается в кетоновые тела (ацетоуксусную кислоту, β-оксимасляную кислоту и ацетон). Если повышенное образование в печени кетоновых тел (кетогенез) начинает превышать способность организма к их утилизации и экскреции, то результатом этого становится кетонемия и связанные с ней метаболический ацидоз и интоксикация. Именно этот механизм лежит в основе одного из тяжелейших острых осложнений СД – кетоацидотической комы. В условиях избытка образования ацетоуксусной кислоты усиливается синтез холестерина, ЛПОНП и ЛПНП, что является одной из составляющих атеросклеротического поражения сосудов при СД. Диагностика СД: Клиническая картина «развернутого» СД складывается из типичных симптомов и жалоб больных, к которым относятся: жажда, сопровождаемая приемом больших количеств жидкости (полидипсия); увеличение суточного диуреза (полиурия); похудание (при СД1) или ожирение (при СД2) на фоне повышенного аппетита (полифагия) (3 «П»). Для подтверждения диагноза сахарного диабета достаточно любых двух из приведенных ниже трех лабораторных критериев: уровень глюкозы плазмы натощак более 7,0 ммоль/л; через 2 часа после проведения перорального теста толерантности (ПГТТ) с 75 г глюкозы уровень глюкозы в плазме – более 11 ммоль/л; глюкозурия (при полиурии, методом сухой химии). Биоматериал сдается строго натощак. Для взятия венозной крови используются вакуумные пробирки (с серой крышкой) со стабилизатором глюкозы (фторид натрия) и антикоагулянтом (ЭДТА). Для мочи – стерильные контейнеры с возможностью срочной доставки в лабораторию (оптимально – 2 часа). ПГТТ следует проводить утром на фоне не менее чем 3-дневного неограниченного питания (более 150г углеводов в сутки) и обычной физической активности. Тесту должно предшествовать ночное голодание в течение 8–14 часов (можно пить воду). Последний вечерний прием пищи должен содержать 30–50г углеводов. После забора крови натощак испытуемый должен не более чем за 5 мин выпить 75г безводной глюкозы или 82,5г моногидрата глюкозы, растворенных в 250–300мл воды. Для детей нагрузка составляет 1,75г безводной глюкозы (или 1,925 г моногидрата глюкозы) на кг массы тела, но не более 75г (82,5 г). В процессе теста не разрешается курение. Через 2 часа осуществляется повторный забор крови. Нельзя проводить на фоне острого заболевания и во время приема препаратов влияющих на уровень гликиемии. В качестве диагностического критерия СД выбран уровень HbA1c ≥6,5% (48 ммоль/моль). Исследование должно быть выполнено с использованием метода определения HbA1c, сертифицированного в соответствии с National Glycohemoglobin Standardization Program (NGSP) или International Federation of Clinical Chemists (IFCC) и стандартизованного в соответствии с референсными значениями, принятыми в Diabetes Control and Complications Trial (DCCT). Таким методом является высокоэффективная жидкостная хроматография (ВЭЖХ). Нормальным считается уровень HbA1c до 6,0% (42 ммоль/моль). Другие методы см. в прак навыках – вопрос 48. Для дифференциальной диагностики форм СД: Определение аутоантител к бета-клеткам поджелудочной железы (методом нРИФ – непрямой реакции иммунофлуоресценции с визуализацией в люминисцентном микроскопе) и аутоантител IgG к глутаматдекарбоксилазе / тирозинфосфатазе (методом ИФА). Определение уровня инсулина и С-пептида (при синтезе инсулина, проинсулин = инсулин + С-пептид, где второй - маркер уровня эндогенного инсулина и секреторной функции ПЖ) методами ИХЛА, ИФА. (Для ответа на вопрос о разнице тестов): В отличие от инсулина, С-пептид не подвергается "эффекту первого прохождения" в печени, поэтому концентрация С-пептида в крови соответствует его продукции в поджелудочной железе. Так как С-пептид вырабатывается в равном соотношении с инсулином, то концентрация С-пептида в периферической крови соответствует непосредственной продукции инсулина в поджелудочной железе. Кроме того, концентрация С-пептида не зависит от изменения уровня глюкозы в крови и относительно постоянна, а при введении экзогенного инсулина невозможно достоверно определить концентрацию эндогенного. Эти особенности позволяют считать анализ на С-пептид наилучшим методом оценить выработку инсулина в поджелудочной железе. Молочная кислота (лактат). Лактатацидоз – метаболический ацидоз с большой анионной разницей (≥10 ммоль/л) и уровнем молочной кислоты в крови > 4 ммоль/л. Биохимический анализ крови: Лактат > 4,0 ммоль/л, реже 2,2 – 4 ммоль/л (определение кинетическим колориметрическим способом). Кетоны. Определяют уровни ацетоацетата в моче (сухая химия) и бета-оксибутирата в крови. Уровень бета-оксибутирата в крови выше 0,5 ммоль/л является повышенным. Определение кетонов и лактата важно для дифференциальной диагностики диабетического ацидоза и комы (лактатацидозной или кетоацидозной). Для диагностики диабетической нефропатии (специфическое поражение почек при СД, сопровождающееся формированием узелкового гломерулосклероза, приводящего к развитию терминальной почечной недостаточности, требующей проведение заместительной почечной терапии (диализ, трансплантация)), определение сывороточного креатинина (кинетический метод Яффе с колориметрией окрашенного в красный цвет раствора после реакции в щелочной среде с пикратом натрия) и СКФ (рассчитывается по формуле). 2. Антигены и антитела системы крови. Антигенные системы эритроцитов человека (АВО, резус и другие системы). Антиэритроцитарные антитела (изологичные, аутологичные и гетерологичные) и их роль в патологии человека. Под группами крови понимают различные сочетания антигенов эритроцитов (агглютиногенов). Антигены групп крови расположены на внешней поверхности мембраны эритроцитов и являются генетическими признаками, наследуемыми от родителей и не изменяющимися в течение жизни. На сегодняшний день известно около 270 антигенов эритроцитов, которые образуют 26 систем антигенов группы крови. Важное значение имеют наиболее иммуногенные (иммуногенность — способность вызывать иммунный ответ после переливания компонентов крови) антигены, в первую очередь систем АВ0, Rh (Резус), Кеll и др. Группа крови системы АВ0 Система АВ0 — первая эритроцитарная система антигенов — открыта венским ученым Карлом Ландштейнером в 1900 г. Чуть позднее, в 1907 г, и независимо от Ландштейнера чешский врач Ян Янский пришел к заключению о существовании четырех групп крови. С этого времени и по сей день определение групп крови по данной системе основывается на наличии в эритроцитах группоспецифических антигенов (0,А,В), а в сыворотке — изоиммунных антител — анти-А (α — устаревшее название) и анти-В (β — устаревшее название). Группоспецифические антигены — 0, А, В – генетически обусловлены. Один из трех аллельных генов передается от матери, другой — от отца. Различные сочетания этих антигенов и антител образуют четыре группы крови. В нашей стране, как и в некоторых других, принято буквенно-цифровое обозначение групп крови — 0 (I), А (II), В (III), АВ (IV). Группа крови в течение всей жизни не меняется. Уникальность системы АВ0 состоит в том, что в плазме у людей имеются естественные антитела к отсутствующему на эритроцитах антигену. Частота встречаемости групп крови по системе АВ0 различна у разных народов и зависит от частоты распространения соответствующего фенотипа. Частота встречаемости групп крови (среднеевропейская популяция): 0 (I) — 43%, А (II) — 42%, В (III) — 11%, АВ (IV) — 4%. По мере продвижения с запада на восток уменьшается встречаемость антигена А и возрастает частота антигена В. Основными продуктами генов — генов A и B, но не гена 0 — являются специфические ферменты гликозилтрансферазы, относящиеся к классу трансфераз. Эти гликозилтрансферазы переносят специфические сахара — N-ацетил-D-галактозамин в случае гликозилтрансфераз A типа, и D-галактозу в случае гликозилтрансферазы B-типа. При этом все три типа гликозилтрансфераз присоединяют переносимый углеводный радикал к альфа-связующему звену коротких олигосахаридных цепочек. Субстратами гликозилирования этими гликозилтрансферазами являются как раз углеводные части гликолипидов и гликопротеидов мембран эритроцитов, и в значительно меньшей степени — гликолипиды и гликопротеиды других тканей и систем организма. Именно специфическое гликозилирование гликозилтрансферазой A или B одного из поверхностных антигенов эритроцитов — агглютиногена — тем или иным сахаром (N-ацетил-D-галактозамином либо D-галактозой) и образует специфический агглютиноген A или B. Группа крови системы Резус Система антигенов Резус (от макак Резус, на эритроцитах которых впервые были выявлены эти антигены) представлена 6 антигенами, которые наследуются и не меняются в течение всей жизни. После антигенов АВ0 система антигенов Резус имеет наибольшее значение в клинической практике. Антигены системы резус встречаются со следующей частотой: Д – 85 %; С – 70 %; с – 80 %; Е – 30 %; е – 97,5%. Антигены системы резус обладают способностью вызывать образование иммунных антител. Наиболее активным в этом отношении является антиген Д, который и подразумевается под термином «резус – фактор». Именно по наличию или отсутствию антигена Д все люди делятся на резус – положительных и резус – отрицательных. Иммуногенность других антигенов системы резус существенно ниже и убывает в следующем ряду: с > Е > C > е. Обладая выраженными иммуногенными свойствами, антиген D в 95 % случаев является причиной гемолитической болезни новорожденных при несовместимости матери и плода, а также частой причиной посттрансфузионных осложнений. Доноры, на эритроцитах которых отсутствует антиген Д, но присутствует один из антигенов С или Е, считаются резус – положительными. В системе Резус встречаются случаи отсутствия на эритроцитах какого-либо из антигенов и очень редко – полное отсутствие всех антигенов системы резус (фенотип Rh – ноль). Из-за сложной структуры антигенов системы резус существует возможность возникновения трудностей при определении резус – принадлежности крови человека. Не правильное определение резус – принадлежности может привести к развитию осложнения после переливания компонентов крови, несовместимых по антигенам Резус. Частота резус-положительных лиц достигает среди европейцев 85%, а среди монголоидов — 99%. |
