К онтроль качества клинических лабораторных исследований. Внутрилабораторный контроль качества клинических лабораторных исследований. Построение контрольных карт. Критерии оценки контрольной карты. Правила Вестгарда
 Скачать 2.79 Mb. Скачать 2.79 Mb.
|
|
3. Ситуационная задача. Мужчина 47 лет предъявляет жалобы на боли в костях, геморрагии, объективно - отмечается увеличение печени, селезенки, лимфатических узлов. В анализе крови: эритроциты – 2,9 × 1012/л, Нb – 91 г/л, тромбоциты – 110 × 109/л, лейкоциты – 9,8 × 1012/л, сегментоядерные нейтрофилы – 33%, лимфоциты – 60%, моноциты – 6%, эозинофилы – 1%, СОЭ – 65 мм/ч. В пунктате грудины 80% составляют лимфоциты, в том числе с выраженной базофилией цитоплазмы, плазматические клетки – 8%. На электрофореграмме белков сыворотки крови – М-градиент. Электрофорез с иммунофиксацией показал наличие моноклонального IgMκ. Вопрос: Клинико-лабораторные данные наиболее характерны для заболевания: Предполагаемый ответ: А. анемия хронического заболевания; Б. миеломная болезнь; В. аутоиммунная тромбоцитопения; Г. макроглобулинемия Вальденстрема; Д. cистемная красная волчанка с антифосфолипидным синдромом. Билет 15 1) Белки плазмы крови. Состав и функции белков плазмы крови. Гипопротеиннемия, гиперпротеинемия, диспротеинемия, парапротеинемия. Причины развития. Электрофорез белков сыворотки крови. В плазме крови человека содержится около 100 различных белков. Их концентрация колеблется в пределах 5,5 – 8,5 г /100 мл. Выделяют следующие фракции: преальбумины, альбумины, a1 -, a2- , b-, g- глобулины и фибриноген. Соотношение количества белков этих фракций имеет важное диагностическое значение. 1) Преальбумины выполняют транспортную функцию. Переносят тироксин и ретинол. Содержание этого белка снижается при циррозе и хроническом гепатите печени, когда нарушается ее белоксинтезирующая активность. 2) Альбумины – наиболее гомогенная фракция белков крови. Основная функция – связывание воды, что обеспечивает коллоидно-осмотическое (онкотическое) давление в крови. Альбумины транспортируют ионы магния, кальция, билирубин, свободные ЖК, стероидные гормоны, такие лекарственные соединения как антибиотики, барбитураты, сердечные гликозиды. Снижение содержание альбуминов наблюдается при повышении проницаемости сосудов клубочка нефрона (нефротический синдром) и заболеваниях печени. 3) a1-глобулины. К этой фракции относятся два белка: Антитрипсин – ингибитор таких протеиназ как трипсина, химотрипсина, плазмина. Его содержание повышается при воспалительных заболеваниях и механических повреждениях тканей. Гликопротеин содержит в составе около 40 % углеводов. Транспортирует стероиды. Повышается его содержание при воспалительных процессах, снижается при циррозе печени. 4) a2-глобулины содержат следующие белки: Макроглобулин – цинксодержащий гликопротеин с большой молекулярной массой. Ингибирует протеолитические ферменты, как и антитрипсин. Содержание его увеличивается при циррозе, нефротическом синдроме, сахарном диабете и не изменяется при воспалении. Гаптоглобин связывает и транспортирует свободный гемоглобин А. Содержание снижается при поражениях паренхимы печени, гемолитической анемии. Увеличивается при воспалении и сахарном диабете. Церулоплазмин – медьсодержащий белок. Окисляет двухвалентное железо в трехвалентное. 3) b-глобулины представлены двумя белками: Трансферрин участвует в транспорте трехвалентного железа. Гемопексин переносит свободный гем, порфирин. Связывает гемсодержащие белки и переносит их в печень для разрушения. 4) g-глобулины. В этой фракции представлены антитела. Эти белки обладают двоякой специфичностью: по отношению к данному виду животного и к белку-антигену, вызвавшему образование антител. Они состоят из двух цепей тяжелой и легкой, соединенных между собой дисульфидными связями. Помимо вышеперечисленных белков в состав плазмы крови входят факторы коагуляции: 1) фибриноген – фибриллярный белок, который образует основу тромба; 2) протромбин – кальцийсвязывающий белок, предшественник тромбина – фермента, который катализирует превращение фибриногена в фибрин; 3) ионизированный кальций – обеспечивает сближение и оптимальную ориентацию ферментов гемостаза.; 4) проакцелерин – липопротеид, обеспечивает нормальную взаимоориентацию; 5) проконвертин – кальцийсвязывающий белок; 6) антигемофилический глобулин – гликопротеид. И еще ряд гликопротеидов. Их взаимодействие направлено на превращение растворимого белка фибриногена в нерастворимый фибрин.
Гипопротеинемия – уменьшение концентрации белков в крови. Абсолютная гипопротеинемия возникает после увеличения выделения почками альбумина при их патологии или в результате нарушения синтеза. Гипоальбуминемия, как правило, основная причина гипопротеинемии. Недостаточный синтез альбумина в печени может быть связан с уменьшенным поступлением аминокислот или с повреждением гепатоцитов. Нарушение всасывания в кишечнике (синдром мальабсорбции) может быть результатом бактериальной или паразитарной (лямблиоз) инфекции, муковисцедоза, колита, дисахаридазной недостаточности, энтеропатии с потерей белков или демпинг-синдрома. Поражение гепатоцитов может быть при циррозе, токсикозе, атрофии, метастазировании или первичном раке печени. Относительная гипопротеинемия возникает, например, в результате избыточной инфузионной терапии или значительного уменьшения выделения мочи (олигурия, анурия). Потеря белка возникает при: нефротическом синдроме при гломерулонефрите (80 %), диабете, системной красной волчанке и других аутоиммунных заболеваниях, амилоидозе, тромбозе почечных вен; энтеропатии в результате заболеваний желудка или кишечника, колита, полипов; поражениях кожи: ожоги, дерматоз; экссудатах и транссудатах: перитонит, плеврит, асцит; усиленном катаболизме: сепсис, лихорадки, злокачественные опухоли. Гиперпротеинемия – повышение концентрации общего белка в крови. Может быть две основных причины повышения общего белка в сыворотке: уменьшение объема плазмы при дегидратации и повышение в плазме содеражания одного или нескольких специфических белков. В связи с этим различают абсолютную гиперпротеинемиюй, например, повышение концентрации иммуноглобулинов (парапротеинемия), и относительную гиперпротеинемию при дегидратации. Гиперпротеинемия не может быть результатом усиленного синтеза альбумина, поэтому гиперальбуминемия указывает на дегидратацию или артефакты (стаз крови при венопункции ). Выраженное поликлональное увеличение иммуноглобулинов наблюдается при хроническом бактериальном воспалении, обострении вирусных инфекций (в частности, ВИЧ), хронических заболеваниях печени (хронический и подострый гепатит), аутоиммунных болезнях (ревматоидный артрит, дерматомиозит), саркоидозе. Диспротеинемия проявляется количественными и качественными изменения концентрации нормальных белков плазмы, например, при остром воспалении, циррозе печени, болезнях почек, парапротеинемии, опухолях. Диспротеинемия может быть обусловлена увеличением или уменьшением концентрации отдельных групп белков или продукцией новых белков, которые до этого не выявлялись. Диспротеинемия выявляется при электрофорезе белков плазмы. Парапротеинемии (моноклональные гаммапатии). Парапротеины – это иммуноглобулины или их фрагменты, вырабатываемые плазматическими клетками, образующимися из одной специфической клетки линии В лимфоцитов (моноклон). Парапротеины часто не способны выполнять функцию антител. Парапротеины обычно структурно однородны, то есть молекула состоит из тяжелых или легких цепей одного типа, иногда они состоят только из отдельных легких цепей (каппа или лямбда) или только из тяжелых цепей (фрагментов иммуноглобулинов). Класс и тип не меняется в течение болезни. Так как все молекулы идентичны, то парапротеины определяются при электрофорезе белков по наличию узкого пика (М-градиента), обычно в зоне γ-глобулинов (моноклональная гаммапатия). Тем не менее, достаточно часто полоса М-градиента может мигрировать от γ-глобулинов до альбумина. Миграция М-градиента может быть обусловлена присутствием фрагментов IgG или IgM, полимеризацией иммуноглобулинов или образованием комплексов иммуноглобулинов с другими белками плазмы. Парапротеины (обычно IgG или IgM) встречаются наиболее часто при множественной миеломе, при таких системных заболеваниях иммунной системы, как макроглобулинемия Вальденстрема, острый плазмобластный лейкоз, болезни тяжелых цепей, лимфомы с парапротеинемией. Электрофорез белков сыворотки крови. Электрофорез широко используется для полуколичественного определения белков сыворотки и для выявления парапротеинов. Электрофорез проводится с сывороткой, а не с плазмой, так как присутствие фибриногена в плазме приводит к образованию выраженной β2-полосы, что может быть расценено как парапропротеинемия. Электрофорез на ацетате целлюлозы или геле агарозы разделяет белки на фракции альбумина, α1-, α2-, β- и γ-глобулины. 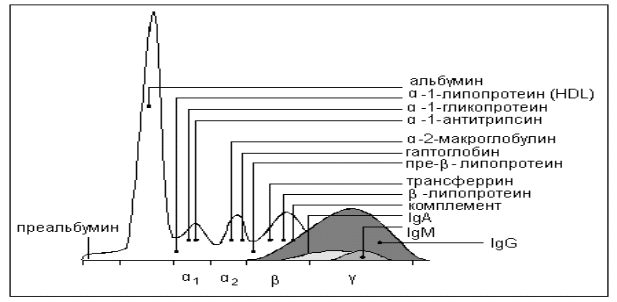 Основные типы протеинограмм. Острофазный ответ – повышение α1- и α2-глобулинов в связи с усилением биосинтеза в печени белков острой фазы при воспалении любой этиологии (травма, хирургическое вмешательство, острый инфаркт миокарда, инфекция и др.). Хроническое воспаление – увеличение γ-глобулинов (хронические гепатиты разной этиологии, ревматоидный артрит, некоторые хронические инфекции). Цирроз печени – увеличение γ-глобулинов, слияние β- и γ-глобулинов вследствие мезенхимально-воспалительного синдрома, при развитии гепатодепрессивного синдрома возможно снижение альбумина. Нефротический синдром – повышение α2-глобулинов в связи с усилением синтеза и повышением сывороточного уровня α2-макроглобулина, возможно снижение альбумина из-за его массивной потери с мочой. Моноклональная гаммапатия – появление на электрофореграмме отдельной дискретной полосы в области глобулярных фракций (моноклональный белок, М-градиент, М-белок), состоящей из иммуноглобулинов или их фрагментов, синтезирующихся злокачественно трансформированными клонами В-лимфоцитов. Концентрации М-белка более 15 г/л с высокой вероятностью свидетельствует о миеломной болезни. При болезни лёгких цепей М-белок при электрофорезе сыворотки может не определяться, поскольку лёгкие цепи иммуноглобулинов (белок Бенс-Джонса) проходят через почечный фильтр и выводятся с мочой. Появление М-белка может наблюдаться при хронических гепатитах, циррозе печени, а также у некоторых пациентов престарелого возраста без клинических патологий, ассоциированных с моноклональной гаммапатией. Имитировать М-белок могут высокие концентрации C-реактивного белка и некоторых других острофазных белков, а также фибриноген. При выявлении М-белка необходима его последующая иммунохимическая идентификация методом электрофореза с иммунофиксацией. 2) Антигены тканевой совместимости и их генитический контроль. Главный комплекс гистосовместимости человека. Структурная организация и генная карта. Антигены I, II, III классов в тканевой совместимости, их экспрессия и роль в иммунном ответе. Корреляция с различными заболеваниями. Главный комплекс гистосовместимости - комплекс тесно сцепленных генетических локусов, а также их белковых продуктов, отвечающих за развитие иммунного ответа и синтез трансплантационных антигенов. Основные свойства MHC • Полигенность (открыто более 200 генов, входящих в состав главного комплекса гистосовместимости) • Полиморфность (для значительной части генов системы гистосовместимости существуют множественные аллельные варианты) • Кодоминантность (в гетерозиготном состоянии проявляются оба аллельных варианта) • Высокая гетерозиготность Основные физиологические функции МНС • Обеспечение взаимодействия клеток организма • Обеспечение процессинга (переработки) и презентации пептидов – индукторов и мишеней иммунного ответа • Распознавание собственных, измененных собственных и чужеродных клеток => запуск и реализация иммунного ответа против носителей генетической чужеродности • Поддержание иммунологической толерантности (в том числе во время беременности) • Участие в позитивной и негативной селекции T-лимфоцитов • Создание генетического разнообразия и обеспечение выживаемости вида Комплекс HLA локализован в коротком плече хромосомы 6 человека. Выделяют три класса генов HLA • В отторжении несовместимых трансплантатов и презентации антигена Тклеткам участвуют продукты генов классов I и II. • Гены HLA класса III кодируют некоторые компоненты комплемента, цитокины семейства фактора некроза опухоли, белки теплового шока. 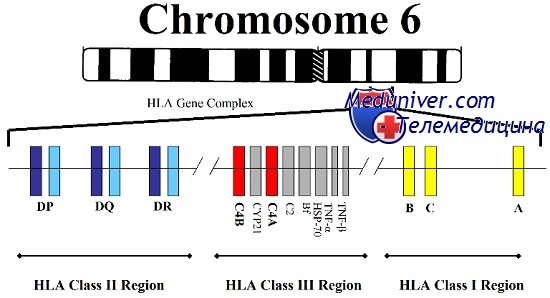 Гены HLA I класса Выделяют 2 группы генов I класса: • Первую образуют гены А, В и С, отличающиеся высоким полиморфизмом (известно по нескольку сотен их аллельных форм). Это классические гены I класса • Другую группу образуют неклассические гены Е, F, G, H (гены с ограниченным полиморфизмом). Характеристика генов HLA I класса • Продукты классических генов I класса участвуют в презентации антигена Тлимфоцитам • Экспрессия HLA-G обнаружена только на клетках плаценты – цитотрофобластах. Наиболее выраженная экспрессия в I триместре беременности. HLA-Н является псевдогеном, молекула нефункциональна. Особенности экспрессии в тканях и биологические функции HLA-E и HLA-F неизвестны. Локализация белковых продуктов генов HLA I • Продукты генов HLA I класса экспрессируются (располагаются) на мембранах ВСЕХ соматических клеток. • Исключение составляют эритроциты (лишены ядра) и клетки ворсинчатого трофобласта (обеспечение толерантности к плоду; на трофобласте экспрессированы неклассические молекулы HLA I). Гены HLA II класса Выделяют 2 группы генов II класса: • Классические локусы DR (α и β), DP (α и β) и DQ (α и β). Для генов β-цепей характерен значительно более высокий полиморфизм, чем для генов α-цепей. • Гены с невысоким уровнем полиморфизма - (HLA-DM, HLA-DO, ТАР, LMP). Гены DR (α и β), DP (α и β) и DQ (α и β) и кодируемые ими соответствующие полипептидные цепи участвуют в презентации антигена • Гены ТАР, LMP участвуют во внутриклеточном процессинге антигенов; • Гены HLA-DM, HLA-DO - способствуют встраиванию антигенного пептида в молекулы MHC-II . Продукты генов HLA II класса постоянно экспрессируются на мембранах антигенпредставляющих клеток (дендритные клетки, макрофаги, Bлимфоциты). • Молекулы HLA II могут присутствовать на мембранах нейтрофилов, тучных клеток, базофилов, эозинофилов, при стимуляции появляются на эпителии и эндотелии. Гены HLA III класса Продукты этих генов не полиморфны и не имеют прямого отношения ни к гистосовместимости, ни к презентации антигена. Гены HLA III класса Продукты этих генов не полиморфны и не имеют прямого отношения ни к гистосовместимости, ни к презентации антигена. Основная биологическая роль HLA I класса состоит в том, что они определяют биологическую индивидуальность («биологический паспорт») и являются маркерами «своего» для иммунокомпетентных клеток. Заражение клетки вирусом или мутация изменяют структуру HLA I класса.Содержащая чужеродные или модифицированные пептиды молекула МНС I класса имеет нетипичную для данного организма структуру и является сигналом для активации Т-киллеров (CD8+ - лимфоциты). Клетки, отличающиеся по I классу, уничтожаются как чужеродные. Биологическая роль МНС II класса чрезвычайно велика. Фактически этот комплекс участвует в индукции приобретенного иммунного ответа. Фрагменты молекулы антигена экспрессируются на цитоплазматической мембране особой группы клеток, которая получила название антигенпрезентирующих клеток (АПК). Это еще более узкий круг среди клеток, способных синтезировать МНС II класса. Наиболее активной АПК считается дендритная клетка, затем – В-лимфоцит и макрофаг. Структура МНС II класса с включенным в него пептидом в комплексе с ко-факторными молекулами CD-антигенов воспринимается и анализируется Т-хелперами (CD4+-лимфоциты). В случае принятия решения о чужеродности включенного в МНС II класса пептида Т-хелпер начинает синтез соответствующих иммуноцитокинов, и включается механизм специфического иммунного реагирования. В итоге активируется пролиферация и окончательная дифференцировка антигенспецифичных клонов лимфоцитов и формирование иммунной памяти. Существует взаимосвязь между HLA 1 и 2 классов и предрасположенностью к самым различным заболеваниям. Иногда даже у здоровых людей в крови отсутствуют иммуноглобулины класса А. Такие люди чрезвычайно подвержены заболеваниям дыхательной системы. Оказалось, что у 80% таких людей имется антиген В8, а почти у 50% – антиген DR3. Нередко при наличии HLA-A1, B8 у детей очень рано выявляется бронхиальная астма и одновременно отмечается дефицит секреторного IgA. В группе больных ишемической болезнью сердца (ИБС) более часто, чем у здоровых, определяются антигены A10, DR2 и DR5. У детей при наличии антигенов A10, DR2 и DR5 выявлены неблагоприятные сдвиги в показателях углеводного и липидного обменов, а также торможение фибринолиза, что является ведущими факторами для возникновения атеросклероза и ИБС. Установлено, что антиген HLA B27 связан с иммунокомплексными заболеваниями – анкилозирующим спондилоартритом, болезнью Рейтера (триада – артрит, уретрит и конъюнктивит), диффузными болезнями соединительной ткани, болезнью Бехтерева. У больных острым панкреатитом установлено повышение частоты А1, В8, В18. В то же время у больных острым деструктивным панкреатитом отсутствует антиген В16, а при отечной форме острого панкреатита – антиген В27. У больных системной красной волчанкой (СКВ) существенно повышена частота распределения Аг HLA-B27, B8 и В17. Хронический характер течения СКВ наблюдается при наличии антигенов Cw6-Cw7. Сочетание этих признаков с антигенами В8-В27 или В12-В18 повышает возможность развития именно хронического варианта течения СКВ до 99%. У людей, страдающих ревматизмом, наблюдается довольно значительное повышение частоты HLA-B7 и HLA-B8, наряду со снижением частоты антигенов HLA-A3, HLA-A19, HLA-B13, HLA-B14 и HLA-B21. Среди населения России рак легких значительно чаще выявляется у лиц, имеющих антиген HLA-DR4, а рак желудка – при сочетании антигенов HLA-A1-B27, A3-B12, A9-B35. Более того, некоторые Аг или их сочетание – HLA-В51, HLA-B5, DR2, HLA-B13, DR1, HLA-A9, DR1 – не выявляются у здоровых лиц и с различной частотой определяются у больных раком желудка. У мужчин с различным исходом клещевого энцефалита неблагоприятный прогноз ассоциируется с антигенами HLA-A3 и HLA-B35 и сочетанием антигенов HLA-A3-A9. Для прогнозирования неблагоприятного исхода для женщин значимыми являются признаки А28-В28, В7-В16, В13-В16. При перенашивании беременности чаще встречаются антигены А2, А11, В8, В40, DR6. При невынашивании беременности превалируют антигены А3, А23, А29, А9, В12, В5, В7, В52, DR7, DR3. При ЕРН-гестозе (токсикозе беременных) чаще выявляются антигены А1, А9, А10, В5, В7, В12, В27, DR2, DR3. Установлена пародонтит-протективная роль антигенов HLA-A1, A9, A26, B13 и С4. Предрасположенность к генерализованному пародонтиту связана с антигенами А28, В7 и В27. Повышенная восприимчивость к возникновению кариеса обусловлена антигенами А26 и В27. Выявив в детстве гаплотип ребёнка (составив карту иммуногенетического обследования – HLA 1 и 2 классов), можно со значительной долей вероятности предсказать, к каким заболеваниям предрасположен человек, и применить комплекс профилактических мер, направленный на предупреждение этих патологических состояний. |
