Коммуникации эндокринная
 Скачать 1.15 Mb. Скачать 1.15 Mb.
|
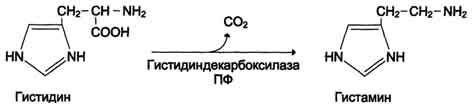 Схема А участвует в формировании воспалительной реакции - вызывает расширение сосудов, покраснение кожи, отёчность ткани; вызывает аллергическую реакцию; выполняет роль нейромедиатора; является медиатором боли. Серотонин. Синтез. Химическая природа. Биологическая роль. Синтез и биологическая роль серотонина 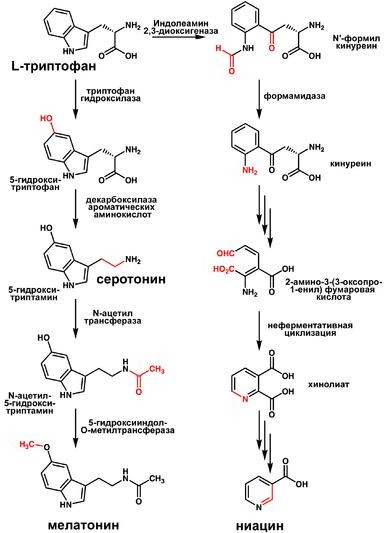 Серотонин - нейромедиатор проводящих путей. Образуется в надпочечниках и ЦНС из аминокислоты 5- гидрокситриптофана в результате действия декарбоксилазы ароматических аминокислот. Этот фермент обладает широкой специфичностью и способен также декарбоксилировать триптофан и ДОФА, образующийся из тирозина. 5-Гидрокситриптофан синтезируется из триптофана под действием фенилаланингидроксилазы с коферментом Н4БП (этот фермент обладает специфичностью к ароматическим аминокислотам и гидроксидирует также фенилаланин) (см. схему ниже). Серотонин может превращаться в гормон мелатонин, регулирующий суточные и сезонные изменения метаболизма организма и участвующий в регуляции репродуктивной функции. Серотонин - биологически активное вещество широкого спектра действия. Он стимулирует сокращение гладкой мускулатуры, оказывает сосудосуживающий эффект, регулирует АД, температуру тела, дыхание, обладает антидепрессантным действием. По некоторым данным он может принимать участие в аллергических реакциях, поскольку в небольших количествах синтезируется в тучных клетках. Биологические активные пептиды: брадикинины, нейропептиды, атриопептиды. Биологическая роль. Нейропептиды (НП) присутствуют в немиелинизированных волокнах С-типа и небольших миелинизированных волокнах А-дельта-типа. Они синтезируются клетками дорзальных рогов ганглиев, а затем транспортируются вдоль аксонов в нервные окончания, где накапливаются в плотных везикулах. Вначале было изучено влияние НП на сосудистый тонус. Од- нако впоследствии было обнаружено, что некоторые из них генерируют и поддерживают воспалительный процесс, называемый «нейрогенным». Брадикинин (англ. Bradykinin) — пептид, расширяющий кровеносные сосуды и потому снижающий артериальное давление. Ингибиторы АПФ[1], которые используются для снижения артериального давления, повышают уровень брадикинина. Брадикинин воздействует на кровеносные сосуды, высвобождая простациклин, оксид азота(II). Брадикинин — это физиологически и фармакологически активный пептид из кининовой группы белков, состоящий из девяти аминокислот. Считается, что брадикинин является основным фактором, обеспечивающим болевую чувствительность, являясь плазменным алгогеном. Брадикинин открыт в 1948 году коллективом бразильских учёных, руководил которым М. Роша э Силва (англ.)русск., они же исследовали свойства пептида, включая гипотензивные. атриопептиды - выделенные из ткани предсердия, усиливают клубочковую фильтрацию и выделение натрия и хлоридов почками; нейропептиды - выделенные из тканей мозга. Некоторые из них имеют отношение к обезболивания, сна, механизмов памяти, обучения и т.д.; Особенности развития, строения и метаболизма эритроцитов. Эритроциты - высокоспециализированные клетки, которые переносят кислород от лёгких к тканям и диоксид углерода, образующийся при метаболизме, из тканей к альвеолам лёгких. Транспорт О2 и СО2 в этих клетках осуществляет гемоглобин, составляющий 95% их сухого остатка. Организм взрослого человека содержит около 25×1012 эритроцитов, при этом каждые сутки обновляется примерно 1% этого количества клеток, т.е. в течение одной секунды в кровоток поступает около 2 млн эритроцитов. А. Особенности строения и дифференцировки эритроцитов Эритроциты - единственные клетки, доторые имеют только клеточную мембрану и цитоплазму. Дифференцировка стволовых клеток в специализированные происходит в клетках костного мозга и заканчивается в кровотоке. Особенности строения эритроцитов соответствуют их функциям: большая площадь поверхности обеспечивает эффективность газообмена, эластичная клеточная мембрана облегчает движение по узким капиллярам, специальная ферментативная сисгема защищает эти клетки от активных форм кислорода. Дифференцировка эритроцитов. Эритроциты, так же как и другие клетки крови, образуются из полипотентных стволовых клеток костного мозга (рис. 14-1). Размножение и превращение начальной клетки эритроидного ряда в унипотентную стимулирует ростовой фактор интерлейкин-3. Интерлейкин-3 синтезируется Т-лимфоцитами, а также клетками костного мозга. Это низкомолекулярный белок группы цитокинов - регуляторов роста и дифференцировки клеток. Дальнейшую пролиферацию и дифференцировку унипотентной клетки эритроидного ряда регулирует синтезирующийся в почках гормон эритропоэтин. Скорость образования эритропоэтина в почках зависит от парциального давления кислорода. При недостатке кислорода скорость образования гормона повышается и, соответственно, количество эритроцитов тоже увеличивается. Хроническая почечная недостаточность сопровождается снижением образования эритропоэтина в почках, что приводит к развитию анемии. В процессе дифференцировки на стадии эритробласта происходят интенсивный синтез гемоглобина, конденсация хроматина, уменьшение размера ядра и его удаление. Образующийся ретикулоцит ещё содержит глобиновую мРНК и активно синтезирует гемоглобин. Циркулирующие в крови ретикулоциты лишаются рибосом, ЭР, митохондрий и в течение двух суток превращаются в эритроциты. Стволовая клетка превращается в эритроцит за две недели. Эритроциты не содержат ядра и поэтому не способны к самовоспроизведению и репарации возникающих в них повреждений. Эти клетки циркулируют в крови около 120 дней и потом разрушаются макрофагами в печени, селезёнке и костном мозге (см. раздел 13). Строение эритроцитов. Двояковогнутая форма эритроцитов имеет большую площадь поверхности по сравнению с клетками сферической формы такого же размера. Это облегчает газообмен между клеткой и внеклеточной средой. Кроме того, такая форма, а также особенности строения мембраны и цитоскелета обеспечивают большую пластичность эритроцитов при прохождении ими мелких капилляров. Важную роль в сохранении формы и способности к обратимой деформации эритроцитов играют липиды и белки плазматической мембраны. Липиды бислоя плазматической мембраны эритроцитов, так же, как плазматические мембраны других клеток, содержат глицерофосфолипиды, сфингофосфолипиды, гликолипиды и холестерол (см. раздел 5). Увеличение содержания холестерола в составе мембраны, которое может наблюдаться при некоторых заболеваниях, снижает её текучесть и эластичность, а следовательно, и способность к обратимой деформации. Это, в свою очередь, затрудняет движение эритроцитов через капилляры и может способствовать развитию гемостаза. Методом электрофореза в мембране эритроцитов обнаруживают около 15 основных мембранных белков с молекулярной массой от 15 до 250 кД. Около 60% массы мембранных белков приходится на спектрин, гликофорин и белок полосы 3 (называется так по расположению этой белковой фракции на электрофореграмме относительно других белков). Интегральный гликопротеин гликофорин присутствует только в плазматической мембране эритроцитов (рис. 14-2). К N-концевой части белка, расположенной на наружной поверхности мембраны, присоединено около 20 олигосахаридных цепей (см. раздел 5). Олигосахариды гликофорина - антигенные детерминанты системы групп крови АВО (см. раздел 10). Спектрин - периферический мембранный белок, нековалентно связанный с цитоплазматической поверхностью липидного бислоя мембраны. Он представляет собой длинную, тонкую, гибкую фибриллу и является основным белком цитоскелета эритроцитов. Спектрин состоит из α- и β-полипептидных цепей, имеющих доменное строение; α- и β-цепи димера расположены антипараллельно, перекручены друг с другом и нековалентно взаимодействуют во многих точках. Спектрин может прикрепляться к мембране и с помощью белка анкирина. Этот крупный белок соединяется с β-цепью спектрина и цитоплазматическим доменом интегрального белка мембраны - белка полосы 3. Анкирин не только фиксирует 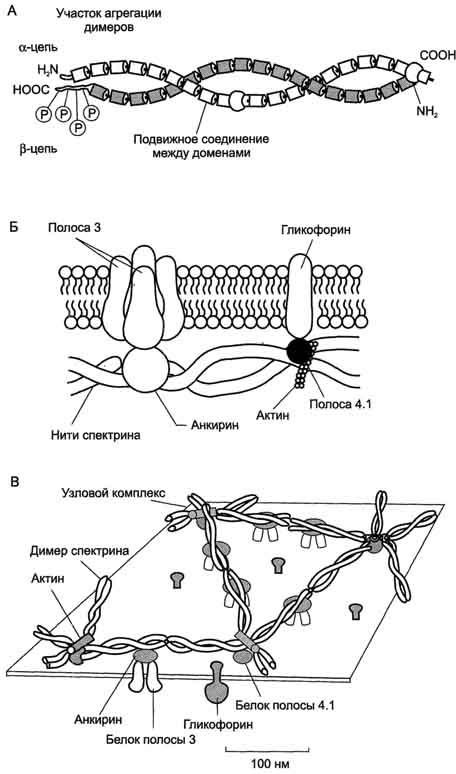 Рис. 14-2. Строение спектрина (А), околомембранного белкового комплекса (Б) и цитоскелета эритроцитов (В). Каждый димер спектрина состоит из двух антипараллельных, нековалентносвязанных между собой α- и β-полипептидных цепей (А). Белок полосы 4.1 образует со спетрином и актином "узловой комплекс", который посредством белка полосы 4.1 связывается с цитоплазматическим доменом гликофорина. Анкирин соединяет спектрин с основным интегральным белком плазматической мембраны - белком полосы 3 (Б). На цитоплазматической поверхности мембраны эритроцита имеется гибкая сетеобразная структура, состоящая из белков и обеспечивающая пластичность эритроцита при прохождении им через мелкие капилляры (В). спектрин на мембране, но и уменьшает скорость диффузии белка полосы 3 в липидном слое. Таким образом, на цитоплазматической поверхности эритроцитов образуется гибкая се-тевидная структура, которая обеспечивает сохранение их формы при прохождении через узкие капилляры сосудов (рис. 14-2). Интегральный белок полосы 3 - белок-переносчик ионов С1- и НСО3- через плазматическую мембрану эритроцитов по механизму пассивного антипорта. В разделе 1 подробно описана роль эритроцитов в газообмене. Поступающий из тканей в эритроциты СО2 под действием фермента карбоангидразы превращается в слабую угольную кислоту, которая распадается на Н+ и НСО3-. Образующиеся при этом протоны присоединяются к гемоглобину, уменьшая его сродство к О2, а бикарбонаты с помощью белка полосы 3 обмениваются на Cl- и выходят в плазму крови. Н2О + СО2 → Н2СО3 → Н+ + НСО3- → обмен на Сl- . В лёгких увеличение парциального давления кислорода и взаимодействие его с гемоглобином приводят к вытеснению протонов из гемоглобина, обмену внутриклеточного Сl- на НСО3- через белок полосы 3, образованию угольной кислоты и её разрушению на СО2 и Н2О. Мембранный фермент Nа+, К+-АТФ-аза обеспечивает поддержание градиента концентраций Na+ и К+ по обе стороны мембраны. При снижении активности Na+, К+-АТФ-азы концентрация Na+ в клетке повышается, так как небольшие ионы могут проходить через мембрану простой диффузией. Это приводит к увеличению осмотического давления, увеличению поступления воды в эритроцит и к его гибели в результате разрушения клеточной мембраны - гемолизу. Са2+-АТФ-аза - ещё один мембранный фермент, осуществляющий выведение из эритроцитов ионов кальция и поддерживающий градиент концентрации этого иона по обе стороны мембраны. Образование и обезвреживание активных форм кислорода в эритроцитах. Большое содержание кислорода в эритроцитах определяет высокую скорость образования супероксидного анион-радикала (О2-), пероксида водорода (Н2О2) и гидроксил радикала (ОН.). Эритроциты содержат ферментативную систему, предотвращающую токсическое действие активных форм кислорода и разрушение мембран эритроцитов (рис. 14-4). Постоянный источник активных форм кислорода в эритроцитах - неферментативное окисление гемоглобина в метгемоглобин: В течение суток до 3% гемоглобина может окисляться в метгемоглобин. Однако постоянно метгемоглобинредуктазная сисгема восстанавливает метгемоглобин в гемоглобин. Метгемоглобинредуктазная сисгема состоит из цитохрома B5 и флавопротеина цитохром B5 редуктазы, донором водорода для которой служит NADH, образующийся в глицеральдегиддегидрогеназной реакции гликолиза (рис. 14-4). Цитохром B5 восстанавливает Fe3+ метгемог-лобина в Fe2+: Hb-Fe3+ + цит. b5 восст. → HbFe2+ + цит. b5 ок. . Окисленный цитохром B5 далее восстанавливается цитохром B5 редуктазой: Цит. B5 ок + NADH → цит. B5 восст. + NAD+. Супероксидный анион с помощью фермента супероксидцисмутазы превращается в пероксид водорода: O2- + O2- + Н+ → H2О2 + O2 . Пероксид водорода разрушается каталазой и содержащим селен ферментом глутатионпероксидазой. Донором водорода в этой реакции служит глутатион - трипептид глутамилцистеинилглицин (GSH) (см. раздел 12). 2Н2О → 2Н2О + О2; 2GSH + 2Н2О2 → GSSG + 2Н2О . Окисленный глутатион (GSSG) восстанавливается NADPH-зависимой глутатионредуктазой. Восстановление NADP для этой реакции обеспечивают окислительные реакции пентозофосфатного пути (см. раздел 7). |
