Коммуникации эндокринная
 Скачать 1.15 Mb. Скачать 1.15 Mb.
|
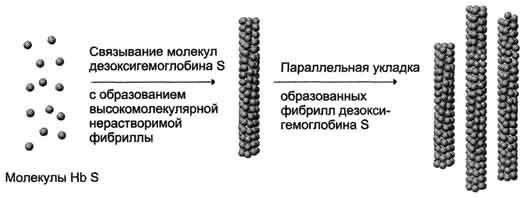 Рис. 1-40. Ассоциация молекул дезоксигемоглобина S. Для диагностики наличия HbS в эритроцитах человека используют метод электрофореза, основанного на движении заряженных белков в электрическом поле. Так как в HbS отрицательно заряженные группы глутамата в ?-цепях заменены незаряженным валином, HbS в щелочной среде будет двигаться медленнее, чем НЬА. Высокая частота гена HbS среди жителей Африки (до 40% населения в некоторых районах) обусловлена тем, что гетерозиготы менее чувствительны к малярии, чем люди с нормальным гемоглобином A. Plasmodium falciparum - возбудитель малярии, облигатную часть своего жизненного цикла он проводит в эритроцитах. Так как эритроциты гетерозиготных по HbS людей имеют более короткий срок жизни, чем нормальные эритроциты, возбудитель малярии не успевает закончить необходимую стадию развития. Это создаёт избирательное преимущество для гетерозиготных по HbS людей в тех областях, где малярия вызывает гибель многих людей. Серповидно-клеточная: анемия - первый описанный пример молекулярной болезни. Почти все встречающиеся замены аминокислот на поверхности молекулы гемоглобина безвредны. Гемоглобин S - редкое исключение. Изменения аминокислотного состава в области активного центра гемоглобина Между гемом и белковой частью гемоглобина существует около 60 межатомных контактов. Большинство мутаций, нарушающих в той или иной мере эти контакты, приводят к развитию гемоглобинопатии и анемии. Гемоглобин М - вариант гемоглобина А, где в результате мутации в гене ?- или ?-цепи происходит замена Гис Е7 или Гис F8 тирозином. В результате Fe2+ окисляется в Fe3+ и стабилизируется в этой форме. Гемоглобин, содержащий в теме Fe3+, называют метгемоглобином (отсюда и название - гемоглобин М). Вместо О2 к Fe3+ присоединяется Н2О. Обычно изменения затрагивают либо ?-, либо ?-цепи, в результате гемоглобин может переносить не более двух молекул О2. У гетерозиготных людей отмечают цианоз, связанный с нарушением транспорта О2, а гомозиготность по этому гену приводит к летальному исходу. Гемоглобин Хаммерсмита - вариант гемоглобина А, где в положении D1 вместо фенил-аланина (гидрофобной аминокислоты) находится серии (гидрофильная аминокислота). Фен D1 входит в неполярное окружение тема. Замена его на гидрофильную аминокислоту приводит к нарушению прочности связывания тема с глобином; в "гидрофобный карман", где размещается гем, способна проникать вода, окисляющая Fe2+ до Fe3+, в результате чего развивается анемия. Изменения аминокислотного состава, деформирующие третичную структуру гемоглобина Во всех нормальных гемоглобинах и в миоглобине в месте пересечения двух ?-спиралей В и Е находится аминокислота глицин. Так как глицин вместо радикала содержит атом водорода, в этом месте две спирали плотно прилегают друг к другу. В гемоглобине Ривердейла-Бронкса (вариант гемоглобина А) вместо глицина в положении В6 находится аминокислота аргинин, имеющая объёмный радикал. В результате он не умещается в столь узком пространстве, молекула меняет конформацию и становится нестабильной. Замены аминокислот в области контактов димеров ?1?2, ?2?2, нарушающие аллостерические регуляторные функции гемоглобина Почти все варианты гемоглобина А, где происходит замена аминокислот в области контакта димеров ?1?2, ?2?2, проявляют пониженную кооперативность и нарушенное сродство гемоглобина к О2. Так, гемоглобин Кемпси - вариант гемоглобина А, где в положении G1 ?-цепи аспарагиновая кислота заменена на аспарагин. В норме аспарагиновая кислота участвует в образовании водородной связи, стабилизирующей дезокси-гемоглобин. В результате замены эта связь не образуется, что нарушает стабильность конформации дезоксигемоглобина, и сродство гемоглобина к О2 повышается. У больных развивается анемия с выраженным цианозом. Белковые фракции крови и клинико-диагностическое значение их определения (при воспалительном процессе, циррозе печени и нефротическом синдроме). Диспротеи- немии. Белковые фракции – количественное соотношение фракций общего белка сыворотки крови: альбуминов, α-1- глобулинов, α-2-глобулинов, β-глобулинов и γ-глобулинов. Фракция альбуминов однородна, в норме составляет 50-65% от общего количества белка. Глобулиновые фракции по составу более разнородны. Фракция α-1-глобулинов включает в себя альфа-1-антитрипсин (основной компонент этой фракции) – ингибитор протеолитических ферментов, альфа-1-кислый гликопротеин (орозомукоид) – обладает широким спектром функций, в зоне воспаления способствует фибриллогенезу, альфа-1-липопротеины(функция – участие в транспорте липидов), протромбин и транспортные белки: тироксинсвязывающий глобулин, транкортин (функция – связывание и транспорт кортизола и тироксина соответственно). Фракция α-2-глобулинов преимущественно включает белки острой фазы – альфа-2 макроглобулин, гаптоглобин, церулоплазмин, а также аполипопротеин В. Альфа-2-макроглобулин, являющийся основным компонентом фракции, участвует в развитии инфекционных и воспалительных реакций. Гаптоглобин – это гликопротеин, который образует комплекс с гемоглобином, высвобождающемся из эритроцитов при внутрисосудистом гемолизе. Церулоплазмин специфически связывает ионы меди, а также является оксидазой аскорбиновой кислоты, адреналина, диоксифенилаланина (ДОФА), способен инактивировать свободные радикалы. Альфа-липопротеины участвуют в транспорте липидов. Фракция β-глобулинов содержит трансферрин (главный плазменный белок – переносчик железа), гемопексин (связывает гемм/метгем, вследствие чего предотвращает выведение его почками и потерю железа), компоненты комплемента (которые учавствуют в реакциях иммунитета), бета-липопротеины (принимают участие в транспорте холестерина и фосфолипидов) и часть иммуноглобулинов. Фракция γ-глобулинов состоит из иммуноглобулинов (соответственно порядку количественного убывания – IgG, IgA, IgM, IgE). Функционально иммуноглобулины представляют собой антитела, обеспечивающие гуморальный иммунитет. Изменение соотношения белковых фракций плазмы крови наблюдается при многих заболеваниях при нормальном содержании общего белка (диспротеинемии). Диспротеинемии отмечаются чаще, чем изменение общего количества белка. При наблюдении в динамике могут характеризовать стадию заболевания, его длительность, эффективность проводимых лечебных мероприятий. Характерные варианты сдвигов содержания белковых фракций. Острофазный ответ (изменения, связанные с воспалением и некрозом тканей) – повышение содержания α-1- и α-2-глобулинов. Наблюдается при острой вирусной инфекции, острой пневмонии, остром бронхите, остром пиелонефрите, инфаркте миокарда, травмах (включая хирургические), новообразованиях. Хроническое воспаление – увеличение содержания γ-глобулинов (ревматоидный артрит, хронический гепатит). Нефротический синдром – повышение концентрации в крови α-2-глобулинов (происходит за счет накопления альфа-2-макроглобулина на фоне потери альбумина и других белков при фильтрации в почечных клубочках). Цирроз печени – значительное увеличение белков гамма-фракции. Диспротеинемия — нарушение нормального соотношения между фракциями белков; наблюдается при болезнях печени (острый и хронический гепатит, цирроз), почек (острый и хронический гломерулонефрит, амилоидоз, нефротический синдром), крови (лейкоз), воспалительных и аллергических заболеваниях, ревматизме, инфаркте миокарда. Энзимодиагностика: механизмы изменения уровня активности ферментов в крови; Энзимодиагностика заключается в постановке диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях человека. Принципы энзимодиагностики основаны на следующих позициях: при повреждении клеток в крови или других биологических жидкостях (например, в моче) увеличивается концентрация внутриклеточных ферментов повреждённых клеток; количество высвобождаемого фермента достаточно для его обнаружения; активность ферментов в биологических жидкостях, обнаруживаемых при повреждении клеток, стабильна в течение достаточно длительного времени И отличается от нормальных значений; ряд ферментов имеет преимущественную или абсолютную локализацию в определённых органах (органоспецифичность); существуют различия во внутриклеточной локализации ряда ферментов. Причины, приводящие к увеличению количества ферментов в крови Ферменты плазмы крови можно разделить на 2 группы. Первая, относительно небольшая группа ферментов активно секретируется в плазму крови определёнными органами. Например, печень синтезирует неактивные предшественники ферментов свёртывающей системы крови. Ко второй относят большую группу ферментов, высвобождающихся из клеток во время их нормального функционирования. Обычно эти ферменты выполняют свою функцию внутри клетки и не имеют физиологического значения в плазме крови. У здорового человека активность этих ферментов в плазме низкая и достаточно постоянная, так как постоянно соотношение скоростей высвобождения их из клеток и скоростей разрушения. При многих заболеваниях происходит повреждение клеток, и их содержимое, в том числе и ферменты, высвобождаются в кровь. К причинам, вызывающим высвобождение внутриклеточного содержимого в кровь, относят нарушение проницаемости мембраны клеток (при воспалительных процессах) или нарушение целостности клеток (при некрозе). Определение в крови активности ряда ферментов хорошо налажено в биохимических лабораториях, что используют для диагностики заболеваний сердца, печени, скелетной мускулатуры и других тканей. Уровень активности ферментов в плазме коррелирует со степенью повреждения клеток. Для энзимодиагностики имеют большое значение знания о субклеточной локализации ферментов. Так, появление в плазме крови ферментов, имеющих только цитозольную локализацию, свидетельствует о воспалительном процессе; при обнаружении митохондриальных или ядерных ферментов можно говорить о более глубоких повреждениях клетки, например о некрозе. Однако повышение концентрации ферментов не всегда связано с повреждением тканей. При избыточной клеточной пролиферации, например при онкопролиферативных процессах, при повышенной скорости синтеза некоторых ферментов в клетках или при нарушенном клиренсе (способности вьпюдиться почками) наблюдают повышение концентрации в крови определённых ферментов. Врачам следует учитывать, что нормальные значения активности ферментов в крови детей и беременных женщин отличаются от показателей, характерных для взрослых здоровых людей. Изоферменты Ферменты, катализирующие одну и ту же химическую реакцию, но отличающиеся по первичной структуре белка, называют изофермен-тами, или изоэнзимами. Они катализируют один и тот же тип реакции с принципиально одинаковым механизмом, но отличаются друг от друга кинетическими параметрами, условиями активации, особенностями связи апофермента и кофермента. Природа появления изоферментов разнообразна, но чаще всего обусловлена различиями в структуре генов, кодирующих эти изоферменты. Следовательно, изоферменты различаются по первичной структуре белковой молекулы и, соответственно, по физико-химическим свойствам. На различиях в физико-химических свойствах основаны методы определения изоферментов. По своей структуре изоферменты в основном являются олигомерными белками. Причём та или иная ткань преимущественно синтезирует определённые виды протомеров. В результате определённой комбинации этих протомеров формируются ферменты с различной структурой - изомерные формы. Обнаружение определённых изоферментных форм ферментов позволяет использовать их для диагностики заболеваний. Изоформы лактатдегидрогеназы. Фермент лак-татдегидрогеназа (ЛДГ) катализирует обратимую реакцию окисления лактата (молочной кислоты) до пирувата (пировиноградной кислоты) (см. раздел 7). Лактатдегидрогеназа - олигомерный белок с молекулярной массой 134 000 Д, состоящий из 4 субъединиц 2 типов: М (от англ, muscle - мышца) и Н (от англ, heart - сердце). Комбинация этих субъединиц лежит в основе формирования 5 изоформ лактатдегидрогеназы (рис. 2-35, А). ЛДГ1 и ЛДГ2 наиболее активны в сердечной мышце и почках, ЛДГ4 и ЛДГ5 - в скелетных мышцах и печени. В остальных тканях имеются различные формы этого фермента. Изоформы ЛДГ отличаются электрофоретической подвижностью, что позволяет устанавливать тканевую принадлежность изоформ ЛДГ (рис. 2-35, Б). |
