Коммуникации эндокринная
 Скачать 1.15 Mb. Скачать 1.15 Mb.
|
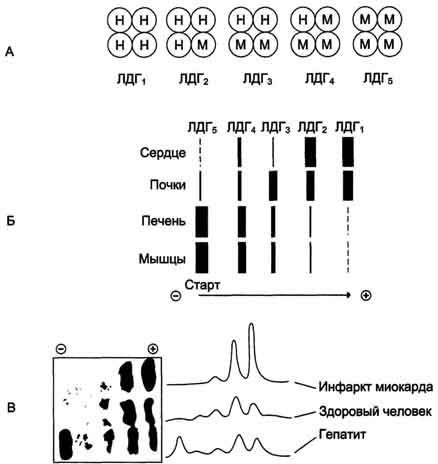 Рис. 2-35. Изоформы лактатдегидрогеназы. А - строение различных изоформ ЛДГ; Б - распределение на электрофореграмме и относительные количества изоформ ЛДГ в различных органах; В - содержание изоформ ЛДГ в плазме крови в норме и при патологии (электрофореграммы - слева и фотометрическое сканирование - справа). Появление в эволюции различных изоформ ЛДГ обусловлено особенностями окислительного метаболизма тканей. Изоферменты ЛДГ4 и ЛДГ5 (М-типы ЛДГ) работают эффективно в анаэробных условиях, ЛДГ, и ЛДГ2 (Н-типы) - в аэробных, когда пируват быстро окисляется до СО2 и Н2О, а не восстанавливается до молочной кислоты. При ряде заболеваний исследуют активность ЛДГ в плазме крови. В норме активность ЛДГ составляет 170- 520 ЕД/л. Повышение активности наблюдают при острых поражениях сердца, печени, почек, а также при мегалобластных и гемолитических анемиях. Однако это указывает на повреждение лишь одной из перечисленных тканей. Для постановки диагноза необходимо исследование изоформ ЛДГ в плазме крови методом электрофореза. На рис. 2-35, В представлены электрофореграммы плазмы крови здорового человека, больного инфарктом миокарда и больного гепатитом. Выявление в плазме крови тканеспецифичес-ких изоформ ЛДГ используют в качестве диагностического теста повреждения данной ткани. Изоформы креатинкиназы. Креатинкиназа (КК) катализирует реакцию образования креатинфосфата: Молекула КК - димер, состоящий из субъединиц двух типов: М (от англ, muscle - мышца) и В (от англ, brain мозг). Из этих субъединиц образуются 3 изофермента - ВВ, MB, MM. Изофермент ВВ находится преимущественно в головном мозге, ММ - в скелетных мышцах и MB - в сердечной мышце. Изоформы КК имеют разную электрофоретическую подвижность (рис. 2-36). Активность КК в норме не должна превышать 90 МЕ/л. Определение активности КК в плазме крови имеет диагностическое значение при инфаркте миокарда (происходит повышение уровня МВ-изоформы). Количество изоформы ММ может повышаться при травмах и повреждениях скелетных мышц. Изоформа ВВ не может проникнуть через гематоэнцефалический барьер, поэтому в крови практически не определяется даже при инсультах и диагностического значения не имеет. Энзимодиагностика при инфаркте миокарда и заболеваниях печени. Энзимодиагностика при инфаркте миокарда Примерно 30% больных инфарктом миокарда имеют атипичную клиническую картину этого заболевания. Поэтому необходимо проводить дополнительные методы исследования для подтверждения повреждения сердечной мышцы. При инфаркте миокарда наблюдают достоверные изменения в крови активности ферментов КК, ЛДГ и аспартатаминотрансферазы - ACT, которые зависят от времени, прошедшего от начала развития инфаркта и от зоны тканевого повреждения. Типичную кривую изменения активности этих ферментов можно видеть на рис. 2-37. После закупорки (окклюзии) коронарного сосуда в крови вначале отмечают повышение активности КК изоформы MB, однако фермент быстро удаляется из кровотока. Обнаружение повышенной активности КК в плазме крови - основной энзимодиагностический критерий инфаркта миокарда. Если у пациента с загрудинными болями не обнаружено изменения в активности КК, диагноз инфаркта миокарда маловероятен. Дополнительным подтверждением диагноза инфаркта миокарда служит обнаружение активностей ферментов ACT и ЛДГ в крови больных. Динамика изменений этих активностей также представлена на этом рисунке. Активность ACT в норме составляет 5-40 МЕ/л. При инфаркте миокарда активность ACT повышается через 4-6 ч; максимум активности наблюдают в течение 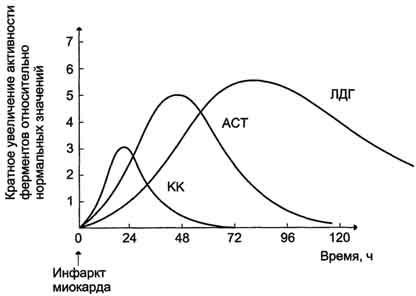 Рис. 2-37. Изменение активности ферментов в плазме крови при инфаркте миокарда. 2-3 дней. Уровень ЛДГ также увеличивается в плазме крови через несколько часов после закупорки кровеносного сосуда; максимум активности наблюдают на 3-4-й день, затей наступает постепенная нормализация активности. Уровень повышения активности ЛДГ коррелирует с размерами повреждения сердечной мышцы. Аланинаминотрансфераза (АЛТ, АлАТ) – норма, результат при заболеваниях печени Нормальная активность АЛТ в крови мужчин равна 10-40 Ед/л, у женщин – 12-32 Ед/л.Различные уровни повышения активности АЛТ выявляются при острых гепатитах, циррозе печени, обтурационной желтухе и при приеме гепатотоксических препаратов (яды, некоторые антибиотики). Резкое повышение активности АЛТ в 5-10 и более раз является несомненным признаком острого заболевания печени. Причем такое повышение выявляется еще до того как проявятся клинические симптомы (желтуха, боли и прочее). Увеличение активности АЛТ можно засечь за1-4 недели до проявления клиники и начать соответствующее лечение, не дав развиться заболеванию в полной мере. Высокая активность фермента при таком остром заболевании печени после проявления клинических симптомов держится недолго. Если нормализация активности ферментане происходит в течение двух недель, это говорит о развитии массивного повреждения печени. Максимальная активность АСТ выявлена в сердце, печени, мышцах и почках. В норме у здорового человека активность АСТ составляет 15-31 Ед/л у мужчин и 20-40 Ед/л у женщин. Активность АСТ возрастает при некрозе печеночных клеток. Причем в данном случае имеет место прямо пропорциональная зависимость между концентрацией фермента и степенью повреждения гепатоцитов: то есть чем выше активность фермента, тем сильнее и обширнее повреждения гепатоцитов. Увеличение активности АСТ также сопровождает острый инфекционный и острый токсический гепатит (отравления солями тяжелых металлов и некоторыми лекарствами). Соотношение активности АСТ/АЛТ называется коэффициент де Ритиса. Нормальное значение коэффициента де Ритиса равно 1,3. При повреждениях печени значение коэффициента де Ритиса снижается. Лактатдегидрогеназа (ЛДГ) – норма, результат при заболеваниях печени ЛДГ является широко распространенным ферментом в организме человека. Степень его активности в различных органах в убывающем порядке: почки>сердце>мышцы>поджелудочная железа>селезенка> печень>сыворотка крови. В сыворотке крови присутствует 5 изоформ ЛДГ. Поскольку ЛДГ содержится и в эритроцитах, то кровь для исследования не должна содержать следы гемолиза. В плазме крови активность ЛДГ на 40% ниже, чем в сыворотке. Нормальная активность ЛДГ в сыворотке крови составляет 140-350 Ед/л. При каких патологиях печени увеличено содержание изоформ В связи с широкой распространенностью ЛДГ в различных органах и тканях, повышение общей активности ЛДГ не имеет большого значения для дифференциальной диагностики различных заболеваний. Для диагностики инфекционного гепатита используют определение активности изоформ ЛДГ 4 и 5 (ЛДГ4 и ЛДГ5). При остром гепатите активность ЛДГ5 в сыворотке крови повышается в первые недели желтушного периода. Повышение совокупной активности изоформ ЛДГ4 и ЛДГ5 выявляется у всех больных инфекционным гепатитом в первые 10 суток. При желчнокаменной болезни без закупорки желчных ходов повышения активности ЛДГ не обнаружено. При ишемии миокарда происходит увеличение активности общей фракции ЛДГ за счет явления застоя крови в печени. Щелочная фосфатаза (ЩФ) – норма, результат при заболеваниях печени Щелочная фосфатаза располагается в мембране клеток канальцев желчных ходов. Эти клетки канальцев желчных ходов имеют выросты, которые образуют, так называемую, щеточную каемку. Щелочная фосфатаза располагается именно в этой щеточной каемке. Поэтому при повреждении желчных ходов щелочная фосфатаза высвобождается и выходит в кровь. В норме активность щелочной фосфатазы в крови колеблется в зависимости от возраста и пола. Так у здоровых взрослых людей активность щелочной фосфатазы лежит в пределах 30-90 Ед/л. Активность этого фермента повышается в периоды активного роста – при беременности и у подростков. Нормальные показатели активности щелочной фосфатазы у подростков достигают 400 Ед/л, а у беременных женщин – до 250 Ед/л. При каких патологиях печени увеличено содержание При развитии обтурационной желтухи активность щелочной фосфатазы в сыворотке крови возрастает в 10 и более раз. Определение активности ЩФ используют в качестве дифференциально-диагностического теста именно обтурационной желтухи. Менее значительное повышение активности щелочной фосфатазы в крови выявляется также при гепатитах, холангитах, язвенных колитах, кишечных бактериальных инфекциях и тиреотоксикозе. Глутаматдегидрогеназа (ГлДГ) – норма, результат при заболеваниях печени В норме глутаматдегидрогеназа присутствует в крови в небольших количествах, так как является митохондриальным ферментом, то есть, расположен внутриклеточно. Степень увеличения активности данного фермента выявляет глубину поражения печени. Увеличение концентрации глутаматдегидрогеназы в крови является признаком начала дистрофических процессов в печени, вызванных эндогенными факторами или экзогенными. К эндогенным факторам относят опухоли печени или метастазы в печень, а к экзогенным –токсины, повреждающие печень (тяжелые металлы, антибиотики и т.д.), и инфекционные заболевания. Коэффициент Шмидта Совместно с аминотрансферазами рассчитывают коэффициент Шмидта (КШ). КШ = (АСТ+АЛТ)/ГлДГ. При обтурационной желтухе коэффициент Шмидта равен 5-15, при остром гепатите – более 30, при метастазах опухолевых клеток в печень – около 10. Сорбитолдегидрогеназа (СДГ) – норма, результат при заболеваниях печени В норме в сыворотке крови сорбитолдегидрогеназа выявляется в следовых количествах, а её активность не превышает 0,4 Ед/л. Активность сорбитолдегидрогеназы увеличивается в 10-30 раз при всех формах острого гепатита. Сорбитолдегидрогеназа является органоспецифическим ферментом, который отражает повреждение мембран гепатоцитов при первичном развитии острого процесса или при обострении хронического. γ-глутамилтрансфераза - нормы, при каких патологиях печени увеличено содержание Данный фермент имеется не только в печени. Максимальная активность γ-глутамилтрансферазы выявляется в почках, поджелудочной железе, печени и предстательной железе. У здоровых людей в норме концентрация γ-глутамилтрансферазы составляет у мужчин – 250-1800 нмоль/л*с, у женщин – 167-1100 нмоль/с*л. У новорожденных детей активность фермента в 5 раз выше, а у недоношенных – в 10 раз. Активность γ-глутамилтрансферазы повышается при заболеваниях печени и желчевыводящей системы, а также при диабете. Наиболее высокая активность фермента сопровождает обтурационную желтуху и холестаз.Активность γ-глутамилтрансферазы при данных патологиях увеличивается в 10 и более раз. При вовлечении печени в злокачественный процесс происходит увеличение активности фермента в 10-15 раз, при хронических гепатитах – в 7 раз.γ-глутамилтрансфераза очень чувствительна к алкоголю, что используется для дифференциальной диагностики между вирусными и алкогольными поражениями печени. Определение активности этого фермента является наиболее чувствительным скрининговым тестом, который предпочтительнее определения активности аминотрансфераз (АСТ и АЛТ) или щелочной фосфатазы. Информативно определение активности γ-глутамилтрансферазы и при заболеваниях печени у детей. Фруктозо-монофосфат-альдолаза (ФМФА) – норма, результат при заболеваниях печени В норме в крови содержится в следовых количествах. Определение активности ФМФА используют для диагностики острого гепатита. Однако в большинстве случаев определение активности данного фермента используют для выявления профессиональной патологии у людей, которые работают с токсичными для печени химическими веществами. При остром инфекционном гепатите активность фруктозо-монофосфат-альдолазы возрастает в десятки раз, а при воздействии токсинов в низких концентрациях (хроническом отравлении токсинами) – только в 2-3 раза.
СДГ ↑↑↑ ↑ (при обострении) – – ФМФА ↑↑ – – – Свёртывающая система крови. Этапы образования фибринового сгустка. При повреждении кровеносного сосуда инициируется каскад реакций, в результате которого образуется сгусток крови - тромб, предотвращающий кровотечение. Основную роль в свёртывании (коагуляции) крови играют тромбоциты и ряд белков плазмы крови. В остановке кровотечения различают 3 этапа. На первом этапе происходит сокращение кровеносного сосуда. Затем к месту повреждения прикрепляются тромбоциты, которые, наслаиваясь друг на друга, образуют тромбоцитарную пробку (белый тромб). Белый тромб является непрочным и может закупорить только небольшой кровеносный сосуд. На третьем этапе растворимый белок плазмы крови фибриноген превращается в нерастворимый белок фибрин, который откладывается между тромбоцитами, и формируется прочный фибриновый тромб. Такой тромб содержит эритроциты и поэтому называется красным тромбом. Образованию фибринового тромба предшествует каскад протеолитических реакций, приводящий к активации фермента тромбина, который и превращает фибриноген в фибрин. Все белки, участвующие в свёртывании крови, называют факторами свёртывания. Они синтезируются в основном в печени и клетках крови в виде неактивных предшественников, обозначаются римскими цифрами, но имеют и тривиальные названия (табл. 14-1). Большинство этих белков активируется в каскаде ферментативных реакций свёртывания крови. Активные формы этих белков обозначают такими же римскими цифрами, но с добавлением буквы "а". А. Образование фибринового тромба Образование фибринового тромба начинается с превращения растворимого белка плазмы крови фибриногена в нерастворимый фибрин. Фибриноген (фактор I) - гликопротеин с молекулярной массой 340 кД. Он синтезируется в печени и содержится в плазме крови в концентрации 8,02-12,9 мкмоль/л (2 - 4 г/л). Молекула фибриногена состоит из шести полипептидных цепей, которые связаны друг с другом дисульфидными связями. Состав полипептидных цепей молекулы фибриногена обозначают Аα2, Вβ2, γ2 Заглавные буквы соответствуют тем участкам, которые отщепляются под действием тромбина при превращении фибриногена в фибрин. Фрагменты А в цепях Аα и В в цепях Вβ содержат большое количество остатков аспартата и глутамата. Это создаёт сильный отрицательный заряд на N-концах молекул фибриногена и препятствует их агрегации. Молекула фибриногена состоит из трех глобулярных доменов, по одному на каждом конце молекулы (домены Д) и один в середине (домен E). Домены отделены друг от друга участками полипептидных цепей, имеющими стержнеобразную конфигурацию. Из центрального домена E выступают N-концевые фрагменты А и В цепей Аα и Вβ (рис. 14-8). В образовании фибринового тромба можно выделить 4 этапа. Превращение фибриногена в мономер фибрина. Сначала молекулы фибриногена освобождаются от отрицательно заряженных фрагментов А и В, в результате чего образуются мономеры фибрина. Превращение фибриногена (фактор I) в фибрин (фактор 1а) катализирует фермент тромбин (фактор Па). В каждой молекуле фибриногена тромбин гидролизует четыре пептидные связи аргинилглицил, две из которых соединяют фрагменты А с α-цепью, |
