Коммуникации эндокринная
 Скачать 1.15 Mb. Скачать 1.15 Mb.
|
 Фосфатидилинозитольный цикл как механизм внутриклеточной коммуникации. Инозитолтрифосфаты и диацилглицерол – вторичные посредники в передаче сигна- ла. Фосфатидилинозитольный цикл как механизм внутриклеточной коммуникации. Инозитолтрифосфаты и диацилглицерол – вторичные посредники в передаче сигна- ла. Инозитолфосфатная система Биология / G-белки и их функция / Инозитолфосфатная система Функционирование инозитолфосфатной системы трансмембранной передачи сигнала обеспечивают: R (рецептор), фосфолипаза С, Gрlс - белок, активирующий фосфолипазу С, белки и ферменты мембран и цитозоля. Последовательность событий, приводящих к активации фосфолипазы С: связывание сигнальной молекулы, например гормона с рецептором (R) вызывает изменение конформации и увеличение сродства к Gplc-белку. образование комплекса [Г] [R] [Gрlс ГДФ] приводит к снижению сродства α-протомера G рlс белка к ГДФ и увеличению сродства к ГТФ. ГДФ заменяется на ГТФ. это вызывает диссоциацию комплекса; отделившаяся α-субъединица, связанная с молекулой ГТФ, приобретает сродство к фосфолипазе С. α-ГТФ взаимодействует с фосфолипазой С и активирует её. Под действием фосфолипазы С происходит гидролиз липида мембраны фосфатидилинозитол-4,5 - биофосфата (ФИФ2). в ходе гидролиза образуется и выходит в цитозоль гидрофильное вещество инозитол-1,4,5-трифосфат (ИФ3). Другой продукт реакции диацилглицерол (ДАГ) остаётся в мембране и участвует в активации фермента протеинкиназы С (ПКС). инозитол-1,4,5-трифосфат (ИФ3) связывается специфическими центрами Са2 - канала мембраны ЭР, это приводит к изменению конформации белка и открытию канала - Са²+ поступает в цитозоль. В отсутствие в цитозоле ИФ3 канал закрыт. Активация протеинкиназы С. Повышение концентрации Са²+ в цитозоле клетки увеличивает скорость взаимодействия Са²+ с неактивным цитозольным ферментом протеинкиназой С(ПКС) и белком кальмодулином, таким образом сигнал, принятый рецептором клетки, раздваивается. Связывание протеинкиназы С с ионами кальция позволяет ферменту вступать в кальций-опосредованное взаимодействие с молекулами "кислого" фосфолипида мембраны, фосфатидилсерина (ФС). Диацилглицерол, занимая специфические центры в протеинкиназе С, ещё более увеличивает её сродство к ионам кальция. На внутренней стороне мембраны образуется ферментативный комплекс - [ПКС] [Са²+] [ДАГ] [ФС] - активная протеинкиназа С, фосфорилирующая специфические ферменты по серину и треонину. 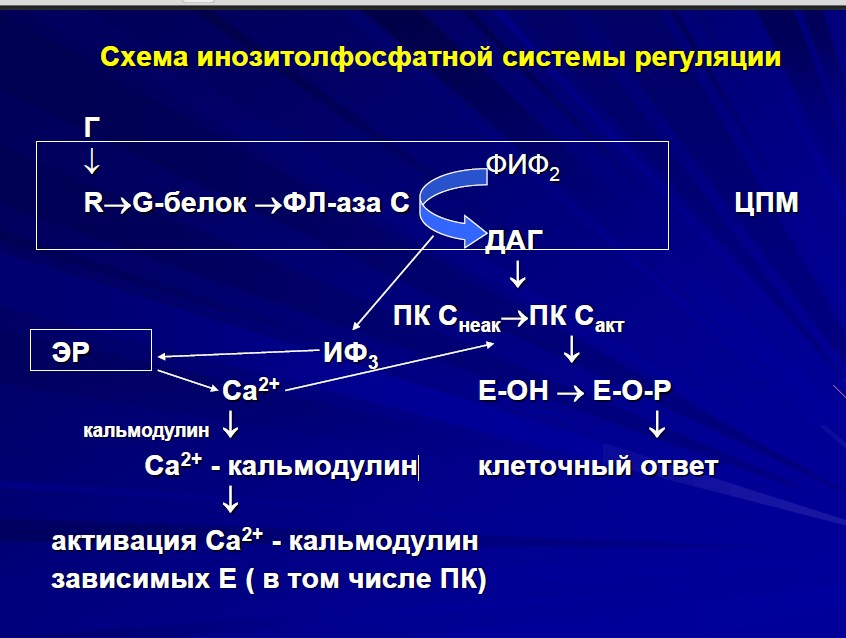 B. Инозит-1,4,5-трифосфат и диацилглицерин Гидролиз фосфатидилинозит-4,5-дифосфата [ФИФ2 (PlnsP2)] фосфолипазой С [4] приводит к образованию двух вторичных мессенджеров: инозит-1,4,5-трифосфата и диацилглицерина. Гидрофильный ИФ3 поступает в эндоплазматический ретикулум [ЭР (ЕR)] и индуцирует высвобождение ионов Са2+ из запасающих везикул. Липофильный ДАГ остается в мембране и активирует протеинкиназу C, которая в присутствии Са2+ фосфорилирует различные белковые субстраты, модулируя их функциональную активность. Ионы кальция – вторичный посредник в передаче сигнала. Регуляция уровня кон- центрации ионов кальция в цитоплазме клетки. Биологическая роль кальция. Каль- модулин. Протеинкиназа С и кальмодулин-зависимые протеинкиназы. Уровень ионов кальция. Концентрация ионов Са2+ в цитоплазме нестимулированной клетки очень низка (10- 100 нМ). Низкий уровень поддерживается кальциевыми АТФ-азами (кальциевыми насосами) и натрий- кальциевыми обменниками. Резкое повышение концентрации ионов Са2+ в цитоплазме (до 500-1000 нМ) происходит в результате открывания кальциевых каналов плазматической мембраны или внутриклеточных кальциевых депо (гладкого и шероховатого эндоплазматического ретикулума). Открывание каналов может быть вызвано деполяризацией мембран или действием сигнальных веществ, нейромедиаторов (глутамат и АТФ, см. с. 342), вторичных мессенджеров (ИФ3 и цАМФ), а также вещества растительного происхождения рианодина. В цитоплазме и клеточных органеллах имеется множество белков способных связывать Са2+, некоторые из них выполняют роль буфера. При высокой концентрации в цитоплазме ионы Са2+ оказывает на клетку цитотоксическое действие. Поэтому уровень кальция в отдельной клетке испытывает кратковременные всплески, увеличиваясь в 5-10 раз, а стимуляция клетки увеличивает лишь частоту этих флуктуаций. Действие кальция опосредовано специальными Са2+-связывающими белками («кальциевыми сенсорами»), к которым принадлежат аннексин, кальмодулин и тропонин (см. с. 326). Кальмодулин — сравнительно небольшой белок (17 кДа) — присутствует во всех животных клетках. При связывании четырех ионов Са2+ (на схеме голубые кружочки) кальмодулин переходит в активную форму, способную взаимодействовать с многочисленными белками. За счет активации кальмодулина ионы Са2+ оказывают влияние на активность ферментов, ионных насосов и компонентов цитоскелета. Протеинкиназа С Протеинкиназы С — это семейство протеинкиназ, содержащее порядка десяти изоферментов, которые классифицируют по вторичным посредникам на три семейства: традиционные, или классические, оригинальные, или нестандартные и нетипичные. Традиционным протеинкиназам С для активации требуется Ca, диацилглицерол или фосфатидилхолин. Оригинальные протеинкиназы С активируются молекулами диацилглицерола, и не требуют Ca. Традиционные и оригинальные протеинкиназы С активируются через сходные пути сигнальной трансдукции, например, с помощью фосфолипазы С. Нетипичные изоформы, не требуют ни Ca, ни диацилглицерола для активации. Все протеинкиназы С состоят из регуляторного и каталитического доменов, связанных шарнирной областью. Каталитические районы высоко консервативны между разными изоформами, и значительно отличаются от каталитических районов других серин-треониновых протеинкиназ. Консервативность каталитических доменов связано с выполняемыми функциями, различия в регуляторных районах обуславливают различия во вторичных посредниках. Регуляторный домен на N-конце протеинкиназы С содержит отдельные участки. С1 домен, представленный во всех изоформах протеинкиназы С, имеет сайт связывания диацилглицерола. С2 домен воспринимает ион Ca. Район псевдосвязывания субстрата представляет собой короткую последовательность аминокислот, которые подражают субстрату и занимают участок связывания субстрата в активном центре, делая фермент неактивным. Ca и диацилглицерол связываются с доменами С2 и С1, соответственно, и вызывают прикрепление протеинкиназы С к плазматической мембране. Взаимодействие с мембраной вызывает освобождение псевдосубстрата из каталитического центра и активирует фермент. Для осуществления подобных аллостерических взаимодействий, протеинкиназе С требуется предварительное фосфорилирование каталитического района. Протеинкиназа С должна быть предварительно фосфорилирована и для осуществления собственной киназной активности. Молекула протеинкиназы С содержит несколько сайтов фосфорилирования 3- фосфоинозитол-зависимой протеинкиназой-1. После активации протеинкиназа С переносится к плазматической мембране и присоединяются к RACK-белкам, аминокислотная последовательность которых на 47 % гомологична бета-субъединицам G-белков. Для протеинкиназ С характерен длительный период активности, которая сохраняется, даже если первоначальный сигнал пропал или снизилась концентрация ионов Ca. Это достигается образованием диацилглицерола из фосфатидилхолина с помощью фосфолипазы С. Последовательность остатков аминокислот в молекуле протеинкиназы С сходна с таковой для протеинкиназы А, и содержит остатки основных аминокислот вблизи остатков серина и треонина, подвергающихся фосфорилированию. Субстратами протеинкиназы С являются следующие белки: MAP-киназы, Raf-киназы, MARCKS. Белки-субстраты протеинкиназы С играют важную роль в поддержании формы клеток, способности к движению, секреции, трансмембранном транспорте, регуляции клеточного цикла. MARCKS вовлечены в процессы экзоцитоза некоторых секреторных пузырьков, содержащих, муцин и хромафин. MARCKS — кислые белки, содержат большое количество остатков аланина, глицина, пролина и глутаминовой кислоты. MARCKS связаны N-концом с липидами мембраны, регулируются ионами Ca, кальмодулином, протеинкиназой С. VDR — кальцитриоловый рецептор. Рецептор стероидных гормонов из семейства ядерных рецепторов. После активирования молекулой витамина D, образует гетеродимер с ретиноидным-Х-рецептором и связывается с регуляторными элементами на ДНК, изменяя экспрессию генов или снимая репрессоры генов. Глюкокортикоиды снижают экспрессию VDR во всех тканях. Рецептор эпидермального фактора роста — относится к семейству рецепторов факторов роста, связывающих внеклеточные белковые лиганды и обладает тирозинкиназными активностями. Мутации, затрагивающие EGRF часто могут проявляться в раковом перерождении клетки. После связывания лиганда, рецептор димеризуется, происходит самофосфорилирование по пяти остаткам тирозина на С-конце рецептора, и EGRF приобретает внутриклеточную тирозинкиназную активность. Последующая активность EGRF связана с инициацией каскада сигнальной трансдукции, активируются MAPK, Akt, JNK — что приводит к синтезу ДНК и пролиферации. Киназный домен также может фосфорилировать другие рецепторы, связанные с EGRF по остаткам тирозина. Ca/кальмодулин — зависимые протеинкиназы Ca2+/кальмодулин-зависимая киназа II Са/кальмодулин-зависимые киназы, или СаМ киназы, регулируются Са/кальмодулиновым комплексом. СаМ киназы классифицируют на два класса: специализированные СаМ киназы и многофункциональные СаМ киназы, порядка 2 % белков головного мозга представлены СаМ второго типа. Кальмодулин — это вездесущий, кальций-связывающий белок, который связывается с многими другими белками и регулирует их активность. Это маленький кислый белок, состоит из 148 аминокислотных остатков, содержит четыре домена связывания кальция. СаМ служит промежуточным звеном в воспалении, апоптозе, мышечных сокращениях, развитии кратковременной и длительной памяти, росте нервов и иммунном ответе. Кальмодулин экспрессируется во многих типах клеток и находится в цитоплазме, внутри органелл, а также находится в плазматической мембране и мембранах органелл. Многие белки, которые связываются с кальмодулином, не могут сами связывать кальций и используют кальмодулин как «датчик» кальция и компонент системы передачи сигнала. Кальмодулин Кальмодулин также используется для запасания Ca в эндоплазматическом и саркоплазматическом ретикулумах. После связывания кальция молекула кальмодулина претерпевает конформационные изменения, что позволяет молекуле связывать другие белки для осуществления специфического ответа. Молекула кальмодулина может связать до четырёх ионов кальция, может подвергаться посттрансляционной модификации, например, фосфорилированию, ацетилированию, метилированию, протеолизу, причем эти модификации могут модулировать активность СаМ. Киназа легких цепей миозина. Киназа легких цепей миозина фосфорилирует миозин. Киназа легких цепей миозина имеет ключевое значение в сокращении гладкой мускулатуры. Сокращение гладких мышц может произойти после повышения концентрации кальция в результате притока из саркоплазматического ретикулюма или из внеклеточного пространства. Сперва кальций связывается с кальмодулином, это связывание активирует киназу легких цепей миозина, которая фосфорилирует легкие цепи молекул миозина. Фосфорилирование позволяет молекулам миозина образовывать поперечные мостики и связываться с актиновыми филаментами и стимулирует мышечное сокращение. Данный путь является основным в механизме сокращения гладких мышц, так как гладкие мышцы не содержат тропонинового комплекса, в отличие от поперечно-полосатых. Механизм действия стероидных гормонов. Ядерные рецепторы гормонов. Механизм действия стероидных гормонов. Стероидные гормоны легко проникают внутрь клетки через поверхностную плазматическую мембрану в силу своей липофильности и взаимодействуют в цитозоле со специфическими рецепторами. В цитозоле образуется комплекс «гормон-рецептор», движущейся в ядро. В ядре комплекс распадается и гормон взаимодействует с ядерным хроматином. В результате этого происходит взаимодействие с ДНК, а затем — индукция матричной РНК. В ряде случаев стероиды, например, стимулируют в одной клетке образования 100-150 тыс. молекул м РНК, в которых закодирована структура лишь 1-3 белков. Итак, первый этап действия стероидных гормонов — активация транскрипции. Одновременно происходит активация РНК- полимеразы, осуществляющего синтез рибосомальной РНК (р-РНК). За счет этого образуется дополнительное количество рибосом, которые связываются с мембранами эндоплазматического ретикулума и образуют полисомы. Вследствие всего комплекса событий (транскрипции и трансляции) через 2-3 часа после воздействия стероида наблюдается усиленный синтез индуцированных белков. В одной клетке стероид влияет на синтез не более 5-7 белков. Известно также, что в одной и той же клетке стероид может вызвать индукцию синтеза одного белка и репрессию синтеза иного белка. Это происходит вследствие того, что рецепторы данного стероида неоднородны. Рецепторы стероидных гормонов: механизм действия До недавнего времени считалось, что рецепторы стероидных гормонов исходно (т.е. в отсутствие гормона) локализованы в цитозоле, и в 1972 году Дженсеном с соавторами была предложена двухступенчатая модель взаимодействия стероидных гормонов с клеткой-мишенью . Согласно этой модели, липофильные молекулы стероидов свободно проникают из крови в клетку-мишень и быстро связываются в цитоплазме с рецепторными белками. После связывания рецептора с гормоном резко повышается его сродство к ядерному хроматину. Повышение сродства рецептора к хроматину коррелирует с его физической трансформацией, при которой от него отделяется бтш 90 , и рецептор выявляется в форме 4S. Предполагают, что отделение бтш 90 является следствием изменения конформации гормон-связывающего участка под влиянием связывания с гормоном. Активированный гормон-рецепторный комплекс перемещается ( транслоцируется ) из цитоплазмы в ядро и аккумулируется в хроматине. В хроматине он взаимодействует с определенными акцепторными участками хроматина и модулирует процесс транскрипции. Затем под действием специальных выключающих (терминирующих) механизмов гормон- рецепторный комплекс распадается. Взаимодействие стероидных рецепторов с ДНК осуществляется через ДНК- связывающие участки рецептора . С другой стороны, в составе ДНК имеются специфические гормон-чувствительные элементы, примыкающие, как правило, с 5 - конца к гормон-зависимым генам. Эти элементы усиливают транскрипцию, работая на расстоянии 10#-10# пар оснований вниз и вверх от промоторных участков соответствующих генов. Для рецептора прогестерона и рецептора эстрадиола показано, что с палиндромным гормон- чувствительным участком связываются две рецепторные молекулы, образуя функциональный димер. При этом рецептор прогестерона способен образовывать как гомодимеры (АА или ВВ), так и гетеродимеры (АВ). Взаимодействие стероид-рецепторных комплексов с хроматином может приводить к изменению структуры хроматина и тем самым регулировать доступ к определенным участкам ДНК белков, участвующих в регуляции транскрипции ( транскрипционный фактор ). Кроме того, это взаимодействие может влиять на активность самих транскрипционных факторов. Лимитируя или повышая активность рецепторов, они могут играть решающую роль в осуществлении эффектов стероидов. В 80-х гг стройная гипотеза Дженсена о транслокации гормон-рецепторных комплексов из цитоплазмы в ядро подверглась пересмотру в связи с появлением данных, указывающих на локализацию неоккупированных рецепторов стероидных гормонов не в цитоплазме, а в ядре (см. Рецепторы стероидных гормонов: концепция ядерной локализации Классификация гормонов по химическому строению и биологическим функциям. Номенклатура гормонов. По химической структуре: белки (инсулин, тиреотропин, гонадотропины) и пептиды (все гормоны гипоталамуса,а также вазопрессин, окситоцин, кальцитонин и др.); производные аминокислот (гормоны мозгового слоя надпочечников адреналин, норадреналин и гормоны щитовидной железы Т3 и Т4). стероиды (кортикостероиды, половые гормоны -эстрогены и андрогены, кальцитриол). производные жирных кислот – арахидоновой кислоты — ПГ, ПЦ, ТХ и ЛТ. газы (окись азота). По биологическим функциям: регулирующие обмен углеводов, липидов, АК: инсулин, глюкагон, адреналин, кортизол, тироксин и др.; регулирующие водно-солевой обмен: минералокортикостероиды (альдостерон), АДГ (вазопрессин); регулирующие обмен Са и фосфатов: ПТГ, кальцитонин, кальцитриол; регулирующие репродуктивную функцию: эстрадиол, прогестерон, тестостерон, гонадотропные гормоны; регулирующие синтез и секрецию гормонов эндокринных желез (тропные гормоны гипофиза, либерины и статины гипоталамуса). регулирующие изменение метаболизма в клетках, синтезирующих гормон (эйкозаноиды,, цитокины и др). Гормоны гипоталамуса. Химическая природа. Биологическая роль. Гипоталамический гормон Структура Функция Тиреотропин-рилизинг-гормон (тиреолиберин, ТРФ) Пептид, 3 а.к.1 Стимулирует секрецию тиреотропина и пролактина Кортикотропин-рилизинг-гормон (кортиколиберин, КРФ) Полипептид, 41 а.к. Стимулирует секрецию кортикотропина Гонадотропин-рилизинг-гормон (гонадолиберин, ГРФ)Полипептид, 10 а.к. Стимулирует секрецию ЛГ и ФСГ Соматотропин-рилизинг-гормон (соматолиберин, СРФ) Полипептид, 40 или 44 а.к. Стимулирует секрецию соматотропина Соматостатин(соматотропин-ингибирующий гормон) Полипептид, 14 или 28 а.к. Ингибирует секрецию соматотропина Пролактолиберин2 Стимулирует секрецию пролактина Пролактостатин (дофамин)3 Полипептид, 56 а.к. Ингибирует секрецию пролактина Гормоны передней доли гипофиза. Химическая природа. Биологическая роль. Из- менения метаболизма при гипо- и гиперфункции. Гормон роста (FP), соматотропный гормон (СТГ) Полипептид, 191 а.к Стимулирует йостнатальный рост скелета и мягких тканей. Участвует в регуляции энергетического и минерального обмена. Тиреотропин,Димер (αβ) Стимулирует синтез йодтиронинов Тиреотропный α-полипептид, гормон (ТТГ) 96 а.к. β-Полипептид, 112а.к. Пролактин (ПРЛ) Полипептид, 197 а.к. Стимулирует лактацию Лютеинизирующий гормон (ЛГ) α-Полипептид, 96 а.к. У женщин индуцирует овуляцию β-Полипептид, 121 а.к. У мужчин индуцирует синтез андрогенов в клетках Лейдига Фолликулостимулирующий гормон (ФСГ) α-Полипептид, 96 а.к. У женщин стимулирует рост фолликулов У мужчин стимулирует сперматогенез β-Полипептид, 120 а.к. Кортикотропин, адренокортикотропный гормон (АКТГ) Полипептид, 39 а.к. Стимулирует рост надпочечников и синтез кортикостероидов β-Липотропин (β-ЛТГ) Полипептид, 93 а.к. Стимулирует липолиз Гормоны задней доли гипофиза. Химическая природа. Биологическая роль. Изме- нения метаболизма при гипо- и гиперфункции. Гормоны задней доли гипофиза Принято считать гормонами задней доли гипофиза два гормона - окситоцин и вазо- прессин, хотя они образуются и секретируются нейронами, формирующими ядра гипоталамуса. Вазопрессин преимущественно синтезируется нейронами супраоптического, а окситоцин паравентрикулярного ядер. Это нанопептиды с очень подобным аминокислотным составом и последовательностью. Вазопрессин имеет некоторые видовые различия: арг-вазопрессин у человека и лиз-вазопрессин у свиньи, а окситоцин одинаково устроен у всех видов животных. После синтеза в составе секреторных пузырьков вместе с белками получившими на- звание нейрофизинов, оба гормона аксоплазматическим током переносятся в нервные окончания задней доли гипофиза , из которых секретируются в кровоток при соответствующей стимуляции. Свое название вазопрессин получил благодаря способности повышать артериальное давление, а название окситоцин также связано с его физиологическим эффектом ускорения родов, хотя эти гормоны оказывают и другие эффекты. Вазопрессин – антидиуретический гормон. Несмотря на вазоконстрикторское действие, оправдывающее его название, основным для вазопрессина оказался антидиуретический эффект. Вазопрессин – ведущий гормон, обеспечивающий сохранение воды в организме. Основным регулятором секреции вазопрессина является изменение осмотического давления крови. Осморецепторы, расположенные в переднем гипоталамусе, обладают высокой чувствительностью к изменению осмотического давления и начинают реагировать на изменение менее чем на 1% осмолярности плазмы. Кроме того имеются внегипоталамические (печеночные или портальные осморецепторы) которые реагируют на изменение осмолярности плазмы более чем на 1% от нормальных величин. Другим регулятором оказывающим влияние на секрецию вазопрессина является из- менение объема циркулирующей крови. Импульсы с барорецепторов левого предсердия, каротидного синуса и дуги аорты ингибируют секрецию вазопрессина. Снижение интенсивности нервной импульсации от этих рецепторов приводит к повышению высвобождения вазопрессина. Основной физиологический эффект окситоцина соответствует названию гормона. Рис.11.16. Регуляция лактации. За последние годы представления о роли окситоцина несколько расширились, хотя по-прежнему лучше изучена его роль у женщин. Можно выделить три основных эффекта влияния этого гормона: Усиление сокращения мышц матки во время родов. Стимуляция выхода молока в лактирующей молочной железе из альвеол в протоки. 3.Регуляция поведенческой активности , связанной с беременностью, лактацией и уходом за потомством. В 90-е годы прошлого столетия было показано участие окситоцина в механизмах фиксации памяти. Главными стимулами высвобождения окситоцина являются нервные импульсы, возникающие при раздражении грудных сосков (см рис 12-27) Растяжение влагалища и матки также играет некоторую роль в стимуляции образования окситоцина. При многих воздействиях, вызывающих секрецию окситоцина, происходит высвобождение пролактина что дает право говорить, что фрагмент окситоцина может играть роль пролактин-рилизинг-фактора. Эстрогены стимулируют, а прогестерон ингибирует продукцию окситоцина. Рецепторы окситоцина (ОТ) найдены в клетках матки и миоэпителиальных клетках молочной железы . Их количество увеличивается под действием эстрогенов и снижается под влиянием прогестерона . Наступление лактации до родов можно, очевидно, объяснить одновременным повышением количества эстрогенов и падением уровня прогестерона непосредственно перед родами. У мужчин основной эффект окситоцина связывают с его стимулирующим влиянием на семявыносящие протоки (эйякуляция) и влиянием на поведенческую активность, связанную с половой функцией. Инактивация окситоцина как и вазопрессина происходит главным образом почками (40%) и печенью (около 50%). Экзогенно введенный вазопрессин частично (10-20%) выделяется с мочой в биологически активной форме. В процессах инактивации окситоцина определенное место занимает также молочная железа Несахарное мочеизнурение – форма проявления функциональной недостаточности вазопрессина. Термин несахарный диабет был введен для обозначения полиурии, при которой моча не имела сладкого вкуса, что позволяло отличить это состояние от сахарного диабета. Заболевание проявляется жаждой и экскрецией большого количества мочи (до 20 л) с низкой плотностью. Прием большого количества жидкости является компенсаторной реакцией для предотвращения дегидратации и гиперосмолярности в организме. Заболеваемость несахарным диабетом составляет 1 вновь выявленный случай на 1 млн. населения Различают две основные формы несахарного диабета: |
