Коммуникации эндокринная
 Скачать 1.15 Mb. Скачать 1.15 Mb.
|
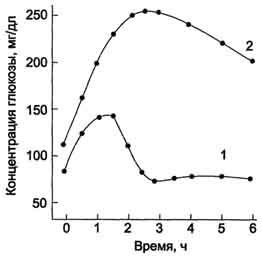 Рис. 11-30. Изменение толерантности к глюкозе у больных скрытой формой сахарного диабета. Определение толерантности к глюкозе используют для диагностики сахарного диабета. Обследуемый принимает раствор глюкозы из расчёта 1 г на 1 кг массы тела (сахарная нагрузка). Концентрацию глюкозы в крови измеряют в течение 2-3 ч с интервалами в 30 мин. 1 - у здорового человека; 2 - у больного сахарным диабетом. сахарного диабета. В этих случаях у людей отсутствуют жалобы и клинические симптомы, характерные для сахарного диабета, а концентрация глюкозы в крови натощак соответствует норме. Однако использование провокационных проб (например, сахарной нагрузки) выявляет снижение толерантности к глюкозе (рис. 11- 30). Повышение концентрации глюкозы в плазме крови обусловлено снижением скорости использования глюкозы тканями вследствие недостатка инсулина или снижения биологического действия инсулина в тканях-мишенях. При дефиците инсулина уменьшается количество белков-переносчиков глюкозы (ГЛЮТ-4) на мембранах инсулинзависимых клеток (жировой ткани и мышц). В мышцах и печени глюкоза не депонируется в виде гликогена, в жировой ткани уменьшается скорость синтеза и депонирования жиров. Кроме того, при снижении инсулинглюкагонового индекса активируется глюконеогенез из аминокислот, глицерола и лактата. Повышение концентрации глюкозы в крови при сахарном диабете превышает концентрационный почечный порог, что становится причиной выделения глюкозы с мочой (глюкозурия). В норме проксимальные канальцы почек реабсорбируют всю фильтрующуюся в клубочках глюкозу, если её уровень не превышает 8,9 ммоль/л (160 мг/дл). К характерным признакам сахарного диабета относят также повышение концентрации в крови кетоновых тел - кетонемия. При низком соотношении инсулин/глюкагон жиры не депонируются, а ускоряется их катаболизм, так как гормончувствительная липаза в жировой ткани находится в фосфорилированной активной форме. Концентрация неэтерифицирован-ных жирных кислот в крови повышается. Печень захватывает жирные кислоты, окисляет их до ацетил-КоА, который, в свою очередь, превращается в β- гидроксимасляную и ацетоуксусную кислоты. В тканях ацетоацетат частично декарбоксилируется до ацетона, запах которого исходит от больных сахарным диабетом и ощущается даже на расстоянии. Увеличение концентрации кетоновых тел в крови (выше 20 мг/дл, иногда до 100 мг/дл) приводит к кетонурии. Накопление кетоновых тел снижает буферную ёмкость крови и вызывает ацидоз. Ещё один характерный признак сахарного диабета - повышенный уровень в крови ли-попротеинов (в основном, ЛПОНП) - гипер-липопротеинемия. Пищевые жиры не депонируются в жировой ткани вследствие ослабления процессов запасания, а поступают в печень, где частично превращаются в триацилглицеролы, которые транспортируются из печени в составе ЛПОНП. При сахарном диабете дефицит инсулина приводит к снижению скорости синтеза белков в организме и усилению распада белков. Это вызывает повышение концентрации аминокислот в крови. Аминокислоты поступают в печень и дезаминируются. Безазотистые остатки гликогенных аминокислот включаются в глюконеогенез, что ещё более усиливает гипергликемию. Образующийся при этом аммиак вступает в орнитиновый цикл, что приводит к увеличению концентрации мочевины в крови и, соответственно, в моче - азотемия и азотурия. Высокие концентрации глюкозы, кетоновых тел, мочевины требуют усиленной экскреции их из организма. Поскольку концентрационная способность почек ограничена, резко увеличивается выделение большого количества воды, в результате чего может наступить обезвоживание организма. Выделение мочи у больных возрастает в несколько раз и в некоторых случаях достигает 8-9 л в сутки, но чаще не превышает 3-4 л - полиурия. Потеря воды вызывает постоянную жажду - полидипсия. Острые осложнения сахарного диабета. Механизмы развития диабетической комы Нарушения обмена углеводов, жиров и белков при сахарном диабете могут приводить к развитию коматозных состояний (острые осложнения). Диабетическая кома проявляется в резком нарушении всех функций организма с потерей сознания. Основные предшественники диабетической комы - ацидоз и дегидратация тканей (рис. 11-31). Параллельно кетоацидозу при декомпенсации диабета развивается нарушение водно-электролитного обмена. В его основе лежит гипергликемия, сопровождающаяся повышением осмотического давления в сосудистом русле. Для сохранения осмолярности начинается компенсаторное перемещение жидкости из клеток и внеклеточного пространства в сосудистое русло. Это ведёт к потере тканями воды и электролитов, прежде всего ионов Na+, K+, С1-, НСО3. В результате развиваются тяжёлая клеточная дегидратация и дефицит внутриклеточных ионов (прежде всего К+), затем возникает общая дегидратация. Это приводит к снижению периферического кровообращения, уменьшению мозгового и почечного кровотока и гипоксии. Диабетическая кома развивается медленно, в течение нескольких дней, но иногда может возникнуть и в течение нескольких часов. Первыми признаками могут быть тошнота, рвота, заторможенность. АД у больных снижено. Коматозные состояния при сахарном диабете могут проявляться в трёх основных формах: кетоацидотической, гиперосмолярной и лакто-ацидотической. Для кетоацидотической комы характерны выраженный дефицит инсулина, кетоацидоз, полиурия, полидипсия. Гипергликемия (20-30 ммоль/л), обусловленная инсулиновой недостаточностью, сопровождается большими потерями жидкости и электролитов, дегидратацией и гиперосмоляльностью плазмы. Общая концентрация кетоновых тел достигает 100 мг/дл и выше. При гиперосмолярной коме наблюдают чрезвычайно высокие уровни глюкозы в плазме крови, полиурию, полидипсию, всегда проявляется тяжёлая дегидратация. Предполагают, что у большинства больных гипергликемия обусловлена сопутствующим нарушением функции почек. Кетоновые тела в сыворотке крови обычно не определяются. При лактоацидотической коме преобладают гипотония, снижение периферического кровообращения, гипоксия тканей, приводящая к смещению метаболизма в сторону анаэробного гликолиза, что обусловливает повышение концентрации молочной кислоты в крови (лакто-ацидоз). Разные варианты диабетической комы в чистом виде практически не встречаются. Их возникновение может быть обусловлено разными факторами, например инфекционными заболеваниями, травмами, хирургическими вмешательствами, токсическими соединениями и др. Поздние осложнения сахарного диабета Главная причина поздних осложнений сахарного диабета - гипергликемия. Гипергликемия приводит к повреждению кровеносных сосудов 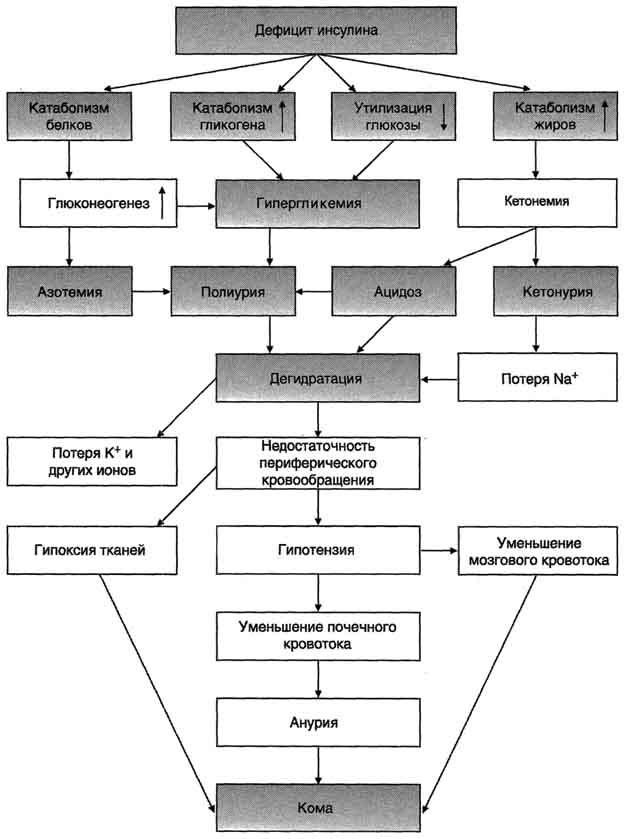 Рис. 11-31. Изменение метаболизма при сахарном диабете и причины диабетической комы. и нарушению функций различных тканей и органов. Одним из основных механизмов повреждения тканей при сахарном диабете является гликозилирование белков, приводящее к изменению их конформации и функций. Некоторые белки в норме содержат углеводные компоненты, причём образование таких гликопротеинов протекает ферментативно (например, образование гликопротеиновых гормонов аденогипофиза). Однако в организме человека может происходить и неферментативное взаимодействие глюкозы со свободными аминогруппами белков - неферментативное гликозилирование белков. В тканях здоровых людей эта реакция протекает медленно. При гипергликемии процесс гликозилирования ускоряется. Степень гликозилирования белков зависит от скорости их обновления. В медленно обменивающихся белках накапливается больше изменений. К одним из первых признаков сахарного диабета относят увеличение в 2-3 раза количества гликозилированного гемоглобина (норма НbА1С 5,8-7,2%). Другим примером медленно обменивающихся белков служат кристаллины - белки хрусталика. При гликозилировании кристаллины образуют многомолекулярные агрегаты, увеличивающие преломляющую способность хрусталика. Прозрачность хрусталика уменьшается, возникает его помутнение, или катаракта. К медленно обменивающимся белкам относятся белки межклеточного матрикса, базальных мембран. Утолщение базальных мембран, одно из характерных осложнений сахарного диабета, приводит к развитию диабетических ангиопатий. Причиной многих поздних осложнений сахарного диабета также служит повышение скорости превращения глюкозы в сорбитол (см. раздел 7). Реакция превращения глюкозы в шестиатомный спирт (сорбитол) катализируется ферментом альдозоредуктазой. Сорбитол не используется в других метаболических путях, а скорость его диффузии из клеток невелика. У больных сахарным диабетом сорбитол накапливается в сетчатке и хрусталике глаза, клетках клубочков почек, шванновских клетках, в эндотелии. Сорбитол в высоких концентрациях токсичен для клеток. Его накопление в нейронах приводит к увеличению осмотического давления, набуханию клеток и отёку тканей. Так, например, помутнение хрусталика может развиться вследствие вызванного накоплением сорбитола набухания хрусталика и нарушения упорядоченной структуры кристаллинов. Диабетические ангиопатий. Диабетические ангиопатий обусловлены прежде всего поражением базальных мембран сосудов. При высокой концентрации глюкозы в плазме крови протеогликаны, коллагены, гликопротеины гликозилируются, нарушается обмен и соотношение между компонентами базальных мембран, нарушается их структурная организация. Макроангиопатии проявляются в поражениях крупных и средних сосудов сердца, мозга, нижних конечностей. Патологические изменения во внутренней оболочке артерий и повреждения артериальной стенки в средних и наружных слоях - следствие гликозилирования базальных мембран и белков межклеточного матрикса (коллагена и эластина), что приводит к снижению эластичности артерий. В сочетании с гиперли-пидемией это может быть причиной развития атеросклероза. При сахарном диабете атеросклероз встречается чаще, развивается в более раннем возрасте и прогрессирует значительно быстрее, чем в отсутствие диабета. Микроангиопатии - результат повреждения капилляров и мелких сосудов. Проявляются в форме нефро-, нейро- и ретинопатии. Нефропатия развивается примерно у трети больных сахарным диабетом. Электронно-микроскопические изменения базальной мембраны в почечных клубочках можно обнаружить уже на первом году после установления диагноза. Однако у большинства больных клинические признаки диабетической нефропатии проявляются через 10-15 лет существования диабета. Признаком ранних стадий нефропатии служит микроальбуминурия (в пределах 30-300 мг/сут), которая в дальнейшем развивается до классического нефротического синдрома, характеризующегося высокой протеинурией, гипоальбуминемией и отёками. Ретинопатия, самое серьёзное осложнение сахарного диабета и наиболее частая причина слепоты, развивается у 60-80% больных сахарным диабетом. На ранних стадиях развивается базальная ретинопатия, которая проявляется в кровоизлияниях в сетчатку, расширении сосудов сетчатки, отёках, Если изменения не затрагивают жёлтого пятна, потеря зрения обычно не происходит. В дальнейшем может развиться пролиферативная ретинопатия, проявляющаяся в новообразовании сосудов сетчатки и стекловидного тела. Ломкость и высокая проницаемость новообразованных сосудов определяют частые кровоизлияния в сетчатку или стекловидное тело. На месте тромбов развивается фиброз, приводящий к отслойке сетчатки и потере зрения. В. Диагностика сахарного диабета Обычно диагноз сахарного диабета можно поставить на основе классических симптомов сахарного диабета - гипергликемии, полиурии, полидипсии, полифагии, ощущения сухости во рту. Важнейшие биохимические признаки ИЗСД выявляют на основе: теста толерантности к глюкозе (см. рис. 11-30). Уровень глюкозы в плазме крови выше 10 ммоль/л через 2 ч после сахарной нагрузки свидетельствует о сахарном диабете; определения гликозилированного гемоглобина. При сахарном диабете уровень НbА1с, в норме составляющий около 5% от всего содержания гемоглобина, увеличивается в 2-3 раза; отсутствия или низкого уровня инсулина и С-пептида в крови и моче. В норме инсулин и С-пептид секретируются в эквимолярных концентрациях. Поскольку печенью задерживается примерно 2/3 инсулина, соотношение инсулин/С-пептид в воротной вене и периферических сосудах в норме составляет 1/3. Величина уровня С-пептида в сыворотке или моче позволяет достаточно точно оценить функциональное состояние β- клеток; альбуминурии. При сахарном диабете суточное выведение альбумина составляет примерно 30-300 мг - микроальбуминурия (в норме около 8 мг). Поскольку ИНСД развивается значительно медленнее, классические клинические симптомы, гипергликемию и дефицит инсулина диагностируют позднее, часто в сочетании с симптомами поздних осложнений сахарного диабета. Г. Подходы к лечению сахарного диабета Лечение сахарного диабета зависит от его типа (I или II), является комплексным и включает диету, применение сахаропонижающих средств, инсулинотерапию, а также профилактику и лечение осложнений. Современные сахаропонижающие препараты делят на две основные группы: производные суль- фонилмочевины и бигуаниды. К препаратам, действие которых направлено на стимуляцию секреции инсулина, относят производные сульфонилмочевины (например, манинил). Механизм действия препаратов сульфонилмочевины объясняют их влиянием на функцию АТФ-чувствительных К+-каналов. Повышение внутриклеточной концентрации К+ приводит к деполяризации мембраны и ускорению транспорта ионов кальция в клетку, вследствие чего стимулируется секреция инсулина. Другую основную группу сахаропонижающих препаратов составляют бигуаниды. По данным некоторых исследований, бигуаниды увеличивают количество переносчиков глюкозы ГЛЮТ-4 на поверхности мембран клеток жировой ткани и мышц. К перспективным методам лечения сахарного диабета относят следующие: трансплантация островков поджелудочной железы или изолированных β-клеток, трансплантация генетически реконструированных клеток, а также стимуляция регенерации панкреатических островков. При сахарном диабете обоих типов важнейшее значение имеет диетотерапия. Рекомендуют хорошо сбалансированную диету: на долю углеводов должно приходиться 50-60% общей калорийности пищи (исключение должны составлять легкоусвояемые углеводы, пиво, спиртные напитки, сиропы, пирожные и др.); на долю белков - 15-20%; на долю всех жиров - не более 25-30%. Пищу следует принимать 5-6 раз в течение суток. 22. Мужские и женские половые гормоны. Химическая природа. Биологическая роль. Репродуктивные функции организма регулируются половыми гормонами: у мужчин - тестостероном, у женщин - эстрогенами и прогестинами. Синтез и секреция половых гормонов, в свою очередь, находятся под контролем фол-ликулостимулирующего и лютеинизирующего гормонов. А. Гонадотропные гормоны гипофиза, стимулирующие синтез и секрецию половых гормонов Фолликулостимулирующий гормон (ФСГ) и лютеинизирующий гормон (ЛГ) - гонадотропные гормоны гипофиза. Представляют собой гликопротеины с молекулярной массой около 30 кД, состоящие из α- и β- субъединиц. α-Субъединицы содержат 92 аминокислоты и две боковые углеводные цепи и идентичны α- субъединице тиреотропина, β-Субъединицы индивидуальны для каждого гормона. Регуляция секреции ФСГ и ЛГ Образование и освобождение обоих гормонов стимулируется гипоталамическим декапеп-тидом - гонадотропин-рилизинг-гормоном, секреция которого происходит эпизодически, что в основном и определяет импульсный характер секреции ЛГ и ФСГ. У женщин эстрогены и прогестерон по механизму обратной связи влияют на секрецию ЛГ и ФСГ как на гипоталамическом, так и на гипофизарном уровне. У мужчин тестостерон и эстроген, образованный в клетках Лейдига и в процессе метаболизма тестостерона, блокируют по механизму обратной связи синтез и секрецию гонадолиберина и гонадотропных гормонов гипофиза. Кроме этого, клетками гранулёзы фолликулов и клетками Сертоли вырабатывается белок ингибин, который тормозит гипофизарную секрецию ФСГ. Т1/2 ФСГ составляет примерно 150 мин, а Т1/2 ЛГ - 30 мин. Механизм действия и эффекты ФСГ и ЛГ Гонадотропные гормоны ЛГ и ФСГ связываются с рецепторами на мембранах своих клеток-мишеней в яичниках и яичках, в результате чего происходит активация аденилатциклазной системы. Образующийся цАМФ активирует протеинкиназу, которая фосфорилирует белки, опосредующие эффекты ЛГ и ФСГ. У женщин лютеинизирующий гормон стимулирует образование прогестерона клетками жёлтого тела, у мужчин - синтез тестостерона интерстициальными клетками Лейдига. ФСГ ускоряет развитие фолликулов в яичниках и образование эстрогенов, а действуя на клетки Сертоли, запускает процесс сперматогенеза. Б. Мужские половые гормоны Мужские половые гормоны (рис. 11-39) вырабатываются в основном в мужских половых железах - в интерстициальных клетках Лейдига семенников (95%). Небольшое количество андрогенов образуется в коре надпочечников. Мишени для андрогенов К мишеням тестостерона относят эмбриональные вольфовы структуры, сперматогонии, мышцы, кости, почки, мозг. Подобно другим стероидным гормонам, андрогены образуют внутри клетки комплекс с рецептором, который связывается с определённым участком хроматина, активируя специфические гены, белковые продукты которых опосредуют биологические эффекты андрогенов. Эффекты андрогенов Физиологическое действие андрогенов различно в разные периоды жизни организма. У эмбриона под действием андрогенов из вольфова протока образуются придаток яичка (эпидидимис), семявыносящий проток и семенной пузырёк. У плода мужского пола происходит маскулинизация мозга. Поскольку андрогены в организме обладают мощным анаболическим действием и стимулируют клеточное деление, повышенный уровень андрогенов в препубертатный период приводит к скачкообразному увеличению линейных размеров тела, увеличению скелетных мышц, росту костей, но одновременно способствуют и остановке роста, так как стимулируют сращение эпифизов длинных костей с их стволами. Андрогены вызывают изменение структуры кожи и волос, снижение тембра голоса вследствие утолщения голосовых связок и увеличения объёма гортани, стимулируют секрецию сальных желёз. 3. Механизм действия и биологические эффекты эстрогенов Эстрогены связываются с внутриклеточными рецепторами и, подобно другим стероидным гормонам, регулируют транскрипцию структурных генов. Предполагается, что эстрогены индуцируют синтез свыше 50 различных белков, участвующих в проявлении физиологических эффектов эстрогенов. Эстрогены стимулируют развитие тканей, участвующих в размножении, определяют развитие многих женских вторичных половых признаков, регулируют транскрипцию гена рецептора прогестина. В лютеиновой фазе под действием эстрогенов вместе с прогестинами пролиферативный эндометрий (эпителий матки) превращается в секреторный, подготавливая его к имплантации оплодотворённой яйцеклетки. Совместно с простагландином F2α эстрогены увеличивают чувствительность миометрия к действию окситоцина во время родов. Эстрогены оказывают анаболическое действие на кости и хрящи. Другие метаболические эффекты эстрогенов включают поддержание нормальной структуры кожи и кровеносных сосудов у женщин, способствуют образованию оксида азота в сосудах гладких мышц, что вызывает их расширение и усиливает теплоотдачу. Эстрогены стимулируют синтез транспортных белков тиреоидных и половых гормонов. Эстрогены могут индуцировать синтез факторов свёртывания крови II, VII, IX и X, уменьшать концентрацию антитромбина III. Эстрогены оказывают влияние на обмен липидов. Так, увеличение скорости синтеза ЛПВП и торможение образования ЛПНП, вызываемое эстрогенами, приводит к снижению содержания холестерола в крови. 5. Биологические эффекты прогестерона Действие прогестерона в основном направлено на репродуктивную функцию организма. Образование прогестерона отвечает за увеличение базальной температуры тела на 0,2-0,5 °С, которое происходит сразу после овуляции и сохраняется на протяжении лютеиновой фазы менструального цикла. При высоких концентрациях прогестерон взаимодействует с рецепторами, локализованными в клетках почечных канальцев, конкурируя таким образом с альдостероном. В результате конкурентного игибирования альдостерон теряет возможность стимулировать реабсорбцию натрия. Прогестерон может также оказывать действие и на ЦНС, в частности вызывать некоторые особенности поведения в предменструальный период. 23. Эйкозаноиды. Их синтез. Химическая природа. Биологическая роль. ЭЙКОЗАНОИДЫ Эйкозаноиды, включающие в себя простагландины, тромбоксаны, лейкотриены и ряд других веществ, - высокоактивные регуляторы клеточных функций. Они имеют очень короткий Т1/2, поэтому оказывают эффекты как "гормоны местного действия", влияя на метаболизм продуцирующей их клетки по аугокзэинному механизму, и на окружающие клетки - по паракринному механизму. Эйкозаноиды участвуют во многих процессах: регулируют тонус ГМК и вследствие этого влияют на АД, состояние бронхов, кишечника, матки. Эйкозаноиды регулируют секрецию воды и натрия почками, влияют на образование тромбов. Разные типы эйкозаноидов участвуют в развитии воспалительного процесса, происходящего после повреждения тканей или инфекции. Такие признаки воспаления, как боль, отёк, лихорадка, в значительной мере обусловлены действием эйкозаноидов. Избыточная секреция эйкозаноидов приводит к ряду заболеваний, например бронхиальной астме и аллергическим реакциям. А. Субстраты для синтеза эйкозаноидов Главный субстрат для синтеза эйкозаноидов у человека - арахидоновая кислота (20:4, ω-6), так как её содержание в организме человека значительно больше остальных полиеновых кислот-предшественников эйкозаноидов (см, выше табл. 8-1). В меньшем количестве для синтеза эйкозаноидов используются эйкозапентаеновая (20:5, ω-3) и эйкозатриеновая (20:3, ω-6) жирные кислоты. Полиеновые кислоты с 20 атомами углерода поступают в организм человека с пищей или образуются из незаменимых (эссенциальных) жирных кислот с 18 атомами углерода, также поступающими с пищей (рис. 8- 44). Полиеновые жирные кислоты, которые могут служить субстратами для синтеза эйкозаноидов, входят в состав глицерофосфолипидов мембран. Под действием ассоциированной с мембраной фосфолипазы А2 жирная кислота отщепляется от глицерофосфолипида и используется для синтеза эйкозаноидов. Б. Структура, номенклатура и биосинтез простагландинов и тромбоксанов Хотя субстраты для синтеза эйкозаноидов имеют довольно простую структуру (полистовые жирные кислоты), из них образуется большая и разнообразная группа веществ. Наиболее распространены в организме человека простагландины, которые впервые были выделены из предстательной железы, откуда и получили свое название. Позже было показано, что и другие ткани организма синтезируют простагландины и другие эйкозаноиды. Структура и номенклатура простагландинов и тромбоксанов Простагландины (рис. 8-45) обозначают символами, например PG А, где PG обозначает слово "простагландин", а буква А обозначает заместитель в пятичленном кольце в молекуле эйкозаноида. Каждая из указанных групп простагландинов состоит из 3 типов молекул, отличающихся по числу двойных связей в боковых цепях. Число двойных связей обозначают нижним цифровым индексом, например, PG Е2. Число двойных связей в боковых цепях простагландинов зависит от структуры предшественника - полистовой кислоты, из которой образовались простагландины. Две двойные связи полиеновой кислоты используются при образовании кольца в молекуле простагландина, а количество оставшихся двойных связей в радикалах, связанных с кольцом, определяет серию простагландина: 1 - если одна двойная связь, 2 - если две двойные связи и 3 - если в радикалах имеются три двойных связи. PG I - простациклины. Имеют 2 кольца в своей структуре: одно пятичленное, как и другие простагландины, а другое - с участием атома кислорода. Их также подразделяют в зависимости от количества двойных связей в радикалах (PG I2, PG I3). Тромбоксаны. В отличие от простагландинов, тромбоксаны синтезируются только в тромбоцитах, откуда и происходит их название, и стимулируют их агрегацию при образовании тромба. Тромбоксаны имеют шестичленное кольцо, включающее атом кислорода (рис. 8-46). Так же, как и другие эйкозаноиды, тромбоксаны могут содержать различное число двойных связей в боковых цепях, образуя ТХ А2, или ТХ A3, отличающиеся по активности. ТХ В2 - продукт катаболизма ТХ А2 и активностью не обладает. Циклооксигеназный путь: синтез простагландинов и тромбоксанов Активация фосфолипаз. Синтез проетагландинов начинается только после отделения полиеновых кислот от фосфолипида мембраны под действием ферментов (рис. 8-47). Активация фосфолипаз, ассоциированных с мембранами, происходит под действием многих факторов: |
