
Рис. 11-34. Система ренинангиотензинальдостерон. Ренин, протеолитический фермент, катализирует превращение ангиотензиногена (гликопротеина) в ангиотензин I (декапептид). 1 - ренин, протеолитический фермент, катализирует превращение ангиотензиногена (глйкопротеина) в ангиотензин I; 2 - ангиотензин I превращается в ангиотензин II под действием АПФ, отщепляющего два аминокислотных остатка от декапептида; 3 - ангиотензин II стимулирует синтез и секрецию альдостерона; 4 - ангйотензин II вызывает сужение сосудов периферических артерий; 5 - альдостерон стимулирует реабсорбцию Na+ и экскрецию К+; 6, 7, 8, 9 - торможение секреции ренина и альдостерона по механизму отрицательной обратной связи. Пунктирные линии - регуляция по принципу обратной связи.
18. Гормоны мозгового слоя надпочечников. Их синтез, химическая природа и биоло- гическая роль. Изменения метаболизма при гипо- и гиперфункции.
Подобно задней доле гипофиза, мозговой слой надпочечников - производное нервной ткани. Его можно рассматривать как продолжение симпатической нервной системы, так как преганглионарные волокна чревного нерва оканчиваются на хромаффинных клетках мозгового слоя надпочечников.
Своё название эти клетки получили потому, что они содержат гранулы, окрашивающиеся бихроматом калия в красный цвет. Такие клетки находятся также в сердце, печени, почках, половых железах, постганглионарных нейронах симпатической нервной системы и в ЦНС.
При стимуляции преганглионарного нейрона хромаффинные клетки продуцируют катехол-амины - дофамин, адреналин и норадреналин.
У большинства видов животных хромаффинные клетки секретируют в основном адреналин (
80%) и в меньшей степени норадреналин.
По химическому строению катехоламины - 3,4-дигидроксипроизводные фенилэтиламина. Непосредственным предшественником гормонов служит тирозин (см. раздел 9).
Синтез и секреция катехоламинов
Синтез катехоламинов происходит в цитоплазме и гранулах клеток мозгового слоя надпочечников (рис. 11- 22). В гранулах происходит также запасание катехоламинов.
Катехоламины поступают в гранулы путём АТФ-зависимого транспорта и хранятся в них в комплексе с АТФ в соотношении 4:1 (гормон-АТФ). Разные гранулы содержат разные катехоламины: некоторые только адреналин, другие - норадреналин, третьи - оба гормона.
Секреция гормонов из гранул происходит путём экзоцитоза. Катехоламины и АТФ освобождаются из гранул в том же соотношении, в каком они сохраняются в гранулах. В отличие от симпатических нервов, клетки мозгового слоя надпочечников лишены механизма обратного захвата выделившихся катехоламинов.
В плазме крови катехоламины образуют непрочный комплекс с альбумином. Адреналин транспортируется в основном к печени и скелетным мышцам. Норадреналин образуется в основном в органах, иннервируемых симпатическими нервами (80% от общего количества). Норадреналин лишь в незначительных количествах достигает периферических тканей. Т1/2 катехоламинов - 10-30 с. Основная часть катехоламинов быстро метаболизируется в различных тканях при участии специфических ферментов (см. раздел 9). Лишь небольшая часть адреналина (
5%) выделяется с мочой.
Механизм действия и биологические функции катехоламинов
Катехоламины действуют на клетки-мишени через рецепторы, локализованные в плазматической мембране. Выделяют 2 главных класса таких рецепторов: α-адренергические и β-адренергические. Все рецепторы катехоламинов - гликопротеины, которые являются продуктами разных генов, различаются сродством к агонистам и антагонистам и передают сигналы в клетки с помощью разных вторичных посредников. Это определяет характер их влияния на метаболизм клеток-мишеней.

Рис. 11-22. Синтез и секреция катехоламинов. Биосинтез катехоламинов происходит в цитоплазме и гранулах клеток мозгового слоя надпочечников. В одних гранулах содержится адреналин, в других норадреналин, а в некоторых - оба гормона. При стимуляции содержимое гранул высвобождается во внеклеточную жидкость. А
адреналин; НА - норадреналин.
Адреналин взаимодействует как с α-, так и с β-рецепторами; норадреналин в физиологических концентрациях главным образом взаимодействует с α-рецепторами.
Взаимодействие гормона с β-рецепторами активирует аденилатциклазу, тогда как связывание с α2- рецептором её ингибирует. При взаимодействии гормона с α1-рецептором происходит активация фосфолипазы С и стимулируется инозитолфосфатный путь передачи сигнала (см. раздел 5).
Биологические эффекты адреналина и норадреналина затрагивают практически все функции организма и рассматриваются в соответствующих разделах. Общее во всех этих эффектах заключается в стимуляции процессов, необходимых для противостояния организма чрезвычайным ситуациям.
Патология мозгового вещества надпочечников
Основная патология мозгового вещества надпочечников - феохромоцитома, опухоль, образованная хромаффинными клетками и продуцирующая катехоламины. Клинически феохромоцитома проявляется повторяющимися приступами головной боли, сердцебиения, потливости, повышением АД и сопровождается характерными изменениями метаболизма.
19. Гормоны поджелудочной железы и желудочно-кишечного тракта. Строение синтез и секреция инсулина. Биологические функции и механизм действия инсулина. Строение и биологическая роль глюкагона.
Поджелудочная железа выполняет в организме две важнейшие функции: экзокринную и эндокринную. Экзокринная функция обеспечивает синтез и секрецию ферментов и ионов, необходимых для процессов пищеварения. Эндокринную функцию выполняют клетки островкового аппарата поджелудочной железы, которые секретируют гормоны, участвующие в регуляции многих процессов в организме.
В островковой части поджелудочной железы (островки Лангерханса) выделяют 4 типа клеток, секретирующих разные гормоны: А- (или α-) клетки секретируют глюкагон, В- (или β-) - инсулин, D- (или δ-)
соматостатин, F-клетки секретируют панкреатический полипептид.
Инсулин. Строение, синтез и секреция
Инсулин - полипептид, состоящий из двух полипептидных цепей. Цепь А содержит 21 аминокислотный остаток, цепь В - 30 аминокислотных остатков. Обе цепи соединены между собой двумя дисульфидными мостиками (рис. 11-23). Инсулин может существовать в нескольких формах: мономера, димера и гексамера. Гексамерная структура инсулина стабилизируется ионами цинка, который связывается остатками Гис в положении 10 В-цепи всех 6 субъединиц.
Молекула инсулина содержит также внутримолекулярный дисульфидный мостик, соединяющий шестой и одиннадцатый остатки в А-цепи. Инсулины некоторых животных имеют значительное сходство по первичной структуре с инсулином человека.
Бычий инсулин отличается от инсулина человека по трём аминокислотным остаткам, а инсулин свиньи отличается только на одну аминокислоту, которая представлена аланином вместо треонина на карбоксильном конце В-цепи.
В обеих цепях во многих положениях встречаются замены, не оказывающие влияния на биологическую активность гормона. Наиболее часто эти замены обнаруживаются в положениях 8, 9 и 10 цепи А.
В то же время в положениях дисульфидных связей, остатков гидрофобных аминокислот в С-концевых участках В-цепи и С- и N-концевых остатков А-цепи замены встречаются очень редко, что свидетельствует о важности этих участков для проявления биологической активности инсулина. Использование химических
модификаций и замен аминокислот в этих участках позволили установить структуру активного центра инсулина, в формировании которого принимают участие остатки фенилаланина В-цепи в положениях 24 и 25 и N- и С-концевые остатки цепи А.
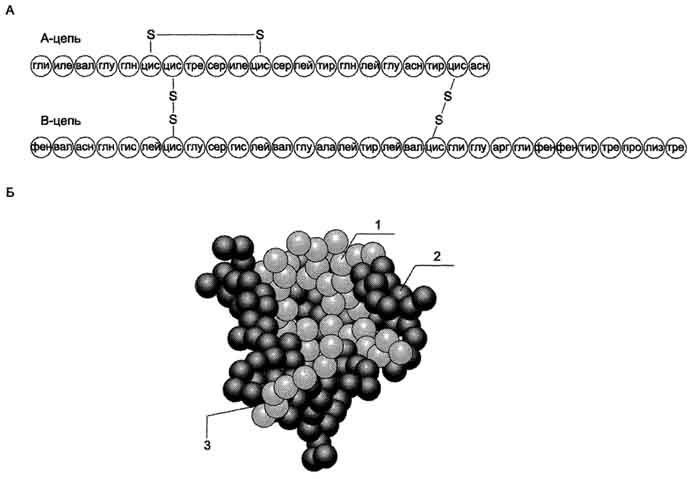
Рис. 11-23. Структура инсулина человека. А. Первичная структура инсулина. Б. Модель третичной структуры инсулина (мономер): 1 - А-цепь; 2 - В-цепь; 3 - участок связывания с рецептором.
Биосинтез инсулина включает образование двух неактивных предшественников, препроинсулина и проинсулина, которые в результате последовательного протеолиза превращаются в активный гормон. Биосинтез препроинсулина начинается с образования сигнального пептида на полирибосомах, связанных с ЭР. Сигнальный пептид проникает в просвет ЭР и направляет поступление в просвет ЭР растущей полипептидной цепи. После окончания синтеза препроинсулина сигнальный пептид, включающий 24 аминокислотных остатка, отщепляется (рис. 11-24).
Проинсулин (86 аминокислотных остатков) поступает в аппарат Гольджи, где под действием специфических протеаз расщепляется в нескольких участках с образованием инсулина (51 аминокислотный остаток) и С- пептида, состоящего из 31 аминокислотного остатка.
Инсулин и С-пептид в эквимолярных количествах включаются в секреторные гранулы. В гранулах инсулин соединяется с цинком, образуя димеры и гексамеры. Зрелые гранулы сливаются с плазматической мембраной, и инсулин и С-пептид секретируются во внеклеточную жидкость в результате экзоцитоза. После секреции в кровь олигомеры инсулина распадаются. Т1/2 инсулина в плазме крови составляет 3-10 мин, С- пептида - около 30 мин.
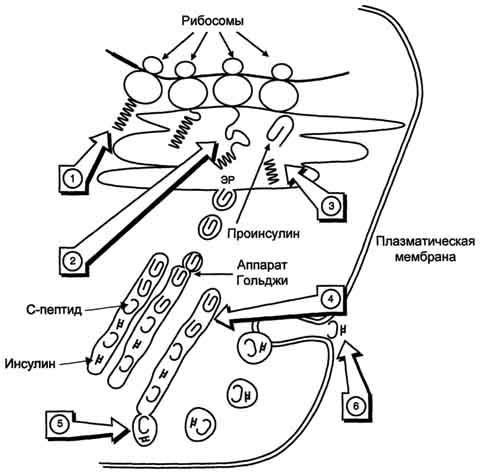
Рис. 11-24. Схема биосинтеза инсулина в β-клетках островков Лангерханса. ЭР - эндоплазматический ретикулум. 1 - образование сигнального пептида; 2 - синтез препроинсулина; 3 - отщепление сигнального пептида; 4 - транспорт проинсулина в аппарат Гольджи; 5 - превращение проинсулина в инсулин и С-пептид и включение инсулина и С-пептида в секреторные гранулы; 6 - секреция инсулина и С-пептида.
Разрушение инсулина происходит под действием фермента инсулиназы в основном в печени и в меньшей степени в почках.
Регуляция синтеза и секреции инсулина. Глюкоза - главный регулятор секреции инсулина, а β-клетки - наиболее важные глюкозо-чувствительные клетки в организме. Глюкоза регулирует экспрессию гена инсулина, а также генов других белков, участвующих в обмене основных энергоносителей. Действие глюкозы на скорость экспрессии генов может быть прямым, когда глюкоза непосредственно взаимодействует с транскрипционными факторами, или вторичным, через влияние на секрецию инсулина и глюкагона. При стимуляции глюкозой инсулин |
 Скачать 1.15 Mb.
Скачать 1.15 Mb.



