Коммуникации эндокринная
 Скачать 1.15 Mb. Скачать 1.15 Mb.
|
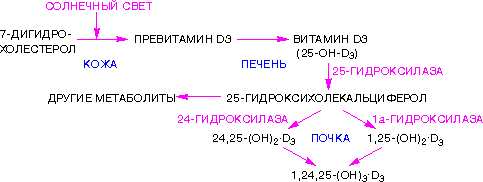 Г. Рецепторы 1,25(OH)2D3, 25(OH)D3 и 24,25(OH)2D3 обнаружены не только в тонкой кишке и костях, но и в почках, поджелудочной железе, скелетных мышцах, гладких мышцах сосудов, клетках костного мозга, лимфоцитах. По-видимому, роль метаболитов витамина D не ограничивается регуляцией уровня кальция во внеклеточной жидкости. Г. Рецепторы 1,25(OH)2D3, 25(OH)D3 и 24,25(OH)2D3 обнаружены не только в тонкой кишке и костях, но и в почках, поджелудочной железе, скелетных мышцах, гладких мышцах сосудов, клетках костного мозга, лимфоцитах. По-видимому, роль метаболитов витамина D не ограничивается регуляцией уровня кальция во внеклеточной жидкости. Гормоны коры надпочечников: глюкокортикоиды и минералокортикоиды. Химиче- ская природа. Биологическая роль. Изменения метаболизма при гипо- и гиперкор- тицизме. Биохимическая интеграция организма. В коре надпочечников синтезируется более 40 различных стероидов, различающихся по структуре и биологической активности. Биологически активные кортикостероиды объединяют в 3 основные класса в зависимости от их преобладающего действия. Глюкокортикоиды, С21-стероиды, играют важную роль в адаптации к стрессу. Они оказывают разнообразные эффекты, но наиболее важный - стимуляция глюконеогенеза (см. раздел 7). Основной глюкокортикоид человека - кор-тизол. Минералокортикоиды, С21-стероиды, необходимы для поддержания уровня Na+ и К+. Самый активный гормон этого класса - альдостерон (см. ниже подраздел VI). Биологические функции кортикостероидов отличаются широким спектром влияний на процессы метаболизма и подробно рассматриваются в соответствующих разделах. Важнейший фактор в механизме действия кортикостеровдов - взаимодействие их со специфическими рецепторами, расположенными в цитозоле клетки или в ядре. Регуляция внутриклеточных процессов под влиянием кортико-стероидных гормонов проявляется в изменении количества белков, обычно ключевых ферментов метаболизма, путём регуляции транскрипции генов в клетках-мишенях. Влияние глюкокортикоидов на промежуточный метаболизм связано с их способностью координированно воздействовать на разные ткани и разные процессы, как анаболические, так и катаболические. Кортизол стимулирует образование глюкозы в печени, усиливая глюконеогенез и одновременно увеличивая скорость освобождения аминокислот - субстратов глюконеогенеза из периферических тканей. В печени кортизол индуцирует синтез ферментов катаболизма аминокислот (аланинаминотрансферазы, трипто- фанпирролазы и тирозинаминотрансферазы и ключевого фермента глюконеогенеза - фосфо- енолпируваткарбоксикиназы). Кроме того, кортизол стимулирует синтез гликогена в печени и тормозит потребление глюкозы периферическими тканями. Это действие кортизола проявляется в основном при голодании и недостаточности инсулина (см. ниже подраздел V). У здоровых людей эти эффекты кортизола уравновешиваются инсулином. Избыточное количество кортизола стимулирует липолиз в конечностях и липогенез в других частях тела (лицо и туловище). Кроме того, глюкокортикоиды усиливают липолитическое действие катехоламинов и гормона роста. Влияние глюкокортикоидов на обмен белков и нуклеиновых кислот проявляется двояко: в печени кортизол в основном оказывает анаболический эффект (стимулирует синтез белков и нуклеиновых кислот). В мышцах, лимфоидной и жировой ткани, коже и костях кортизол тормозит синтез белков, РНК и ДНК и стимулирует распад РНК и белков. При высокой концентрации глюкокортикоиды подавляют иммунные реакции, вызывая гибель лимфоцитов и инволюцию лимфоидной ткани; подавляют воспалительную реакцию, снижая число циркулирующих лейкоцитов, а также индуцируя синтез липокортинов, которые ингибируют фосфолипазу А2, снижая таким образом синтез медиаторов воспаления - простагландинов и лейкотриенов (см. раздел 8). Высокая концентрация глюкокортикоидов вызывает торможение роста и деления фибро-бластов, а также синтез коллагена и фибронектина (см. раздел 15). Для гиперсекреции глюкокортикоидов типичны истончение кожи, плохое заживление ран, мышечная слабость и атрофия мышц. Глюкокортикоиды участвуют в физиологическом ответе на стресс, связанный с травмой, инфекцией или хирургическим вмешательством. В этом ответе в первую очередь участвуют кате-холамины, но во многих случаях для проявления их максимальной активности необходимо участие глюкокортикоидов. Минералокортикоиды стимулируют реабсорбцию Na+ в дистальных извитых канальцах и собирательных трубочках почек. Кроме того, они способствуют секреции К+, NH4+ в почках, а также в других эпителиальных тканях: потовых железах, слизистой оболочке кишечника и слюнных железах. В организме человека альдостерон - наиболее активный минералокортикоид. . Изменения метаболизма при гипо- и гиперфункции коры надпочечников Заболевания коры надпочечников могут проявиться симптомами как гипо-, так и гиперпродукции гормонов. Большинство клинических проявлений надпочечниковой недостаточности обусловлено дефицитом глюкокортикоидов и минералокортикоидов. Острая надпочечниковая недостаточность представляет большую угрозу для жизни, так как сопровождается декомпенсацией всех видов обмена и процессов адаптации. Она проявляется сосудистым коллапсом, резкой адинамией, потерей сознания. Такое состояние возникает вследствие нарушения обмена электролитов, которое приводит к потере ионов Na+ и Сl- с мочой, обезвоживанию за счёт потери внеклеточной жидкости, повышению уровня К+ в сыворотке крови, в межклеточной жидкости и клетках, в результате чего может нарушаться сократительная способность миокарда. Изменение углеводного обмена проявляется в снижении уровня сахара в крови, уменьшении запаса гликогена в печени и скелетных мышцах. Острая недостаточность функции коры надпочечников может быть следствием декомпенсации хронических заболеваний, а также развивается у больных, лечившихся длительное время глюкокортикоидными препаратами по поводу неэндокринных заболеваний, например инфекционно-аллергических заболеваний. В результате длительного приёма глюкокортикоидов подавляется функция гипоталамо-гипофизарно- надпочечниковой системы и развивается атрофия клеток коры надпочечников. Резкая отмена гормональных препаратов может сопровождаться острой надпочечниковой недостаточностью (так называемый синдром "отмены"). Первичная недостаточность надпочечников (болезнь Аддисона) развивается в результате поражения коры надпочечников туберкулёзным или аутоиммунным процессом. Основные клинические проявления выражаются в снижении массы тела, общей слабости, снижении аппетита, тошноте, рвоте, снижении АД и типичной для первичной надпочечниковой недостаточности гиперпигментацйи кожи ("бронзовая болезнь") . Причина гиперпигментации - повышение продукции ПОМК - предшественника АКТГ и меланоцитстимулирующего гормона. Вторичная недостаточность надпочечников может развиться при дефиците АКТГ, что, в свою очередь, может быть следствием опухоли или инфекционного поражения гипофиза. При вторичной недостаточности надпочечников, в отличие от болезни Аддисона, отсутствует гиперпигментация. При врождённой гиперплазии надпочечников нарушается синтез кортизола. В 95% случаев при этой патологии обнаруживается дефект 21-гидроксилазы (реже 11-гидроксилазы). Снижение продукции кортизола сопровождается увеличением секреции АКТГ, накоплением промежуточных продуктов синтеза кортикостероидов, в частности, предшественников андрогенов. Избыток андрогенов ведёт к усилению роста тела, раннему половому созреванию у мальчиков и развитию мужских половых признаков у девочек (адреногенитальный синдром). При частичной недостаточности 21-гидроксилазы у женщин может нарушаться менструальный цикл. Гиперпродукция глюкокортикоидов (гиперкортицизм) может быть следствием повышения уровня АКТГ при опухолях гипофиза (болезнь Иценко-Кушинга) и опухолях других клеток (бронхов, тимуса, поджелудочной железы), вырабатывающих кортикотропинподобные вещества, или избыточного синтеза кортизола при гормонально-активных опухолях коры надпочечников (синдром Иценко-Кушинга). При гиперкортицизме наблюдаются гипергликемия и снижение толерантности к глюкозе, обусловленные стимуляцией глюконеогенеза ("стероидный диабет"), усиление катаболизма белков, уменьшение мышечной массы, истончение кожи, остеопороз, инволюция лимфоидной ткани. Характерно своеобразное перераспределение отложений жира ("лунообразное лицо", выступающий живот). Гипернатриемия, гипертензия, гипокалиемия обусловлены некоторой минералокортикоидной активностью кортизола, которая проявляется при его избытке. Для выявления первичной причины гиперкортицизма, помимо определения концентрации АКТГ в плазме крови, используют тесты с применением высоких доз синтетического глюкокортикоида дексаметазона (структурного аналога кортизола). Дексаметазон подавляет секрецию АКТГ по механизму отрицательной обратной связи. Для болезни Иценко-Кушинга характерно снижение концентрации кортизола после применения дексаметазона более чем на 50%. Отсутствие реакции на введение дексаметазона может указывать на наличие опухоли надпочечников или внегипофизарной секреции АКТГ. Регуляция водно-солевого обмена. Строение и функции альдостерона и вазопресси- на. Система ренин-ангиотензин и вазопрессин. Ангиотензин-превращающий фер- мент. Биохимические механизмы возникновения гипертонии, отеков, дегидратации. Антидиуретический гормон Антидиуретический гормон (АДГ), или вазопрессин - пептид с молекулярной массой около 1100 Д, содержащий 9 аминокислот, соединённых одним дисульфидным мостиком. Синтез и секреция антидиуретического гормона АДГ синтезируется в нейронах гипоталамуса в виде предшественника препрогормона, который поступает в аппарат Гольджи и превращается в прогормон. В составе нейросекреторных гранул прогормон переносится в нервные окончания задней доли гипофиза (нейрогипофиз). Во время транспорта гранул происходит процессинг прогормона, в результате чего он расщепляется на зрелый гормон и транспортный белок - нейрофизин. Гранулы, содержащие зрелый антидиуретический гормон и нейрофизин, хранятся в терминальных расширениях аксонов в задней доле гипофиза, из которых секретируются в кровоток при соответствующей стимуляции. Стимулом, вызывающим секрецию АДГ, служит повышение концентрации ионов натрия и увеличение осмотического давления внеклеточной жидкости. При недостаточном потреблении воды, сильном потоотделении или после приёма большого количества соли осморецепторы гипоталамуса, чувствительные к колебаниям осмолярности, регистрируют повышение осмотического давления крови. Возникают нервные импульсы, которые передаются в заднюю долю гипофиза и вызывают высвобождение АДГ. Секреция АДГ происходит также в ответ на сигналы от барорецепторов предсердий. Изменение осмолярности всего на 1% приводит к заметным изменениям секреции АДГ. Механизм действия Для АДГ существуют 2 типа рецепторов: V1 и V2. Рецепторы V2, опосредующие главный физиологический эффект гормона, обнаружены на базолатеральной мембране клеток собирательных трубочек и дистальных канальцев - наиболее важных клеток-мишеней для АДГ, которые относительно непроницаемы для молекул воды. В отсутствие АДГ моча не концентрируется и может выделяться в количествах, превышающих 20 л в сутки (норма 1,0-1,5 л в сутки). Связывание АДГ с V2 (рис. 11-32) стимулирует аденилатциклазную систему и активацию протеинкиназы А. В свою очередь, протеинкиназа А фосфорилирует белки, стимулирующие экспрессию гена мембранного белка - аквапорина-2. Аквапорин-2 перемещается к апикальной мембране собирательных канальцев и встраивается в неё, образуя водные каналы. Это обеспечивает избирательную проницаемость мембраны клеток для воды, которые свободно диффундируют в клетки почечных канальцев и затем поступают в интерстициальное пространство. Поскольку в результате происходит реабсорбция воды из почечных канальцев и экскреция малого объёма высококонцентрированной мочи (антидиурез), гормон называют антидиуретическим гормоном. Рецепторы типа V1 локализованы в мембранах ГМК сосудов. Взаимодействие АДГ с рецептором V1 приводит к активации фосфолипазы С, которая гидролизует фосфатидилинозитол-4,5-бисфосфат с образованием инозитолтрифосфата и диацилглицерола. Инозитолтрифосфат вызывает высвобождение Са2+ из ЭР. Результатом действия гормона через рецепторы V1 является сокращение гладкомышечного слоя сосудов. Сосудосуживающий эффект АДГ проявляется при высоких концентрациях гормона. Поскольку сродство АДГ к рецептору V2 выше, чем к рецептору V1, при физиологической концентрации гормона в основном проявляется его антидиуретическое действие. Несахарный диабет Дефицит АДГ, вызванный дисфункцией задней доли гипофиза, а также нарушениями в системе передачи гормонального сигнала, приводит к развитию несахарного диабета. При этом происходит нерегулируемая экскреция воды, а наиболее опасным последствием является дегидратация организма. Под названием "несахарный диабет" объединяют заболевания с разной этиологией. Так, основными причинами центрального несахарного диабета могут быть генетические дефекты синтеза препро- АДГ в гипоталамусе, дефекты процессинга и транспорта проАДГ (наследственная форма), а также повреждения гипоталамуса или нейрогипофиза (например, в результате черепно-мозговой травмы, опухоли, ишемии). Нефрогенный несахарный диабет возникает вследствие мутации гена рецептора АДГ типа V2 (наследственная форма), следствием которого является неспособность почек реагировать на гормон. Основное проявление несахарного диабета - гипотоническая полиурия, т.е. выделение большого количества мочи низкой плотности. Снижение секреции АДГ приводит также к усиленному потреблению воды. Диагностические критерии несахарного диабета: выраженная полиурия (до 20 л в сутки, плотность мочи <1,010, в норме - 1,020). Б. Альдостерон Альдостерон - наиболее активный минера-локортикостероид, синтезирующийся в коре надпочечников из холестерола. Синтез и секреция альдостерона клетками клубочковой зоны непосредственно стимулируются низкой концентрацией Na+ и высокой концентрацией К+ в плазме крови. На секрецию альдостерона влияют также простагландины, АКТГ. Однако наиболее важное влияние на секрецию альдостерона оказывает ренинангиотензиновая система. Альдостерон не имеет специфических транспортных белков, но за счёт слабых взаимодействий может образовывать комплексы с альбумином. Гормон очень быстро захватывается печенью, где превращается в тетрагидроальдостерон-3-глюкуронид и экскретируется с мочой. Механизм действия альдостерона В клетках-мишенях гормон взаимодействует с рецепторами, которые могут быть локализованы как в ядре, так и в цитозоле клетки. Образовавшийся комплекс гормон-рецептор взаимодействует с определённым участком ДНК и изменяет скорость транскрипции специфических генов. Результат действия альдостерона - индукция синтеза: а) белков-транспортёров Na+ из просвета канальца в эпителиальную клетку почечного канальца; б) Nа+,К+,-АТФ-азы, обеспечивающей удаление ионов натрия из клетки почечного канальца в межклеточное пространство и переносящей ионы калия из межклеточного пространства в клетку почечного канальца; в) белков-транспортёров ионов калия из клеток почечного канальца в первичную мочу; г) митохондриальных ферментов ЦТК, в частности цитратсинтазы, стимулирующих образование молекул АТФ, необходимых для активного транспорта ионов (рис. 11-33). Суммарным биологическим эффектом индуцируемых альдостероном белков является увеличение реабсорбции ионов натрия в канальцах нефронов, что вызывает задержку NaCl в организме, и возрастание экскреции калия. Роль системы ренин-ангиотензин- альдостерон в регуляции водно-солевого обмена Главным механизмом регуляции синтеза и секреции альдостерона служит система ренинангиотензин. Ренин - протеолитический фермент, продуцируемый юкстагломерулярными клетками, расположенными вдоль конечной части афферентных (приносящих) артериол, входящих в почечные клубочки (рис. 11-34). Юкстагломерулярные клетки особенно чувствительны к снижению перфузионного давления в почках. Уменьшение АД (кровотечение, потеря жидкости, снижение концентрации NaCl) сопровождается падением перфузионного давления в приносящих артериолах клубочка и соответствующей стимуляцией высвобождения ренина. Субстратом для ренина служит ангиотензиноген. Ангиотензиноген - α2-глобулин, содержащий более чем 400 аминокислотных остатков. Образование ангиотензиногена происходит в печени и стимулируется глюкокортикоидами и эстрогенами. Ренин гидролизует пептидную связь в молекуле ангиотензиногена и отщепляет N-концевой декапептид (ангиотензин I), не имеющий биологической активности. Под действием карбоксидипептидилпептидазы, или антиотензин-превращающего фермента (АПФ), выявленного в эндотелиальных клетках, лёгких и плазме крови, с С-конца ангиотензина I удаляются 2 аминокислоты и образуется октапептид - ангиотензин II. Ангиотензин II, связываясь со специфическими рецепторами, локализованными на поверхности клеток клубочковой зоны коры надпочечников и ГМК, вызывает изменение внутриклеточной концентрации диацилглицерола и инозитолтрифосфата. Инозитолтрифосфат стимулирует высвобождение из ЭР ионов кальция, совместно с которым активирует протеинкиназу С, опосредуя тем самым специфический биологический ответ клетки на действие ангиотензина П. При участии аминопептидаз ангиотензин II превращается в ангиотензин III - гептапептид, проявляющий активность ангиотензина II. Однако концентрация гептапептида в плазме крови в 4 раза меньше концентрации октапептида, и поэтому большинство эффектов являются результатом действия ангиотензина П. Дальнейшее расщепление ангиотензина II и ангиотензина III протекает при участии специфических протеаз (ангиотензиназ). Ангиотензин II оказывает стимулирующее действие на продукцию и секрецию альдостерона клетками клубочковой зоны коры надпочечников, который, в свою очередь, вызывает задержку ионов натрия и воды, в результате чего объём жидкости в организме восстанавливается. Кроме этого, ангиотензин II, присутствуя в крови в высоких концентрациях, оказывает мощное сосудосуживающее действие и тем самым повышает АД. Восстановление объёма крови при обезвоживании организма Уменьшение общего объёма жидкости, например в результате кровопотери, при обильной рвоте, диарее вызывает высвобождение ренина. Этому способствует также снижение импульсации от барорецепторов предсердий и артерий в результате уменьшения внутрисосудистого объёма жидкости. В результате увеличивается продукция ангиотензина II, наиболее мощного стимулятора секреции альдостерона. Повышение концентрации альдостерона в крови вызывает задержку ионов натрия, что является сигналом для осморецепторов гипоталамуса и секреции из нервных окончаний передней доли гипофиза АДГ, стимулирующего реабсорбцию воды из собирательных трубочек. Ангиотензин II, оказывая сильное сосудосуживающее действие, повышает АД и, кроме этого, усиливает жажду. Поступающая с питьём вода в большей мере, чем это происходит в норме, задерживается в организме. Увеличение объёма жидкости а, также повышение АД приводят к устранению стимула, который вызвал активацию ренинангиотензиновой системы, секрецию альдостерона и восстановление объёма крови (рис. 11-35). Гиперальдостеронтм Гиперальдостеронизм - заболевание, вызванное гиперсекрецией альдостерона надпочечниками. Причиной первичного гиперальдостеронизма (синдром Кона) примерно у 80% больных является аденома надпочечников, в остальных случаях - диффузная гипертрофия клеток клубочковой зоны, вырабатывающих альдостерон. При первичном гиперальдостеронизме избыток альдостерона усиливает реабсорбцию натрия в почечных канальцах. Увеличение концентрации Na+ в плазме служит стимулом к секреции АДГ и задержке воды почками. Кроме того, усиливается выведение ионов калия, магния и протонов. В результате развиваются гипернатриемия, вызывающая, в частности, гипертонию, гипер-волемию и отёки, а также гипокалиемия, ведущая к мышечной слабости, возникают дефицит магния и лёгкий метаболический алкалоз. Вторичный гиперальдостеронизм встречается гораздо чаще, чем первичный, и может быть связан с рядом состояний (например, сердечная недостаточность, хронические заболевания почек, а также сопровождающиеся нарушением кровоснабжения опухоли, секретирующие ренин). При вторичном гиперальдостеронизме у больных наблюдают повышенный уровень ренина и ангиотензина II, что стимулирует кору надпочечников продуцировать и секретировать избыточное количество альдостерона. Клинические симптомы менее выражены, чем при первичном альдостеронизе. Одновременное определение концентрации альдостерона и активности ренина в плазме позволяет окончательно дифференцировать первичный (активность ренина в плазме снижена) и вторичный (активность ренина в плазме повышена) гиперальдостеронизм. |
