Коммуникации эндокринная
 Скачать 1.15 Mb. Скачать 1.15 Mb.
|
 Рис. 8-45. Семейства простагландинов. 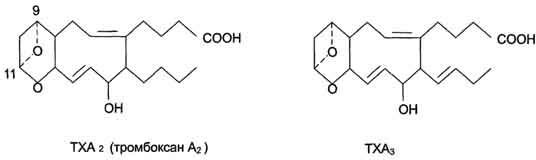 Рис. 8-46. Структура тромбоксанов. ТХ А2 синтезируется из арахидоновои кислоты; ТХ А3 синтезируется из эйкозапентаёновой кислоты. 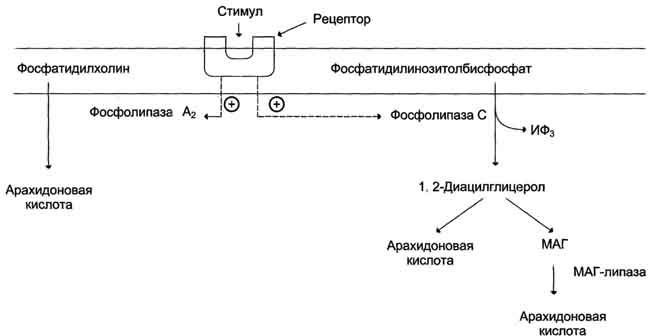 Рис. 8-47. Отделение арахидоновои кислоты от глицерофосфолипидов. МАГ- моноацилглицерол; ИФ3- инозитолтри-фосфат. гормонов, гистамина, цитокинов, механического воздействия. Связывание стимулирующего агента с рецептором может активировать или фосфолипазу А2 или фосфолипазу С. Это зависит от типа клетки и типа рецепторов. После отделения арахидоновой кислоты от фосфолипида она выходит в цитозоль и в различных типах клеток превращается в разные эйкозаноиды. В клетках имеется 2 основных пути превращения арахидоновой кислоты: циклооксигеназный, приводящий к синтезу простагландинов, простациклинов и тромбоксанов, и липоксигеназный, заканчивающийся образованием лейкотриенов или других эйкозаноидов (рис. 8-48). Синтез простагландинов. Фермент, катализирующий первый этап синтеза простагландинов, называется PG Н2 синтазой и имеет 2 каталитических центра. Один из них называют циклооксигеназой, другой - пероксидазой. Этот фермент представляет собой димер гликопротеинов, состоящий из идентичных полипептидных цепей. Фермент имеет гидрофобный домен, погружённый в липидный слой мембран ЭР, и каталитический домен, обращённый в полость ЭР. В активном центре циклооксигеназы находится тирозин (385), в активном центре пероксидазы - простетическая группа - гем. В организме имеются 2 типа циклооксигеназ (PG Н2 синтаз). Циклооксигеназа 1 - конститутивный фермент, синтезирующийся с постоянной скоростью. Синтез циклооксигеназы 2 увеличивается при воспалении и индуцируется соответствующими медиаторами - цитокинами. Оба типа циклооксигеназ катализируют включение 4 атомов кислорода в арахидоновую кислоту и формирование пятичленного кольца. В результате образуется нестабильное гидропероксидпроизводное, называемое PG G2. Гидропероксид у 15-го атома углерода быстро восстанавливается до гидроксильной группы пероксидазой с образованием PG Н2. До образования PG Н2 путь синтеза разных типов простагландинов одинаков. Дальнейшие превращения PG Н2 специфичны для каждого типа клеток. Например, PG Н2 в клетках ГМК может быть восстановлен под действием PG E синтазы с образованием PG Е2 или под действием PG D синтазы с образованием PG D2. В тромбоцитах содержится фермент тромбоксансинтаза, превращающий тот же исходный PG Н2 в ТХ А2 обладающий сильным сосудосуживающим действием. В клетках эндотелия под действием фермента простациклинсинтазы из PG Н2 синтезируется PG I2 (простациклин), имеющий сосудорасширяющее действие. В. Структура и синтез лейкотриенов, ГЭТЕ, липоксинов Лейкотриены также образуются из эйкозаноевых кислот, однако в их структуре отсутствуют циклы, как у простагландинов, и они имеют 3 сопряжённые двойные связи, хотя общее число двойных связей в молекуле больше (рис. 8-49). Лейкотриены С4, D4 и Е4 имеют заместители в виде трипептида глутатиона, дипептида глицилцистеина или цистеина, соответственно. Липоксигеназный путь синтеза, приводящий к образованию большого количества разных эйкозаноидов, начинается с присоединения молекулы кислорода к одному из атомов углерода у двойной связи, с образованием гидропероксидов - гидропероксидэйкозатетраеноатов (ГПЭ-ТЕ). Далее гидропероксиды превращаются в соответствующие гидроксиэйкозатетроеноаты (ГЭТЕ). Структура и синтез лейкотриенов и ГЭТЕ Синтез лейкотриенов идёт по пути, отличному от пути синтеза простагландинов, и начинается с образования гидроксипероксидов - гидропероксидэйкозатетраеноатов (ГПЭТЕ). Эти вещества или восстанавливаются с образованием гидроксиэйкозатетроеноатов (ГЭТЕ) или превращаются в лейкотриены или липоксины. ГЭТЕ отличаются по положению гидроксильной группы у 5-го, 12-го или 15-го атома углерода, например: 5-ГЭТЕ, 12-ГЭТЕ. Липоксигеназы действуют в 5-й, 12-й или 15-й позиции арахидоновой кислоты в зависимости от типа ткани. Например, в ПЯЛ содержится в основном 5-липоксигеназа, в тромбоцитах - 12-липоксигеназа, в эозинофилах 15-липоксигеназа. В лейкоцитах и тучных клетках 5-ГПЭТЕ превращается в эпоксидлейкотриен А4 (LT А4), где нижний индекс 4 обозначает общее количество двойных связей. Наличие 3 сопряжённых двойных связей обусловливает название "лейкотриен".  Рис. 8-48. Синтез эйкозаноидов из арахидоновои кислоты. Глюкокортикоиды ингибируют синтез всех типов эйкозаноидов, так как ингибируют фосфолипазу А2, и таким образом уменьшают количество субстрата для их синтеза. Аспирин и другие противовоспалительные препараты нестероидного действия ингибируют только циклооксигеназный путь. 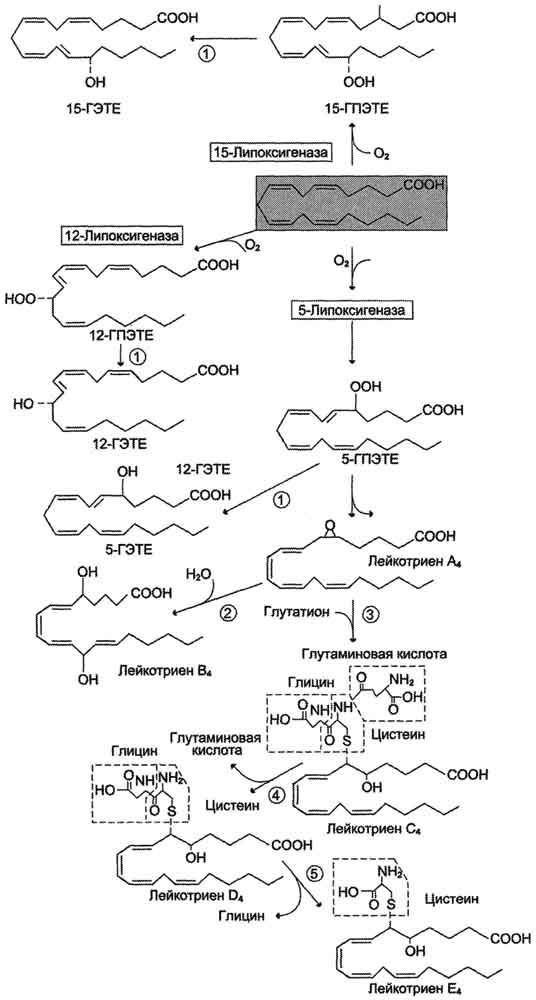 Рис. 8-49. Липоксигеназный путь синтеза эикозаноидов. Другие типы лейкотриенов образуются из LT А4. LT В4 образуется под действием эпоксидгидролазы в лейкоцитах и клетках эпителия сосудов. Другой путь приводит к образованию группы лейкотриенов: LT C4, LT D4, LT E4. Их синтез начинается с присоединения трипепти-да глутатиона к 6-му атому углерода с образованием LT С4 в реакции, катализируемой глутатион-8-трансферазой. В следующей реакции удаляется глутамат, и LT D4 содержит дипептид глицилцистеин. На последней стадии отщепляется глицин, и LT Е4 содержит только цистеин. Липоксины (например, основной липоксин А4) включают 4 сопряжённых двойных связи и 3 гидроксильных группы. Синтез липоксинов начинается с действия на арахидоновую кислоту 15-липоксигеназы, затем происходит ряд реакций, приводящих к образованию липоксина А4 (рис. 8-50). 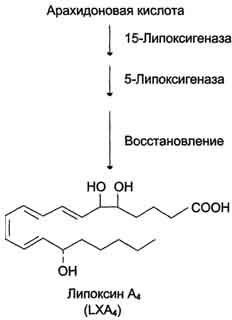 Рис. 8-50. Строение и синтез липоксина А4. Г. Механизмы действия эйкозаноидов, основные биологические эффекты Эйкозаноиды - гормоны местного действия по ряду признаков: образуются в различных тканях и органах, а не только в эндокринных железах; действуют по аутокринному или паракринному механизмам; концентрация эйкозаноидов в крови меньше, чем необходимо, чтобы вызвать ответ в клетках-мишенях. Только при некоторых патологических состояниях эйкозаноиды могут оказывать системное действие, если их концентрация в крови увеличивается до количеств, когда они могут оказать действие на ГМК всего органа, например кишечника, лёгких, кровеносных сосудов. Механизмы действия эйкозаноидов Один и тот же тип эйкозаноида может действовать по паракринному и по аутокринному механизму. Например, ТХ А2, продуцируемый тромбоцитами при их активации, действует на сами тромбоциты, увеличивая их способность к агрегации, ив то же время действует на окружающие ГМК кровеносных сосудов, способствуя их сокращению. Таким образом создаются условия для образования тромба и предотвращения кровотечения в области повреждения сосудов. Эйкозаноиды действуют на клетки через специальные рецепторы. Некоторые рецепторы эйкозаноидов связаны с аденилатциклазной системой и протеинкиназой А - это рецепторы PGE, PG D, PC I. PG F2α, ТХ А2 эндоперекиси (ГПЭТЕ) и лейкотриены действуют через механизмы, увеличивающие уровень кальция в цитозоле клеток-мишеней. Во многих клетках эйкозаноиды влияют на степень активации аденилатциклазной системы в ответ на действие других факторов, например гормонов. В этих случаях эйкозаноиды влияют на конформацию G-белков в плазматической мембране клеток. Если эйкозаноид связывается со стимулирующими Gs-белками, то эффект основного стимулирующего агента увеличивается; если с Gi- ингибирующими - эффект снижается. Эйкозаноиды действуют на клетки почти всех тканей организма. Избыточная продукция эйкозаноидов наблюдается при многих заболеваниях. Роль эйкозаноидов в развитии воспаления Воспаление - реакция организма на повреждение или инфекцию, направленная на уничтожение инфекционного агента и восстановление повреждённых тканей. Продукция медиаторов воспаления - эйкозаноидов, гистамина, кининов (пептидных гормонов местного действия) - активируется каскадами реакций, запускающимися при внедрении инфекционных агентов или повреждении тканей. Фактором, лимитирующим скорость синтеза эйкозаноидов, служит освобождение жирной кислоты под действием фосфо-липазы A2. Фосфолипаза A2 связана с мембранами клеток и активируется многими факторами: гистамином, кининами, механическим воздействием на клетку, контактом комплекса антиген-антитело с поверхностью клетки. Активация фосфолипазы A2 приводит к увеличению синтеза эйкозаноидов. Многие эйкозаноиды выполняют функцию медиаторов воспаления и действуют на всех этапах воспаления. В результате увеличивается проницаемость капилляров, транссудат и лейкоциты проходят через сосудистую стенку. Лейкотриен В4 и липоксин А4 являются мощными факторами хемотаксиса; взаимодействуя с рецепторами, стимулируют движение лейкоцитов в область воспаления и секрецию ими лизосомальных ферментов и фагоцитоз чужеродных частиц. Симптомы воспаления - покраснение, жар, отёк и боль. Покраснение и жар вызываются факторами, увеличивающими приток крови к месту повреждения. Отёк - результат увеличения притока жидкости из капилляров и движения клеток белой крови в область воспаления. Боль вызывается химическими компонентами (продуктами распада тканей, протонами) и сдавлением нервных окончаний. В развитии этих признаков воспаления участвуют разные типы эйкозаноидов (табл. 8-8). Роль эйкозаноидов в тромбообразовании Свёртывание крови можно рассматривать как процесс, который поддерживается в состоянии равновесия противодействующими системами: свёртывания и противосвёртывания. В условиях патологии или при действии фармакологических средств это равновесие может смещаться в ту или другую сторону. В норме клетки эндотелия сосудов продуцируют простациклин I2, который препятствует агрегации тромбоцитов и сужению сосудов (рис. 8-51). При разрушении клеток эндотелия (например, в результате образования атеросклеротической бляшки) синтез PGI2 снижается. Тромбоциты контактируют с повреждённой стенкой сосуда, в результате чего активируется фосфолипаза А2. Это приводит к увеличению секреции ТХ А2, стимулирующего агрегацию тромбоцитов и образование тромба в области повреждения сосуда (рис. 8-52), что часто приводит к развитию инфаркта. При изучении факторов риска инфаркта миокарда было показано, что люди, потребляющие большое количество рыбьего жира, значительно меньше подвержены этому заболеванию, так как у них реже образуются тромбы в сосудах сердца. Оказалось, что на семейства эйкозаиоидов, синтезируемых в организме, влияет состав жирных кислот пищи (см. выше табл. 8-3). Если с пищей поступает больше эйкозапентаеновой кислоты (20:5, ю-3), в большом количестве содержащейся в рыбьем жире, то эта кислота включается преимущественно в фосфо-липиды мембран (вместо арахидоновой) и после действия фосфодипазы А2 служит основным субстратом для синтеза эйкозаноидов. Это имеет существенное влияние на свёртывание крови. При обычной диете с преобладанием арахидоновой кислоты (20:4, ю-6) над эйкозапентаеновой действие ТХ А2 уравновешено действием PG I2 (рис. 8-53) и другими простагландинами. В случае диеты с преобладанием ω-3 кислот в клетках эндотелия образуются более сильные ингибиторы тромбообразования (PG I3, PG E3, PG D3), что снижает риск образования тромба и развития инфаркта миокарда. Гистамин. Синтез. Химическая природа. Биологическая роль. Гистамин образуется путем декарбоксилирования гистидина в тучных клетках соединительной ткани (см. схему А на с. 516). Гистамин образует комплекс с белками и сохраняется в секреторных гранулах тучных клеток. Секретируется в кровь при повреждении ткани (удар, ожог, воздействие эндо- и экзогенных веществ), развитии иммунных и аллергических реакций. Гистамин выполняет в организме человека следующие функции: стимулирует секрецию желудочного сока, слюны (т.е. играет роль пищеварительного гормона); повышает проницаемость капилляров, вызывает отёки, снижает АД (но увеличивает внутричерепное давление, вызывает головную боль); сокращает гладкую мускулатуру лёгких, вызывает удушье; |
