Коммуникации эндокринная
 Скачать 1.15 Mb. Скачать 1.15 Mb.
|
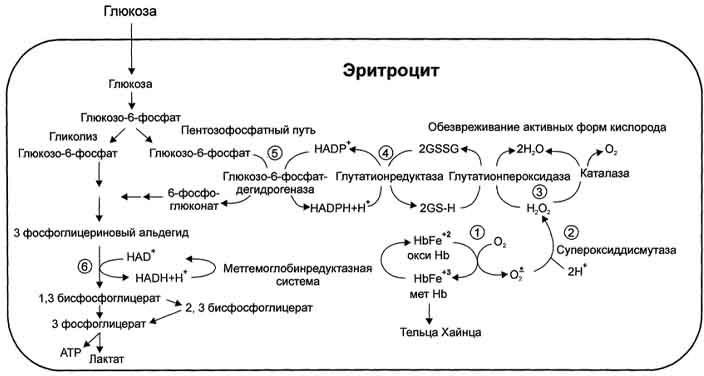 - спонтанное окисление Fe2+ в теме гемоглобина - источник супероксидного аниона в эритроцитах; - Супероксиддисмутаза превращает супероксидный анион в пероксид водорода и воду: О2-+ О2- + 2Н+ → Н2О2 + О2; - пероксид водорода расщепляется каталазой: 2 Н2О2 → 2 Н2О + О2или глутатионпероксидазой: 2 GSH + Н2О2 → GSSG +2 Н2О; - Глутатионредуктаза восстанавливает окисленный глутатион: GSSG + NADPH + Н+ → 2GSH + NADP+; - NADPH, необходимый для восстановления глутатиона, образуется на окислительном этапе пентозофосфатного пути превращения глюкозы; - NADH, необходимый для восстановления гемоглобина метгемоглобинредуктазной системой, образуется в глицеральдегидфосфатдегидрогеназной реакции гликолиза. Транспорт кислорода и диоксида углерода. В крови капилляров тканей организма напряжение углекислого газа составляет 5,3 кПа (40 мм рт. ст.), а в самих тканях — 8,0—10,7 кПа (60—80 мм рт. ст.). В результате С02 диффундирует из тканей в плазму крови, а из нее — в эритроциты по градиенту парциального давления С02. В эритроцитах С02 образует с водой угольную кислоту, которая диссоциирует на Н+ и HCO3. (С02 + Н20 = Н2СО3 = Н+ + HCO3). Эта реакция протекает быстро, поскольку С02 + Н20 = Н2СОэ катализируется ферментом карбоангидразой мембраны эритроцитов, которая содержится в них в высокой концентрации (рис. 10.19). Эта реакция протекает по закону действия масс и в норме выражается в логарифмической форме, известной как уравнение Гендерсо- на—Гассельбаха (см. главу 15). В эритроцитах диссоциация углекислого газа продолжается постоянно по мере образования продуктов этой реакции, поскольку молекулы гемоглобина действуют как буферное соединение, связывая положительно заряженные ионы водорода. В эритроцитах по мере освобождения кислорода из гемоглобина его молекулы будут связываться с ионами водорода (С02 + Н20 = Н2С03 = = Н+ + HCO3), образуя соединение (Нb-Н+). В целом это называется эффектом Холдена, который приводит к сдвигу кривой диссоциации оксигемоглобина вправо по оси х, что снижает сродство гемоглобина к кислороду и способствует более интенсивному освобождению его из эритроцитов в ткани. При этом в составе соединения НЬ-Н+ транспортируется примерно 200 мл С02 в одном литре крови от тканей к легким. Рис. 10.19. Роль эритроцитов в транспорте углекислого газа от тканей к легким. А. Процессы газообмена углекислого газа между клетками тканей и плазмой крови. С02 поступает путем диффузии в плазму крови из тканей и дифференцирует внутрь эритроцитов. В эритроцитах С02 превращается при участии фермента карбоангидразы мембраны эритроцитов в НСОз и в виде этого иона вновь активно транспортируется в плазму крови, в которой в составе бикарбонатов (NaHC03) переносится к капиллярам легких. Водородные ионы, образующиеся при реакции дегидратации Н2С03, захватываются молекулами гемоглобина и также транспортируются кровью от тканей к легким. При транспорте из эритроцитов НСОз-ионное постоянство внутри эритроцитов поддерживается хлорным сдвигом. Кроме того, С02 в эритроцитах непосредственно соединяется с Nh2 группами белков гемоглобина. Б. Процессы газообмена углекислого газа между плазмой крови и альвеолами легких. В капиллярах легких в эритроцитах под влиянием эффекта Бора происходит диссоциация карбаминовых соединений и С02 диффундирует через мембрану эритроцитов и альвеолярную мембрану в просвет альвеол легких. Диссоциация углекислого газа в эритроцитах может быть лимитирована только буферной емкостью молекул гемоглобина. Образующиеся внутри эритроцитов в результате диссоциации С02 ионы НСОз с помощью специального белка-переносчика мембраны эритроцитов выводятся из эритроцитов в плазму, а на их место из плазмы крови закачиваются ионы СГ (феномен «хлорного» сдвига) (рис. 10.19). Основная роль реакции С02 внутри эритроцитов заключается в обмене ионами СГ и НСОз между плазмой и внутренней средой эритроцитов. В результате этого обмена продукты диссоциации углекислого газа Н+ и НСОз будут транспортироваться внутри эритроцитов в виде соединения (Нb-Н+), а плазмой крови — в виде бикарбонатов. Эритроциты участвуют в транспорте углекислого газа от тканей к легким, поскольку С02 образует прямую комбинацию с — NН2-группами белковых субъединиц гемоглобина: С02 + Нb -> НbС02 или карбаминовое соединение. Транспорт кровью С02 в виде карбаминового соединения и ионов водорода гемоглобином зависит от свойств молекул последнего; обе реакции обусловлены величиной парциального давления кислорода в плазме крови на основе эффекта Холдена. В количественном отношении транспорт углекислого газа в растворенной форме и в форме карбаминового соединения является незначительным, по сравнению с его переносом С02 кровью в виде бикарбонатов. Однако при газообмене С02 в легких между кровью и альвеолярным воздухом эти две формы приобретают основное значение. Когда венозная кровь возвращается от тканей к легким, С02 диффундирует из крови в альвеолы и РС02 в крови снижается с 46 мм рт. ст. (венозная кровь) до 40 мм рт.ст. (артериальная кровь). При этом в величине общего количества С02 (6 мл/100 мл крови), диффундирующего из крови в альвеолы, доля растворенной формы С02 и карбаминовых соединений становится более значительной относительно бикарбонатной. Так, доля растворенной формы составляет 0,6 мл/100 мл крови, или 10 %, карбаминовых соединений — 1,8 мл/100 мл крови, или 30%, а бикарбонатов — 3,6 мл/100 мл крови, или 60 %. В эритроцитах капилляров легких по мере насыщения молекул гемоглобина кислородом начинают освобождаться ионы водорода, диссоциировать карбаминовые соединения и НСОз вновь превращается в С02 (Н+ + НСОз = = Н2С03 = С02 +Н20), который путем диффузии выводится через легкие по градиенту его парциальных давлений между венозной кровью и альвеолярным пространством. Таким образом, гемоглобин эритроцитов играет основную роль в транспорте кислорода от легких к тканям, и углекислого газа в обратном направлении, поскольку способен связываться с 02 и Н+. В состоянии покоя через легкие из организма человека за минуту удаляется примерно 300 мл С02: 6 мл/100 мл крови х 5000 мл/мин минутного объема кровообращения. 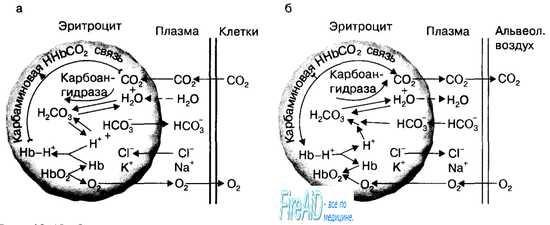 Гемоглобин плода и его физиологическое значение. Полиморфные формы гемогло- бинов человека. Гемоглобины, синтезирующиеся в период внутриутробного развития плода: Эмбриональный гемоглобин синтезируется в эмбриональном желточном мешке через несколько недель после оплодотворения. Представляет собой тетрамер 2?2?. Через 2 нед после формирования печени плода в ней начинает синтезироваться гемоглобин F, который к 6 мес замещает эмбриональный гемоглобин. Гемоглобин F - фетальный гемоглобин, синтезируется в печени и костном мозге плода до периода его рождения. Имеет тетрамерную структуру, состоящую из 2 ?- и 2 ?-цепей. После рождения ребёнка постепенно замещается на гемоглобин А, который начинает синтезироваться в клетках костного мозга уже на 8-м месяце развития плода. Гемоглобин плода обладает выраженным сродством к кислороду. Фетальный гемоглобин отличается повышенной способностью поглощать кислород, поступающий из крови матери; эта способность гемоглобина плода имеет важное значение в обеспечении кислородом всех его тканей и органов. Фетальный («эмбриональный») гемоглобин постепенно замещается гемоглобином обычного типа. Молекулы гемоглобина. Молекула человеческого гемоглобина состоит из четырех полипептидных цепей. Молекула гемоглобина обозначается общей формулой а2$2, которая показывает, что в состав молекулы входят две пары сходных цепей глобина [1348]. Большинство разновидностей гемоглобина человека имеют идентичные а-цепи и различаются по другим цепям. К каждой цепи глобина в специфическом участке присоединяется молекула небелковой природы -гемогруппа, или гем (рис. 4.34). Четыре глобиновые цепи, каждая со своим гемом, образуют функциональную молекулу гемоглобина, которая переносит кислород из легких в ткани. Молекула глобина построена из 140 с небольшим аминокислот, которые расположены в строго определенном порядке (рис. 4.35). Последовательность аминокислот в белке (например, в гемоглобине) считают его первичной структурой. Пространственное расположение соседних остатков называется вторичной структурой, а трехмерное расположение белковых субъединиц-третичной структурой. Термин четвертичная структура относится к взаимной организации четырех субъединиц в составе функционирующей молекулы. Преобладающим типом гемоглобина у детей и взрослых является НЬА, или гемоглобин взрослых (сс2р2). Его отличительная черта строение р-цепи (рис. 4.35). а- и Р-цепи различаются по многим аминокислотным остаткам. У всех взрослых есть небольшое количество (2-3%) гемоглобина НЬА2(сс252). Характерная для него 5-цепь отличается от р-цепи только по десяти аминокислотным остаткам. После рождения у всех детей обнаруживается также небольшое количество (меньше 1%) фетального гемоглобина HbF:a2y2 (см. ниже), у- цепь значительно отличается от а- и (3-цепей. a-цепи НЬА, НЬА2 и HbF идентичны. Существует несколько типов гемоглобинов, характерных для эмбрионального и фетального развития. С,- цепи напоминают по аминокислотному составу а-цепи [1155], а Е-цепи похожи на р-цепи [1232]. С,-цепи, вероятно, появляются раньше других в эмбриональном развитии. исчезают через 8 10 недель внутриутробного развития (рис. 4.36) [1364]. Затем преобладающим становится гемоглобин HbF(a2y2), который отличается от других присутствим у-цепи. Известно два типа у-цепей: с аланином (Ау) или с глицином (Gy) в 136-м положении. Существует и третий тип у-цепи с треонином вместо изолейцина в 75-м положении. Он встречается у 10-15% эмбрионов и, судя по всему, не связан с каким-либо нарушением. Гемоглобин а2(32 обнаруживается уже на 6-8 неделе развития плода [1319; 1364]. Синтез у-цепей у эмбриона происходит в основном в печени и селезенке, но могут они синтезироваться и кроветворными клетками костного мозга. Наоборот, Р-цепи, в детстве и в более зрелом возрасте синтезируются главным образом в костном мозге, однако синтез вне костного мозга также возможен. Различные типы гемоглобина перечислены в табл. 4.12. Все нормальные гемоглобины человека, которые были исследованы, имеют идентичную трехмерную структуру, существенную для переноса кислорода. Все глобиновые цепи различных гемоглобинов имеют общее эволюционное происхождение и возникли в результате последовательных дупликаций генов (см. разд. 7.2.3). Чем больше сходство между двумя цепями, тем позднее в эволюции произошла дупликация. Очевидно, цепи Ау и Gy, которые различаются по одной аминокислоте, дивергировали позже всех других, а дупликация генов {3- и a-цепей произошла в весьма отдаленном прошлом. Гены гемоглобина. Аминокислотная последовательность каждой глобиновой цепи кодируется своим собственным геном. В гаплоидном наборе у нормального человека присутствует по крайней мере по одному гену а, р, у, 5, г, С, и по крайней мере по два таких гена в диплоидном наборе. В большинстве популяций человека ген а-цепи существует в дуплицированном состоянии, причем отличий между двумя a-генами не обнаружено [1350]. Имеются два гена у-цепей Ау и Gy, которые различаются по кодону, детерминирующему аминокислотный остаток в 136-м положении. Некоторые гены Ау несут необычный кодон, в результате в 75- м положении изолейцин замещен на треонин (ТАу). Синтез небелковой гемогруппы также контролируется генами, поскольку они кодируют ферменты, обеспечивающие биосинтез тема. Различные гены глобинов, соответствующие им глобиновые цепи и различные нормальные гемоглобины приведены в табл. 4.12 и на рис. 4.37. Была подробно исследована структура всех генов глобинов, опубликованы их пол-ные нуклеотидные последовательности [981; 1041; 1200; 1273; 1304; 1314]. Подобно многим генам млекопитающих, гены глобинов у человека образуют мультигенное семейство и расположены на хромосомах в составе двух кластеров (рис. 4.38, 4.39). a-кластер глобиновых генов занимает 25000 пар оснований (25 т. п. н.) в коротком плече 16-й хромосомы. Семейство у-Р-5-генов глобина расположено в коротком плече 11-й хромосомы на участке длиной 60 т. п. н. Пока остается неизвестным генетический механизм, регулирующий координированное функционирование генов на двух различных хромосомах, в результате которого образуется равное количество субъединиц а- и Р-у-типа. В a-кластере структурные гены расположены в следующем порядке в направлении. псевдоген а-цепи и два идентичных гена а-цепи (рис. 4.38). Выяснено расположение генов и в (3-кластере: ген эмбриональной s-цепи, два гена фетальных у-цепей (Ау и Gy), псевдоген |3-цепи, ген 5-цепи и ген Р-цепи (рис. 4.39). Порядок расположения генов в этих кластерах совпадает с очередностью их экспрессии в онтогенезе. По последовательности нуклеотидов псевдогены мало отличаются от своих функциональных гомологов. Однако в результате различных мутаций стала невозможной их транскрипция и, следовательно, экспрессия. Предполагается, что псевдогены возникли в результате дупликации, после которой их экспрессия перестала быть необходимой для нормального функционирования организма. Ген 5-глобина, продукт которого составляет лишь 2-3% всего гемоглобина, можно считать геном, который находится в переходном состоянии к псевдогену. Все глобиновые гены во многом сходны по своей функциональной организации. Каждый из них имеет в составе три коди-рующие последовательности, т.е. три экзо-на. Между 1-ми 2-м экзонами и между 2-м и 3-м экзонами расположены уникальные вставочные последовательности, или интроны, известные соответственно как IVS-1 и IVS-2 (от англ. intervening sequences) (рис. 4.38, 4.39, 4.40). Интроны транскрибируются вместе с экзонами, так что в первичном транскрипте представлены как кодирующие, так и некодирующие последовательности соответствующего гена. Вставочные последовательности вырезаются в ходе процессинга, который происходит в ядре, в результате конец первого экзона соединяется с экзоном 2, а конец второго экзона-с экзоном 3, при этом образуется функциональная мРНК, которая и служит матрицей для синтеза гемоглобина на рибосомах (рис. 4.40). Две вставочные послдовательности идентичны у различных генов у-5-р-кластера, но отличаются от более коротких интронов генов а-кластера. Детали процесса сплайсинга пока не ясны, однако для его изучения оказались весьма полезными мутации, которые вызывают [3-талассемии (см. ниже) и обусловлены нарушениями вырезания интронов. Все интроны начинаются с нуклеотидов GT (донорный сайт) и кончаются динуклеотидом AG (ак-цепторный сайт)эти динуклеотиды составляют часть так называемых обобщенных последовательностей сайтов сплайсинга. Более подробно см. в [1041 и 1238]. Некоторые детали этапов синтеза гемоглобина (от гена до белковой молекулы) представлены на рис. 4.40 и 4.41. Генетические доказательства несцепленности генов а- и Р-глобинов появились задолго до определения структуры кластеров этих генов. Было показано, что если один из родителей является двойной гетерозиготой с мутациями в генах а- и Р-глобинов, а другой - нормальной в отношении гемоглобина гомозиготой, то в потомстве выявляются четыре фенотипа: нормальный, с измененным а-глобином, с измененным Р-глобином и двойной мутант (рис. 4.42). Если бы гены а- и р-глобинов были тесно сцеплены, то в потомстве наблюдались бы генотипы Hbax и НЬ6Х, но не было бы двойных мутантов или нормальных индивидов. Подобным образом генетически доказано тесное сцепление генов 5- и Р-глобинов: если один из родителей был двойной 1 срозиготои с мутациями в генах р- и 5-цепей, то рекомбинантов среди детей не было [1013] (рис. 4.43). Открытие гемоглобина Lepore-продукта слияния генов 5-и Р-цепей - послужило биохимическим доказательством сцепления этих генов в составе одной хромосомы [1350] (см. ниже). Вывод о сцеплении генов у- и Р-глобинов был сделан на основании исследований гемоглобина Kenya, ген которого образуется при слиянии этих двух генов. Промоторы. Перед каждым глобиновым геном расположены три различные последовательности. Они близки по структуре у разных генов и, судя по всему, участвуют в регуляции транскрипции блок (последовательность Хогнесса), который находится на расстоянии в 30 пар нуклеотидов от точки начала транскрипции. Эта последовательность представляет собой элемент промотора, необходимый для точной инициации транскрипции. Другая последовательность, СААТ, расположенная 5а oU пар основании от стартовой точки, служит сайтом узнавания для РНК-полимеразы. Третий, дистальный, элемент локализован за 80-100 нуклеотидов, имеет характерную последовательность (Puпурин). До сих пор неизвестно, требуются ли для образования глобинов «энхансеры» (усилители)-генетические элементы, влияющие на эффективность транскрипции независимо от их позиции или ориентации. Последовательности, расположенные за геном. Терминация транскрипции осуществляется примерно через 1000 пар оснований после 3-го экзона гена р-глобина (рис. 4.40). Сигналом расщепления РНК эндонуклеазой служит последовательность AAUAA, к которой затем присоединяется polyA-«хвост» длиной в 220 нуклеотидов. Она незакодирована в ДНК и необходима для стабилизации мРНК, которая переносит генетическую информацию от ядерных генов к рибосомам, где в результате соединения аминокислот в нужной последовательности происходит синтез глобинов (рис. 4.41). Полиморфизм ДНК в области глобиновых генов. [972; 1253]. При картировании генов у-8-р-кластера с помощью рестрикционного анализа была обнаружена значительная вариабельность последовательности ДНК у различных индивидов (рис. 4.40). Все известные варианты Р-глобинового комплекса генов возникли в результате одиночных нуклеотидных замен и обозначаются как присутствующие ( + ) или отсутствующие ( —). Среди 17 полиморфных сайтов в (3-кластере 12 локализованы во фланкирующих последовательностях, 3 внутри нитронов, 1 внутри псевдогена и только 1 внутри кодирующей части гена (3-глобина (синонимическая замена). Такое расположение закономерно, поскольку мутации в кодирующих областях скорее могут вызвать нежелательные эффекты. Большая часть ДНК, расположенной между структурными генами, не экспрессируется, поэтому изменения нуклеотидной последовательности в этих районах обычно не имеют функциональных последствий. Различные полиморфные сайты имеют древнее происхождение, поскольку они обнаружены у всех расовых групп (табл. 4.13). Заметим, однако, что некоторые варианты встречаются только у негров, у других расовых групп их нет. Два случая полиморфизма ДНК в сеглобиновом локусе относятся к гиперва-риабельным районам, состоящим из различного числа случайно повторенных фрагментов ДНК длиной 36 нуклеотидов (разд. 2.3.3.9). Специфическое сочетание полиморфных сайтов в генном кластере (или генетическом локусе) называется гаплотипом. Например, расположение пяти сайтов возможного полиморфизма можно записать. Совокупность четырех основных гаплотипов, различающихся между собой минорными вариациями в 5 сайтах гена р-глобина, (табл. 4.14) была названа «остов». Отличительной чертой вариабельности ДНК в р-глобиновом кластере является неравновесие по сцеплению полиморфных сайтов. Если бы в течение многих поколений происходила свободная рекомбинация, сочетание полиморфных сайтов было бы случайным, а число различных гаплотипов составило 2", где «-количество возможных сайтов полиморфизма. В действительности обнаруживается лишь несколько гаплотипов. Например, имеет место сильное неравновесие по сцеплению восьми сайтов полиморфизма в 5- фланкирующей области гена 8-глобина (сайты 1-8 на рис. 4.44), вследствие чего 94% всех хромосом в популяции содержит лишь четыре гаплотипа из всех возможных. Сходным образом, для пяти других полиморфных сайтов, локализованных в гене р-глобина и его З-фланкирующей области (сайты 12-17 на рис. 4.44), только четыре гаплотипа на участке длиной 18 т.п.н. характеризуют 90% всех хромосом. При сравнении этих двух кластеров полиморфных сайтов неожиданно оказалось, что их сочетания полностью подчиняются случайному распределению. Проще всего это можно объяснить, предположив, что между кластерами имеется горячая точка рекомбинации участок, в котором рекомбинация происходит с высокой частотой. Такая рекомбинация уже продемонстрирована в одной из семей. Точные границы этой области с высокой частотой рекомбинации пока не определены. Варианты гемоглобинов. Варианты гемоглобина возникают вследствие различных мутационных событий в конкретном глоби-новом гене. Чаще всего разные варианты гемоглобина отличаются друг от друга одной аминокислотой в глобиновой цепи. Описано около 350 таких единичных замен [119]. Эти аминокислотные замены вызываются замещением всего одного нуклеотида в триплете. Например, при замене GUA и GAA смысл кодона меняется и место валина в глобиновой цепи занимает глутаминовая кислота (рис. 4.45). Если новая аминокислота отличается от исходной по заряду, измененный гемоглобин будет аномальным по электрофоретическим свойствам. Мутации, которые не влияют на заряд полипептида, обычно удается обнаружить только в том случае, если они существенно нарушают функционирование гемоглобина и приводят к болезни. Большинство мутаций гемоглобина независимо от того, меняют они заряд молекулы или нет, не влияют на функции гемоглобина и не приводят к патологии. Как правило, аминокислотные замены в участках полипептидной цепи, которые в молекуле гемоглобина обращены наружу, оказывают меньшее воздей кислоту - только заменой GUA на GUG. Следовательно, исходные индивиды, у которых произошли указанные мутации, различались по 67-му кодону валина Р-цепи глобина.ствие на функцию, чем замены аминокислот во внутренних частях цепей или в участках присоединения тема. Замены, нарушающие нормальную спиральную структуру цепи, часто вызывают нестабильность гемоглобина. Замены аминокислот в участках, которыми субъединицы контактируют друг с другом, влияют на сродство к кислороду [1320]. Большинство гемоглобиновых вариантов-редки. Лишь немногие, например гемоглобины HbS, НЬС иНЬЕ, встречаются чаще других. В кодирующей области гена полиморфизм тоже регистрируется. Известно, что генетический код вырожденный (табл. 2.12), т. е. несколько триплетов кодируют одну и ту же аминокислоту (см. рис. 4.45). Анализ двух различных замен в 67-м положении цепи р-глобина (рис. 4.45) показал, что два индивида, у которых произошли мутации, и появились новые формы гемоглобина, должны были различаться по исходным триплетам, кодирующим валин в 67-м по-ложении (рис. 4.45). Таким образом, у разных индивидов различные кодоны могут кодировать одну и ту же аминокислоту. Гемоглобинопатии. Анемические гипоксии. Важность первичной структуры белков для формирования их конформации и функции можно проследить на примерах наследственных заболеваний, связанных с изменением первичной структуры гемоглобина. В настоящее время известно около 300 вариантов НЬА, имеющих в первичной структуре ?- или ?-цепей лишь небольшие изменения. Некоторые из них почти не влияют на функцию белка и здоровье человека, другие снижают функцию белка и особенно в экстремальных ситуациях снижают возможность адаптации человека, третьи - вызывают значительные нарушения функций НbА и развитие анемии, что приводит к тяжёлым клиническим последствиям. В аномальных гемоглобинах изменения могут затрагивать аминокислоты: находящиеся на поверхности белка; участвующие в формировании активного центра; замена которых нарушает общую трёхмерную конформацию молекулы; изменяющие четвертичную структуру белка и его регуляторные свойства. Замена аминокислоты на поверхности гемоглобина А Ещё в 1904 г. чикагский врач Джеймс Херрик описал у студента тяжёлую анемию с обнаружением в его крови множества удлинённых, похожих на полумесяц, эритроцитов. Заболевание получило название "серповидно-клеточной анемии", и только в 1949 г. Лайнус Полинг и его сотрудники доказали, что оно вызвано изменением первичной структуры НЬА. В молекуле гемоглобина S (так назван аномальный гемоглобин) мутантными оказались 2 ?-цепи, в которых глутамат, высокополярная отрицательно заряженная аминокислота в положении 6 была заменена валином,
В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают "слипаться", образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа (рис. 1-40). В оксигемоглобине S комплементарный участок "замаскирован" в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина S друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение рН, условия высокогорья, полёт на самолёте). Так как "серповидные" эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли "даже некроз клеток в данной области. Серповидно-клеточная анемия - гомозиготное рецессивное заболевание; проявляется только в том случае, когда от обоих родителей наследуются 2 мутантных гена ?-цепей глобина. После рождения ребёнка болезнь не проявляется до тех пор, пока значительные количества HbF не заместятся на HbS. У больных выявляют клинические симптомы, характерные для анемии: головокружение и головные боли, одышка, учащённое сердцебиение, боли в конечностях, повышенную восприимчивость к инфекционным заболеваниям. Гетерозиготные индивидуумы, имеющие один нормальный ген НЬА, а другой ген HbS, в крови имеют лишь следовые количества серповидных клеток и нормальную продолжительность жизни; клинические симптомы болезни у них обычно не проявляются. |
