Лекции по химии. Конспект лекций по курсу общая химия
 Скачать 1.01 Mb. Скачать 1.01 Mb.
|
|
Еразл. реальный Еразл. теор. Причина – перенапряжение электродов. Перенапряжение электродов. Для того, чтобы процессы протекали с заметной скоростью, необходимо приложить такой потенциал, который обеспечит определенную плотность тока на катоде ( jк ) и аноде ( jа ). Чем больше плотность тока, тем больше скорость реакции (до определенного предела). Графическая зависимость Е ( j ) – называется поляризационной кривой (это экспериментальная зависимость). Из рис.28 видно, что процесс разложения воды на Pt-электродах при рН=7 будет протекать с заметной скоростью, если потенциал катода сместить в более отрицательную область по отношению к теоретическому (-0,41 вольт), а потенциал анода – в более положительную область по отношению к теоретическому значению (+0,815 вольт). Смещение реального потенциала разряда ионов на данном электроде от теоретического значения называется перенапряжением электрода. Рис.28. Катодная и анодная поляризационные кривые процесса разложения воды на Pt-электродах при рН=7 и на угольных электродах при рН=7 Перенапряжение электрода зависит от многих факторов (состава электролита, концентрации ионов, плотности тока), но особенно от типа электрода. На Pt-электродах перенапряжение водорода и кислорода мало, поэтому можно пользоваться табличными значениями потенциалов с учетом среды. На всех других электродах (угольных, металлических) – перенапряжение водорода и кислорода велико и его необходимо учитывать. Потенциал водорода смещается вплоть до значения (0.8)(1.0) вольт (в любой среде), а потенциал кислорода – вплоть до значения (+1.8) вольт (в любой среде). Электролиз водных растворов солей. Соли диссоциируют в растворе нацело на катионы и анионы (кислотные остатки), которые могут участвовать в конкурирующих процессах на катоде и аноде. Катодные процессы – процессы восстановления, протекают на электроде (-). Из водных растворов солей восстанавливаться могут: а) катионы металлов, Men+ + ne = Me0 - катодный осадок металла; б) ионы водорода., 2Н+ + 2е = Н2 (при рН 7) 2Н2О + 2е = Н2 + 2ОН- (при рН 7) При наложении минимальной разности потенциалов к электродам в первую очередь пойдет процесс, который характеризуется наибольшим потенциалом. ПРИМЕР. В водном растворе находятся катионы Сu2+ , K+, Zn2+, среда нейтральная.
Если электролиз ведут с Pt-катодом, то при наложении минимальной разности потенциалов к электродам начнется процесс восстановления ионов меди, затем, по мере увеличения разности потенциалов, будет разлагаться вода. Катионы K+, Zn2+ восстанавливаться не будут. Если катод из другого материала, то потенциал восстановления ионов водорода смещается в отрицательную область значений (см. ранее). Перенапряжение электрода при восстановлении катионов металлов минимальное, следовательно, реальные потенциалы близки к табличным. Ими и следует пользоваться. Тогда порядок разряда ионов будет следующим: медь – цинк- водород, а возможно и одновременное выделение цинка и водорода. Ясно, что те металлы, у которых Е0 (Меn+/Me) B, не будут разряжаться на катоде из водного раствора (только из расплавов). Анодные процессы – процессы окисления, протекают на (+). Из водных растворов солей окисляться могут: а) анионы соли (бескислородные), 2Cl- - 2e = Cl2, 2J- - 2e = J2, 2Br- - 2e = Br2; б) ионы кислорода из воды или гидроксильных ионов, 2Н2О – 4е = О2 + 4Н+ (рН 7), 4ОН- - 4е = О2 + 2Н2О (рН 7); в) материал анода.Различают аноды нерастворимые (инертные) – угольные и Pt-электроды, и растворимые – металлические электроды, которые при окислении растворяются, например, Cu – 2e = Cu2+. На аноде в первую очередь идут те реакци, которые характеризуются наименьшими электродными потенциалами. Кислород на всех электродах, кроме Pt, выделяется с перенапряжением, Е(О2/2Н2О) +1,8 В (в любой среде). Кислородсодержащие анионы NO3-, SO42- и др. при электролизе разбавленных водных растворов, не участвуют в анодных процессах, поскольку характеризуются очень высокими потенциалами. Вместо них идет процесс разложения воды с выделением кислорода. ПРИМЕР. Рассмотрим анодные процессы, протекающие при электролизе раствора NaCl , если анод а) из Pt, б) угольный, в) цинковый (среда нейтральная). А) Конкурирующие реакции: 2Cl- - 2e = Cl2 , E0 = +1,36 2Н2О – 4е = О2 + 4Н+, E = +0,815 - будет выделяться кислород. Б) Конкурирующие реакции: 2Cl- - 2e = Cl2 , E0 = +1,36 – будет выделяться хлор 2Н2О – 4е = О2 + 4Н+, E = +1,8 В) Конкурирующие реакции: 2Cl- - 2e = Cl2 , E0 = +1,36 2Н2О – 4е = О2 + 4Н+, Е = +1,8 Zn – 2e = Zn2+ , E0 = -0,76 – будет растворяться электрод. Метод электролитической очистки металлов. ПРИМЕР. Рафинирование меди. (-) Cu раствор СuSO4Cu (+) Катод (-) – из очищнной меди. Анод (+) – черновая медь, содержит примеси, например Zn, Ag, Au и др. Электродные процессы: (-) Cu2+ + 2e = Cu, E 0 = +0,34 – чистая медь осаждается на катоде 2Н2О + 2е = Н2 + 2ОН- , E = -1 (+) SO42- - ионы не участвуют 2Н2О – 4е = О2 + 4Н+, Е = +1,8 Cu – 2e = Cu2+ , E 0 = +0,34 - растворение анода (черновой меди). Рассмотрите самостоятельно поведение примесных металлов в ходе электролиза. Коррозия металлов Коррозия – это процес разрушения (окисления) металлов под воздействием окружающей среды. Различают два основных вида коррозии – химическую и электрохимическую. Химическая коррозия – это процесс окисления металла без участия элктрического тока (процессы окисления при высоких температурах, в диэлектрических средах). Электрохимическая коррозия – это окисление металлов при обычных температурах в токопроводящих средах за счет электрохимических процессов. К электрохимической коррозии относятся электрокоррозия (электролиз блуждающими токами) и гальванокоррозия (образование гальванопар при контакте металлов различной активности). ПРИМЕР. Два металла Cu и Zn находятся в контакте в атмосфере влажного воздуха. Рис.29. Запишем условно гальванопару (+) Cu H2O, O2, CO2Zn (-) Электродные процессы: (-) Zn – 2e = Zn2+ - начало работы гальванопары. Освободившиеся электроны переходят на медь и на поверхности меди могут протекать следующие конкурирующие реакции:  (+) а) 2H+ + 2e = H2 (кислая среда образуется в результате (+) а) 2H+ + 2e = H2 (кислая среда образуется в результате реакции СО2 + Н2О = Н2СО3) 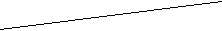 коррозия с водородной коррозия с водородной б) 2Н2О + 2е = Н2 + 2ОН- деполяризацией в) О2 + 4е + 2Н2О = 4ОН- – коррозия с кислородной деполяризацией В литературе по коррозии термин деполяризатор означает – окислитель. Выводы: 1) Из двух различных металлов, находящихся в контакте, корродирует более активный. 2) Коррозия цинка в контакте с медью идет значительно быстрее, чем коррозия чистого цинка. Методы защиты от коррозии. Во-первых, различные защитные покрытия: смазки, краски, лаки, эмали, полимеры. Во-вторых, электрохимические методы защиты – катодная защита и метод протекторов. При катодной защите защищаемая деталь присоединяют к отрицательному полюсу внешнего источника постоянного тока, т.е. становится катодом (см. процессы электролиза). Электроны укрепляют кристаллическую решетку металла и он не разрушается в ходе электрохимических процессов. Для любого металла протектором является более активный металл. Находясь в контакте с защищаемым металлом, протектор является отрицательным полюсом гальванопары и растворяется. Освобождающиеся электроны переходят в кристаллическую решетку защищаемого металла, укрепляют ее и расходуются на реакции, рассмотренные в разделе “Kоррозия металлов”.
Реакции, протекающие с изменением степеней окисления участвующих в реакции элементов, называются окислительно-восстановительными реакциями (ОВ-реакции). Как минимум, два элемента меняют свою степень окисления: один – повышает, другой – понижает. В ходе ОВ-процесса происходит переход электронов от одних частиц (молекул, атомов, ионов) к другим. Рассмотрим реакцию: 0 -1 0 -1 Cl2 + 2KJ = J2 + 2KCl Мысленно любую ОВ-реакцию можно разделить на две полуреакции - окисления и восстановления: Cl2 + 2e = 2Cl- - присоединение электронов, восстановление окислителя, окислитель 2J- - 2e = J2 - Отдача электронов, Окисление восстановителя. восстановитель Атомы, молекулы, ионы, принимающие электроны, называют окислителями (окислитель – “грабитель”). Атомы, молекулы или ионы, которые отдают электроны, называются восстановителями. Каждая полуреакция представляет собой равновесие между окисленной (Ox) и восстановленной (Red) формами какого-либо элемента (редокспара). Окисленной называется форма с более высокой степенью окисления элемента. Равновесный стандартный потенциал любой редокспары Е0Ox/Red приводится в справочнике. ПРИМЕЧАНИЕ: независимо от формы записи равновесного процесса знак потенциала не менять!!! Cl2 + 2e = 2Cl- или 2Cl- - 2e = Cl2, E0(Cl2/2Cl-) = +1,36 B. Ox Red Red Ox J2 + 2e = 2J- или 2J- - 2e = J2, E0(J2/2J- ) = +0,54 B. По величине потенциала полуреакций можно судить об окислительно-восстановительных свойствах систем. Более высокий по своей алгебраической величине потенциал указывает на более высокую окислительную способность окислителя. Более низкий потенциал свидетельствует о более высокой восстановительной способности восстановителя. Таким образом, согласно потенциалам, Cl2 - более сильный окислитель, чем J2 , а ион J- - более сильный восстановитель, чем Cl-. В зависимости от степени окисления элемента в веществе он может проявлять различные функции в ОВ-реакциях. По этому признаку можно выделить три группы веществ и соединений.
Из простых веществ только окислительными свойствами обладают F2 и O2, атомы которых имеют наивысшую электроотрицательность. Сильными окислителями являются также Cl2 и J2, но в отличие от фтора и кислорода в некоторых реакциях они могут проявлять и восстановительные свойства. Из соединений только окислительными свойствами обладают те, которые содержат элементы в высших степенях окисления: Mn(+7) HMnO4, KMnO4, в растворе ион MnO4- Cr(+6) H2Cr2O7, K2Cr2O7, в растворе нейтральном и кислом ион Cr2O72- H2CrO4, K2CrO4, в щелочной среде ион СrO42- Bi(+5) NaBiO3 – нерастворим в воде Pb(+4) PbO2 - нерастворим в воде Fe3+ FeCl3, в растворе ионы Fe3+ + e = Fe2+ Sn4+ SnCl4, в растворе ионы Sn4+ + 2e = Sn2+ S(+6) H2SO4 (конц) – сильный окислитель N(+5) HNO3 – сильный окислитель в любой концентрации Cl(+7) HClO4 , KClO4 – сильнейшие окислители Сильные окислители характеризуются значениями потенциалов Е0Ox/Red В. Если Е В – это свидетельствует о слабых окислительных свойствах системы.
Только восстановительные свойства проявляют металлы в свободном состоянии: Me0– ne = Men+. Особенно активными восстановительными свойствами обладают металлы, стоящие в ряду напряжений левее водорода (чем левее, тем активнее). Из соединений только восстановительными свойствами обладают те, которые содержат элементы в низших степенях окисления – это соединения, содержащие, например, ионы Cl-, Br-, J-, S2-, Se2-, Te2-, азот в степени окисления (-3) в молекуле NH3 или ионе NH4+ , кислород в степени окисления (-2) в молекуле Н2О или ионе ОН-. Сильные восстановители характеризуются значениями потенциалов Е0Ox/Red В. Если Е , В – это свидетельствует о слабых восстановительных свойствах системы.
Если элемент в составе простого вещества или соединения находится в промежуточной степени окисления (ни высшей, ни низшей), то он может проявлять как окислительные, так и восстановительные свойства. Это зависит от второго участника реакции. Например, элементарная сера S0 в реакции с сильным окислителем проявляет восстановительные свойства и может окисляться до S(+6) (до ионов SO42-), а в реакциях с сильным восстановителем – проявляет окислительные свойства и восстанавливается до S2-. S0 + 2e = S2- S0 - 6e = S (+6) 3s 3p 3s 3p 3s 3p 3s 3p Возможность и направленность ОВ-реакций Возможность осуществления и самопроизвольного протекания ОВ-реакции определяется двумя условиями:
Рассмотрим ОВ-реакцию, о которой известно, что она самопроизвольно протекает в прямом направлении. Вспомним гальванический элемент Даниэля-Якоби. Суммарный ОВ-процесс, протекающий в ГЭ самопроизвольно, отражается уравнением: Zn + CuSO4 = ZnSO4 + Cu или в ионном виде Zn0 + Cu2+ = Zn2+ + Cu0. Запишем полуреакции: Cu2+ + 2e = Cu0, E0(Cu2+/Cu) = +0,34 B, окислитель Zn0 – 2e = Zn2+, E0(Zn2+/Zn) = -0,76 B, восстановитель В гальваническом элементе данные полуреакции разделены пространственно, что позволяет преобразовать энергию химической реакции в электрическую. Эта же реакция, проведенная в пробирке, идет самопроизвольно в том же направлении, только энергия ее рассеивается. Разность потенциалов окислителя и восстановителя – есть ЭДС окислительно-восстановительной реакции (ЭДС гальванического элемента). При стандартных условиях Е0 = Е0окислителя – Е0восстановителя. Изменение свободной энергии Гиббса для ОВ-реакции G0 = -RTlnK = -zFE0, где F – константа Фарадея, z – число электронов, передаваемых восстановителем окислителю за один пробег этой реакции. Самопроизвольное протекание процесса возможно, если G0 , это возможно, если Е0, т.е. Е0окислителя Е0восстановителя. ПРИМЕРЫ. 2+ 0 0 2+
Окислитель Cu2+ + 2e = Cu0 , E0 (Cu2+/Cu) = +0.34 B. Восстановитель Fe0 - 2e = Fe2+ , E0 (Fe2+/Fe) = -0.44 B. E0окислителя Е0восстановителя - реакция возможна.
Сосуществование ионов возможно при отсутствии между ними каких-либо химических реакций. Среди указанных ионов есть типичный окислитель – Fe3+ и типичные восстановители – Cl- и J-. Проверим, возможно ли между ними химическое взаимодействие в виде ОВ-реакции. Fe3+ + e = Fe2+, E0 = +0.77 B 2Cl- - 2e = Cl2 , E0 = +1.36 B 2J- - 2e = J2 , E0 = +0.54 B Между ионами Fe3+ и J– возможен ОВ-процесс. Следовательно, совместное сосуществование указанных ионов в растворе без изменения их степеней окисления невозможно. Участие среды (Н+, ОН-, Н2О) в ОВ-реакциях
При проведении ОВ-реакций в водных растворах необходимо учитывать, что в результате этих реакций происходит изменение ионного состава растворов. Чтобы отразить эти изменения, составляют уравнения в ионной форме. При этом руководствуются общими правилами составления ионных уравнений, т.е. записывают сильные электролиты в виде ионов, а неэлектролиты, слабые электролиты, газы и осадка – в виде молекул. В электронную схему включают только реально существующие ионы. При этом следует помнить, что, во-первых, элементы с высокой степенью окисления входят в состав сложных кислородсодержащих ионов, и, во-вторых, свободные ионы О2- в растворе не существуют.
В щелочной среде катионы металлов образуют труднорастворимые гидроксиды (кроме щелочных металлов и Ca2+, Sr2+, Ba2+. Амфотерные гидроксиды растворяются в избытке щелочи с образованием гидроксокомплексов (см. таблицу).
Если ионы Н+ или ОН- участвуют в равновесном процессе между окисленной и восстановленной формами, то потенциал такой системы зависит от их концентрации (см уравнение Нернста). ПРИМЕР. Какая среда благоприятствует протеканию реакции KJ + KJO3 /J2/ ? Составим схему реакции в ионном виде, найдем окислитель и восстановитель: 5+ 0 J- + JO3- /J2/ - реакции такого типа называются реакциями конмутации или выравнивания степеней окисления 2J- - 2e = J2 , Е0 (J2/2J-) = +0.54 B - потенциал этой реакции от среды не зависит восстановитель 2JO3- + 10e + 6H2O = J2 + 12OH-, Е0 (2JO3-/(J2 + 12OH-)) = +0.26 B – в ходе прямой реакции окислитель накапливаются ионы ОН-, т.е. среда становится щелочной. Поскольку Еокислителя Евосстановителя , реакция между иодидом и иодатом калия в нейтральной и щелочной среде невозможна. 2JO3- + 10e + 12H+ = J2 + 6H2O, E0 ((2JO3- +12Н+)/J2 ) = +1,09 В – кислотная среда способствует смещению равновесия в сторону прямой реакции, окислительные свойства иодат-ионов возрастают. В кислотной среде Еокислителя Евосстановителя , реакция будет протекать самопроизвольно. Составим уравнение реакции, учитывая два основополагающих принципа:
5 2J- - 2e = J2 1 2JO3- + 10e + 12H+ = J2 + 6H2O _______________________________________________________________ 10J- + 2JO3- + 12H+ = 6J2 + 6H2O 5J- + JO3- + 6H+ = 3J2 + 3H2O Чтобы уравнять число электронов, отданных иодид-ионами и принятых иодат-ионами, необходимо первую полуреакцию умножить на 5. После сложения уравнений полуреакций получим уравнение ОВ-реакции в ионной форме. Поскольку все коэффициенты получились четные, то можно их сократить в два раза. Далее можно записать молекулярное уравнение, сохраняя все коэффициенты, полученные в ионном уравнении. Ионы Н+ вводят в раствор, добавляя сильную кислоту. Обычно используется разбавленная серная кислота. Соляную и азотную кислоты применяют реже, так как они могут сами участвовать в ОВ-реакции: НС1 как восстановитель за счет ионов С1-, а HNO3 как сильный окислитель за счет N(+5). В молекулярной форме уравнение реакции принимает вид: 5KJ + KJO3 + 3H2SO4 = 3J2 + 3H2O + 3K2SO4. Ионы калия и сульфат-ионы записывают в виде соли сульфата калия.
ПРИМЕРЫ. 1) Cr3+ + окислитель OH- / СrO42- + продукты восстановления окислителя/ Cr3+ + окислитель H+ / Сr2O72- + продукты восстановления окислителя/ 2) KMnO4 + восстановитель H+ / Mn2+ + продукты окисления восстановителя/ малиновый бесцветный KMnO4 + восстановитель Н2О / MnО2 + продукты окисления восстановителя/ малиновый темный коричневый KMnO4 + восстановитель ОН- / MnО42- + продукты окисления восстановителя/ малиновый зеленый Составление уравнений ОВ-реакций
ПРИМЕЧАНИЕ: В реакциях, идущих в разбавленных водных растворах, не образуются оксиды металлов (кроме MnO2), только соли !!! Оксиды неметаллов SO2, SO3, N2O, NO, NO2 , как правило, образуются в реакциях с участием концентрированной серной кислоты или азотной кислоты. В других случаях записывают ионы –SO42-, NO3-.
реакций протекает в кислой среде. Щелочная среда менее желательна, т.к. могут протекать побочные процессы (например, осаждение труднорастворимых основных солей и гидроксидов).
полуреакция должна быть уравнена по элементам и зарядам. ПРИМЕЧАНИЕ: При написании полуреакций с участием кислородсодержащих ионов нередко возникают избыточные атомы кислорода в одной из частей уравнений. Необходимо уравнять этот кислород. Это достигается одним из следующих приемов. А) В кислой среде избыток атомов кислорода связывают ионами водорода (на каждый ион кислорода требуется два иона водорода) О(-2) + 2Н+ Н2О +4 +6 SO32- - 2e + H2O = SO42- + 2H+ Б) В щелочной среде избыток атомов кислорода связывают молекулами воды (на каждый ион кислорода требуется одна молекула воды) О(-2) + Н2О 2ОН- +4 +6 SO32- - 2e + 2ОН- = SO42- + Н2О В) В нейтральной среде избыток атомов кислорода следует связывать одним из двух первых способов, но так, чтобы в левой части уравнения получались молекулы воды.
Ионы Н+ вводят в раствор, добавляя обычно разбавленный раствор H2SO4. Разбавленные растворы соляной и азотной кислоты применяют реже, как правило, в тех случаях, когда они являются непосредственными участниками реакции. Ионы ОН- вводят в раствор, добавляя разбавленные растворы щелочей NaOH, KOH. ПРИМЕРЫ. +7 +4
окислитель восстановитель Перманганат калия – типичный окислитель за счет Mn(+7). Сульфит натрия – обладает ОВ-двойственностью, поскольку сера находится в промежуточной степени окисления S(+4). В присутствии сильного окислителя сульфит натрия проявляет свойства восстановителя. Перманганат-ионы в кислой среде восстанавливаются до ионов Mn2+ (малиновый раствор перманганата калия обесцвечивается). Сера в сульфит-ионе окисляется до S(+6), т.е. образуются сульфат-ионы SO42-. Среда задана. Записываем полуреакции. 2 MnO4- +5e +8H+ = Mn2+ + 4H2O 5 SO32- - 2e + H2O = SO42- + 2H+ ________________________________________________________ 2 MnO4- + 5 SO32- + 16H+ + 5H2O = 2Mn2+ + 5SO42- + 8H2O + 10H+ После приведения подобных членов получаем: 2 MnO4- + 5 SO32- + 6H+ = 2Mn2+ + 5SO42- + 3H2O Записываем молекулярное уравнение реакции: 2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + K2SO4 + 5Na2SO4 + 3H2O В правой части уравнения 8 сульфатных группировок – 5 образовались в результате ОВ-реакции, а 3 – внесены в раствор с серной кислотой. +7 +4 +6 +6
окислитель восстановитель Поскольку задана щелочная среда, то в уравнениях полуреакций не должно быть Н+ -ионов !!! 2 MnO4- +e = MnО42- 1 SO32- - 2e + 2ОН- = SO42- + Н2О ________________________________________________________ 2 MnO4- + SO32- + 2ОН- = 2MnО42- + SO42- + H2O 2KMnO4 + Na2SO3 + 2NaOH = 2Na2MnO4 + K2SO4 + H2O +7 +4 +4 +6
окислитель восстановитель По условию задана нейтральная среда, следовательно, в левой части уравнений полуреакций могут быть только молекулы воды. 2 MnO4- +3e + 2Н2О = MnО2 + 4OН- 3 SO32- - 2e + H2O = SO42- + 2H+ ________________________________________________________ 2 MnO4- + 3 SO32- + 7H2O = 2MnО2 + 3SO42- + 8ОН- + 6H+ 6Н2О + 2ОН- После приведения подобных членов получаем: 2 MnO4- + 3 SO32- + H2O = 2MnО2 + 3SO42- + 2ОН- 2KMnO4 + 3Na2SO3 + H2O = 2MnO2 +3Na2SO4 + 2KOH Как видно из уравнения, среда в результате реакции становится щелочной. +5 +2 4. Cu0 + HNO3 (разбавленная) / Сu2+, NO / Среда проведения данной реакции задана (молчаливо) исходными веществами (азотной кислотой). 3 Cu – 2e = Cu2+ 2 NO3- + 3e + 4H+ = NO + 2H2O ____________________________________________________ 3Cu + 2NO3- + 8H+ = 3Cu2+ + 2NO + 4H2O Две молекулы HNO3 необходимы для окисления меди, а шесть молекул HNO3 вводятся дополнительно для создания среды. Суммарное число молекул кислоты – 8 (восемь ионов Н+). 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O Участие пероксида водорода Н2О2 в ОВ-реакциях. +1 -1 -1 +1 В пероксиде водорода степень окисления кислорода (-1): H OOH Эта степень окисления кислорода не является устойчивой, поэтому кислород стремится перейти в устойчивые степени окисления (-2) или (0). Таким образом, пероксид водорода обладает ОВ-двойственностью и в зависимости от среды проявляет сильные окислительные или восстановительные свойства. | ||||||||||||||||||||||||||
