Лекции по химии. Конспект лекций по курсу общая химия
 Скачать 1.01 Mb. Скачать 1.01 Mb.
|
|
Н2О2 как окислитель. Н2О2 + 2е + 2Н+ = 2Н2О, Е0 = +1,76 В Н2О2 + 2е = 2ОН-, Е0 = +0,878 В В кислой среде пероксид водорода является сильным окислителем. Н2О2 как восстановитель. Н2О2 – 2е = О2 + 2Н+, Е0 = +0,868 В Н2О2 – 2е + 2ОН- = О2 + 2Н2О, Е0 = -0,076 В В щелочной среде пероксид водорода является сильным восстановителем.
Простые вещества. ______________________________________________________________________________________ Группа IIIA IVA VA VIA VIIA VIIIA s2p1 s2p2 s2p3 s2p4 s2p5 s2p6 ______________________________________________________________________________________ B С N2 (газ) О2 (газ) F2 (газ) Ne п/п алмаз, атомная КР sp3-гибр., диэлектрик графит (слоист.) sp2-гибр., проводник карбин (линейные цепи) sp-гибр., полупроводник Al Si P (тв.) S (тв.) С12 (газ) Ar металл п/п Р4 белый, молекулярная КР S8 ромбическая,моноклинная, алмазоподобная КР Р красный, черный молекулярная КР, S пластическая Ga Ge As (тв.) Se (тв.) Br2 (ж) Kr металл п/п As4 желтый, молекулярная КР Sе8 красный, алмазоподобная КР As серый, металлоподобный молекулярная КР, Sе серый, п/п In Sn Sb (тв.) Те (тв.) J2 (крист) Xe металл металл желтая и серая, Te п/п металлоподобная Tl Pb Bi Po At (тв) Rn металл металл металл металл радиоактивные радиоактивные изотопы изотопы Химические свойства Высшая степень окисления равна № группы (кроме O, F). В пределах каждой подгруппы элементы являются электронными аналогами и химическими аналогами. Имеют одинаковые степени окисления, образуют однотипные соединения. По группе По периоду Число электронных слоев , r, потенциал ионизации , r, увеличивается число электронов на внешнем слое, усиливается способность потенциал ионизации , усиливается способность отдавать электроны (ЭО), присоединять электроны (ЭО), усиливаются нарастают металлические свойства неметаллические свойства Изменение характера высших оксидов. B2O3 кислотный H3BO3 слабая Al2O3 SiO2 P2O5 SO3 Cl2O7 амфотерный кислотный кислотный кислотный кислотный HAlO2 слабая H2SiO3 (HPO3)x – метафосфорная H2SO4 HClO4 Al(OH)3 H4P2O7 – пирофосфорная H3PO4 – ортофосфорная сильные кислоты Ga2O3 амфотерный In2O3 амфотерный Tl2O3 основной Tl(OH)3 Оксиды металлов по характеру основные или амфотерные. Оксиды неметаллов – кислотные. Оксиды переходных элементов – амфотерные или кислотные (Ge, Sb). Безразличные оксиды – NO, CO – плохо растворимы в воде, не имеют соответствующих кислот и солей. Группа VII А. Галогены (ns2np5) Г0 (s2p5) + е Г ( s2p6). Характерные степени окисления от (-1) до (+7). Степень окисления (-1) наиболее устойчивая. Фтор не имеет положительных степеней окисления. В свободном состоянии – двухатомные молекулы Г2, токсичны (особенно F2), имеют резкий запах, активные окислители: Г2 + 2е = 2Г – Ок-ль в-ль
увеличиваются окислительные свойства Г2 увеличиваются восстановительные свойства Г – 0 -2 -1 0 В атомосфере фтора вода горит: F2 + H2O = 2HF + O Фтор реагирует со всеми металлами и неметаллами, окисляя их до высших степеней окисления и образуя фториды, которые имеют низкие температуры кипения, являются летучими соединениями. Фтор реагирует даже с некоторыми инертными газами. F2 + S, P, Si, Xe и др. SF6, PF5, SiF4, XeF2, XeF4, XeF6 и др. Активные металлы (Na, Mg) горят в атмосфере фтора. Металлы Mo, W, Ti, U взаимодействуют со фтором при повышенных температурах. Наиболее устойчивы к действию фтора – Cu, Ni, Fe, реагируют со фтором при температуре выше 5000С. На поверхности этих металлов образуются прочные защитные пленки фторидов. Хлор, бром и иод менее сильные окислители. При взаимодействии с металлами и неметаллами образуют соли хлориды, бромиды, иодиды. 3Cl2 + 2P = 2PCl3 3J2 + 2Al = 2AlJ3 Хлор и бром ограниченно растворяются в воде (хлорная и бромная вода), при этом протекает реакция: 0 -1 +1 Cl2 + H2O = HCl + HClO – реакция диспропорционирования Галогеноводороды НГ. При обычных условиях галогеноводороды (хлороводород, бромоводород, иодоводород) – бесцветные газы. Фтороводород имеет температуру кипения +200С. Все галогеноводороды хорошо растворяются в воде с образованием растворов кислот: H[HF2] – плавиковая, HCl – соляная, HBr – бромистоводородная, HJ – иодистоводородная. Получение галогеноводородов: 1) Г2 + Н2 = 2НГ (F2, Cl2 реагируют со взрывом); 2) СaF2 (тв.) + H2SO4 конц. = t = 2HF + CaSO4 NaCl (тв.) + H2SO4 конц. = t = HСl + NaHSO4 Молекулы фтороводорода даже в парах находятся в виде ассоциатов (HF)x. Молекулы соединяются друг с другом за счет образования водородных связей. Водородная связь – это связь через водородный атом сильно электроотрицательных атомов F, O, N, имеющих очень малые радиусы. Очень ярко проявляется в соединениях (HF)x, (H2O)x, (NH3)x. Механизм образования водородной связи – донорно-акцепторное или электростатическое взаимодействие. + H 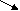 F F 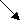 Сильно H F Сильно H F полярная связь H F Водородные связи более прочные, чем силы межмолекулярного взаимодействия. Для их разрушения требуется затратить энергию, поэтому перечисленные соединения обладают аномально высокими температурами кипения, плавления, удельной теплоемкостью по сравнению с однотипными соединениями их электронных аналогов. Кислоты, соли. Степень окисления -1 +1 +3 +5 +7 ___________________________________________________________________________ H[HF] HCl HClO HClO2 HClO3 HClO4 Хлорноватистая хлористая хлорноватая хлорная HBr аналогичные кислоты брома HJ аналогичные кислоты иода ___________________________________________________________________________________ Соли Фториды Хлориды гипохлориты хлориты хлораты перхлораты Бромиды гипобромиты бромиты броматы пероброматы Иодиды гипоиодиты иодиты иодаты периодаты только ОВ – двойственность только восстановительные (но преобладают окислительные свойства) окислительные свойства свойства Плавиковая кислота. (HF)2 H[HF2] H+ + HF2, Kк = 6,7104. Согласно константе ионизации плавиковая кислота – электролит средней силы, но очень агрессивна, пары ее ядовиты. Соли – фториды, ядовиты, большинство нерастворимы в воде, имеют низкие температуры кипения, летучи. Плавиковая кислота растворяет стекло, поэтому раствор хранят в полиэтиленовой посуде: SiO2 + 4HF = SiF4 + 2H2O, процесс автокаталитически ускоряется образующейся водой. Соляная кислота. Концентрированный раствор кислоты имеет массовую долю НС1 в растворе 35%. Обладает восстановительными свойствами за счет ионов С1 и окислительными за счет Н+. Реагирует с металлами, стоящими левее водорода в ряду напряжений металлов, с выделением Н2 и образованием хлоридов металлов. С малоактивными металлами не реагирует. 2НС1 + Zn = H2 + ZnCl2 Концентрированная соляная кислота и ее соли (при высокой концентрации хлорид-ионов) реагирует с активными окислителями с выделением газообразного хлора. HClконц. + сильный окислитель (KMnO4, MnO2, K2Cr2O7) / Cl2 + Mn2+, Cr3+/ Окислительные свойства кислородных соединений галогенов. KJO4 + Cr(NO3)3 + щелочная среда / J, CrO42- / KJ + KJO3 = / J2 / - реакция конмутации KCl + KСlO3 = / Cl2 / - реакция конмутации Группа VI A (ns2np4) Характерные степени окисления в соединениях –2, 0, +4, +6 (кроме кислорода). Для кислорода устойчивая степень окисления (–2), неустойчивые (-1) в пероксиде водорода Н2О2 и других пероксидных соединениях и (+2) в соединении OF2. Степени окисления -2 +4 +6 H2O (ж) Водные растворы H2S (г) H2S H+ + HS- SO2 (г) H2SO3 SO3 H2SO4 Сероводород сероводородная к-та сернистый газ сернистая к-та серный газ серная кислота сернистый ангидрид серный ангидрид H2Se (г) селеноводородная к-та SeO2 H2SeO3 SeO3 H2SeO4 H2Te (г) теллуроводородная к-та TeO2 H2TeO3 TeO3 H2TeO4 газы с слабые кислоты слабые кислоты сильные кислоты неприятным запахом соли соли соли халькагено- сульфиды сульфиты сульфаты водороды селениды селениты селенаты теллуриды теллуриты теллураты Вода. В молекуле воды атом кислорода находится в состоянии sp3 – гибридизации, но валентный угол немного меньше 1090 за счет эффекта отталкивания неподеленных электронных пар. Рис.30. Орбитальная диаграмма и валентная схема молекулы воды. В жидком и кристаллическом состояниях вода образует ассоциаты (Н2О)x за счет водородных связей. Рис.31. Схема образования ассоциатов (Н2О)2, (Н2О)6 (снежинка), (Н2О)x (лед) Рис.32. Зависимость плотности воды от температуры Получение водородных соединений. S + H2 =t= H2S ZnS + H2SO4 = H2S + ZnSO4 2H2 + O2 =катализатор Pt= 2H2O - взрыв гремучий газ Восстановительные свойства сероводорода и сульфидов. Na2S (или H2S) + окислитель (KMnO4, K2Cr2O7, Cl2) / SO42-, Mn2+, Cr3+, Cl- / ОВ – двойственность сульфитов. Na2SO3 + типичный окислитель (KMnO4, K2Cr2O7) + кислотная среда / SO42-, Mn2+, Cr3+ / Na2SO3 + типичный восстановитель (Na2S) / S0 / - реакция конмутации (выравнивания степеней окисления) Серная кислота. +2 П   олучение: 4FeS2 + 11 О2 =t= 2Fe2O3 + 8SO2 пирит Fe олучение: 4FeS2 + 11 О2 =t= 2Fe2O3 + 8SO2 пирит FeS S 2SO2 + O2 =t= 2SO3 (катализатор V2O5 ) -1 -1 SO3 + H2O = H2SO4 Серную кислоту, в отличие от других кислот, можно получить с массовой долей 100% - это олеум. В олеуме может растворяться еще некоторое количество серного ангидрида: H2SO4 + SO3 = H2S2O7 – пиросерная кислота, существует только в кристаллическом состоянии: H2S2O7 + H2O = 2H2SO4 Окислительные свойства серной кислоты. В молекуле серной кислоты два окислителя – H+ и S (+6). В разбавленной H2SO4 окислителем являются ионы водорода. Металлы, стоящие левее водорода, растворяются в разбавленной серной кислоте, при этом выделяется водород и образуется сульфат металла: H2SO4 разб. + Mg = H2 + MgSO4 H2SO4 разб. + Сu реакция не идет Концентрированная серная кислота – является сильным окислителем за счет S (+6), которая в ходе реакции восстанавливается до SO2, S, H2S (H2 не выделяется). HBr + H2SO4 конц. / Br2, SO2 / HJ + H2SO4 конц. / J2, H2S / C + H2SO4 конц. / CO2, SO2 / Металлы активные (Mg, Zn) + H2SO4 конц. / MgSO4, ZnSO4, H2S / Металлы малоактивные (Cu) + H2SO4 конц. / CuSO4, SO2 / Группа V A (ns2np3) Возможные степени окисления от (-3) до (+5). Соединения со степенью окисления элементов (-3). Аммиак NH3, ион аммония NH4+, нитриды, фосфиды, арсениды и т.д. Нитриды образуются при взаимодействии металлов и неметаллов с азотом при высоких температурах (хотя в обычных условиях азот инертен): Na3N, Mg3N2, AlN, BN, Si3N4, Ge3N4, S4N4, Cl3N и др. tпл 2000-30000С диэлектрики, полупроводники BN – твердый как алмаз Соединения с водородом. N  H3 - аммиак H3 - аммиакPH3 – фосфин очень ядовитые газы, некоторые с чесночным запахом; AsH3 – арсин устойчивость молекул уменьшается SbH3 - стибин BiH3 - висмутин Получение аммиака. 1) В промышленности: N2 + 3H2 = 2NH3, T 400-5000C, P = 3000 атм, катализатор сложного состава 2) В лабораторных условиях: любая соль аммония и щелочь NH4+ + OH- t NH3 + H2O Свойства аммиака. Хорошо растворяется в воде за счет образования водородных связей N 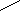  H3H2O H O H3H2O H O H N H H H В растворе - ассоциаты (NH3)х, например, H H N H H N H H Водный раствор аммиака проявляет свойства слабого основания: NH3 + H2O = NH4+ + OH- , Kосновности = 1,7510-5 Как любое основание, раствор аммиака взаимодействует с кислотами (реакция нейтрализации) и осаждает из растворов солей металлов труднорастворимые гидроксиды: NH3H2O + HCl = NH4Cl + H2O соли аммония хорошо раств. в воде AlCl3 + 3NH3H2O = Al(OH)3 + 3NH4Cl Гидроксиды некоторых металлов растворяются в избытке аммиака вследствие комплексообразования: Cu(OH)2 + 4NH3H2O = [Cu(NH3)4](OH)2 Аммиак и соли аммония проявляют восстановительные свойства за счет N (-3). Термическое разложение солей аммония. (NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O NH4NO2 = N2 + 2H2O ОВ - реакции NH4NO3 = N2O + 2H2O NH4Cl = NH3 + HCl Соединения с положительными степенями окисления. Степени окисления +1 +2 +3 +4 +5 N2O NO N2O3 NO2 N2O5 Веселящий газ азотистый ангидрид (бурый газ) азотный ангидрид H2N2O2 HNO2 2NO2+H2O= HNO2+HNO3 HNO3 Азотноватистая азотистая азотная Очень неустойчивая слабая сильная |
