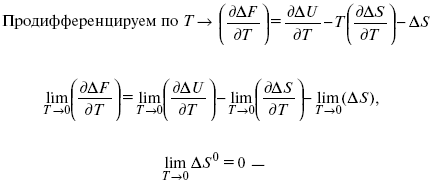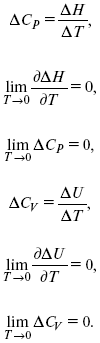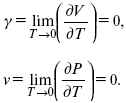|
|
Физическая химия конспект лекций. Конспект лекций Введение
ЛЕКЦИЯ № 15. Третий закон термодинамики
Понятие химического сродства. Известно, что многие вещества реагируют друг с другом легко и быстро, другие вещества реагируют с трудом, а третьи – не реагируют. Исходя из этого, вывели предположение, что между веществами существует какое-то химическое сродство.
1-е предположение – мерой химического сродства была скорость реакции.
2-е предположение – М. Бертло и Х. Томсон высказали, что мерой химического сродства является тепловой эффект.
3-е предположение – max А (Вант-Гофф). Если max А > 0, то химическое сродство между веществами существует, и реакция протекает слева направо. Если Аmax< 0 →, то химического сродства между веществами нет, и реакция протекает справа налево. Если Аmax= 0, то реакция протекает и туда, и обратно. На основе этого создавался третий закон термодинамики; М. Бертло и Х. Томсон, изучая поведение термодинамических систем при низких температурах, в 1906 г. обнаружили, что при низких температурах между веществами существует так называемое химическое сродство, которое они определили как тепловой эффект, ими было установ-лено, что тепловой эффект Qv – Аmax в конденсированных системах при низких температурах, где Аmax – максимальная работа.
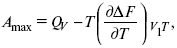
но на самом деле это не max, если исходить из уравнения Гельмгольца.
Для того, чтобы работа была max, она должна равняться тепловому эффекту Amax = Qv, надо вычислить:
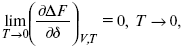
ΔF = Qv.
Аналитические выражения третьего закона термодинамики:
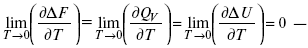
это изохорно-изотермические условия.
Если Аmax = QP, ΔG, Qp, ΔH – функции
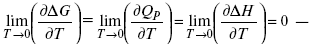
это изобарно-изотермические условия.
Тепловая теорема Нернста (третий закон термодинамики)(рис. 16)
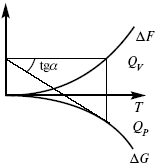
Рис. 16
Энергии (ΔU, ΔH, QV, QP, ΔF, ΔG), tgαугла наклона прямой – дает температурный коэффициент любой функции.
Для реакций, протекающих в конденсированных системах при приближении температуры к абсолютному нулю, кривые max работы и теплового эффекта соединяются и имеют одну большую касательную, параллельную оси температур.
Следствия из третьего закона термодинамики:
1. Свойства энтропии вблизи абсолютного нуля – постулат Планка:
ΔF = ΔU – TΔS.
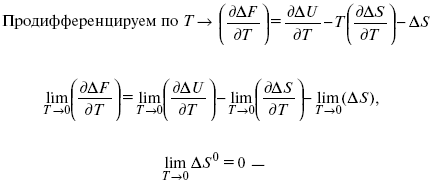
абсолютная энтропия.
2. Теплоемкость Сp, Сv
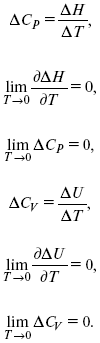
3. Коэффициент термического расширения тела и термического давления.
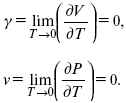
Идеальные газы не подчиняются третьему закону термодинамики, так как газ вблизи абсолютного нуля называется вырожденным.
CP– CV≠ R вблизи абсолютного нуля – уравнение Майера не работает.
4. О невозможности достижения абсолютного нуля. Третий закон термодинамики – приближенный закон. Используется для совершенного кристалла любого вещества.
Оглавление
Введение
ЛЕКЦИЯ № 1. Идеальный газ. Уравнение состояния реального газа
Элементы молекулярно-кинетической теории
Уравнение состояния идеального газа
Кинетическая теория газов
Уравнение состояния реального газа
ЛЕКЦИЯ № 2. Химическая термодинамика
Системы и их классификация
Термодинамические параметры. Термодинамические показатели. Баланс напряжений
Первый закон термодинамики. Калорические коэффициенты. Связь между функциями CP и Cv
Изопроцессы в термодинамике. Энергия Гельмгольца
Процессы. Второй закон термодинамики
Цикл Карно
Невозможность вечного двигателя
ЛЕКЦИЯ № 3. Растворы
Общая характеристика растворов
Концентрация и способы ее выражения
Растворимость газов в жидкостях
Растворы неэлектролитов. Закон Рауля и его следствия
Осмос
Фугитивность
Закон Генри
ЛЕКЦИЯ № 4. Катализ
История открытия явления катализа
Механизм каталитического взаимодействия. Виды катализаторов
ЛЕКЦИЯ № 5. Химическое равновесие
Понятие химического равновесия. Закон действующих масс
Уравнение изотермы химической реакции
Уравнения изохоры, изобары химической реакции
Расчет KP (метод Темкина-Шварцмана)
Расчет равновесного состава химического равновесия
ЛЕКЦИЯ № 6. Химическая кинетика
Понятие химической кинетики
Факторы, влияющие на скорость химической реакции
ЛЕКЦИЯ № 7. Коррозия металлов
Основные понятия и терминология
Классификация процессов коррозии металлов
Виды коррозионных разрушений
Методы защиты от коррозии
ЛЕКЦИЯ № 8. Физико-химический анализ
Суть физико-химического анализа
Однокомпонентные системы
Физико-химические методы анализа состава сплавов
ЛЕКЦИЯ № 9. Термохимия
Понятие термохимии
Закон Гесса
Закон Кирхгоффа. Интегральная форма уравнений Кирхгоффа
ЛЕКЦИЯ № 10. Гальванические элементы
Понятие гальванического элемента
Химические источники тока
Регенерация и утилизация ХИТов
ЛЕКЦИЯ № 11. Электрохимия
Понятие электрохимии
Электродные процессы
Катодные и анодные процессы в гальванотехнике
Современные направления в развитии термодинамической и прикладной электрохимии
ЛЕКЦИЯ № 12. Теоретическая электрохимия
Ассоциации в растворах электролитов. Понятие о теории сильных электролитов. Активность
Термодинамика растворов электролитов. Типы ДЭС
Современные подходы к описанию термодинамических свойств растворов электролитов
Термодинамические характеристики ионов в растворах электролитов
Неравновесные явления в ионной системе
Равновесие в системе жидкость – жидкость
Понятие ДЭС. Модельные представления о строении ДЭС на границе раздела фаз
Проводники первого и второго рода
Электроды сравнения
ЛЕКЦИЯ № 13. Электрохимическая кинетика
Основные кинетические характеристики и методы их расчетов
Уравнения электрохимической кинетики, пределы их применимости
Кинетические особенности электроосаждения металлов и сплавов
Влияние природы растворителя на скорость электрохимических реакций
Электроосмос
Электрокапиллярные кривые
Электрохимическое перенапряжение (перенапряжение переноса заряда)
Факторы, влияющие на перенапряжение водорода. Перенапряжение кислорода
ЛЕКЦИЯ № 14. Применение теоретической и прикладной электрохимии
Прикладная электрохимия
Электрохимия углерода
Биоэлектрохимия
Стохастические процессы и самоорганизующиеся системы
Исследование явления высокотемпературной сверхпроводимости в оксидах сложного состава
Моделирование электрохимических процессов
Метод гальваностатических кривых
ЛЕКЦИЯ № 15. Третий закон термодинамики
|
|
|
 Скачать 1.05 Mb.
Скачать 1.05 Mb.