Физическая химия конспект лекций. Конспект лекций Введение
 Скачать 1.05 Mb. Скачать 1.05 Mb.
|
|
Термодинамические показатели К термодинамическим показателям относятся те, которые можно рассчитать, используя законы термодинамики, исходя из условий, что система находится в равновесии. Напряжение разложения: где ΔG – изменение термодинамического потенциала; п – число электронов, участвующих в химической реакции; F– число Фарадея. где А – максимальная работа, которую способна совершить система в равновесном состоянии. где Q – тепловой эффект реакций; Up– термодинамическая характеристика электрохимической системы, которая мало зависит от условий электролиза. Отклонение системы – поляризация. Электрохимическая реакция является гетерогенным процессом, и ее скорость может лимитироваться одной из стадий: 1) подвод реагирующего вещества к границе раздела фаз; 2) разряд и ионизация; 3) отвод продуктов реакции. Поляризация, определяемая медленной стадией массопереноса – концентрационная. Если медленной стадией является стадия разряда ионизации, то поляризация называется перенапряжением. Природа и значение поляризации зависят от многих факторов: природа реагирующего вещества, материал электрода, состояние поверхности электрода, плотность тока, состав раствора и режим электролиза. Кинетический параметр – параметр, определяемый в реальных условиях электрохимической системы: ρ тока, ЕАКТИВ, коэффициент диффузии, коэффициент переноса α (на катод), β (на анод) – доля расхода на процесс: 1) сила тока в электрохимическом аппарате J= iKSед загрузки, A, Z, iK – в зависимости от электролита; 2) скорость электролиза – образование массы вещества за единицу времени где q – электрохимический эквивалент, v электролиза – J тока, если в 1 см2 – v – i тока. Баланс напряжений. Напряжение на электрохимическом аппарате определяет расход электроэнергии при электролизе. Баланс напряжений на электрохимическом аппарате складывается из следующих составляющих: UЭЛ-РЕ = Еa– Еk+ ηa+ ηk, + ΔUЭЛ-ТА+ ΔUДИФ+ ΔUКОН+ ΔUЭЛ, где Еa– обратимый потенциал анода, В; ЕК – обратимый потенциал катода, В; ηa– поляризация анода, В; ηk– поляризация катода, В; ΔUЭЛ-ТА– падение напряжения в электролите, В; ΔUДИФ– падения напряжения в диафрагме, В; ΔUКОН– падение напряжения в контактах, В; ΔUЭЛ – падение напряжения в электродах, В.  где i– плотность катодного тока; ρ0 – удельное сопротивление электролита, ρ0 повышается при вводе газа; l – расстояние между электродами; S – площадь сечения электролита; J – электропроводность. Коэффициент газонаполнения k = ρ/ρ0. Падение напряжения газозаполнения элемента определяется по формуле ΔUЭЛ-ТА = ilρ0k. Падение напряжения в диафрагме ΔUДИФ= JRДИАФ. Падение напряжения в контактах обычно принимают равным 5 – 10% от общего напряжения. Падение напряжения в электродах: Снижение напряжения на электрохимическом аппарате – оптимальное расстояние между электродами, максимальной электропроводностью.  Рис. 2 К энергетическим характеристикам относятся: 1) напряжение на электрохимическом аппарате; 2) отдача по напряжению. 3) отдача по емкости 4) отдача по энергии 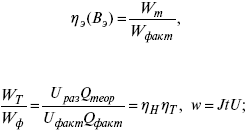 5) производительность электрохимического аппарата оценивается количеством продукта на одной затраченной энергии. Расход электрической энергии на 1 тонну произведенного продукта определяется так: 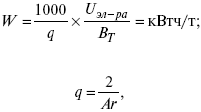 ВT – выход по току в долях единицы. Энергетический баланс – устанавливает соотношение между видом энергии, поступающей в электролизер, и энергией, уходящей из него, демонстрируя равенство статей прихода и расхода. Электроэнергия const тока, подводимая к электролизеру, составляет: WЭЛ= UJt. Общее уравнение энергетического баланса имеет следующий вид: Wэ+ ∑Qприхода = Wэл.хим.р-ии + Wтока + ∑Qрасх, где ∑Qприхода – тепловая энергия, поступающая в электролизер с электролитом и электродами за счет вторичных процессов; Wэл.хим.р-ии – энергия тока, затраченная на электрохимическую реакцию; Wтока – энергия тока, перешедшая в тепловую энергию; ∑Qрасх– тепловая энергия, уносимая электролитом, электродами, газами при испарении Н2О, излучении и конвекции. 3. Первый закон термодинамики. Калорические коэффициенты. Связь между функциями CP и Cv Формулировки первого закона термодинамики. 1. Общий запас энергии в изолированной системе остается постоянным. 2. Разные формы энергии переходят друг в друга в строго эквивалентных количествах. 3. Невозможно построить вечный двигатель первого рода, который бы давал механическую энергию, не затрачивая на это определенное количество молекулярной энергии. 4. Количество теплоты, подводимое к системе, расходуется на изменение Uвн и совершаемую работу. 5. Uвн– функция состояния, т. е. она не зависит от пути процесса, а зависит от начального и конечного состояния системы. Доказательство: Пусть ТДС рассматривается при двух параметрах давления и объема, имеется два состояния системы I и II. Нужно перевести систему из состояния I в состояние II либо по пути А, либо по пути В (рис. 3). 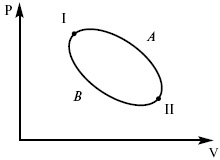 Рис. 3 Предположим, что по пути А изменение энергии будет ΔUA, а по пути В – ΔUB. Внутренняя энергия зависит от пути процесса ΔUA = ΔUB, ΔUA – ΔUB ≠ 0. Согласно пункту 1 из формулировок первого закона термодинамики, общий запас энергии в изолированной системе остается постоянным ΔUA = ΔUB , Uвн – функция состояния не зависит от пути процесса, а зависит от состояния системы I или II. Uвн – функция состояния, является полным дифференциалом Q = ΔU + А – интегральная форма уравнения первого закона термодинамики. δQ = dU + δA– для бесконечно малого процесса, δA– сумма всех элементарных работ. Калорические коэффициенты 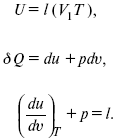 Теплота изотермического расширения: 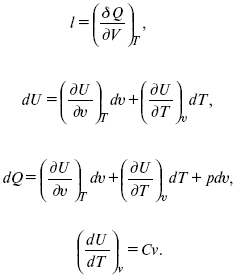 Уравнение первого закона термодинамики в калорических коэффициентах δQ = ldv + CvdT, где l– коэффициент изотермического расширения; Сv– теплоемкость при постоянном объеме. 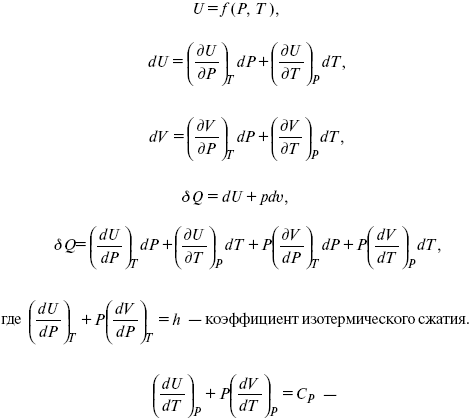 теплоемкость при const давлении, δQ = hdp + СpdT, δQ = χdP + ψpdv. Связь между функциями CPи Cv δQ = hdp + СpdT = ldv + CvdT, 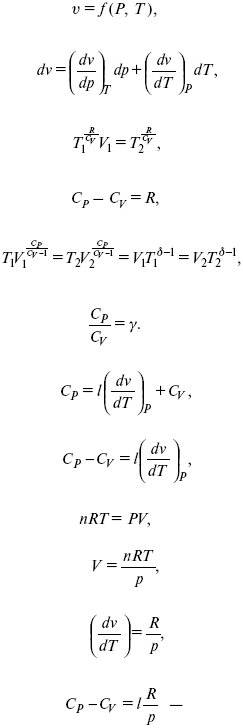 для реального газа. Для идеального газа l= р Ср– СV= R, к = (δQ/дv)ρ– теплота изохорного расширения; m = (δQ/дP)v– теплота изобарного сжатия. 4. Изопроцессы в термодинамике. Энергия Гельмгольца 1. Изотермический – Т= const 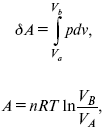 так как 2. Изохорный – V = const δА = 0, δА = pdυ = 0, δQ = dU + pdυ, δQ = CvdT. 3. Изобарный – P = const δА = pdυ, A = pV2 – pV1. 4. Адиабатический – δQ = 0 1) δA = –dU, A = –CV(T2 – T1), T2 > T1; 2) pdδ= –CvdT, 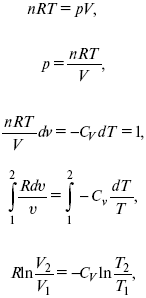 действие, обратное логарифму – потенцирование 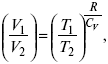 Уравнение первого закона термодинамики в калорических коэффициентах δQ = ldυ + CVdT, где l– коэффициент изотермического расширения; CV – теплоемкость при постоянном объеме.  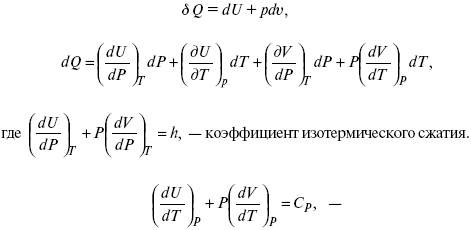 теплоемкость при const давлении, δQ = hdP + CpdT , δQ = χdP + ψdυ. Связь между функциями CPи CV 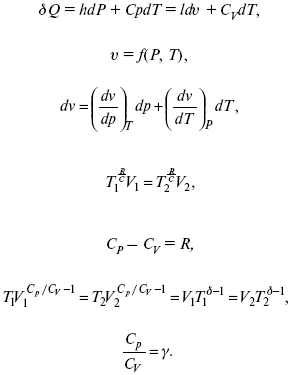 5. Процессы. Второй закон термодинамики Второй закон термодинамики, в отличие от первого закона термодинамики, изучает все процессы, которые протекают в природе, и эти процессы можно классифицировать следующим образом. Процессы бывают самопроизвольные, несамопроизвольные, равновесные, неравновесные. Самопроизвольные процессы делятся на обратимые и необратимые. Второй закон термодинамики называют законом направленности процесса в изолированной системе (закон роста S). Слово «энтропия» создано в 1865 г. Р. Ю. Э. Клаузиусом – «тропе» с греческого означает превращение. В 1909 г. профессор П. Ауербах назвал царицей всех функций внутреннюю энергию, а S – тенью этой царицы. Энтропия – мера неупорядоченности системы. Обратимые и необратимые процессы Необратимые процессы идут без затраты работы, протекают самопроизвольно лишь в одном направлении, это такие изменения состояния в изолированной системе, когда при обращении процессов свойства всей системы меняются. К ним относятся: 1) теплопроводность при конечной разности температур; 2) расширение газа при конечной разности давлений; 3) диффузия при конечной разности концентраций. Обратимыми процессами в изолированной системе называются такие процессы, которые можно обратить без каких-либо изменений в свойствах этой системы. Обратимые: механические процессы в системе, где отсутствует трение (идеальная жидкость, ее движение, незатухающие колебания маятника в вакууме, незатухающие электромагнитные колебания и распространение электромагнитных волн там, где нет поглощения), которые могут возвратиться в начальное состояние. Самопроизвольные – процессы, которые идут сами собой, на них не затрачивается работа, они сами могут производить ее (движение камней в горах, Na с большой скоростью движется по поверхности, так как идет выделение водорода проверить.). Несамопроизвольные – процессы, которые не могут идти сами собой, на них затрачивается работа. Равновесие делится на устойчивое, неустойчивое и безразличное. Постулаты второго закона термодинамики. 1. Постулат Клаузиуса – не может быть перехода тепла от менее нагретого к более нагретому телу. 2. Постулат Томсона – теплота наиболее холодного тела не может служить источником работы. Теорема Карно – Клаузиуса: все обратимые машины, совершающие цикл Карно с участием одного и того же нагревателя и одного и того же холодильника, имеют одинаковый коэффициент полезного действия, независимо от рода рабочего тела. Аналитические выражения второго закона термодинамики. 1. Классическое уравнение второго закона термодинамики 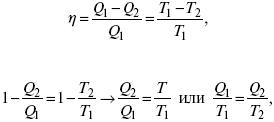 Q1 /Т1– приведенное тепло нагревателя; Q2 / T2 – приведенное тепло холодильника; Q1 /Т1= Q2 /Т2 – равенство приведенных теплот нагревателя и холодильника. Это второе уравнение термодинамики. 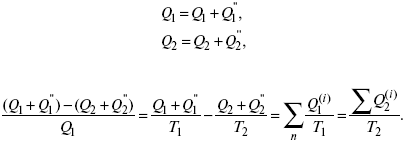 Если делим адиабатами на множество циклов Карно, то получим 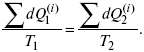 Это третье уравнение второго закона термодинамики для бесконечно малого цикла Карно. Если процесс является конечным, то Это четвертое уравнение второго закона термодинамики Если процесс является замкнутым, то Это пятое уравнение второго закона термодинамики для обратимого процесса. Интеграл по замкнутому контуру – интеграл Клаузиуса. При необратимом процессе: Это шестое уравнение второго закона термодинамики, или уравнение Клаузиуса, для обратимого процесса равно нулю, для необратимого процесса оно меньше 0, но иногда может быть больше 0. это седьмое уравнение второго закона термодинамики. Второй закон термодинамики – закон роста S. S = klnW. Действие, обратное логарифму – потенцирование: 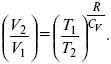 Первый закон термодинамики определяется постоянством функции U в изолированной системе. Найдем функцию, выражающую содержание второго закона, а именно, одностороннюю направленность протекающих в изолированной системе процессов. Изменение искомой функции должно иметь для всех реальных, т. е. необратимых процессов, протекающих в изолированных системах, один и тот же знак. Второй закон термодинамики в приложении к некруговым необратимым процессам должен выражатся неравенством. Вспомним Цикл Карно. Так как любой цикл можно заменить бесконечно большим числом бесконечно малых циклов Карно, то выражение: справедливо для любого обратимого цикла. Считая на каждом элементарном участке теплообмена Т = const, найдем, что: и для всего цикла 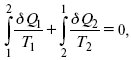 или |
