Физическая химия конспект лекций. Конспект лекций Введение
 Скачать 1.05 Mb. Скачать 1.05 Mb.
|
|
Березовчук А.В. Физическая химия: конспект лекций Введение Физическая химия – наука, объясняющая химические явления и устанавливающая их закономерности на основе общих принципов физики. Общая задача физической химии – предсказание временного хода химического процесса и конечного результата на основании данных о строении и свойствах молекул. Термин «физическая химия» предложен М. В. Ломоносовым. Им же был прочитан первый курс по собственной книге «Введение в физическую химию». В 1860 г. Н. Н. Бекетов впервые вводит физическую химию в качестве особой учебной дисциплины, читает курс лекций в Харьковском университете, создает кафедру физической химии. В 1887 г. В. Оствальд в Лейпцигском университете организует кафедру физической химии. Он же выпускает первое периодическое издание по физической химии. Годом ранее И. А. Каблуков читает курс в Московском университете. К концу XIX в. определились три основных раздела физической химии: химическая термодинамика, химическая кинетика и электрохимия. В настоящее время физическая химия полностью сформировалась как наука, включающая в себя химическую термодинамику (термохимию, фазовое равновесие), дополняющую химическую кинетику катализом, а также создала разнообразные физико-химические методы анализа. ЛЕКЦИЯ № 1. Идеальный газ. Уравнение состояния реального газа 1. Элементы молекулярно-кинетической теории Науке известно четыре вида агрегатных состояний вещества: твердое тело, жидкость, газ, плазма. Переход вещества из одного состояния в другое называют фазовым переходом. Вода, как известно, существует в трех агрегатных состояниях: в жидком (вода), твердом (лед), газообразном (пар). Это различие между тремя агрегатными состояниями определяется межмолекулярным взаимодействием и степенью сближения молекул. Газ – агрегатное состояние вещества, в котором молекулы движутся хаотически, расположены на большом расстоянии друг от друга. В твердых телах расстояния между частицами малы, сила притяжения соответствует силе отталкивания. Жидкость – агрегатное состояние, промежуточное между твердым и газообразным. В жидкости частицы расположены близко одна к другой и могут перемещаться друг относительно друга; жидкость, как и газ, не имеет определенной формы. Каждое из этих состояний можно описать набором некоторых параметров: например, состояние газа достаточно полно описывается тремя параметрами: объем, давление, температура. Комбинация трех параметров, достаточно легко измеряемых, уже с середины ХVII века, когда были созданы барометры и термометры, хорошо описывает состояние газовой системы. Именно поэтому изучение сложных многоатомных систем началось с газов. У истоков наук химии и физики стоял Р. Бойль. 2. Уравнение состояния идеального газа Изучение эмпирических газовых законов (Р. Бойль, Ж. Гей-Люссак) постепенно привело к представлению об идеальном газе, поскольку обнаружилось, что давление данной массы любого газа при постоянной температуре обратно пропорционально объему, занимаемому этим газом, и термические коэффициенты давления и объема с высокой точностью совпадают для различных газов, составляя, по современным данным, 1/273 град–1. Придумав способ графического представления состояния газа в координатах «давление – объем», Б. Клапейрон получил объединенный газовый закон, связывающий все три параметра: PV = BT, где коэффициент В зависит от вида газа и его массы. Только через сорок лет Д. И. Менделеев придал этому уравнению более простой вид, записав его не для массы, а для единицы количества вещества, т. е. 1 кмоля. PV = RT, (1) где R – универсальная газовая постоянная. Физический смысл универсальной газовой постоянной. R – работа расширения 1 кмоля идеального газа при нагревании на один градус, если давление не меняется. Для того, чтобы понять физический смысл R, представим себе, что газ находится в сосуде при постоянном давлении, и мы повысим его температуру на ΔT, тогда PV1 = RT1, (2) и PV2 = RT2. (3) Вычитая из (3) уравнение (2), получим P(V2 – V1) = R(T2 – T1). Если правая часть уравнения равна единице, т. е. мы нагрели газ на один градус, тогда R = PΔV Поскольку P = F/S, а ΔV равно площади сосуда S, умноженной на высоту подъема его поршня Δh, имеем  Очевидно, что справа получим выражение для работы, и это подтверждает физический смысл газовой постоянной. 3. Кинетическая теория газов Очень плодотворным в середине XIX века оказалось представление о молекулярном строении вещества. Когда была принята гипотеза А. Авогадро о том, что в киломоле любого вещества содержится одно и то же количество структурных единиц: 6,02 x 1026 кмоля = 6,02 x 1023 моля, поскольку молярная масса воды M(H2O) = 18 кг/кмоль , следовательно, в 18 литрах воды находится столько же молекул, сколько в 22,4 м3 водяного пара. Это позволяет легко понять, что расстояние между молекулами газообразной воды (пара) значительно больше, в среднем на один порядок, чем в жидкой воде. Можно предположить, что это выполняется для любого вещества. Считая, что в газах молекулы движутся хаотически, можно вывести так называемое основное уравнение кинетической теории:  где Na – 6,02 x 1026 кмоль = 6,02 x 1023 моль – число Авогадро; VM– молекулярный объем = 22,4 м3; m – масса одной молекулы; v – скорость молекулы. Преобразуем уравнение (4):  где Ek– энергия одной молекулы. Видно, что справа стоит полная кинетическая энергия всех молекул. С другой стороны, сравнивая с уравнением Менделеева – Клапейрона, видим, что это произведение равно RT. Это позволяет выразить среднюю кинетическую энергию молекулы газа: где к = R / Na – постоянная Больцмана, равная 1,38 ґ 10–23 кДж/кмоль. Зная кинетическую энергию молекулы, можно рассчитать ее среднюю скорость 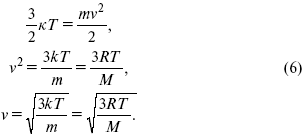 Около 1860 г. Д. К. Максвелл вывел функцию, описывающую распределение молекул газа по скоростям. Эта функция имеет на графике вид характерной кривой с максимумом около наиболее вероятной скорости примерно 500 м/с. Важно заметить, что существуют молекулы со скоростями, превышающими этот максимум. С другой стороны, уравнение (6) позволяет сделать вывод об увеличении доли молекул с большими скоростями при нагревании газа. Спустя почти 60 лет гениальная догадка Д. К. Максвелла была подтверждена в опытах О. Штерна. 4. Уравнение состояния реального газа Исследования показали, что уравнение Менделеева – Клапейрона не очень точно выполняется при исследовании разных газов. Голландский физик Я. Д. Ван-дер-Ваальс первым понял причины этих отклонений: одна из них состоит в том, что вследствие огромного числа молекул, их собственный объем в целом сравним с объемом сосуда, в котором находится газ. С другой стороны, существование взаимодействия между молекулами газа слегка искажает показание манометров, с помощью которых обычно измеряют давление газа. В итоге Ван-дер-Ваальс получил уравнение следующего вида: где а, в – постоянные величины для различных газов. Недостаток этого уравнения в том, что а и в должны быть измерены для каждого газа эмпирически. Преимущество в том, что оно включает область перехода газа в жидкую фазу при высоких давлениях и низких температурах. Осознание этого сделало возможным получать любой газ в жидкой фазе. ЛЕКЦИЯ № 2. Химическая термодинамика Химическая термодинамика – наука, изучающая условия устойчивости систем и законы. Термодинамика – наука о макросистемах. Она позволяет apriori определить принципиальную невозможность того или иного процесса. Физические и химические явления в термодинамике исследуются с помощью основных законов термодинамики. Состояние рассматриваемых объектов в термодинамике определяется непосредственно измеряемыми величинами, характеризующими вещества; механизм процесса и сама структура вещества не рассматриваются. В химической термодинамике изучается применение законов термодинамики к химическим и физико-химическим явлениям. В ней рассматриваются главным образом: 1) тепловые балансы процессов, включая тепловые эффекты физических и химических процессов; 2) фазовые равновесия для индивидуальных веществ и смесей; 3) химическое равновесие. Тепловые балансы составляют на основе первого закона термодинамики. На основе второго и третьего законов проводят анализ фазового и химического равновесий. Изучение законов, которые описывают химические и физические равновесия, имеет огромное значение в химической термодинамике. Значение их позволяет решать задачи для производственной и научно-исследовательской работы. Рассмотрим основные задачи: 1) определение условий, при которых данный процесс становится возможным; 2) нахождение пределов устойчивости изучаемых веществ в тех или иных условиях; 3) устранение побочных реакций; 4) выбор оптимального режима процесса (давления, концентрации реагентов и т. д.). 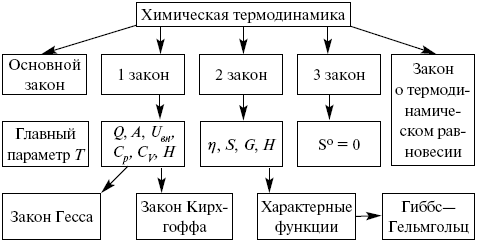 Основные понятия и определения 1. Системы и их классификация Система – тело или несколько тел, находящихся во взаимодействии между собой (диффузия, теплообмен, химическая реакция) и отделенных от окружающей среды. Состояние системы в термодинамике определяется с помощью набора переменных, называемых параметрами состояния и характеризующих термодинамическое состояние при равновесии. Всякое изменение, происходящее в системе и связанное с изменением хотя бы одного из параметров состояния, называется термодинамическим процессом. Системы имеют определенные границы, отделяющие их от внешней среды, и могут быть гомогенными или гетерогенными. Гомогенная система – система, в которой все макроскопические свойства в любых ее частях имеют одно и то же значение или непрерывно меняются от точки к точке. Примеры: ненасыщенные растворы, пар, газовые смеси. Составленные части гомогенной системы не могут быть выделены из нее с помощью простых механических приемов (фильтрования, отбора и т. д.). Гетерогенная система – система, составные части которой отделены друг от друга видимыми поверхностями раздела, на которых происходят резкие скачкообразные изменения какого-либо свойства. Примеры: насыщенный раствор какой-либо соли, находящийся в равновесии с кристаллами этой соли, две несмешивающиеся жидкости и т. д.). Составные части таких систем могут быть отделены друг от друга с помощью механических операций. Совокупность тел, энергетически взаимодействующих между собой и с другими телами, обменивающихся с ними веществом, называется термодинамической системой. Системы делят на изолированные (это те системы, которые не обмениваются энергией и веществом с другими системами), открытые (те системы, которые обмениваются с окружающей средой и веществом, и энергией), закрытые (системы, в которых есть только обмен энергией). 2. Термодинамические параметры. Термодинамические показатели. Баланс напряжений Любая ТДС характеризуется параметрами: температура, давление, плотность, концентрация, мольный объем. В любой ТДС обязательно протекают процессы, и они могут быть равновесными, неравновесными, обратимыми и необратимыми. Если в ТДС определенное свойство системы не будет изменяться во времени, т. е. оно будет одинаковым во всех точках объема, то такие процессы – равновесные. В неравновесных процессах свойство системы будет изменяться во времени без воздействия окружающей среды. Обратимые процессы – процессы, в которых система возвращается в первоначальное состояние. Необратимые – когда система не возвращается в первоначальное состояние. Функции могут зависеть от пути процесса. Функции, которые зависят от начального и конечного состояний системы и не зависят от пути процесса, – функции состояния; внутренняя энергия, энтальпия, энтропия и другие – полные дифференциалы. Функции, которые зависят от начального и конечного состояний системы и зависят от пути процесса, не являются функциями состояния и не являются полными дифференциалами Q, A. Функции можно разделить на две группы: экстенсивные и интенсивные. Экстенсивное свойство системы прямо пропорционально массе системы и обладает аддитивностью (можно складывать): V, H, Uвн, S, G, F. Интенсивное свойство системы не зависит от массы системы и не обладает свойством аддитивности: Q, A, T, P. Давление – параметр состояния, определяемый силой, действующей в теле на единицу площади поверхности по нормали к ней. Оно характеризует взаимодействие системы с внешней средой. Температура определяет меру интенсивности теплового движения молекул. Значение градуса температуры и начало ее отсчета произвольны. В качестве эталона можно было бы выбрать не воду, а любое другое вещество (лишь бы его свойства однозначно изменялись с температурой, были воспроизводимы и легко поддавались измерению). Такая произвольность исчезает, если пользоваться термодинамической (абсолютной) шкалой температур, основанной на втором законе термодинамики. Начальной точкой этой универсальной шкалы является значение предельно низкой температуры – абсолютный нуль, равный 273,15 оС. Уравнение состояния Уравнение, связывающее термодинамические параметры системы в равновесном состоянии, – уравнение состояния. Вследствие взаимосвязи между свойствами системы для определения ее состояния достаточно указать лишь некоторое число свойств. Так, состояние газа можно считать заданным, если указаны два параметра, например, температура и объем, а значение третьего параметра – давления – можно определить из уравнения состояния P = f(V, T ), φ(P, V, T ) = 0. Графически это уравнение является уравнением поверхности, построенной на трех взаимно перпендикулярных осях, каждая из которых соответствует одному термодинамическому параметру. Таким образом, термодинамическая поверхность – геометрическое место точек, изображающих равновесные состояния системы в функциях от термодинамических параметров. Понятие теплоты Пусть дан изолированный сосуд, который разделен полупроницаемой перегородкой (рис. 1). В первой части сосуда температура Т1, во второй – температура Т2; Т1 > Т2.  Рис. 1 Молекулы, ударяясь о полупроницаемую перегородку, будут отдавать часть энергии, а другие – принимать ее, без механического перемещения. Форма передачи энергии от одной части системы к другой называется теплотой Q. Мера переданной энергии от одной системы к другой – количество теплоты. Q не является функцией состояния и не является полным дифференциалом ΔQ. Понятие работы Работа процесса – это энергия, передаваемая одним телом другому при их взаимодействии, не зависящая от температуры этих тел и не связанная с переносом вещества от одного тела к другому. Обмен энергией между системой и внешней средой обуславливается работой, совершаемой этой системой: А = PdV. Работа (А) определяется суммой произведений сил, действующих на систему сил (давления и изменения объема). Работа не является полным дифференциалом, ΔА. Если протекают равновесные процессы, то работа равновесного процесса будет максимальной величиной, по сравнению с неравновесным процессом ΔAравн > ΔAнеравн. Если телу сообщают определенное количество теплоты, то это значит, что тело надо нагреть, а охладить систему – произвести действие, обратное нагреванию, т. е. отвести энергию. Работа и теплота являются количественными характеристиками двух форм обмена энергией между системой и окружающей средой. Понятие внутренней энергии Внутренняя энергия системы Uвнскладывается из энергии поступательного и вращательного движения молекул, энергии внутримолекулярного колебательного движений атомов и атомных групп, энергии, заключающейся в ядрах атомов, энергии межмолекулярного взаимодействия. Uвнявляется полным дифференциалом, она не зависит от пути процесса, а зависит от начального и конечного состояний системы, она однозначно непрерывна и конечна. Абсолютное значение Uвнопределить нельзя, можно определить только ее изменения. Q и А качественно и количественно характеризуют форму передачи энергии, взаимосвязь между Q, A, Uвнустанавливает первый закон термодинамики. |
