Физическая химия конспект лекций. Конспект лекций Введение
 Скачать 1.05 Mb. Скачать 1.05 Mb.
|
|
Катализ – изменение скорости химической реакции в присутствии катализаторов. Самые простые научные сведения о катализе были известны уже к началу XIX в. Знаменитый русский химик, академик К. С. Кирхгоф, открыл в 1811 г. каталитическое превращение крахмала в сахар под действием разбавленных кислот. Эта реакция лежит в основе крахмалопаточного производства. А в 1814 г. он открыл фермент – амилазу, и им же было установлено, что эту реакцию может катализировать диастаза из ячменного солода, чем было положено начало изучению биологических катализаторов – ферментов. Четыре года спустя Г. Деви открыл способность паров спирта и эфира окисляться кислородом на платине. В 1822 г. И. Деберейнер установил, что при обычной температуре можно соединять водород и кислород на платине. Вскоре эти и многие другие открытия привели к установлению существования явлений, в 1833 г. названных Э. Митчерлихом контактными, а в 1835 г. И. Берцелиусом – каталитическими. В органической химии успехи катализа связаны с развитием теории строения органических соединений Бутлерова. Катализ в промышленности и живой природе Большую роль сыграли каталитические методы в развитии процессов органического синтеза. Следующим направлением использования катализатора является каталитическая очистка технологических газов, а также очистка сточных вод, загрязненных органическими веществами. В живой природе вся система управления жизненными процессами в организмах основана на катализе. Такие процессы, как брожение, дыхание, пищеварение, синтез белков и других соединений и т. п. осуществляется с помощью ферментов, называемых энзимами. 2. Механизм каталитического взаимодействия. Виды катализаторов Различают гомогенный и гетерогенный катализ. При однородном (гомогенном) катализе катализатор и реагенты образуют однородную систему. Пример: представляют однородную газовую фазу. Границы раздела между катализатором и реагентом отсутствуют. При гетерогенном – катализатор и реагирующие вещества находятся в разных фазах и отделены границей раздела. При этом катализатором является твердое тело, а реагенты находятся либо в газовой, либо в жидкой фазе. Пример: N2(г) + 3H2(г) → 2NH3(г). Существует еще микрогетерогенный катализ, при котором катализатор находится в коллоидном или в высокомолекулярном состоянии. Пример – биокаталитический процесс, катализаторами служат ферменты (энзимы). Есть еще автокаталитические процессы, когда катализатор – продукт самой реакции. Рассмотрим механизм каталитического взаимодействия в общих чертах. Пусть дана некая химическая реакция А + В = АВ. Без катализатора она протекает медленно. Как же она будет протекать с катализатором, по какой схеме? Ответим на данные вопросы. Катализатор взаимодействует с одним из реагентов, образуя промежуточные соединения по реакции А + К = АК. Затем уже это соединение реагирует с другим исходным веществом, при этом образуется продукт реакции АВ и выделяется еще катализатор. Напомним, катализатор – вещество, активно участ-вующее в химической реакции, но регенерирующееся (восстанав-ливающееся) после ее завершения, что мы и наблюдаем в ходе реакции АК + В = АВ + К. Главное преимущество катализатора в том, что он уменьшает энергию активации, увеличивая скорость реакции, но не влияет на термодинамические величины: ΔU, ΔH, ΔS, ΔG, ΔF. ЛЕКЦИЯ № 5. Химическое равновесие 1. Понятие химического равновесия. Закон действующих масс При протекании химической реакции через некоторое время устанавливается химическое равновесие. Существует два признака химического равновесия: кинетический, термодинамический. В кинетическом – υпр = υобр, в термодинамическом – характеризует химическую реакцию при условиях P, t – const (ΔG = 0); при условиях V, Т – const (ΔF = 0). Химический потенциал – функция, которая характеризует состояние i-го компонента при определенных внешних условиях. 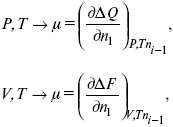 где n1 – число молей i-го компонента. Если к бесконечно большому количеству раствора прибавить определенное количество какого-нибудь компонента, то химический потенциал системы определяется изменением изобарного потенциала при изобарных условиях или изменением изохорного потенциала при изохорных условиях. Химический потенциал зависит от концентрации данного компонента μi = μ0 + RTLnPi– (для идеального газа), где Рi– парциальное давление – вклад каждого компонента в общее давление или давление, которое компонент имел бы, если бы находился в смеси. Парциальное давление – элементарная функция (можно складывать). Пример (O2, N2, H2) – их общее давление μi= μ0+ RTLnCi – (для раствора), μ0– значение химического потенциала при стандартных условиях. Химический потенциал характеризует способность данного компонента выходить из данной фазы путем испарения, растворения, кристаллизации и т. д. Переход этот происходит произвольно. 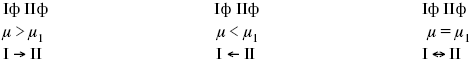 В результате химического равновесия скорость прямой реакции уменьшается, а скорость обратной реакции увеличивается. Концентрации, которые соответствуют химическому равновесию, называются равновесными концентрациями. Связь между равновесными концентрациями устанавливается законом действующих масс (ЗДМ). Этот закон в 1867 г. вывели К. М. Гульберг и П. Вааге. Кинетический вывод ЗДМ 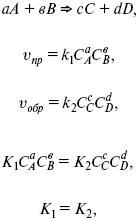 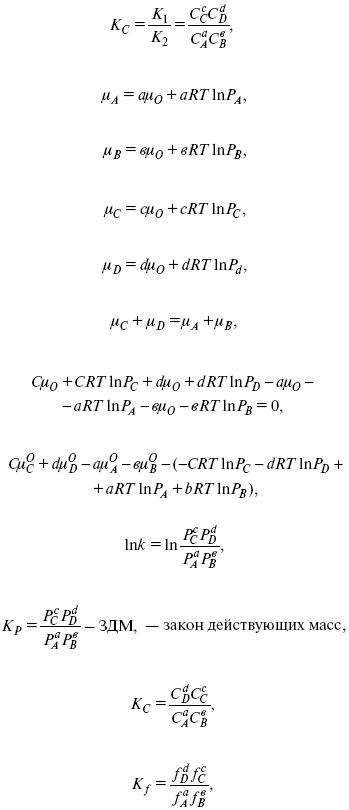 f – фугитивность – парциальное давление для реальных газов. Возникает вопрос, будут ли равняться Кpи Кс. Кpи Кc– отличаются на RT ∑vi в сумме стехиометрических коэффициентов. Связь между Кpи Кс 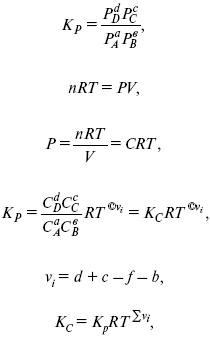 если ∑vi = 0, то Kp = Kc. ∑vi = 1 + 1 – 1 – 1 =0 – когда стехиометрический коэффициент = 1. 2. Уравнение изотермы химической реакции Если реакция протекает обратимо, то ΔG= 0. Если реакция протекает необратимо, то ΔG≤ 0 и можно рассчитать изменение ΔG. 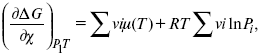 где χ – пробег реакции – величина, которая показывает, сколько молей изменилось в ходе реакции. I сп – характеризует равновесное и неравновесное состояние реакции, II сп – характеризует только неравновесные состояния. Если дχ = 1, то 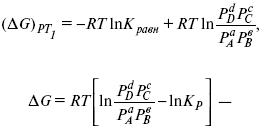 это уравнение изотермы химической реакции. 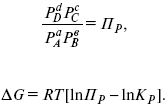 С помощью уравнения изотермы химической реакции можно судить о направлении протекания реакции. 1) Пp< Кp, ΔG < 0, слева направо; 2) Пp> Кp, ΔG > 0, справа налево; 3) Пp= Кp, ΔG = 0, химическое равновесие. 3. Уравнения изохоры, изобары химической реакции Зависимость К от температуры 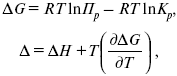 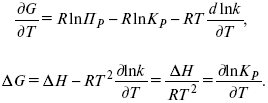 Уравнение изобары: Уравнение изохоры: По ним судят о направлении протекания реакции: 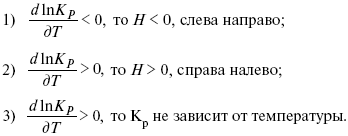 4. Расчет KP (метод Темкина-Шварцмана) 1-й способ: 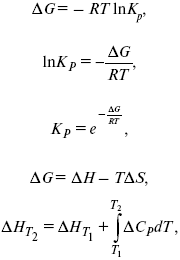 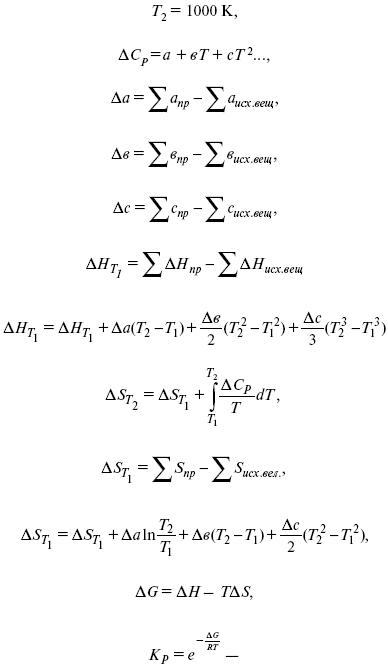 термодинамический метод расчета Kp. 2-й способ: 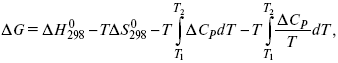 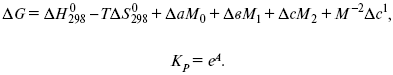 Пример. Расчет Kpдля реакции PbS04 распадается на РbО и S03. 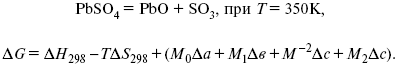 Результаты вычислений занесены в таблицу 2. Таблица 2 Результаты вычислений 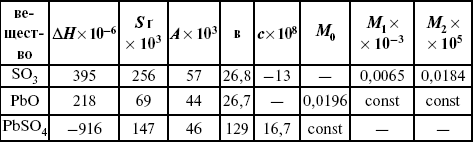 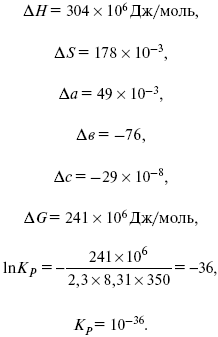 5. Расчет равновесного состава химического равновесия Равновесный состав можно рассчитать только для газовой системы 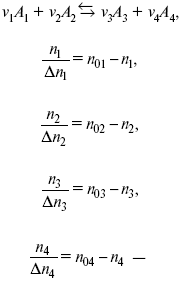 равновесная концентрация. Исходная концентрация всех компонентов 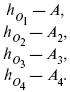 Изменение каждого компонента по числу молей (или стехиометрическому коэффициенту): ξγ– (пробег реакции) – химическая переменная. Она показывает изменение количества вещества по числу молей. Если реакция не началась, то ξγ = 0. Если количество исходных веществ превратилось в такое же количество продуктов реакции, то ξγ = 1. 3H2 + N2 = 2NH3; ξγ= 1, 1,5H2 + 0,5N2 = NH3; ξγ= 0,5, v1 А 1 + v2А2 = v3А3+ v4А4, – газовая реакция. Рассчитать равновесный состав по третьему компоненту при условии, что А = а моль/л; В = в моль/л. 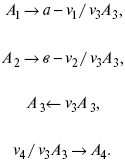 Рассчитываем по 4 компоненту: 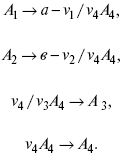 Задача. Газообразные вещества реагируют по уравнению: Общее давление в газовой смеси – Робщ, общий объем – Vоб . Рассчитать KPи Kс. Найти парциальное давление каждого компонента. Вещества А и В превращаются в С в количестве Х. Исходные вещества А= 2 моль, В= 1 моль. Для того, чтобы найти парциальное давление, мы должны Роб умножить на мольную долю. Мольная доля определяется отношением числа молей каждого компонента, отнесенного к общему числу молей всех компонентов. 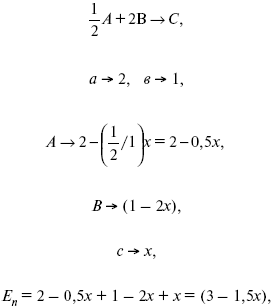 где En– общее число молей, участвующих в этой газовой смеси. где NA – мольная доля А. 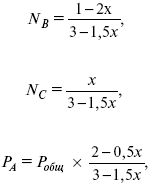 где РА – парциальное давление. 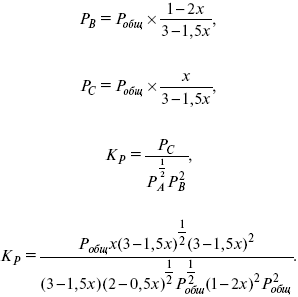 Расчет Kc: Δv= l – 0,5 – 2 = – 1,5, где Δv– изменение количества молей. 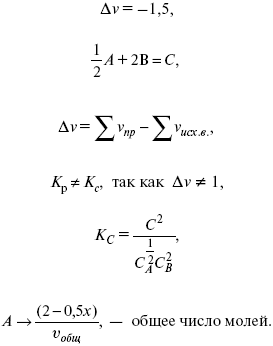 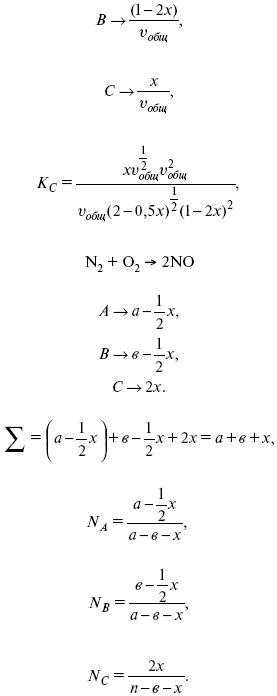 ЛЕКЦИЯ № 6. Химическая кинетика 1. Понятие химической кинетики Кинетика – наука о скоростях химических реакций. Скорость химической реакции – число элементарных актов химического взаимодействия, протекающих в единицу времени в единицу объема (гомогенные) или на единице поверхности (гетерогенные). Истинная скорость реакции: 2. Факторы, влияющие на скорость химической реакции Для гомогенных, гетерогенных реакций: 1) концентрация реагирующих веществ; 2) температура; 3) катализатор; 4) ингибитор. Только для гетерогенных: 1) скорость подвода реагирующих веществ к поверхности раздела фаз; 2) площадь поверхности. Главный фактор – природа реагирующих веществ – характер связи между атомами в молекулах реагентов. Пример: NO2 – оксид азота (IV) – лисий хвост, СО – угарный газ, монооксид углерода. Если их окислить кислородом, то в первом случае реакция пойдет мгновенно, стоит приоткрыть пробку сосуда, во втором случае реакция растянута во времени. Концентрация реагирующих веществ будет рассмотрена ниже. Пример: 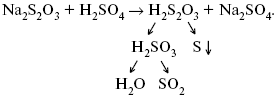 Голубая опалесценция свидетельствует о моменте выпадения серы, чем выше концентрация, тем скорость выше. 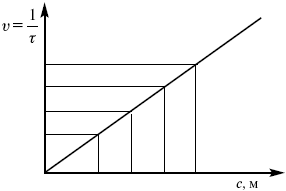 Рис. 10 Чем больше концентрации Na2S2O3, тем меньше времени идет реакция. На графике (рис. 10) изображена прямо пропорциональная зависимость. Количественная зависимость скорости реакции от концент-рации реагирующих веществ выражается ЗДМ (законом действующих масс), который гласит: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. Итак, основным законом кинетики является установленный опытным путем закон: скорость реакции пропорциональна концентрации реагирующих веществ, пример: (т.е. для реакции) 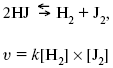 Для этой реакции Н2 + J2 = 2НJ – скорость можно выразить через изменение концентрации любого из веществ. Если реакция протекает слева направо, то концентрация Н2 и J2 будет уменьшаться, концентрация НJ – увеличиваться по ходу реакции. Для мгновенной скорости реакций можно записать выражение: квадратными скобками обозначается концентрация. Физический смысл k– молекулы находятся в непрерывном движении, сталкиваются, разлетаются, ударяются о стенки сосуда. Для того, чтобы произошла химическая реакция образования НJ, молекулам Н2 и J2 надо столкнуться. Число же таких столкновений будет тем больше, чем больше молекул H2 и J2 содержится в объеме, т. е. тем больше будут величины [Н2] и [J2]. Но молекулы движутся с разными скоростями, и суммарная кинетическая энергия двух сталкивающихся молекул будет различной. Если столкнутся самые быстрые молекулы Н2 и J2, энергия их может быть такой большой, что молекулы разобьются на атомы йода и водорода, разлетающиеся и взаимодействующие затем с другими молекулами Н2 + J2 →2H+2J, далее будет H + J2 →HJ + J. Если энергия сталкивающихся молекул меньше, но достаточно велика для ослабления связей H – H и J – J, произойдет реакция образования йодоводорода: У большинства же сталкивающихся молекул энергия меньше необходимой для ослабления связей в Н2 и J2. Такие молекулы «тихо» столкнутся и также «тихо» разойдутся, оставшись тем, чем они были, Н2 и J2. Таким образом, не все, а лишь часть столкновений приводит к химической реакции. Коэффициент пропорциональности (k) показывает число результативных, приводящих к реакции соударений при концентрациях [Н2] = [J2] = 1моль. Величина k– const скорости. Как же скорость может быть постоянной? Да, скоростью равномерного прямолинейного движения называют постоянную векторную величину, равную отношению перемещения тела за любой промежуток времени к значению этого промежутка. Но молекулы движутся хаотически, тогда как же может быть скорость – const? Но постоянная скорость может быть только при постоянной температуре. С ростом температуры увеличивается доля быстрых молекул, столкновения которых приводят к реакции, т. е. увеличивается константа скорости. Но увеличение константы скорости не безгранично. При какой-то температуре энергия молекул станет столь большой, что практически все соударения реагентов будут результативными. При столкновении двух быстрых молекул будет происходить обратная реакция. Настанет такой момент, когда скорости образования 2НJ из Н2 и J2 и разложения будут равны, но это уже химическое равновесие. Зависимость скорости реакции от концентрации реагирующих веществ можно проследить, пользуясь традиционной реакцией взаимодействия раствора тиосульфата натрия с раствором серной кислоты. Na2S2O3 + H2SO4 = Na2SO4 + H2S2O3, (1) H2S2O3 = S↓+H2O+SO2↑. (2) Реакция (1) протекает практически мгновенно. Скорость реакции (2) зависит при постоянной температуре от концентрации реагирующего вещества H2S2O3. Именно эту реакцию мы наблюдали – в этом случае скорость измеряется временем от начала сливания растворов до появления опалесценции. В статье Л. М. Кузнецовой описана реакция взаимодействия тиосульфата натрия с соляной кислотой. Она пишет, что при сливании растворов происходит опалесценция (помутнение). Но данное утверждение Л. М. Кузнецовой ошибочно так как опалесценция и помутнение – это разные вещи. Опалесценция (от опал и латинского escentia – суффикс, означающий слабое действие) – рассеяние света мутными средами, обусловленное их оптической неоднородностью. Рассеяние света – отклонение световых лучей, распространяющихся в среде во все стороны от первоначального направления. Коллоидные частицы способны рассеивать свет (эффект Тиндаля – Фарадея) – этим объясняется опалесценция, легкая мутноватость коллоидного раствора. При проведении этого опыта надо учитывать голубую опалесценцию, а затем коагуляцию коллоидной суспензии серы. Одинаковую плотность суспензии отмечают по видимому исчезновению какого-либо рисунка (например, сетки на дне стаканчика), наблюдаемого сверху через слой раствора. Время отсчитывают по секундомеру с момента сливания. Растворы Na2S2O3 x 5H2O и H2SO4. Первый готовят путем растворения 7,5 г соли в 100 мл H2O, что соответствует 0,3 М концентрации. Для приготовления раствора H2SO4 той же концентрации отмерить надо 1,8 мл H2SO4(к), ρ = = 1,84 г/см3 и растворить ее в 120 мл H2O. Приготовленный раствор Na2S2O3 разлить в три стакана: в первый – 60 мл, во второй – 30 мл, в третий – 10 мл. Во второй стакан добавить 30 мл H2O дистиллированной, а в третий – 50 мл. Таким образом, во всех трех стаканах окажется по 60 мл жидкости, но в первом концентрация соли условно = 1, во втором – Ѕ, а в третьем – 1/6. После того, как будут подготовлены растворы, в первый стакан с раствором соли прилейте 60 мл раствора H2SO4 и включите секундомер, и т. д. Учитывая, что скорость реакции падает с разбавлением раствора Na2S2O3, ее можно определить как величину, обратно пропорциональную времени v = 1/τ и построить график, отложив на оси абсцисс концентрацию, а на оси ординат – скорость реакции. Из этого вывод – скорость реакции зависит от концентрации веществ. Полученные данные занесены в таблицу 3. Можно этот опыт выполнить с помощью бюреток, но это требует от выполняющего большой практики, потому что график бывает неправильным. Таблица 3 Скорость и время реакции  Подтверждается закон Гульдберга-Вааге – профессора химии Гульдерга и молодого ученого Вааге). Рассмотрим следующий фактор – температуру. При увеличении температуры скорость большинства химических реакций повышается. Эта зависимость описана правилом Вант-Гоффа: «При повышении температуры на каждые 10 °C скорость химических реакций увеличивается в 2 – 4 раза». где γ – температурный коэффициент, показывающий, во сколько раз увеличивается скорость реакции при повышении температуры на 10 °C; v1 – скорость реакции при температуре t1; v2 – скорость реакции при температуре t2. Например, реакция при 50 °С протекает за две минуты, за сколько времени закончится процесс при 70 °С, если температурный коэффициент γ= 2? Решение: 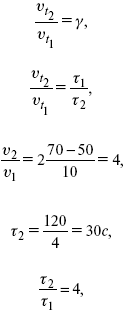 t1 = 120 с = 2 мин; t1 = 50 °С; t2 = 70 °С. Даже небольшое повышение температуры вызывает резкое увеличение скорости реакции активных соударений молекулы. Согласно теории активации, в процессе участвуют только те молекулы, энергия которых больше средней энергии молекул на определенную величину. Эта избыточная энергия – энергия активации. Физический смысл ее – это та энергия, которая необходима для активного столкновения молекул (перестройки орбиталей). Число активных частиц, а следовательно, скорость реакции возрастает с температурой по экспоненциальному закону, согласно уравнению Аррениуса, отражающему зависимость константы скорости от температуры где А – коэффициент пропорциональности Аррениуса; k– постоянная Больцмана; ЕА – энергия активации; R – газовая постоянная; Т– температура. Катализатор – вещество, ускоряющее скорость реакции, которое само при этом не расходуется. Катализ – явление изменения скорости реакции в присутствии катализатора. Различают гомогенный и гетерогенный катализ. Гомогенный – если реагенты и катализатор находятся в одном агрегатном состоянии. Гетерогенный – если реагенты и катализатор в различных агрегатных состояниях. Про катализ см. отдельно (дальше). Ингибитор – вещество, замедляющее скорость реакции. Следующий фактор – площадь поверхности. Чем больше поверхность реагирующего вещества, тем больше скорость. Рассмотрим на примере влияние степени дисперсности на скорость реакции. CaCO3 – мрамор. Плиточный мрамор опустим в соляную кислоту HCl, подождем пять минут, он растворится полностью. Порошкообразный мрамор – с ним проделаем ту же процедуру, он растворился через тридцать секунд. Уравнение обоих процессов одинаково. CaCO3(тв) + HCl(г) = CaCl2(тв) + H2O(ж) + CO2(г) ↑. Итак, при добавлении порошкообразного мрамора время меньше, чем при добавлении плиточного мрамора, при одинаковой массе. С увеличением поверхности раздела фаз скорость гетерогенных реакций увеличивается. ЛЕКЦИЯ № 7. Коррозия металлов 1. Основные понятия и терминология Коррозия – самопроизвольное окисление металлов, вредное для промышленной практики (уменьшающее долговечность изделий). Это слово произошло от латинского corrodere – разъедать. Среда, в которой металл подвергается коррозии (корродирует), называется коррозионной или агрессивной. При этом образуются продукты коррозии: химические соединения, содержащие металл в окисленной форме. В тех случаях, когда окисление металла необходимо для осуществления какого-либо технологического процесса, термин «коррозия» употреблять не следует. Например, нельзя говорить о коррозии растворимого анода в гальванической ванне, поскольку анод должен окисляться, посылая свои ионы в раствор, чтобы протекал нужный процесс. Нельзя также говорить о коррозии алюминия при осуществлении алюмотермического процесса. Но физико-химическая сущность изменений, происходящих с металлом во всех подобных случаях, одинакова: металл окисляется. Следовательно, термин «коррозия» имеет не столько научное, сколько инженерное значение. Правильнее было бы употреблять термин «окисление» независимо от того, вредно или полезно оно для нашей практики. В системе стандартизации (ГОСТ 5272-68) коррозия металлов определена как разрушение металлов вследствие химического и электрохимического взаимодействия их с коррозионной средой. В системе ИСО (международной стандартизации) это понятие несколько шире: физико-химическое взаимодействие между металлом и средой, в результате которого изменяются свойства металла, и часто происходит ухудшение функциональных характеристик металла, среды или включающей их технической системы. Объекты воздействия коррозии – металлы, сплавы (твердые растворы), металлопокрытия, металлоконструкции машин, оборудования и сооружений. Процесс коррозии представляют как коррозионную систему, состоящую из металла и коррозионной среды. Коррозионная среда содержит одно или несколько веществ, вступающих в реакцию с металлом. Она может быть жидкой и газообразной. Газообразная среда, окисляющая металл, называется окислительной газовой средой. Изменение в любой части коррозионной системы, вызванное коррозией, называется коррозионным эффектом. Коррозионный эффект, ухудшающий функциональные характеристики металла, покрытия, среды или включающих их технических систем, расценивают как эффект повреждения или как коррозионную порчу (по системе ИСО). В результате коррозии образуются новые вещества, включающие окислы и соли корродирующего металла, это – продукты коррозии. Видимые продукты атмосферной коррозии, состоящие в основном из гидратированных оксидов железа, называют ржавчиной, продукты газовой коррозии – окалиной. Количество металла, превращенного в продукты коррозии за определенное время, относят к коррозионным потерям. Коррозионные потери единицы поверхности металла в единицу времени характеризуют скорость коррозии. Эффект повреждений, связанный с потерями механической прочности металла, определяют термином – коррозионное разрушение, глубину его в единицу времени называют скоростью проникновения коррозии. Важнейшее понятие – коррозионная стойкость. Она характеризует способность металла сопротивляться коррозионному воздействию среды. Коррозионную стойкость определяют качественно и количественно – скоростью коррозии в данных условиях, группой или баллом стойкости по принятой шкале, с помощью оптических приборов. Металлы, обладающие высокой коррозионной стойкостью, называют коррозионно стойкими. Факторы, влияющие на скорость, вид, рас-пределение коррозии и связанные с природой металла (состав, структура, внутренние напряжения, состояние поверхности), называют внутренними факторами коррозии. Факторы, влияющие на те же параметры коррозии, но связанные с составом коррозионной среды и условиями процесса (температура, влажность, обмен среды, давление и т. п.), называют внешними факторами коррозии. В ряде случаев факторы коррозии целесообразно делить в соответствии с таблицей 4. Таблица 4 Факторы коррозии   2. Классификация процессов коррозии металлов Классифицировать коррозию принято по механизму, условиям протекания процесса и характеру разрушения. По механизму протекания коррозионные процессы, согласно ГОСТ 5272-68, подразделяются на два типа: электрохимические и химические. К электрохимической коррозии относят процесс взаимодействия металла с коррозионной средой, при котором ионизация атомов металла и восстановление окислительных агентов среды протекают не в одном акте и зависят от электронного потенциала (наличия проводников второго рода). Рассмотрим несколько видов электрохимической коррозии: 1) атмосферная – характеризует процесс в условиях влажной воздушной среды. Это наиболее распространенный вид коррозии, так как большинство конструкций эксплуатируют в атмосферных условиях. Ее можно разделить следующим образом: на открытом воздухе, с возможностью попадания на поверхность машин осадков, или с защитой от них в условиях ограниченного доступа воздуха и в замкнутом воздушном пространстве; 2) подземная – разрушение металла в почвах и грунтах. Разновидность этой коррозии – электрохимическая коррозия под воздействием блуждающих токов. Последние возникают в грунте вблизи источников электрического тока (систем передачи электроэнергии, электрифицированных транспортных путей); 3) жидкостная коррозия, или коррозия в электролитах. Ее частным случаем является подводная коррозия – разрушение металлических конструкций, погруженных в воду. По условиям эксплуатации металлоконструкций, этот вид подразделяют на коррозию при полном и неполном погружении; при неполном погружении рассмотрен процесс коррозии по ватерлинии. Водные среды могут отличаться коррозийной активностью в зависимости от природы растворенных в них веществ (морская, речная вода, кислотные и щелочные растворы химической промышленности и т. п.). При подводной коррозии возможны процессы коррозии оборудования в неводных жидких средах, которые подразделяют на неэлектропроводящие и электропроводящие. Такие среды специфичны для химической, нефтехимической и других отраслей промышленности. К химической коррозии относят процесс, в котором окисление металла и восстановление среды представляют единый акт (отсутствие проводников второго рода). Химическая коррозия – это разрушение металлов в окислительных средах при высоких температурах. Различают два вида: газовая (т. е. окисление металла при нагреве) и коррозия в неэлектролитах: а) характерной особенностью газовой коррозии является отсутствие влаги на поверхности металла. На скорость газовой коррозии влияет, прежде всего температура и состав газовой среды. В промышленности часто встречаются случаи этой коррозии: от разрушения деталей нагревательных печей до коррозии металла при термической обработке. б) коррозия металлов в неэлектролитах, независимо от их природы, сводится к химической реакции между металлом и веществом. В качестве неэлектролитов используют органические жидкости. В особую группу следует выделить виды коррозии в условиях воздействия механических напряжений (механическая коррозия). Эта группа включает: собственно коррозию под напряжением, характеризуемую разрушением металла при одновременном воздействии коррозионной среды и постоянных или переменных механических напряжений; коррозионное растрескивание – при одновременном воздействии коррозионной среды и внешних или внутренних механических напряжений растяжения с образованием транскристаллитных трещин. Различают самостоятельные виды коррозии: 1) коррозия при трении – разрушение металла, вызываемое одновременным воздействием коррозионной среды и трения; 2) фреттинг-коррозия – разрушение при колебательном перемещении двух поверхностей относительно друг друга в условиях воздействия коррозионной среды; 3) коррозионная кавитация – разрушение при ударном воздействии среды; 4) коррозионная эрозия – при истирающем воздействии среды; 5) контактная коррозия – разрушение одного из двух металлов, находящихся в контакте и имеющих разные потенциалы в данном электролите. Следует различать коррозию и эрозию. Эрозия о латинского слова erodere (разрушать) – постепенное механическое разрушение металла, например при истирании трущихся частей механизмов. Самостоятельный вид коррозии – биокоррозия – это разрушение металла, при котором в качестве значимого выступает биофактор. Биоагенты – микроорганизмы (грибы, бактерии), которые являются инициаторами или стимуляторами процесса коррозии. По характеру разрушения коррозия делится на сплошную (или общую) и местную (локальную). Сплошная коррозия охватывает всю поверхность металла, при этом она может быть равномерной или неравномерной. Местная коррозия происходит с разрушением отдельных участков поверхности металлов. Разновидность этой коррозии: точечная (питтинг), коррозия пятнами и сквозная коррозия. Подповерхностная коррозия начинается с поверхности, но развивается преимущественно под ней таким образом, что продукты коррозии сосредоточены внутри металла. Ее разновидность – послойная коррозия, распространяющаяся преимущественно в направлении пластической деформации металла. Структурная коррозия связана со структурной неоднородностью металла. Ее разновидность – межкристаллитная – разрушение металла по границам кристаллитов (зерен) металла; внутрикристаллитная – разрушение металла по зернам кристаллитов. Наблюдается при коррозийном растрескивании, протекающем под влиянием внешних механических нагрузок или внутренних напряжений. Ножевая коррозия – локализованное разрушение металла в зоне сплавления сварных соединений в жидких средах с высокой коррозионной активностью. Щелевая коррозия – усиление процесса разрушения металла в зазорах между двумя металлами. Избирательная коррозия – разрушение одной структурной составляющей или одного компонента металла в высокоактивных средах. Существует ряд разновидностей: графитизация чугуна (растворение ферритных или перлитных составляющих) и обесцинкование (растворение цинковой составляющей) латуней. 3. Виды коррозионных разрушений Коррозия, в зависимости от природы металла, агрессивной среды и других условий, приводит к различным видам разрушений. На рисунке 13 представлены разрезы через прокорродировавший образец металла, показывающие возможные изменения рельефа поверхности в результате коррозии. 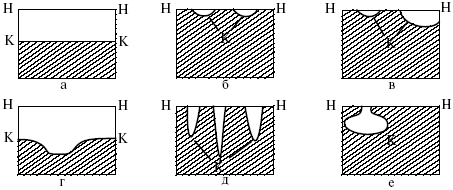 Рис. 11. Схематическое изображение различных видов коррозии: а – равномерная коррозия; б – коррозия пятнами; в, г – коррозия язвами; д – точечная коррозия (питтинг); е – подповерхностная коррозия; НН – исходная поверхность металла; КК – рельеф поверхности, измененный вследствие коррозии. Иногда коррозия протекает со скоростью, одинаковой по всей поверхности; в таком случае поверхность становится только немного более шероховатой, чем исходная (а). Часто наблюдается различная скорость коррозии на отдельных участках: пятнами (б), язвами (в, г). Если язвы имеют малое сечение, но относительно большую глубину (д), то говорят о точечной коррозии (питтинг). В некоторых условиях небольшая язва распространяется вглубь и вширь под поверхностью (е). Неравномерная коррозия значительно более опасна, чем равномерная. Неравномерная коррозия, при сравнительно небольшом количестве окисленного металла, вызывает большое уменьшение сечения в отдельных местах. Язвенная или точечная коррозия могут привести к образованию сквозных отверстий, например, в листовом материале, при малой потере металла. Приведенная классификация, конечно, условна. Возможны многочисленные формы разрушения, лежащие между характерными типами, показанными на данном рисунке. Некоторые сплавы подвержены своеобразному виду коррозии, протекающей только по границам кристаллитов, которые оказываются отделенными друг от друга тонким слоем продуктов коррозии (межкристаллитная коррозия). Здесь потери металла очень малы, но сплав теряет прочность. Это очень опасный вид коррозии, который нельзя обнаружить при наружном осмотре изделия. 4. Методы защиты от коррозии Для ослабления коррозионного процесса требуется повлиять либо на сам металл, либо на коррозионную среду. Выделяют основные направления для борьбы с коррозией: 1) легирование металла, либо замена его другим, более коррозионностойким; 2) защитные покрытия (металлические и неметаллические) органического или неорганического происхождения; 3) электрохимическая защита, различают катодную, анодную и протекторную как вариант катодной защиты. Например, при атмосферной коррозии применяют покрытия органического и неорганического происхождения; от подземной коррозии эффективна электрохимическая защита; 4) введение ингибиторов (веществ, замедляющих скорость реакции). ЛЕКЦИЯ № 8. Физико-химический анализ 1. Суть физико-химического анализа Задача физико-химического анализа состоит в установлении зависимости свойств равновесной системы от параметров состояния. Под параметрами состояния обычно понимают: состав, давление, температуру. Зависимости выражаются в виде различных диаграмм «параметр состояния – свойство». На практике большое значение имеет диаграмма «состав – свойство». Анализ именно такой диаграммы позволяет получать сведения о характере взаимодействия компонентов, о давлении и концентрации компонентов, о составе и устойчивости образующихся в системе химических соединений. Совокупность зависимостей всех свойств равновесной системы от параметров состояния позволяет изобразить в виде графика фазовую диаграмму – диаграмму состояния. Чтобы рассмотреть каждую диаграмму состояния систем, пользуются понятиями: фаза, система, степень свободы, компонент, составляющее вещество, термодинамическое равновесие. Раскроем суть этих понятий. Компонент – химически индивидуальные вещества, наименьшего числа которых достаточно для образования всех фаз, т. е. гомогенных частей данной системы. Система – совокупность тел, находящихся во взаимодействии между собой и отделенных от окружающей среды. Различают физическую и химическую системы. Если составные части системы не вступают друг с другом в химические реакции, то такая система называется физической. Если составные части системы реагируют друг с другом, то она называется химической. Составляющее вещество – вещество, которое может быть выделено из системы и существовать вне ее. Степень свободы (вариантность) – число независимых параметров системы, которые можно произвольно менять в некотором интервале без изменения вида и числа фаз системы. Термодинамическое равновесие – состояние, к которому самопроизвольно стремится система. Она находится в состоянии термодинамического равновесия в том случае, когда изменение свободной энергии Гиббса равно нулю. Фаза – гомогенная часть гетерогенной системы, ограниченная поверхностью раздела от других частей. Раскрыв суть важнейших понятий физико-химического анализа, рассмотрим правила и принципы, лежащие в его основе. Правило фаз – число степеней свободы равновесной системы, на которую из внешних факторов влияют только давление и температура, равно числу независимых компонентов системы плюс два минус число фаз, т. е. F = k + 2 – z, где F – число степеней свободы; k – число компонентов; z – число фаз; число 2 – два независимых параметра системы: давление и температура. Применим правило фаз к однокомпонентной системе: F = 1 + 2 – z. Итак, в этой системе максимальное число фаз, одновременно находящихся в равновесии, равно трем. Состояние равновесия однокомпонентной системы определяется ее объемом, температурой, давлением: f(P, T, V ) = 0. Рассмотрим возможные состояния однокомпонентной системы, сведенные в таблицу 5. Таблица 5 Фазовые состояния однокомпонентной системы 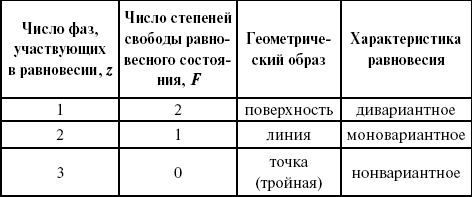 Рассмотрим зависимость между числом фаз и числом степеней свободы в двухкомпонентной системе. F = 2 + 2 – z. Из этого видно, что максимальное число фаз, находящихся одновременно в равновесии, равно четырем. Состояние равновесия двухкомпонентной системы определяется давлением, температурой и концентрацией компонентов. В некоторых случаях возможны и другие состояния (табл. 6). Таблица 6 Фазовые состояния двухкомпонентной системы 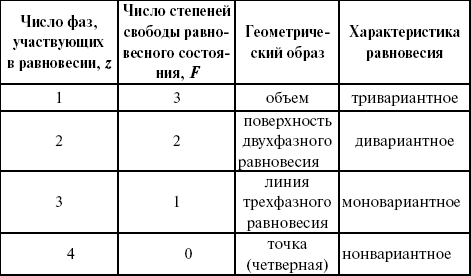 Из этого можно сделать вывод, что в двухкомпонентных системах число независимых переменных достигает пяти: температура, давление, мольный объем, концентрация первого компонента, концентрация второго компонента, т. е. уравнение состояния будет: f(P, T, V, XA, XB) = 0. Из пяти параметров независимы только три, потому что мольный объем является функцией температуры и давления, и при заданной концентрации одного компонента XAконцентрация другого будет 1 – XA. Итак, для характеристики двухкомпонентной системы нужны: давление, температура, концентрация одного из компонентов. Изменение состояния системы, при котором давление, температура и состав фаз остаются постоянными, а масса одних фаз увеличивается за счет массы других фаз, носит название фазовой реакции. Фазовое превращение или фазовый переход – переход вещества из одной фазы в другую. Итак, правило фаз Гиббса имеет большое значение в гетерогенных системах, в учении о равновесии, является теоретической основой для физико-химического анализа, который проанализировав его задачи, понятия и принципы заключается в следующем: измеряют любое физическое свойство расплава или раствора (плотность, температуру плавления, давление пара и т. п.) и, изменяя состав, получают числовые данные свойства и сводят в таблицу, а затем строят диаграмму «состав – свойство», анализируют зависимость между геометрическими особенностями диаграммы и природой раствора. Плавное изменение, минимум или максимум на кривых, излом и другое, т. е. любая геометрическая форма кривой и диаграммы в целом, характеризует взаимодействия между компонентами раствора. Эти диаграммы решают задачи об установлении числа, химической природы и границах существования фаз. С помощью метода физико-химического анализа изучают сплавы, минералы и т. п. Огромная заслуга в этом принадлежит И. С. Курнакову, Х. В. Розебому, Г. Г. Тамману и др. 2. Однокомпонентные системы Пример такой системы – диаграмма состояния воды. В такой системе тройную точку О, координаты которой определяют условия сосуществования трех фаз: лед, вода, пар, – можно рассматривать как геометрический образ с нулевым числом измерений. Число степеней свободы этой системы равно нулю. Если изменить хотя бы один из параметров (давление или температуру), то сразу же изменится число сосуществующих фаз. Кривые, описывающие условия равновесия двух фаз (лед – пар, лед – вода, вода – пар), имеют число степеней свободы, равное единице. Можно менять как угодно любой параметр, сохраняя равновесие двух фаз, но величина второго будет строго определенна. Итак, линия двухфазного равновесия – это функция одного параметра, зависящая от другого: P = f(T ) или I = z(P). Тройная точка в этой системе представляет собой нонвариантное равновесие. 3. Физико-химические методы анализа состава сплавов Различают термический и рентгеноструктурный анализ. Физико-химический анализ – область химии, изучающая посредством сочетания физических и геометрических методов превращения, происходящие в равновесных системах. Рентгеноструктурный анализ – метод исследования строения тел, использующий явление дифракции рентгеновских лучей. Дифракция рентгеновских лучей – один из видов рассеяния рентгеновский лучей. Рентгеноструктурный анализ является основным методом определения структуры кристалла. Исследуемый образец помещают на пути рентгеновских лучей и регистрируют дифракционную картину, возникающую в результате взаимодействия лучей с веществом. Задача физико-химического анализа – установить зависимость свойств равновесной системы от параметров состояния (Т, P, состава). Термический анализ позволяет исследовать всевозможные превращения простых и сложных систем по тепловым эффектам. Термический анализ проводится с визуальным наблюдением за температурой появления и исчезновением кристаллов. Наблюдения за исчезновением и появлением кристаллической фазы при нагревании и охлаждении расплава проводят до получения близких по значению температурных данных. Термический анализ применим, если сплав прозрачен. Хронопотенциометрия в некоторых расплавах. Особенность – постоянная скорость подачи титранта в анализируемый расплав и непрерывная запись показателей рН-метра в процессе титрования. О количестве вещества судят по соответствующей длине диаграммной ленты самописца. Применение хронопотенциометрии для физико-химического исследования расплавов Определение коэффициента диффузии в расплавах: 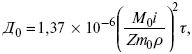 где m0 – концентрация ионов % масс; М0 – молекулярная масса, г/моль; ρ– плотность электролита, г/см3. Определение толщины диффузного слоя В условиях принудительного перемешивания у поверхности электрода существует ограниченный диффузный слой. Для определения толщины используется уравнение хронопотенциограммы: 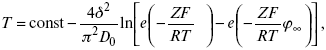 где φ∞– величина установившегося потенциала при заданном токе. По наклону прямой, выражающей зависимость (1), находят величину 4δ2/π 2D0.Отношение D0/ δопределяют из значения установившегося потенциала 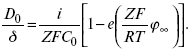 По величинам 4δ2/π 2D0и D0/ δлегко найти δи D0. Определение растворимости Н2, Cl2, O2 в расплаве. Электродные процессы в расплавах с участием Н2, Cl2, O2 привлекают внимание исследователей в связи с развитием электрохимии топливных элементов. Растворимость газообразных веществ в расплавах находят по уравнению Сэнда. Величина произведения i x τ1/2 однозначно связана с величиной растворимости Н2, Cl2, O2 в расплаве, если между газами и компонентами расплава отсутствует какое-либо химическое взаимодействие. В двойной эвтектике CuCN и Cd(CN)2 растворимость Н2 подчиняется закону Генри. Для оценки абсолютного значения растворимости газов необходимо знать величину коэффициента диффузии. Если в исходном расплаве содержатся ионы О2-, то между i x τ1/2 и концентрацией ионов О2- наблюдается линейная зависимость, на основании которой можно судить о содержании О2- . ЛЕКЦИЯ № 9. Термохимия 1. Понятие термохимии |
