Курс лекций НЭ_ч4-ч5_Богач_2013. Курс лекций " Основы наноэлектроники"
 Скачать 3.44 Mb. Скачать 3.44 Mb.
|
4.8.Пленки на основе коллоидных растворов.Щука, с.140. 4.8.1.Основные определения и свойства.Коллоидные растворы (или золи) представляют собой жидкие системы с частицами дисперсной фазы, или мицеллами, перемещающимися свободно и независимо в процессе броуновского движения. Золи, или коллоидные растворы, на основе водной дисперсионной среды называются гидрозолями, с органической — органозолями. Коллоидная суспензия состоит из небольших сферических частиц, взвешенных в жидкости. Размер частиц лежит в пределах 10 нм - 100 нм. Частицы не могут располагаться друг относительно друга ближе, чем на диаметр частицы. Чтобы частицы не агрегировались, им сообщают тем или иным способом электрический заряд. Если объем всех частиц превышает половину всего объема коллоидного раствора, то пространственное расположение частиц представляет собой объемноцентрированную (ОЦК) или гранецентрированную (ГЦК) решетки. На рис. 2.5 приведено изменение состояния коллоидного раствора соли, содержащего сферы полистирола диаметром 720 нм, в зависимости от давления, нормализованного на тепловую энергию. 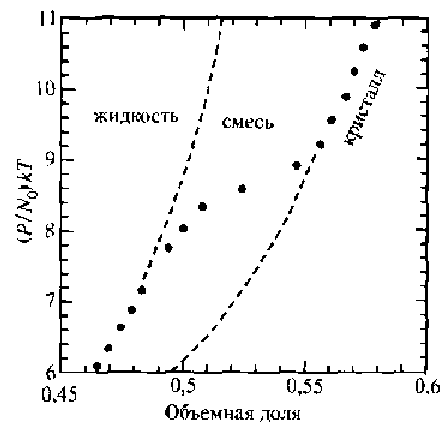 Рис.2.5. Функция состояния коллоидного раствора. N0 -число Авогадро. Метод формирования упорядоченных наноструктур непосредственно из наночастиц, сформированных в коллоидных растворах, дает возможность в широких пределах варьировать размеры частиц, позволяет менять по желанию адсорбционную оболочку и тем самым электронные свойства частиц. Применение этого метода практически не зависит от природы частиц. Метод получения коллоидных кристаллов был впервые реализован для наночастиц CdS. В процессе испарения происходит гомогенная либо гетерогенная (на подложке) нуклеация коллоидных кристаллов. Используя этот метод, можно формировать как трехмерные, так и двумерные коллоидные кристаллы. Схема процесса осаждения упорядоченных наноструктур представлена на рис. 2.6. Полученные структуры исследовались методами электронной микроскопии, показавшей наличие упорядоченности нанокристаллов в масштабах порядка 50 мкм. 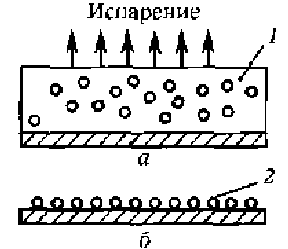 Рис. 2.6. Схема метода испарения коллоидного раствора (а) и получения упорядоченных структур (б): 1 — коллоидный раствор; 2 — структура из наночастиц. Метод также использовался для получения упорядоченных структур из наночастиц металлов. Первоначально опыты проводились с наночастицами золота, поскольку в этом случае состав был стабилизирован. Кроме того, наночастицы золота, покрытые адсорбированным слоем алкантиолов, позволяют легко менять растворители, осаждать и снова диспергировать нано- частицы, а также проводить обменные реакции с лигандной оболочкой. Под лигандой будем понимать молекулы или ионы в химических комплексных соединениях, которые непосредственно связаны с центральным, комплексообразующим атомом. При получении коллоидных кристаллов методом испарения растворителя важную роль в процессах самоорганизации играют монодисперсность частиц, их форма и природа стабилизирующей оболочки. Была исследована самоорганизация наночастиц золота, серебра и платины. Наночастицы первоначально получали в водной среде и лишь затем переносили в органические растворители, содержащие тиолаты, что позволило в широких пределах варьировать размеры и форму частиц. Как оказалось, способность к самоорганизации проявляют все исследованные, системы. Исследовано также влияние стабилизатора на лолученне коллоидных кристаллов. Эксперименты проводились с наночастицами золота, синтезированными в обратных мицеллах с использованием стабилизаторов различной природы, содержащих тиол- , амино- и сульфидные группы. В процессе формирования коллоидных кристаллов иногда наблюдалась самопроизвольная сегрегация наночастиц по размерам. Организованные в кристаллы наночастицы проявляют коллективные свойства. Коллективные эффекты в самоорганизованных ансамблях наночастиц настолько сильны, что специальными приемами удается получить структуры, проявляющие дихроизм. Можно даже управлять оптическими характеристиками упорядоченных слоев наночастиц. Если на многослойную пленку наложить электрический потенциал, то коэффициенты отражения и пропускания существенно меняются. 4.8.2.Золь-гель технология.Золь-гель технология (sol-gel или spin on glass process) базируется на свойстве золи или коллоидного раствора коагулировать и превращаться в гели, которые представляют собой структурированные коллоидные системы с жидкой дисперсионной средой. Гели являются студенистыми телами, механические свойства которых подобны механическим свойствам твердого тела. В гелях частицы дисперсионной фазы соединены между собой в рыхлую пространственную сетку, ячейки которой содержат дисперсионную среду. Гели лишены свойства текучести. Гели с водной дисперсионной средой называются гидрогелями, а с углеводородной — органогелями. Золь-гель технология является удобным путем получения дисперсных материалов, позволяет исключить многочисленные стадии промывки. В качестве исходных веществ используют соединения, не вносящие примеси в состав конечного продукта. В основе золь-гель технологии лежат реакции полимеризации неорганических соединений. Различают следующие стадии золь- гель технологии: - приготовление раствора (в качестве растворителей служит алкоголь — спирты разной природы); - образование геля; - сушка; - термообработка. Обычно исходными веществами служат алкоксилы металлов с общей формулой M(OR)n, где М — металлы (Ti, Zr, V, Zn, Al, Sn, Ge, Mo, Si, W, лантаниды и др.), OR — одновалентная атомная группа углеводородного радикала (алкила) и атома кислорода (окси). Отсюда и название — алкоксилы. Например, СН3О — метоксильная группа, С2Н5О — этоксильная группа, или этоксил. Алкоксилы гидролизуются при добавлении воды. Обычно реакцию проводят в органических растворителях. Последующая полимеризация (конденсация) приводит к формированию геля. Например, при п = 4 M(OR)4 + 4∙Н20 → М(ОН)4 + 4∙ROH, m∙M(OH)4 → (М02)m + 2∙m∙H2O. Реальный процесс намного сложнее и протекает по многомаршрутному механизму. При этом существенное значение имеют условия протекания процесса, а именно, использование катализаторов, природа металла и тип алкоксильной группы. Золь-гель технология включает процессы гидролиза, полимеризацию (или химически контролируемую конденсацию) гель-прокурсора, нуклеацию (образование зародышей) и рост частиц с их последующей агломерацией. В качестве прокурсоров чаще всего используют тетраметилоксисилан (ТМОС) или тетраэтоксисилан (ТЭОС), которые формируют силикагелевую структуру («хозяин») вокруг допанта («гость»). Формируется как бы специфическая клетка-ловушка. Нуклеация протекает через образование полиядерного комплекса, концентрация которого увеличивается, пока не достигается некоторое пересыщение, определяемое его растворимостью. С этого момента начинается рост зародышей, а новые зародыши уже не образуются. На стадии образования геля (желатинизации) можно проводить пропитку геля ионами различных металлов. Образующиеся оксополимеры имеют структуру ультратонкой пористой сетки с размерами пор 110 нм, подобную структуре цеолитов. Их удельная поверхность Sуд в зависимости от условий синтеза составляет 130 - 1260 м2/г, насыпная плотность равна 0,05 - 0,10 г/см3. Условия сушки, во время которой происходит удаление летучих компонентов, определяют текстуру продукта. Образование структуры и текстуры продукта завершается на стадии термообработки. Этим методом могут быть синтезированы нанокомпозиты на основе керамики гетерометаллического типа, например, перовскита со структурой АВ03. Такие материалы (в основном, пленочные, эпитаксиально ориентированные) обладают специфическими ферро-, пьезо- и пироэлектрическими свойствами и широко применяются в электронике и оптоэлектронике. Перовскиты, например PbTi03, обычно получают, прокаливая при температурах выше 600 °С измельченную в вибромельнице смесь РbО и ТiO2. Однако РbО токсичен и присутствие его фазы в конечном продукте нежелательно. Золь-гель технология получения перовскита PbTi03 свободна от этих недостатков. Исходные компоненты Ti(OPr)4, Pb(AcO)2∙3H20, этиленгликоль и лимонную кислоту перемешивают при 50 °С. Далее проводят полимеризацию полученных комплексов металлов при 130 °С и пиролиз при 300 °С. Образовавшийся порошкообразный прекурсор прокаливают на воздухе в течение 2 часов при 400 °С - 600 °С. В итоге получаются тонкие пленки PbTi03, сохраняющие свойства блочного материала. 4.8.3.Методы молекулярного наслаивания и атомно-слоевой эпитаксии.Среди методов синтеза ультратонких слоев следует выделить метод химической сборки, основанный на образовании поверхностных химических соединений при хемосорбции компонентов из газовой фазы (см. ч. 1, разд. 6.7). Существует две разновидности химической сборки. Метод атомно-слоевой эпитаксии позволяет синтезировать тонкопленочные слои оксидов и сульфидов, а также выращивать слои арсенида галлия при низких температурах. Метод молекулярного наслаивания основан на процессах синтеза твердых вешеств на поверхности твердого тела. При этом кристаллическая решетка служит матрицей для сборки пленочных структур. В методе молекулярного наслаивания предусмотрено формирование на поверхности определенных функциональных групп, которые реагируют с низкомолекулярным реагентом и позволяет образовывать устойчивые соединения. Под функциональными группами будем понимать некоторые компоненты синтезируемого слоя. Например, для получения оксидных слоев используется группа -ОН, для сульфидных —SH, для нитридных —NH. Методы атомно-слоевой эпитаксии и молекулярного настаивания позволяет синтезировать наноструктуры на поверхности твердых тел путем запрограммированного многократного чередования химических реакций. При этом толщина образующегося слоя определяется не временем процесса или интенсивностью потока вещества, а количеством повторяющихся циклов химических реакций п. Причем реакции протекают при небольших температурах, лежащих в диапазоне от 25 оС до 400 оС. Именно это обстоятельство резко снижает вклад диффузионных процессов и позволяет создавать многослойные структуры с резкими границами. Процессы молекулярного наслаивания и атомно-слоевой эпитаксии проводят в проточном реакторе при атмосферном давлении. Например, для синтеза сульфида цинка на гидроксилированном кремнии необходимо провести следующие реакции с использованием диметилцинка: 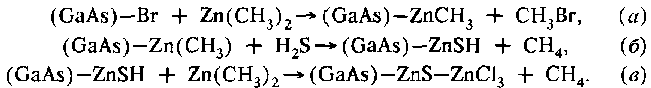 Чередование реакций (б) и (в) при условии постоянного удаления избытков реагентов и продуктов реакции позволяет вырастить цинко-сульфидный слой (рис. 2.7). При этом не образуются трехмерные зародыши, а рост пленок происходит по слоевому механизму. 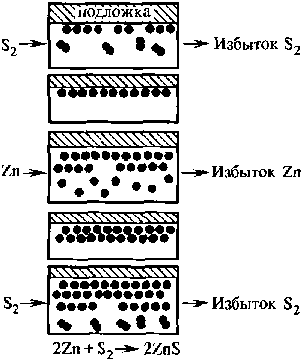 Рис.2.7. Химическая сборка по методу атомно-слоевой эпитаксии. К сожалению, метод молекулярного наслаивания можно проводить для лимитированного круга вешеств и с достаточно низкой скоростью. Метод атомно-слоевой эпитаксии может применяться также для модифицирования поверхностей полупроводниковых или функциональных слоев. Модифицирование поверхности заключается в формировании одного или нескольких монослоев, содержащих кислород, серу или азот для последующих процессов оксидирования, сульфидирования или нитридизации поверхностей. При этом происходит «залечивание» дефектов границы раздела определенным типом ионов. Одновременно значительно улучшается качество границы раздела полупроводник—диэлектрик. Методы молекулярного наслаивания и атомно-слоевой эпитаксии используются для модифицирования слоев фоторезистов при проведении процессов фотолитографии. Эти методы успешно применяется при формировании гетеро- и гомоморфных границ раздела, для уменьшения деградационных явлений в полупроводниках, модифицирования различных функциональных слоев с целью повышения воспроизводимости результатов и повышения выхода годных изделий. |
