лекции токса. Лекции по токсикологической химии
 Скачать 5.01 Mb. Скачать 5.01 Mb.
|
Токсикокинетика спиртовВсасывание (резорбция). В организм спирты попадают через желудочно-кишечный тракт и легкие, Всасывание начинается быстро, уже во рту и пищеводе, но основная масса спирта всасывается в желудке или кишечнике. Механизм всасывания спирта - простая диффузия, молекулы его транспортируются в кровь в неизмененном виде. Скорость всасывания зависит отконцентрации и количества принятого спирта, от степени и характера наполнения желудка и кишечника. При приеме натощак максимальная концентрация этанола в крови наблюдается через 40--80 мин ( в среднем около 1 часа), при полном желудке - через 1,5-2,5 часа. Транспорт (распределение). Через кровь этанол распространяется по органам и тканям, обильно снабжаемым кровью, и концентрируется в тканях пропорционально содержанию в них воды. Наибольшие количество спирта содержатся в биологических жидкостях (кровь, моча, спинномозговая жидкость) и головном мозге. Несколько меньше его в тканях, мышцах, и минимальное количество - в жировой ткани. Небольшие количества этилового спирта могут присутствовать в биоматериале вследствие естественных процессов при гниении крови и других органов трупа. Метаболизм (биотрансформация). После всасывания спирты подвергаются в организме процессам биотрансформации в основном через окисление до соответствующих альдегидов и кислот, конечными продуктами превращения которых являются СО2 и Н2О. Так, метанол окисляется до формальдегида, а затем до муравьиной кислоты: СН3ОН Н2СО НСООН СО2 + Н2О Этанол на 90% и более окисляется до ацетальдегида и уксусной кислоты: С2Н5ОН СН3С=О СН3СООН СО2+Н2О Н Н Катализирует процесс фермент алькогольдегидрогеназа (АДГ), акцептором Н2 служит коэнзим никотинамид-аденин-динуклеотид (НАД): АДГ НАД+АДГ С2Н5ОН + НАД СН3С=О СН3С=О CO+H 2O -Н2НАД НОН Н - Н2НАД ОН Этот процесс протекает в основном в печени, меньше в легких, почках, мышечной ткани. У хронических алкоголиков процессы биохимического окисления спирта протекают, кроме того, в мышцах с помощью фермента каталазы, поэтому такие люди выносят большие дозы алкоголя. Скорость метаболизма зависит, главным образом, от времени, очень незначительно - от концентрации спирта. У взрослого человека скорость метаболизма спирта около 10 мл/час, суточный метаболизм - 400-500 мл. Метанол окисляется в организме значительно медленнее, его можно обнаружить в крови на 3-4 день после смерти. Выделение (элиминация) спирта протекает по механизму простой диффузии и происходит через легкие, кожу, почки, кишечник, слюнные железы в виде метаболитов. Только 10% этанола выделяется в неизмененном виде, из них 7% - через легкие, 2-2,5% - почками. Длительность нахождения (и обнаружения) алкоголя в организме человека обусловлена, в основном, количеством выпитого алкоголя и может быть определена с учетом скорости окисления, которая составляет 7-10 г алкоголя в час. Если в 100 мл водки содержится 40 мл алкоголя, тогда алкоголь может определяться в выдыхаемом воздухе, слюне и крови в течение 4-5 часов с момента употребления этой дозы напитка. В моче алкоголь может быть определен и позднее, так как в составе мочи он находится в мочевом пузыре долгое время до опорожнения пузыря. При приеме больших количеств алкоголя он содержится в организме до суток и более. При этом в конце этого срока к непосредственному действию алкоголя присоединяется влияние продуктов его распада, а также изменения внутренней среды организма, вызываемые интоксикацией алкоголем, такие как, например, гипогликемия и метаболический ацидоз. Именно этим объясняются симптомы, наблюдаемые после алкогольной интоксикации в период, когда алкоголя в организме уже нет: утомляемость, жажда, дрожание конечностей, головная боль, потливость, сердцебиение, колебание артериального давления, неустойчивое, а, нередко, и депрессивное настроение. Объекты исследования и пробоподготовка Наиболее важными объектами для судебно-химической экспертизы служат кровь и моча, реже ткани мозга, легких, печени, почек, редко - глубокие мышцы бедра. Желудок не может быть взят в качестве объекта исследования, так как возможно образование спирта естественным путем при брожении углеводов или при гнилостных процессах его содержимого. Содержание эндогенного алкоголя в крови находится в пределах 0,008-0,4‰ .При диагностике состояния алкогольного опьянения в наркологической практике объектами служат выдыхаемый воздух, слюна, кровь, моча. Правила отбора проб для исследования
2. При отборе жидких биологических сред у живых лиц также необходимо соблюдать определенные требования, а именно: Моча отбирается в сухой стерильный флакон «под пробку». Флакон тотчас же закрывают пробкой. Отбор пробы мочи должен производиться в условиях, исключающих подмену или замену ее другими жидкостями. Слюна отбирается в стерильный сухой флакон из-под пенициллина в количестве 5 мл и тут же закрывается пробкой. Перед отбором пробы крови в сухой стерильный флакон из-под пенициллина закапывают 1-2 капли гепарина или 0,8 мл 3,8%-го раствора цитрата натрия и встряхиванием флакона смачивают его стенки. Кровь в количестве 5 мл отбирается пункцией кубитальной вены при строгом соблюдении асептических условий самотеком во флакон, обработанный гепарином или цитратом. Флакон тотчас же закрывают стандартной резиновой пробкой, фиксируют пробку и содержимое флакона перемешивают. Кожа в месте пункции предварительно обрабатывается раствором сулемы 1:1000 или риванолом 1:500. Дезинфекция кожи спиртом, эфиром, настойкой йода не допускается. У всех флаконов с отобранными пробами фиксируют пробки алюминиевыми колпачками с помощью приспособления для обжима колпачков, обеспечивающего герметизацию флакона, и ставят их в холодильник. В случае герметизации другим способом флаконы должны быть опечатаны. На каждый флакон наклеивается этикетка с указанием номера пробы (по регистрационной книге), даты, времени забора пробы, фамилии освидетельствуемого, фамилии медицинского работника, подготовившего пробу. Биосреды должны исследоваться не позднее суток с момента их отбора. Допускается их хранение в холодильнике при температуре -40 С в течение 5 суток. Экспертиза алкогольного опьянения.Клиническая диагностикаИзвестно, насколько широко распространен алкоголизм (то есть пристрастие к алкоголю) и как велика его социальная опасность (об этом уже говорилось). Законодательством установлена дисциплинарная и административная ответственность за пребывание в нетрезвом виде в общественных местах, на рабочем месте, а также за управление транспортными средствами. При совершении правонарушений и преступлений степень опьянения служит отягчающим фактором и влияет на квалификацию преступного деяния, а, следовательно, и на меру ответственности. Для установления факта употребления алкоголя или степени алкогольного опьянения проводится медицинское освидетельствование, а при возбуждении уголовного дела - экспертиза алкогольного опьянения. У живых лиц экспертиза базируется на данных клинической диагностики и результатов химико-токсикологического исследования. Порядок и правила медицинского освидетельствования регламентируются Приказом Мз РФ № 308 от 14 июля 2003 г. «О медицинском освидетельствовании на состояние опьянения», Приказом МЗ № 06-14/33-14 (Методические указания) от 01.09.1988г. «Медицинское освидетельствование для установления факта употребления алкоголя и состояния опьянения» Клиническая экспертиза ставит своей целью выявление медико-биологических синдромов, то есть сочетания целого ряда признаков и симптомов, специфичных для состояний опьянения разной тяжести. Отдельные проявления алкогольной интоксикации не являются специфическими, поэтому оценка производится по целому комплексу признаков, свидетельствующих о нарушениях в системах организма. Освидетельствование основано на всестороннем клиническом обследовании с использованием необходимых лабораторных тестов, поэтому выполнять его должен только врач-нарколог, имеющий необходимую квалификацию. Этиловый спирт обладает многообразным фармакологическим и токсическим действием на организм. Эффекты, вызываемые при его однократном введении и при систематическом приеме, могут существенно различаться, что важно учитывать для правильной квалификации состояний опьянения. Это обуславливает чрезвычайную сложность физиологического действия алкоголя, полиморфизм клинических проявлений и поведения индивида при алкогольной интоксикации. Отсюда возникает сложность квалификации состояний опьянения. Клиническая диагностика состояний, обусловленных потреблением алкоголя, проводится на основании оценки психической сферы и поведения, выявления неврологических и сердечно-сосудистых нарушений. Как правило, при алкогольном опьянении отмечаются три симптомокомплекса: Простые типы опьянения.
Наряду с изучением психического состояния, важнейшее место в клиническом освидетельствовании занимает выявление нарушений со стороны нервно-двигательного аппарата. Характерным признаком является нарушение походки, координации, равновесия. Диагностической ценностью обладают симптомы, указывающие на нарушение в системе вегетативной регуляции - покраснение склер глаз, тахикардия, гиперемия кожных покровов, изменение артериального давления и температуры тела. В зависимости от характера и выраженности клинических проявлений выделяются следующие степени опьянения:
II. Алкогольное опьянение средней степени устанавливается при выявлении следующих расстройств:
IV Алкогольная кома диагностируется при следующих симптомах:
Следует подчеркнуть, что диагностика тяжелой степени опьянения и тем более алкогольной комы является абсолютным показанием для оказания медицинской помощи. При установлении факта употребления алкоголя и степени алкогольного опьянения диагностическое значение, помимо клинических симптомов, имеют также лабораторные химические пробы и газохроматографическое определение этанола. ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ.Методы анализа в судебно-химической экспертизе отравлений и экспертизе алкогольного опьянения. При судебно-химических исследованиях для доказательства спиртов используют их общие свойства (химизм всех реакций приведен в методическом пособии к лабораторным занятиям):
Из реакций образования сложных эфиров аналитическое значение для СН3ОН имеет реакция образования метилсалицилата, С2Н5ОН - этилацетата и этилбензоата, С5Н11ОН - амилацетата. Продукты реакции определяют только по запаху, что снижает аналитическое значение реакции, так как большую роль играет субъективный фактор исследователя. Реакция образования сложных эфиров высокочувствительна, но не специфична, поэтому ей придается отрицательное судебно-химическое значение. При положительном результате реакции необходимо подтвердить наличие того или иного спирта дополнительными испытаниями.
Метанол окисляется до формальдегида, который обнаруживают по наиболее чувствительным для него реакциям окрашивания с кодеином в концентрированной серной кислоте и с фуксинсернистой кислотой (сине-фиолетовое окрашивание). Поскольку метанол определяют по продукту его окисления – формальдегиду, исследуемый отгон необходимо предварительно проверить на отсутствие формальдегида, чтобы избежать ошибки переоткрытия метанола. В отсутствие формальдегида реакция имеет положительное судебно-химическое значение для метанола и позволяет обнаружить метанол в присутствии других спиртов. Этиловый спирт окисляется до ацетальдегида , а изоамиловый спирт - до изовалерианового альдегида, которые обладают характерным запахом и определяются по его наличию. В судебно-химических исследованиях иногда приходится решать задачу обнаружения какого-либо спирта при возможном присутствии других. Для этого должны быть использованы специфичные реакции, позволяющие отличить спирты друг от друга при их совместном присутствии. Реакциями отличия служат:
Таким образом, при судебно-химических исследованиях доказательство этанола в дистилляте строится на общих реакциях и реакции образования йодоформа. Этой реакции придается отрицательное судебно-химическое значение, то есть по ней можно делать вывод только о необнаружении этанола. Исследование на этанол обязательно начинается с йодоформной пробы, а при положительном ее результате требуется выполнить все остальные реакции. Заключение о нахождении этанола делается по комплексу положительных результатов всех реакций. Для предварительного обнаружения метилового и этилового спиртов в моче и крови применяются так называемые предварительные пробы. Для этого к 1 мл мочи добавляют 10% раствор дихромата калия в 50% растворе серной кислоты. При наличии спиртов протекает реакция их окисления, а Сr+6 восстанавливается до Сr+3, при этом раствор окрашивается в зеленый цвет. Поскольку реакция эта неспецифична, то положительный результат требуется подтвердить дополнительными пробами: кровь (5 мл) или мочу (10 мл) подвергают перегонке с водяным паром, а затем проделывают реакцию образования йодоформа на этанол и реакцию окисления метанола до формальдегида. При экспертизе алкогольного опьянения наряду с клинической диагностикой применяются химические методы определения алкоголя в выдыхаемом воздухе.
В две чистые сухие пробирки наливают по 2 мл дистиллированной воды. В одну из них опускают пипетку с узким вытянутым концом, и испытуемый пропускает через нее 1,9-2,1 л выдыхаемого воздуха. Объем воздуха может дозироваться продолжительностью выдоха или с помощью дозирующего устройства. В первом случае для продувания воздуха используют пипетку типа пастеровской и воздух продувают в течение 20-30 секунд. Проходя через воду, алкоголь, содержащийся в выдыхаемом воздухе, растворяется в ней, и затем наличие его определяется с помощью следующей реакции окисления: в обе пробирки приливают осторожно по 20 капель химически чистой концентрированной серной кислоты и после этого по 1 капле 0,5% свежеприготовленного раствора марганцовокислого калия. Необходимо тщательное выполнение технологии проведение пробы: соблюдение последовательности операций, использование свежеприготовленных дистиллированной воды и 0,5% раствора перманганата калия, чисто вымытых и высушенных пробирок и пипеток, шлангов, проведение реакции в контрольной пробирке. При полном или частичном обесцвечивании раствора пробу через 15-20 минут проводят повторно. Полное обесцвечивание раствора за 1-2 минуты при повторной пробе свидетельствует о наличии экзогенного алкоголя в выдыхаемом воздухе, что при точном соблюдении методики исследования может подтвердить факт потребления испытуемым спиртных напитков. Если при повторной пробе полного обесцвечивания раствора в течение 2 минут не наступило, результаты пробы расцениваются как отрицательные. Изменение цвета раствора в контрольной пробирке свидетельствует о нарушении условий проведения пробы (загрязненная посуда, некачественные регенты) и опровергает результаты исследования.
Эти трубки имеют сухую индикаторную набивку (реагент), что исключает необходимость в проведении каких-либо манипуляций с реактивами в момент экспертизы. Реагент индикаторных трубок состоит из носителя (силикагеля), импрегнированного раствором хромового ангидрида в концентрированной серной кислоте. При воздействии на реагент парами этилового спирта происходит реакция, во время которой этиловый спирт восстанавливают ионы шестивалентного хрома до ионов трехвалентного хрома, в связи с чем оранжевый или желтый цвет реагента изменяется на зеленый, что оценивается как положительная реакция. Несмотря на некоторую неспецифичность метода, все же индикаторные трубки выгодно отличаются от других проб тем, что при воздействии на реагент парами некоторых веществ, лекарств и ядов отсутствует положительная реакция реагента, в то время как она имеет место в других пробах. Реагент изменяет цвет на зеленый при воздействии паров следующих веществ: этилового и метилового спиртов, эфиров, ацетона, альдегидов, сероводорода. При воздействии бензина, скипидара, уксусной кислоты, камфоры, а также фенола, дихлорэтана, реагент приобретает темно-коричневую или коричневую окраску. При воздействии паров валидола, ментола, воды, хлороформа, хлоралгидрата, керосина, аммиака, щелочи, этиленгликоля, окиси углерода, чистого выдыхаемого воздуха и слюны цвет реагента - оранжевый. Ввиду гигроскопичности индикатора трубки вскрываются непосредственно перед употреблением. По этой же причине индикаторные трубки рассчитаны только для однократного употребления даже при наличии отрицательной реакции. Индикаторные трубки, имеющие нарушение герметизации, а также изменившие окраску реагента на зеленый цвет, употреблению не подлежат. Ш.Термокаталитический метод. Метод основан на сорбировании паров алкоголя выдыхаемого воздуха с последующей термодесорбцией и сжиганием на элементах чувствительного детектора. Этот принцип реализуется с помощью прибора для определения паров спирта в выдыхаемом воздухе - ППС-1. Конструкция прибора обеспечивает подогревание выдыхаемого воздуха и отбор для анализа пробы именно альвеолярного воздуха. Калибровка прибора производится с помощью генератора контрольных смесей ГС-2, производящего пароспиртовоздушные смеси с определенным содержанием в них алкоголя. Прибор ППС-1более чувствителен и точен в сравнении с качественными реакциями. Инструкция по медицинскому применению прибора ППС-1 с описанием порядка работы и указанием критериев выявления паров алкоголя в выдыхаемом воздухе входит в комплект прибора. Следует отметить, что термокаталитический метод, реализуемый с помощью прибора ППС-1, также как и качественные пробы на алкоголь (Рапопорта, трубки Мохова-Шинкаренко и «Контроль трезвости»), неизбирателен по отношению к этиловому спирту. Указанные способы дают положительные результаты и при наличии в выдыхаемом воздухе ряда других летучих веществ, например, ацетона, эфиров, метанола. В связи с этим в практике экспертизе алкогольного опьянения перечисленные методы используются как предварительные пробы. Доказательное значение имеет лишь отрицательный результат качественных проб и исследований с помощью прибора ППС-1 или сочетание положительных реакций с клинической картиной опьянения. В ряде случаев у освидетельствуемого необходимо отбирать на исследование жидкие биологические среды (мочу, слюну или кровь) для проведения количественного определения алкоголя в них предпочтительно методом газовой хроматографии. В настоящее время в судебно-химическом анализе и в диагностике алкогольного опьянения наиболее предпочтительным, а иногда и единственным допустимым методом идентификации и количественного определения спиртов является метод газожидкостной хроматографии. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ СПИРТОВ Количественное определение спиртов базируется на их общих реакциях: окислении до альдегидов и образовании сложных эфиров. Из всех спиртов, имеющих токсикологическое значение, только этиловый подлежит обязательному количественному определению при судебно-химических исследованиях. Это обусловлено следующими причинами:
В судебно-химической практике для количественного определения этанола используют методы, основанные на окислении его до ацетальдегида и образовании сложного эфира с азотистой кислотой – этилнитрита. Известно много методов, в том числе химических, но в настоящее время наибольшее значение приобрели наиболее чувствительные и точные современные методы – биохимический и инструментальный (метод ГЖХ). На их рассмотрении мы и остановимся. М АДГ етод биохимический (энзимный, ферментативный, метод АДГ) был разработан в 1951г. Бюхером и Родецки и применяется, в основном, в зарубежных лабораториях. Метод основан на реакции окисления этанола до ацетальдегида под действием фермента алкогольдегидрогеназы (АДГ). CH3CH2OH  - H2AДГ CH3COH 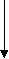 H2ДPN + AДГ λ=366нм Акцептором водорода в реакции служит дифосфопиридин-нуклеотид (ДПН), восстановленная форма которого обладает характерным светопоглощением при длине волны 366 нм. Измеряя оптическую плотность продукта реакции, можно рассчитать содержание этанола в исследуемом объекте, т.к. количество восстановленной формы ДПН, т.е. его оптическая плотность, пропорциональны количеству этанола. Расчет ведут по калибровочному графику, построенному по растворам этанола с известной концентрацией. Судебно-химическая оценка метода. Метод чувствителен (0,1-0,2‰) на уровне естественного содержания этанола в организме, специфичен, позволяет проводить серийные анализы, однако требует специального оборудования и особо чистых ферментов (АДГ и ДПН), в связи с чем в нашей стране не нашел применения. Метод газожидкостной хроматографии (ГЖХ) основан на переведении этанола в более летучее соединение – этиловый эфир азотистой кислоты (этилнитрит). Прежде, чем перейти к описанию этого метода, рассмотрим основные его теоретические положения и аппаратурное оформление и остановимся на преимуществах его перед химическими методами анализа. Достоинства метода ГЖХ.
Теоретические предпосылки метода Теоретические основы метода ГЖХ изложены Мартином и Синджем в 1941г., а для аналитических целей он предложен в 1952г. Мартином и Джеймсом. В химико-токсикологическом анализе метод применяется с 1968г., когда он был предложен В.Ф.Пономаревым для определения одноатомных спиртов С1 – С5 . В настоящее время эта методика расширена для определения алкилгалогенидов и других «летучих» ядов. Газожидкостная хроматография является одним из видов распределительной хроматографии, где в качестве подвижной фазы используется газ, а неподвижной – жидкость, нанесенная в виде тонкой пленки на гранулы твердого носителя, которым заполняется колонка. Разделение компонентов смеси основано на различии коэффициентов распределения этих компонентов между подвижной и неподвижной фазами, что приводит к различной скорости передвижения компонентов по колонке. К = Сs /См , где К – коэффициент распределения, Сs – концентрация в стационарной (неподвижной) фазе, Сv - концентрация в мобильной (подвижной) фазе. Графическим отображением процесса разделения является хроматограмма, представляющая собой ряд хроматографических пиков, каждый из которых соответствует одному из разделяемых веществ. Основные элементы хроматограммы Н  а хроматограмме отмечают ввод пробы. Первый пик- это пик несорбируемого компонента (воздух, растворитель), последующие пики – пики анализируемых веществ. В первую очередь появляются пики веществ с малой сорбируемостью неподвижной жидкой фазой, т.е. с малым коэффициентом распред еления. а хроматограмме отмечают ввод пробы. Первый пик- это пик несорбируемого компонента (воздух, растворитель), последующие пики – пики анализируемых веществ. В первую очередь появляются пики веществ с малой сорбируемостью неподвижной жидкой фазой, т.е. с малым коэффициентом распред еления.Нулевая линия – касательная к местам перегиба пиков ( отражает сигнал детектора от газа-носителя). Величина h – высота хроматографического пика – это перпендикуляр, опущенный от вершины пика на его основание. Величина b1 – ширина пика у основания – часть нулевой линии, отсеченная касательными к сторонам пика. Величина b – ширина пика на середине его высоты. Площадь пика S численно равна площади треугольника: S= b· h = ½ b1 ·h Основные газохроматографические параметры
Время удерживания (абсолютное) – это отрезок времени, который проходит с момента ввода вещества в колонку до появления максимума пика вещества на хроматограмме. На хроматограмме оно отображается как расстояние от точки ввода пробы до выхода максимума пика вещества. Чаще приходится использовать другие характеристики. Исправленное время удерживания рассчитывается как разность абсолютного времени удерживания вещества и времени удерживания несорбируемого компонента: t испр.=t абс. - t н.к. Время удерживания может меняться в зависимости от условий хроматографирования, поэтому более надёжной величиной является относительное время удерживания, которое рассчитывается как отношение абсолютного времени удерживания искомого вещества к времени удерживания вещества – метчика (стандарта): t отн. = t абс. / t ст. Относительное время удерживания является величиной более постоянной, так как на него меньше влияют условия проведения хроматографического процесса.
Удерживаемый объем V– это объем газа-носителя, необходимый для вымывания всего количества вещества из колонки, который численно равен произведению скорости газа – носителя U на время удерживания t: V = U · t Скорость газа измеряется в мл/мин, время удерживания – в минутах. В зависимости от того, какое используется для расчета время удерживания – абсолютное или исправленное - получаем абсолютный или исправленный (приведенный) удерживаемый объем. Удерживаемый объем, как абсолютный, так и исправленный, может меняться с изменением хроматографических условий, поэтому более постоянным является относительный удерживаемый объем, который рассчитывается как отношение абсолютного (или исправленного) объема к удерживаемому объему вещества-стандарта: Vотн.= V абс.(испр.) / Vст. Качественный анализ проводят, сравнивая время удерживания искомых веществ с временами удерживания стандартных веществ (эталонов). При совпадении этих параметров делают вывод о возможной идентичности этих веществ. Хроматографирование ведут в одинаковых условиях для стандарта и искомого вещества, используя 2-3 колонки различной полярности, что повышает надежность метода. Можно добавить предполагаемое (искомое) вещество в анализируемую смесь, и если при этом произойдет увеличение высоты и площади пика на хроматограмме (но не изменение времени удерживания), то можно предположить их идентичность. Количественное определение разделенных компонентов смеси проводится по высоте или площади хроматографических пиков. Высоту используют в случае узких и симметричных пиков, а площадь – когда пик широкий и асимметричный. Расчет ведут по калибровочному графику зависимости концентрации от высоты или площади пиков. Возможны два варианта количественного определения: метод абсолютной калибровки и метод с использованием внутреннего стандарта. Более стабильные результаты дает метод внутреннего стандарта. При этом наряду с исследуемым веществом вводится вещество-стандарт в известном количестве, а при расчете учитывается соотношение высот (или площадей) соответствующих им пиков. Несмотря на колебания в работе прибора, соотношение высот пиков исследуемого вещества и внутреннего стандарта остается постоянным, что позволяет получать стабильные результаты. К внутреннему стандарту предъявляется ряд требований:
Расчет концентрации вещества проводят по калибровочной кривой, откладывая на оси абсцисс концентрацию, а по оси ординат – отношение высот (или площадей) пиков исследуемого вещества и внутреннего стандарта. 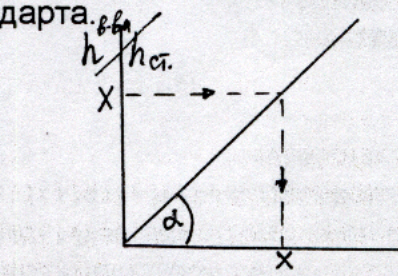 Можно использовать метод расчета по котангенсу угла наклона калибровочной кривой, который рассчитывается заранее по растворам веществ с известной концентрацией. ctg α = Cі / hі/hвн.ст., отсюда Сі = hі /hвн.ст. · ctg α Метод позволяет производить расчет по рассчитанному значению котангенса без построения калибровочного графика, и дает более точное определение. Аппаратурное оформление метода ГЖХПрибор для определения спиртов и других «летучих» ядов состоит из следующих блоков: 2  - устройство ввода пробы 3- хроматографическая колонка (разделение веществ) 4- детектор (регистрация сигналов веществ) 5- самописец (хроматограмма)
В химико-токсикологическом анализе в качестве газа – носителя чаще всего используются азот и гелий.
Набивка колонки состоит из твердого носителя (т.н.) и неподвижной жидкой фазы (н.ж.ф.), которая в виде тонкой пленки наносится на гранулы т.н. Большинство твердых носителей готовят из диатомитовой (диатомовой) земли, представляющей из себя разновидность окислов кремния, а также из огнеупорного кирпича (инзенский кирпич), который по свойствам близок к диатомитовой земле. В настоящее время существует большое количество синтетических т.н. различных марок. Чаще всего используется хроматон, хромосорб, полисорб, целит и др. Основные требования к твердому носителю:
В качестве неподвижной жидкой фазы обычно используют жидкие высокомолекулярные вещества (ВМС), имеющие высокую температуру кипения. Н.ж.ф. наносят тонким слоем на гранулы т.н. в количестве от 5 до 30% от его веса, чтобы не было слипания частиц т.н. К ВМС такого типа относятся полиэтиленгликоли ( полиэтиленгликоль с молекулярной массой 1000-1500, триэтиленгликоль), эфиры полиэтиленгликолей, смеси углеводородов, различные высококипящие масла и ряд других веществ (около 400 наименований). Характеристики различных н.ж.ф. приводятся в справочной литературе. Требования к н.ж.ф.:
Катарометр. Схема устройства. 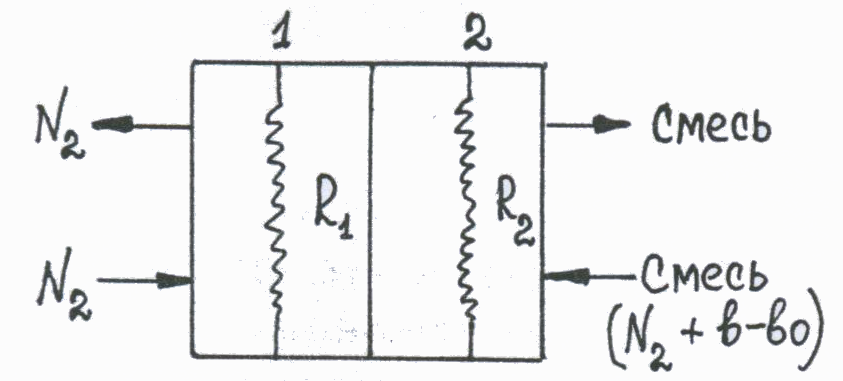
Принцип действия катарометра состоит в измерении разности теплопроводностей чистого газа-носителя, поступающего в сравнительную камеру детектора, и смеси газа с анализируемым веществом, выходящей из колонки в измерительную камеру. Чем больше эта разница, тем выше чувствительность детектора. Самой большой теплопроводностью обладает гелий, поэтому при работе с ним достигается наиболее высокая чувствительность детектора. При использовании в качестве газа-носителя азота чувствительность снижается. Нити сопротивления R1 и R2 в сравнительной и измерительной камерах детектора одинаковы. Если в обе камеры поступает чистый газ-носитель, одинаково охлаждающий сопротивления R1 и R2, тока в цепи детектора не возникает, так как эти сопротивления являются плечами моста Уитстона. 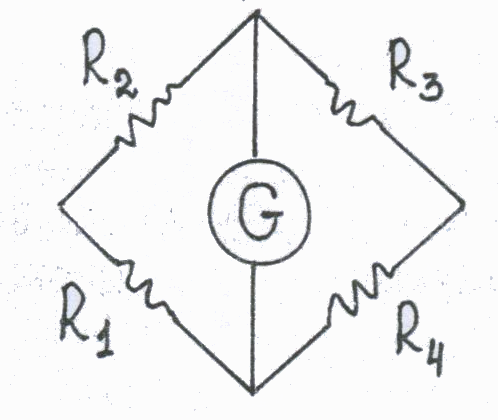 На схеме моста Уитстона На схеме моста Уитстона R3 и R4 – уравновешивающие сопротивления, G- гальванометр. В этом случае самописец вычерчивает прямую линию (сигнал от газа-носителя, нулевая линия на хроматограмме). Когда в газовом потоке появляется вещество (в измерительной камере), меняется теплопроводность газа, что приводит к изменению сопротивления R2, разбалансировке моста и возникновению тока в цепи детектора. Сигнал с детектора поступает на самописец, который вычерчивает хроматографический пик. Величина пика (т.е. высота и площадь) пропорциональна сигналу детектора и количеству вещества в пробе, на чем и основано количественное определение. Катарометр является универсальным детектором, он реагирует на все вещества (органические и неорганические), теплопроводность которых отличается от теплопроводности газа-носителя. Чувствительность определения составляет 10-3 - 10-5 г. Ионизационно-пламенный детектор (ПИД). Схема устройства. 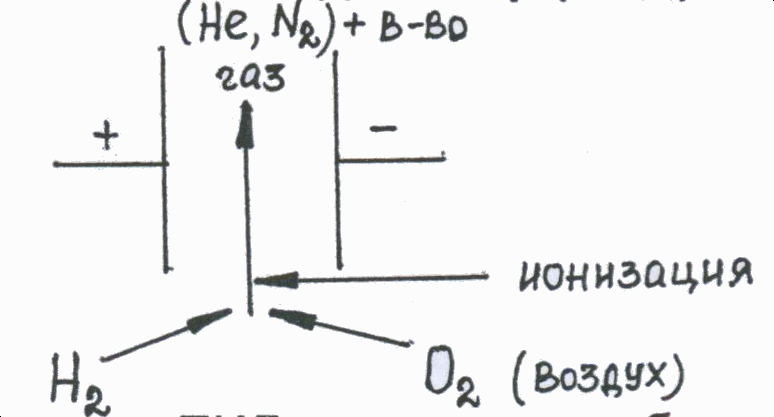 В настоящее время ПИД является наиболее распространенным в газовой хроматографии. Принцип работы ПИД основан на том, что выходящий из колонки газ смешивается с водородом и сжигается в атмосфере воздуха или кислорода. Образующиеся в присутствии исследуемого вещества ионы и электроны ионизируют пламя, в результате чего возникает ионный ток между электродами детектора, находящимися под напряжением. Сигнал детектора (ионный ток) поступает на самописец, вычерчивающий хроматограмму. Чувствительность ПИД на несколько порядков выше чувствительности катарометра и составляет 10-9-10-12 г/сек. (количество органического вещества, поступающего в камеру ПИД в единицу времени). ПИД чувствителен ко всем органическим соединениям и проявляет к ним селективность. Мало чувствителен по отношению к воде, окиси и двуокиси углерода, аммиаку, окислам азота и ряду других веществ. Низкая чувствительность ПИД к воде делает его особенно удобным при анализе биологических жидкостей. Определение этанола методом ГЖХ Определение этилового спирта в биологических жидкостях (крови и моче) методом ГЖХ при судебно-химических исследованиях было предложено в 1968 году судебным химиком Таджикского республиканского БСМЭ В.Ф.Пономаревым. Метод основан на превращении спиртов в сложные эфиры азотистой кислоты – алкилнитриты, высоколетучие соединения, которые подвергаются газохроматографическому анализу. В основе метода лежат реакции: R-OH → R-ONO CCl3COOH + NaNO2 → CCl3COONa + HNO2 HNO2 + C2H5OH → C2H5ONO↑ + H 2O избыток 2HNO2 → H 2O +NO+NO2 Эти реакции выполняются в герметично укупоренном флаконе. Парогазовую фазу, содержащую алкилнитриты, в количестве 0,5 – 3мл отбирают шприцем, прокалывая пробку флакона, и вводят в колонку хроматографа. При определении спиртов технические параметры следующие
Спирты выходят из колонки в порядке молекулярной массы в гомологическом ряду, причем изомеры выходят раньше нормальных спиртов. Хроматограмма смеси спиртов С1 – С5 в виде их алкилнитритов выглядит следующим образом: 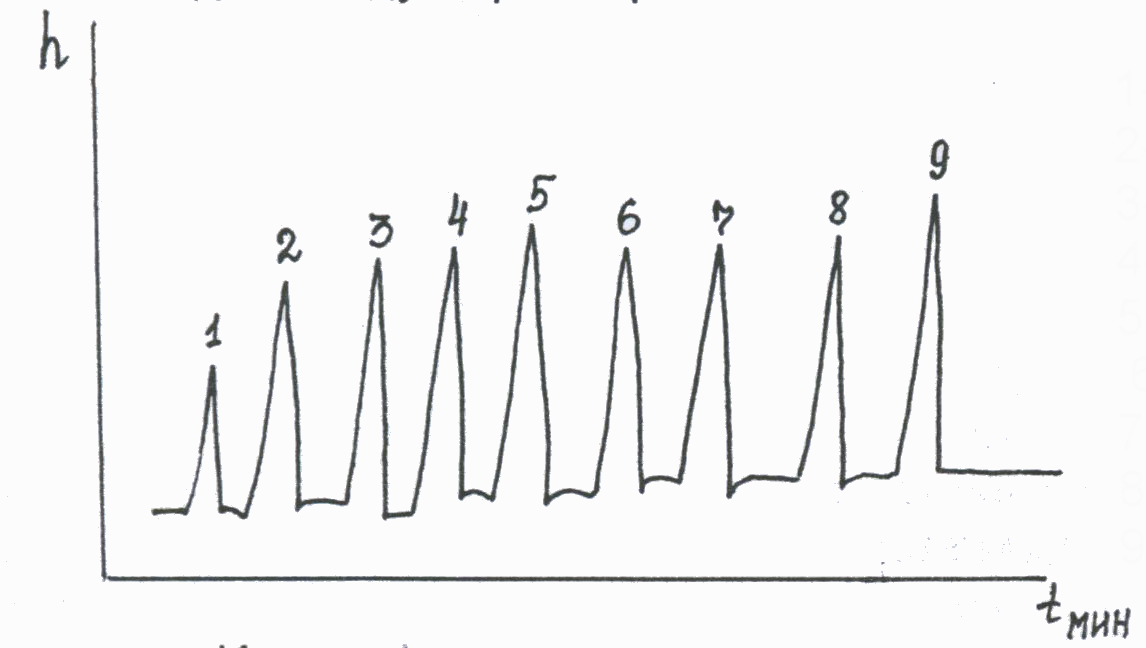 1-окислы азота NO и NO2 2-метилнитрит CH3ONO 3-этилнитрит C 2H 5ONO 4-изопропилнитрит i-C 3H 7ONO 5-пропилнитрит н- C 3H 7ONO 6-изобутилнитрит i-C 4H 9ONO 7-бутилнитрит н-C 4H 9ONO 8-изоамилнитрит i-C 5H 11ONO 9-амилнитрит н-C 5H 11ONO Идентификацию спиртов проводят по относительному времени удерживания их алкилнитритов, используя в качестве метчика (стандарта) метанол. Разделение веществ на колонке дает возможность определять индивидуально каждый спирт и другие «летучие» яды, т.е. делает метод специфичным. Количественное определение этанола проводят по высоте или площади хроматографического пика, используя метод внутреннего стандарта. В качестве внутреннего стандарта используют нормальный или изо-пропанол, который добавляют в известном количестве во флакон с пробой. Расчет проводят по калибровочному графику, который строится заранее по растворам этанола с известной концентрацией (1, 3 или 5‰), или по методу котангенса. Калибровка строится по водным растворам этанола, поэтому при работе с биожидкостями вводят поправочные коэффициенты: 0,95 для крови и 1,05 для мочи. 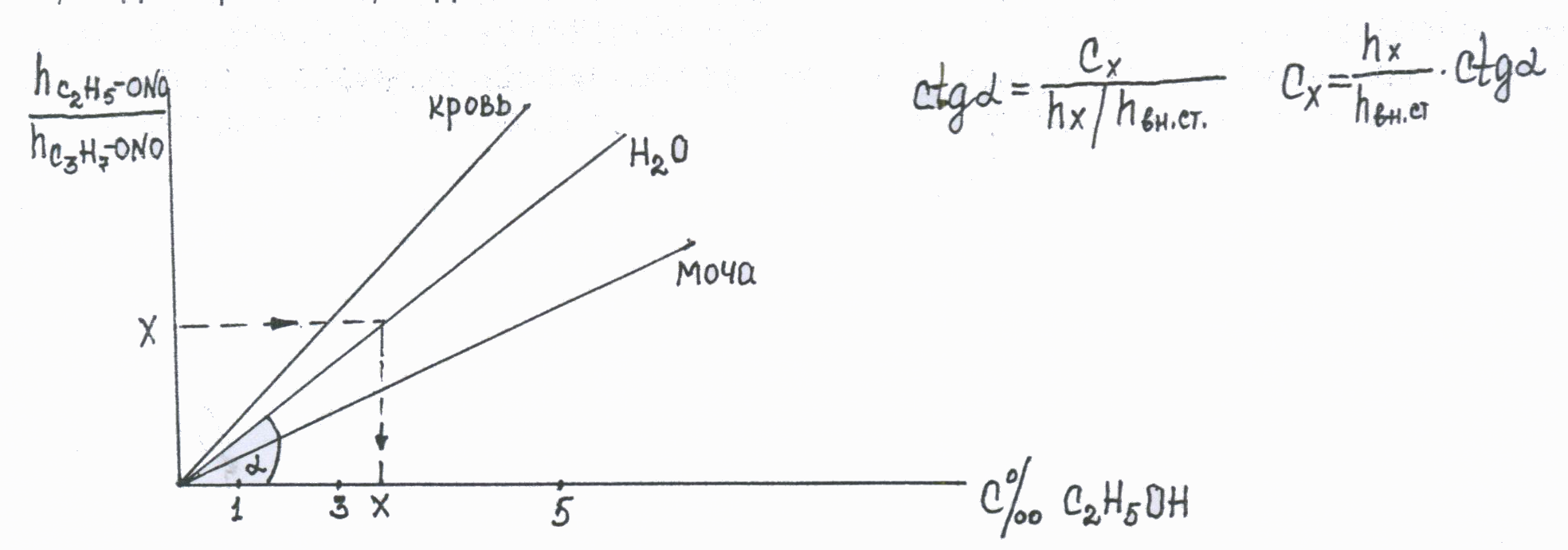 Оценка результатов количественного определения этанола в крови человека Данные о количественном содержании этанола в крови лежат в основе клинико-лабораторной диагностики степени опьянения. Установлена зависимость между содержанием этанола в крови и функциональным состоянием организма. Критерии этой зависимости:
Эта шкала имеет относительный характер, так как не всегда есть строгая корреляция между содержанием этанола в крови и функциональным состоянием организма. Степень и особенности функциональной реакции на прием алкоголя носят строго индивидуальный характер и зависят от многих факторов, таких, как: -индивидуальная чувствительность организма, -пол, возраст человека, -состояние организма (болезнь, утомление и др.), -форма, в которой принят алкоголь (водка, пиво и т.д.) и интервал между приемами, -характер и количество принятой пищи и ряд других. Даже у одного и того же лица одинаковые количества спирта, принятые в разное время при прочих равных условиях, могут вызвать различную функциональную реакцию и привести к разным степеням опьянения. При судебно-химической оценке результатов определения этанола следует учитывать также падение количества алкоголя в крови за 1 час, составляющее 0,1- 0,15‰, поскольку между моментом происшествия и моментом смерти проходит обычно некоторый период времени, в течение которого протекают процессы метаболизма и выделения спирта из организма. |
