лекции токса. Лекции по токсикологической химии
 Скачать 5.01 Mb. Скачать 5.01 Mb.
|
Применение дитизонаДитизон (дифенилтиокарбазон), введен в аналитическую практику в 1957 г. Фишером, который предписывает следующую структуру органического реагента. В зависимости от рН среды, дитизон может существовать в двух таутомерных формах: в кислой среде – в кетоформе, в щелочной среде – в енольной форме. 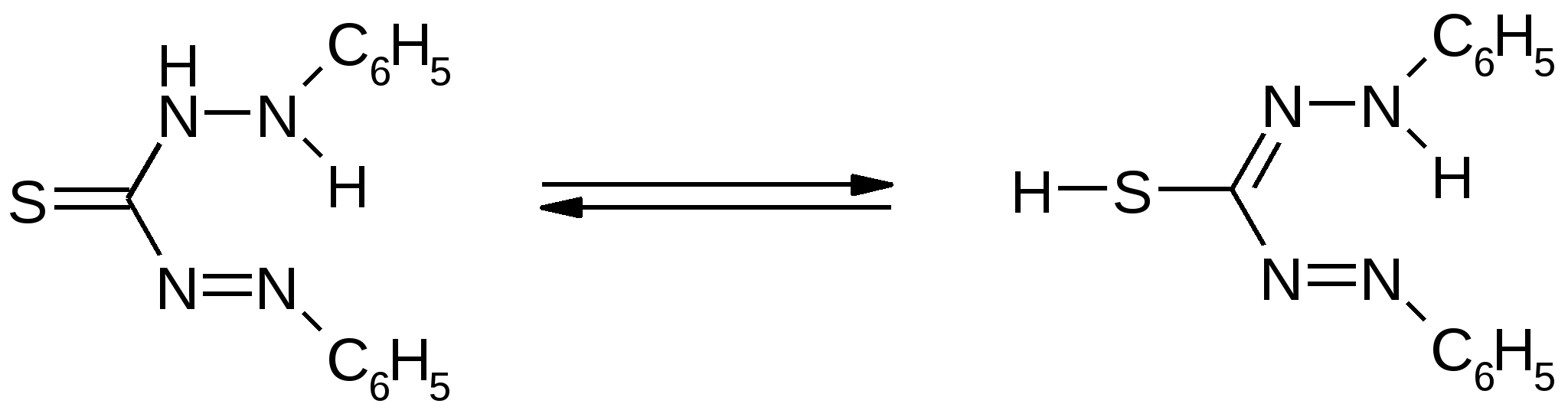 Свойства дитизонатов
Методы количественного определения При отравлении «металлическими» ядами содержание их в различных органах будет колебаться в зависимости от принятого количества, времени наступления смерти и оказания помощи. Поэтому для каждого элемента рекомендованы два метода количественного анализа (фотоэлектроколориметрический и объемный) или один метод определения в широком интервале концентраций. Классификация и характеристика методов количественного определения
ГРУППА ТОКСИКОЛОГИЧЕСКИ ВАЖНЫХ ВЕЩЕСТВ, ИЗОЛИРУЕМЫХ ЭКСТРАКЦИЕЙ ВОДОЙ (МИНЕРАЛЬНЫЕ КИСЛОТЫ, ЩЁЛОЧИ И ИХ СОЛИ) К группе веществ, изолируемых экстракцией водой (с помощью диализа), относятся минеральные кислоты: серная, азотная и хлористоводородная; щелочи: гидроксиды калия, натрия и аммония; и некоторые соли, имеющие токсикологическое значение: нитрит натрия (реже калия), нитраты натрия и аммония (реже калия). Исследование на данную группу веществ проводится в том случае, если материалы дела указывают на отравление этими веществами. В случае перехода кислот в соли, а щелочей в углекислые соли их обнаружение невозможно, так как эти соединения являются составными частями организма. Минеральные кислоты и щелочи широко применяются в народном хозяйстве и легко доступны. Известны случаи умышленных отравлений и самоотравлений кислотами, преступного вредительства, обливания серной кислотой. Кислоты также могут вызвать профессиональные отравления. Пары серной кислоты содержатся в воздухе помещений, где её производят, а газообразный серный ангидрид с влагой воздуха образует серную кислоту. Азотная кислота имеет значение профессионального яда вследствие образования окислов азота при её изготовлении, а также вследствие широкого применения для растворения и травления металлов. Пары хлористого водорода в воздухе рабочих помещений могут вызвать отравление. Смертельная доза при приёме внутрь концентрированной серной кислоты – 5г, концентрированной азотной кислоты – 8г, соляной кислоты -15г. Известны случаи отравления селитрами (КNO3, NaNO3) при смешении их с другими солями (например, с хлоридом натрия или вместо хлорида натрия использовались в пищу) и при большом их приёме (доза около 5г считается ядовитой, а приём 9г является смертельной). На первом месте по частоте отравлений среди щелочей стоит едкий натр (каустическая сода). Довольно часто наблюдаются случаи отравлений и самоотравлений водным раствором аммиака (нашатырный спирт) и при вдыхании газообразного аммиака в воздухе рабочих помещений. Объектами исследования являются содержимое желудка, рвотные массы, остатки пищи, части одежды, а при исследовании на соли ещё печень. Внешний вид объектов исследования может указывать на отравление той или иной кислотой. При отравлении концентрированной серной кислотой происходит сильное повреждение тканей губ, языка, пищевода, желудка, одежды. Характерным признаком концентрированной серной кислоты является обугливание углеводов. Концентрированная азотная кислота поражает ткани языка, пищевода, слизистой желудка. Кожа лица становится желтушной. Если концентрация азотной кислоты менее 20% жёлтой окраски может не быть. Свободная азотная кислота при достаточной концентрации фиксируется на белковых объектах, окрашивая их в жёлтый цвет, переходящий от аммиака в оранжевый (ксантопротеиновая реакция). Открытие иона хлора азотнокислым серебром (обильное выпадение осадка) при наличии свободной минеральной кислоты делает необходимым испытание на свободную соляную кислоту. Реакция среды исследуемых жидкостей может дать ясные указания на отравление тем или иным веществом. Для доказательства минеральных кислот используют кислотно-основные индикаторы: лакмус, метиловый оранжевый, метиловый фиолетовый, конго красный и другие. Кислая реакция на лакмус может обусловливаться наличием свободных кислот, кислых солей сильных кислот и солей тяжёлых металлов. Кислая реакция содержимого желудка уже исключает возможность открытия введённых в организм едких щелочей. Содержимое желудка и ткани внутренностей имеют кислую реакцию на лакмус не вследствие их первоначальной кислотности (соляная кислота желудочного сока уже не открывается в трупе), а как результат кислотного брожения, вызываемого бактериями. С переменой бактерийной флоры начинается щелочное брожение, образуются аммиак и сероводород, содержимое желудка приобретает щелочную реакцию на лакмус. При этом часто успевают нейтрализоваться до исследования даже введённые внутрь кислоты, что делает невозможным их открытие. Ярко выраженная кислая реакция среды не является окончательным доказательством присутствия минеральных кислот. Щелочная реакция на лакмус может обусловливаться наличием едких щелочей и их углекислых солей. Для их отличия используют фенолфталеин. Несколько капель испытуемой жидкости смешивают с одной – двумя каплями спиртового раствора фенолфталеина и взбалтывают с избытком хлористого бария. Если присутствует едкая щёлочь, розовая окраска фенолфталеина не исчезает, а присутствие углекислых солей приводит к обесцвечиванию раствора. 2NaOH + BaCl2 = 2NaCl + Ba(OH)2 Ba(OH)2 = Ba2+ + 2OH- Na2CO3 + BaCl2 = 2NaCl + BaCO3↓ Изолирование. Объект смешивают с небольшим количеством дистиллированной воды до густой кашицы (способной фильтроваться) и фильтруют через 1-2 часа. Для увеличения скорости фильтрования используют водоструйный насос. Смесь до фильтрования или фильтрат для отделения белковых веществ подвергают диализу. Диализ – разделение растворённых веществ, различающихся молекулярными массами. Процесс основан на неодинаковых скоростях диффузии этих веществ через проницаемую мембрану, разделяющую концентрированные и разбавленные растворы. Под действием градиента концентрации растворённые вещества с разными скоростями диффундируют через мембрану в сторону разбавленного раствора. Скорость переноса веществ в обратном направлении снижается вследствие диффузии растворителя (обычно вода). Для диализа используют нитро и ацетилцеллюлозные мембраны. Мембраны – это разделительные перегородки. Разделение с помощью мембран – результат конкурирующих взаимодействий компонентов смеси с поверхностью перегородки. В пограничном слое около поверхности перегородки накапливается вещество, имеющее наименьшую скорость проницания. Кроме диализа для этих целей используют электродиализ. Электродиализ - метод разделения растворов под действием электродвижущей силы, которая создаётся по обе стороны полимерных перегородок. Электродиализаторы состоят из ряда камер, по которым перемещаются растворы электролитов. Они широко используются для обессоливания растворов. Диализ объекта проводят 2-3 раза по 4-6 часов. Полученные диализаты выпаривают на водяной бане до объёма 5-10 мл и исследуют на наличие кислот, щелочей и солей. При исследовании одежды и некоторых других объектов могут быть использованы вытяжки без диализа. Минеральные кислоты. При ярко выраженной кислой реакции диализата проводят исследование на наличие анионов кислот. Обнаружение анионов серной, азотной и соляной кислот не является доказательством отравления кислотами, так как эти анионы могут быть в организме как составная часть органов и тканей. Для доказательства кислот необходимо отогнать их из диализата и исследовать отгон на наличие свободных кислот, соли этих кислот при этом не отгоняются. Едкие щёлочи. Доказательством отравления едкими щелочами является ярко выраженная щелочная реакция диализата (рН 8-10, индикатор фенолфталеин). При гидролизе карбонатов щелочных металлов также могут образоваться щелочи, поэтому вытяжку необходимо проверить на наличие карбонатов (см. выше). Предварительной пробой на аммиак является посинение красной лакмусовой бумажки от паров вытяжки. Обнаружение аммиака в биологическом материале может говорить не только об отравлении им, но и об образовании аммиака при гниении трупного материала. При гниении трупного материала кроме аммиака образуется сероводород. Почернение бумажки, пропитанной щелочным раствором уксуснокислого свинца, указывает на наличие сероводорода и на процессы гниения исследуемых объектов, что делает невозможным открытие введённого аммиака. Соли. Наличие нитритов в диализате доказывают при помощи реакций диазотирования с ароматическими аминами. ГРУППА ТОКСИКОЛОГИЧЕСКИ ВАЖНЫХ ВЕЩЕСТВ, ТРЕБУЮЩИХ ОСОБЫХ МЕТОДОВ ИЗОЛИРОВАНИЯ (СОЕДИНЕНИЯ ФТОРА) К этой группе веществ относятся соли фтористоводородной (плавиковой) кислоты: NaF, NH4F, LiF, CaF2, BaF2, PbF2, CuF2 2H2O, NH4HF2, CrF3, Na3AlF6 (3NaF AlF3) и другие, а также соли кремнефтористоводородной кислоты: Na2SiF6, K2SiF6, CaSiF6 2H2O, BaSiF6 и другие. Данные соли применяются в промышленности, сталеварении, стекловарении, в качестве консерванта древесины, в сельском хозяйстве в качестве инсектицидов. Отравления соединениями фтора обусловлены их ошибочным применением в быту вместо других солей. Токсическая доза для человека 0,012г; смертельная –10г. Клиника и патологоанатомическая картина отравлений фторидами нехарактерна, наблюдаются лишь местные воспалительные явления. Поэтому диагностика отравлений ими затруднительна. Токсическое действие объясняется поражением некоторых ферментных систем и обмена веществ, особенно углеводного и солевого. При остром отравлении происходит поражение центральной нервной системы и желудочно-кишечного тракта, а при хроническом происходит изменение в зубах и костях (флюороз). Фториды поступают в организм через желудочно-кишечный тракт, где кислая реакция желудочного сока способствует переходу нерастворимых соединений фтора в более растворимые, что улучшает их всасываемость. В организме фтор вытесняет иод из некоторых его органических соединений, а также образует комплексные соединения с рядом микроэлементов. Наибольшая концентрация фтора обнаруживается в железах внутренней секреции, костях и зубах. Выделение фтора из организма осуществляется почками, желудочно-кишечным трактом и потовыми железами. В моче фтор появляется через 30 минут после введения в желудок, достигая максимума выделения на 1-5 день. За три недели с мочой выделяется до 55% введённой дозы. Объектами исследования являются моча, содержимое желудка, внутренние органы и пищевые продукты. Изолирование. Измельчённый объект в количестве 25 г подщелачивают избытком едкой извести, смачивают раствором нитрата аммония или концентрированной азотной кислотой, высушивают и прокаливают при температуре не выше 500оС до полного сжигания. Параллельно делают слепой опыт. Качественное обнаружение. Большинство методов открытия фтора основано на травлении стекла. Принцип таких методов заключается в разрушении силикатной основы стекла фтористым водородом с образованием летучего SiF4 SiO2 + 4HF = SiF4 + 2H2O 1. Часть остатка в платиновом (или свинцовом) тигле смачивают несколькими каплями воды и небольшим количеством концентрированной серной кислоты. Тигель быстро закрывают часовым стеклом, низ которого покрыт воском и на поверхности воска сделана какая-нибудь надпись при помощи острия иглы. Пробу оставляют на сутки и наблюдают травление стекла в тех местах, где была сделана надпись за счёт выделения фтористого водорода. Скорость травления стекла можно увеличить при нагревании, но в этом случае вместо воска нужно использовать специальный лак. 2. Часть полученной золы после изолирования смешивают в пробирке с песком (SiO2) и добавляют немного концентрированной серной кислоты. У отверстия пробирки держат стеклянную палочку с капелькой воды. При наличии фтора выделяется SiF4, что приводит к помутнению капельки воды на кончике стеклянной палочки за счёт образования кремниевой кислоты. 3SiF4 + 4H2O = H2SiO4 + 4H+ + 2[SiF6]2- 3. В пробирку с нагретой концентрированной кислотой помещают кристаллик бихромата калия и вносят испытуемую пробу (2-3 капли раствора или 5-10 мг порошка). Смесь нагревают и при наличии фтора наблюдают не смачиваемые места на стекле пробирки, от которых отстаёт тонкая плёнка хромовой смеси. Анализу мешают борная и кремниевая кислоты.
ГРУППА ВЕЩЕСТВ, НЕ ТРЕБУЮЩИХ ОСОБЫХ МЕТОДОВ ИЗОЛИРОВАНИЯ. ВРЕДНЫЕ ПАРЫ И ГАЗЫ. ОКСИД УГЛЕРОДА (II) Из ядовитых газообразных веществ особое токсикологическое значение имеет оксид углерода (II), который можно обнаружить и определить количественно без изолирования непосредственно в биологическом объекте. Оксид углерода (II), угарный газ (СО) – газ без цвета и запаха. С воздухом образует взрывоопасные смеси. Угарный газ находится везде, где существуют условия для неполного сгорания веществ, содержащих углерод. Токсическое действие. Окись углерода присоединяется к гемоглобину крови, образуя карбоксигемоглобин (НbСО), в результате чего понижается содержание кислорода в крови и тканях (аноксемия и гипоксия). Низкие концентрации кислорода оказывает токсическое действие на клетки, нарушая дыхание тканей. При остром отравлении угарным газом наступает головная боль, головокружение, тошнота, рвота, потеря сознания, коллапс, смерть. Симптомы отравления появляются при концентрации 0,2 мг на 1л воздуха и увеличиваются с повышением концентрации СО в воздухе и длительности воздействия. Для хронического отравления СО характерно разнообразие многочисленных симптомов, наиболее типичными из которых являются психическая и физическая астения, головные боли и головокружения. Поступление в организм и всасывание. Оксид углерода (II) поступает в организм через дыхательные пути и определяется концентрацией во вдыхаемом воздухе угарного газа и кислорода, длительностью воздействия СО и интенсивностью лёгочной вентиляции. Окись углерода взаимодействует с двухвалентным железом гемоглобина крови, вытесняя из оксигемоглобина (HbO2) кислород и образуя карбоксигемоглобин (HbCO). HbO2 + CO = HbCO + O2 Грамм гемоглобина может связать 1,34 мл кислорода или окиси углерода. Сродство гемоглобина к окиси углерода в 220-290 раз больше, чем к кислороду, поэтому СО легко вытесняет кислород из оксигемоглобина, образуя более стойкое соединение. Карбоксигемоглобин диссоциирует в 3600 раз медленнее, чем оксигемоглобин, что приводит к накоплению карбоксигемоглобина в крови и усилению кислородной недостаточности. Окись углерода также связывается с двухвалентным железом миоглобина, цитохрома, цитохромоксидазы, пероксидазы и каталазы. В незначительной степени СО окисляется в углекислоту. Распределение в организме. При остром отравлении высокими концентрациями СО большая часть яда, находящегося в крови, связана с эритроцитами. Повторные острые отравления приводят к повышению уровня СО в плазме, а при хроническом отравлении в плазме обнаруживается 25-30% общего количества окиси углерода, связанной кровью. В значительном количестве СО переходит из крови в ткани. При остром отравлении в скелетных мышцах и миокарде обнаруживается до 13,5% от общего количества адсорбированной СО, где она связана с миоглобином. Выделение из организма. Выделение СО происходит через дыхательные пути и продолжается несколько часов. Около 60-70% яда выделяется в течение первого часа, а за 4 часа составляет 96% от адсорбированной организмом дозы. Некоторое количество СО выводится через ЖКТ, ничтожные количества выделяются через кожу, а также с мочой в виде комплексного соединения с железом. Объектами исследования являются кровь из трупа и воздух, содержащий СО. При острых отравлениях концентрация карбоксигемоглобина в крови составляет около 40%, а при смертельных исходах до 60% и более. Обнаружение карбоксигемоглобина в крови является доказательством отравления угарным газом. Для обнаружения и количественного определения СО используют химические, газохроматографические, фотоколориметрические, спектрофотометрические и спектроскопические методы анализа. 1. Спектроскопический метод. При рассматривании крови спектроскопом в спектре можно увидеть тёмные полосы поглощения определённых длин волн для гемоглобина и его производных. В судебно-медицинской практике часто используют микроспектроскоп (спектроскоп, соединённый с окуляром). Оксигемоглобин в видимой части спектра имеет две полосы поглощения при длинах волн 577-589 и 536-556 нм. Карбоксигемоглобин также имеет две полосы поглощения при 564-579 и 523-536 нм. Кровь для исследования разбавляют водой до светло-розовой окраски (чётко видны спектральные полосы). К четырём объёмам водного раствора крови добавляют 1 мл свежеприготовленного раствора сульфида аммония или другого восстановителя. При этом оксигемоглобин восстанавливается до дезоксигемоглобина - исчезают полосы поглощения оксигемоглобина и появляется широкая полоса поглощения дезоксигемоглобина при длинах волн 543-596 нм. Карбоксигемоглобин при этом не восстанавливается и его полосы поглощения не исчезают. По этим полосам делают заключение об отравлении СО. Спектроскопический метод можно использовать при содержании в крови от 10% до 30% карбоксигемоглобина. 2. Спектрофотометрическое определение. Кровь в количестве 0,1 мл растворяют в 10 мл аммиака, наливают в кювету и измеряют оптическую плотность (D) при длинах волн 578 и 564 нм. Содержание карбоксигемоглобина в крови рассчитывают по формуле: %COHb = (1,70 – D578/D564):(1,70 – 0,75) 100 При содержании карбоксигемоглобина до 30% точность метода составляет около 1,5%, а при содержании его в крови до 50%, точность до 5%. Проведение анализа требует 3-5 мин. 3. Фотометрическое определение. Кровь в количестве 0,1 мл растворяют в 5 или 10 мл аммиака и 0,5 мл полученного раствора вносят в кювету. В кювету сравнения вносят раствор аммиака. Измеряют экстинкцию при длинах волны пропускаемого света 530 и 470 нм. По полученным средним значениям экстинкций вычисляют: Q = E530/E470 Процент карбоксигемоглобина определяют по формуле: %COHb = (97,5Q – 100) : (0,0955Q + 0,342) Процент карбоксигемоглобина можно определить также по калибровочному графику (зависимость между величиной Q и содержанием карбоксигемоглобина в крови). Ошибка определения не более 4%, время выполнения анализа около 10 мин. Химические методы обнаружения СО в крови Суть этих методов состоит в том, что при добавлении соответствующих реактивов окраска нормальной крови изменяется, а кровь, содержащая карбоксигемоглобин окраску не изменяет или изменяет незначительно. Поэтому всегда проводят два опыта. 1.Проба Гоппе-Зейлера. К определённому объёму крови добавляют равный объём 30% раствора NаОН. Нормальная кровь буреет, а кровь, содержащая COHb, не изменяется (ярко красная). 2.Проба Сальковского-Катаяма. К 10 мл дистиллированной воды добавляют 5 капель крови и 5 капель сульфида аммония, осторожно взбалтывают и прибавляют 30% раствор уксусной кислоты до слабокислой реакции среды. Нормальная кровь – серо-зелёная, исследуемая – малиново-красная. 3.Проба Хорошкевича-Маркса. К 2 мл крови добавляют 4 мл 8% раствора гидрохлорида хинина, доводят до кипения. После охлаждения прибавляют 2-3 капли сульфида аммония. Нормальная кровь – грязно красно-бурая, исследуемая – красная. 4.Проба Бюркера. К 5-10 мл разбавленной крови добавляют 5 капель 1% раствора гексацианоферрата (III) калия. Нормальная кровь – желтоватого цвета, исследуемая – красная. 5.Проба Сидорова. К 2 мл разбавленной крови добавляют 3-5 капель 30% раствора K3[Fe(CN)]6 и 3-5 капель 0,01% раствора K2Cr2O7. Нормальная кровь – коричневато-зелёная, исследуемая – карминово-красная. 6.Проба Ветцеля. К 10 мл разбавленного раствора крови добавляют 5 мл 20% раствора гексацианоферрата калия и 1 мл ледяной уксусной кислоты. Нормальная кровь образует серовато-коричневый осадок, а исследуемая – вишнёво-красный осадок. 7.Проба Кункеля-Ветцеля. К 5 мл разбавленной крови добавляют 15 мл 3% водного раствора таннина. Нормальная кровь образует серовато-коричневый осадок, а исследуемая светло карминово-красный осадок. 8.Проба Либмана. К 5 мл неразбавленной крови добавляют 5 мл формалина. Нормальная кровь – коричнево-чёрная, исследуемая красного цвета. 9.Проба Рубнера. К 5 мл неразбавленной крови добавляют 20 мл 5% раствора основного ацетата свинца. Нормальная кровь коричневатого цвета, исследуемая красного цвета. 10.Проба Залесского. К 5 мл разбавленной крови добавляют 5 капель 10% раствора сульфата меди. Нормальная кровь – зеленоватая, исследуемая – красная. Заключение о наличии карбоксигемоглобина можно сделать на основании большинства этих реакций. Если в крови мало карбоксигемоглобина, то окраска может измениться, поэтому эти реакции непригодны для малых количеств COHb. Количественное определение СО 1. Определение СО в воздухе. Метод основан на окислении СО в СО2 иодноватым ангидридом и его определение. I2O5 + 5CO = 5CO2 + I2 Ba(OH)2 + CO2 = BaCO3 + H2O Ba(OH)2 изб. + 2HCl = BaCl2 + 2H2O Избыток гидроксида бария оттитровывают соляной кислотой. 2. Определение в крови. Метод основан на определении карбоксигемоглобина спектроскопически. Для этого готовят ряд растворов: раствор А – раствор исследуемой крови; раствор Б – раствор крови, содержащей СОНb и дезоксигемоглобин. Его готовят из раствора А добавлением дитионата натрия. раствор В – раствор крови, в котором все формы гемоглобина переведены в COHb. Расчёт содержания COHb в исследуемой крови в процентах производят по следующей формуле: Р = 100 – (DCOHb – DHbCOHb) 100 : (DHbI K), где DCOHb – оптическая плотность раствора В (при 538 нм) DHbCOHb - оптическая плотность раствора Б (при 538 нм) DHbI – оптическая плотность раствора Б в изобестической точке (точка в которой оптические плотности растворов COHb и дезоксигемоглобина равны) при 550 нм К – коэффициент, равный 0,372. При концентрациях COHb от 3% до 20% ошибка не более 3%, а при концентрациях свыше 20% - не более 5%. ЛИТЕРАТУРА
|
