Майкл Дж[1]. Наука о гибкости. Литература ббк 75. 0 А52
 Скачать 10.31 Mb. Скачать 10.31 Mb.
|
|
25 Наука о гибкости УЧАСТКИ САРКОМЕРА Как отмечалось выше, миофибриллы характеризуются чередованием светлых и темных участков (см. рис. 3.1). Всего в саркомере существует пять зон. Мы уже говорили, что Z-линия образует плотную линию на обоих концах саркомера (т.е. на терминальных его точках). При сильном увеличении можно увидеть, что Z-линия имеет зигзагообразную форму. Частично это объясняется тем, что тонкие филаменты на обоих концах Z-линии не являются коллинеарными. Рис. 3.3 иллюстрирует модель Z-линии. Подобная конфигурация позволяет приспосабливаться к значительным колебаниям диаметра миофибрилл, увеличивая либо уменьшая латеральное разделение между филаментами. Такая структурная гибкость, вполне возможно, способствует пластичности мышц. Рис. 3.3. Схематическая модель Z-диска, включающая "истоки" тонкого филамента. Во взаимопересекающейся плоскости показана квадратная решетка тонких филаментов (Pollack, 1990) 26 По соседству с Z-линией находится I-диск, оптически менее плотная полоска. I-диск включает филаменты актина, титина и I-мостики. Длина I-диска равна примерно 1,5 мкм. Темные участки саркомера называются А-дисками. Такое название они получили потому, что световая волна, проходящая через них, является анизотропической (ее скорость во всех направлениях неодинакова). Длина А-дисков около 1,0 мкм, что соответствует длине толстых филаментов. В центре каждого А-диска находится относительно менее плотный и более светлый участок — Н-зона; она расположена между кончиками тонких филаментов. Таким образом, размер Н-зоны зависит от длины мышцы или от степени взаимного перекрытия филаментов. И наконец, есть еще М-линия. Эта плотная структура находится в центре саркомера и соответствует нескольким параллельным М-мостикам. 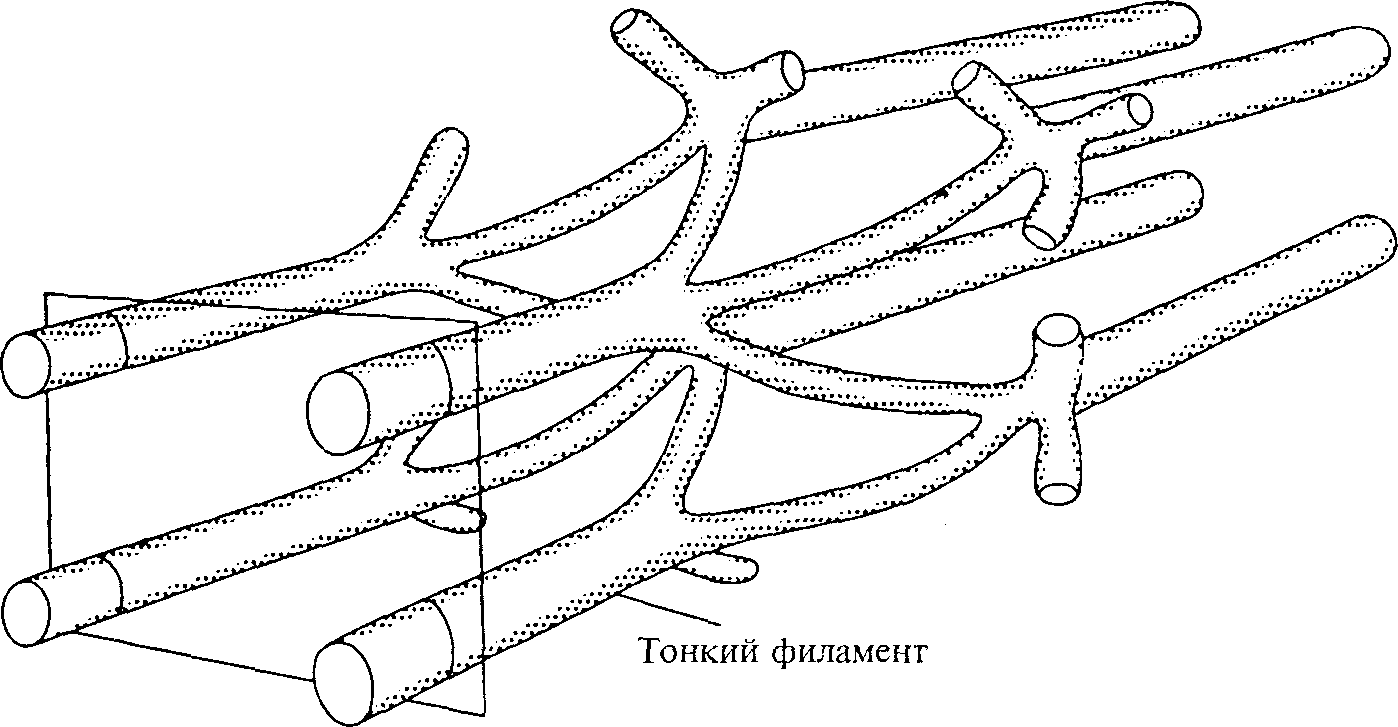 Г л а в а 3 ■ Сократительные компоненты мышцы  УЛЬТРАСТРУКТУРА ТОНКОГО ФИЛАМЕНТА: АКТИН УЛЬТРАСТРУКТУРА ТОНКОГО ФИЛАМЕНТА: АКТИНТонкий филамент называется актином. Его диаметр около 5-6 нм, а длина — примерно 1 мкм. При низкой разрешающей способности этот филамент напоминает жемчужное ожерелье, в котором две нити накручены одна на другую (см. рис. 3.2). Эта структура накручивания двух нитей не является правильной, как считалось раньше; она полупроизвольная (Egelman, Francis, Derosier, 1982). Актин не единственный компонент тонкого филамента. Внутри или вдоль последнего находится несколько других белков, включая небулин, тропонин и тропомиозин. Они служат для ругуляции связывания филаментов. УЛЬТРАСТРУКТУРА ТОЛСТОГО ФИЛАМЕНТА: МИОЗИН Толстым филаментом является миозин (см. рис. 3.2). Его диаметр примерно 10-15 нм, а длина — около 1,5 мкм. Таким образом, он более плотный (толстый) и более короткий, чем актиновый филамент. Уникальность миозиновых филаментов заключается в том, что они имеют множество латеральных отростков, которые простираются по направлению к актиновым филаментам. Эти отростки называются поперечными мостиками. Они являются участками связывания актино-вых и миозиновых филаментов, в результате чего образуется мышечное напряжение. Миозиновая головка. Исследования показывают, что НММ может также расщепляться на два субфрагмента: S-1 и S-2. Субфрагмент S-2 является сегментом миозинового стержня, расположенного между головкой и дистальным сегментом стержня. С другой стороны, субфрагмент S-1 является сегментом молекулы миозина, составляющей головку. Он состоит из легких и тяжелых цепочек. Каждый сегмент тяжелой цепочки, находящийся в пределах головки, делится на три фракции. Функциональное значение этого деления пока еще не выяснено. Кроме тяжелой цепочки, каждая головка содержит две, иногда три легкие цепочки. Результаты исследований показывают, что эти легкие цепочки играют роль в молекулярном привязывании и руководстве головками (Chowrashi и др., 1989). Миозиновый хвост. При тщательном анализе миозиновой молекулы можно увидеть, что она состоит из двух частей: хвоста и головки (см. рис. 3.2). Хвост нередко называют стержнем или участком стержня миозиновой молекулы. Этот сегмент молекулы миозина, состоящий из дисталь-ного конца миозинового стержня, также называют легким меромиозином (ЛММ). К нему присоединен тяжелый меромиозин (ТММ). Этот компонент молекулы миозина включает в себя проксимальный сегмент стержня и головку. В отличие от ЛММ, ТММ обладает способностью связываться с актином. 27 Наука о гибкости УЛЬТРАСТРУКТУРА СОЕДИНИТЕЛЬНОГО ФИЛАМЕНТА: ТИТИН Согласно современной модели двухфиламентного саркомера, предложенной X. Хаксли и Хенсоном (1954), а также А. Хаксли и Нидергерке (1954), сокращение мышцы происходит благодаря связыванию и движению филаментов актина и миозина. Два филамента двигаются или скользят относительно друг друга, изменяя степень взаимного перекрытия, тогда как их длина не изменяется. Однако, если взглянуть на классическую иллюстрацию организации саркомера (см. рис. 3.2), возникают следующие вопросы:
Структура саркомера кажется полностью нелогичной. Неизменной особенностью мышцы является центральное положение миозина в сарко-мере, посередине между Z-линиями. Это положение сохраняется даже при растяжении саркомера. Что же удерживает миозин в центре? Ответом на этот вопрос является наличие соединительного филамента — титина (рис. 3.4 и 3.5). До начала 1990-х гг. в большинстве учебников по физиологии, гистологии и даже анатомии об этих филаментах почти не упоминалось. По мнению Маруямы (1986), это объяснялось тем, что они не очень четко вписывались в теорию скольжения филаментов. Структура титина. Спустя несколько лет после идентификации соединительных филаментов Ванг (1985) приступил к тщательному биохимическому анализу белка коннектин. Исследования показали, что коннектин состоит из двух белков: титина и небулина. На сегодняшний день титин является наиболее крупным белком, его молекулярная масса равна 2,5-3,0 Da (Maruyama и др., 1984; Kurzban и Wang, 1988). Титин составляет около 10 % миофибриллярной массы (Trinick, Knight, Whiting, 1984; Wang, Ramirez-Mitchell, Palter, 1984).  филамент (миозин) (актин) (титин) Рис. 3.4. Схематическая диаграмма, иллюстрирующая расположение основных структурных элементов саркомера (Pollack, 1990) 28 Наука о гибкости   Рис. 3.6. Непосредственное доказательство наличия соединительных филаментов в Рис. 3.6. Непосредственное доказательство наличия соединительных филаментов влетательной мышце рабочей пчелы (а). Примеры филаментов коннектшга (титина) в сильно растянутой мышце лягушки (б). Изображение замороженной летательной мышцы рабочей пчелы (в) (Pollack, 1990) 30       Глава 3 Сократительные компоненты мышцы  Что делает титиновый филамент столь эластичным? Теоретически ряд факторов обусловливают существенную растяжимость титина Во-первых, титин содержит большое количество аминокислоты пролин, которая расщепляет а-спиралевидные цепочки, обусловливающие ригидность полипептидов (Pollack, 1990) Во-вторых, как следствие этого, отдельная молекула титина не содержит никакой а-спиралевидной структуры Наоборот, она состоит из произвольных витков (Тпшск, Knight, 31  Haукa о гибкости Haукa о гибкостиWhiting, 1984). В-третьих, отдельный пептид с молекулярной массой, равной 3 млн Da, может достигать длины до 7,0 мкм. В то же время в покое длина саркомера составляет около 2,4 мкм, а при максимальном растягивании — 7,0 мкм. На основании этих данных было высказано предположение, что титин должен быть компактно «упакован» в саркомере (Maruyama, 1986). Таким образом, в случае начального растягивания мышцы сегмент титина, находящийся между концом миозинового фила-мента и Z-линией, является главным фактором, обусловливающим увеличение длины саркомера (Trombitas и др., 1993). После того как этот сегмент титина достигнет предела своей длины, рекрутирование дополнительных «завернутых» (скрученных) или каким-то образом прикрепленных к филаменту миозина сегментов титина обусловливает дальнейшее увеличение длины саркомера (Wang и др., 1991). Однако и эта структура имеет свои пределы. Регулирование растяжимости мышц. В связи с вышесказанным попытаемся ответить на следующие вопросы. Во-первых, что регулирует растяжимость мышц? Во-вторых, можно ли повлиять на фактор(-ы), регулирующий(-е) растяжимость мышц, таким образом, чтобы увеличить гибкость? Первый вопрос изучал Ванг с коллегами (1991). В результате проведенных исследований они установили, что длина и размеры имеют большое значение, если необходимо определить, когда сарко-меры производят напряжение покоя при растягивании и куда исчезает саркомер при нагрузке. Например, мышцы, выражающие более крупные изоформы титина (т.е. структурные варианты), как правило, инициируют напряжение при большей длине саркомера, а также достигают своего предела эластичности. А мышцы, выражающие более длинные изоформы титина, развивают наименьшее напряжение. Ученые также пришли к выводу, что различные мышечные группы выражают различные типы титановых изоформ и, таким образом, проявляют различные кривые нагрузки-растяжения. Эти данные говорят о том, что «клетки скелетной мышцы могут контролировать и модулировать тугоподвижность и предел эластичности на основании избирательного выражения определенных изоформ титина» (Wang и др., 1991). Любопытно, что наблюдаемые анатомические изменения изоформ титина отмечаются в мышцах из различных участков тела (Akster, Granzier, Focant, 1989; С. Hill, Weber, 1986; Wang, Wright, 1988). Возникает вопрос, могут ли тренировочные занятия повлиять на определенные изоформы титина? К сожалению, до настоящего времени он остается открытым. В последнее время изучался и другой весьма важный вопрос: какова взаимосвязь между расщеплением титина и различными нервно-мышечными расстройствами, такими, например, как синдром Шварца-Ям-пеля (Soussi-Yanicostas и др., 1991) и мышечная дистрофия Дюшенна. По мнению Мацумуры и коллег (1989), расщепление титина, «даже вторичное, скорее всего, играет важную роль в патогенезе миофибрилляр-ной дегенерации при мышечной дистрофии Дюшенна». Другим важным 32    Глава 3. Сократительные компоненты мышцы Глава 3. Сократительные компоненты мышцыаспектом является влияние на титановые изоформы различных медикаментов. Весьма важным представляется также выяснить, изменяется ли изо-форма титина вследствие травмы. Если да, то как реагирует организм в случае макротравмы? Могут ли происходить изменения в изоформе вследствие, например, хронически неправильной осанки? Эти и другие вопросы требуют подробного изучения. Функция титина. Ученые считают, что титин выполняет две важные функции. Во-первых, поскольку эластичные элементы связывают каждый конец толстого филамента с Z-линией, филаменты титина производят напряжение покоя, то есть напряжение, имеющее место при нормальной физиологической длине мышечного волокна и увеличивающееся по мере удлинения расслабленного волокна; кроме того, они производят силу, которая центрирует толстые филаменты в саркомере (Horowits, 1992). Во-вторых, предполагают, что титин играет определенную роль в морфогенезе миофибрилл (Fulton, Isaacs, 1991; Pollack, 1990). СТРУКТУРНЫЕ МОСТИКИ САРКОМЕРА Миофибриллярный саркомер удерживается не только в осевом направлении, но и в поперечном. Источником поперечного сопротивления, обеспечивающего целостность саркомера, являются три структуры: М-мостики, А-мостики и I-мостики (рис. 3.7 и 3.8). М-мостики. В центре некоторых мышц организующий центр саркомера содержит поперечные взаимосвязи между толстыми филаментами. Эти ступенеобразные структуры, соединяющие соседние толстые филаменты в их средних участках, называются М-мостиками. Их функция состоит в том, чтобы помочь организовать и стабилизировать филаментную решетку (Pollack, 1990). Но так как в некоторых мышцах эти М-мостики отсутствуют, должны существовать еще какие-то структуры, способствующие стабилизации филаментной решетки (Pollack, 1990). Этими структурами являются А-и 1-мостики. А-мостики. Ученые понимали, что для организации и стабилизации миозиновых филаментов требуется какая-то дополнительная структура. В противном случае филаменты попросту разорвались бы. Какой же механизм обеспечивает сохранение решетчатой структуры организации? В 1983 г. Пол-лак обнаружил наличие взаимосвязей на множестве опубликованных микрофотографий, хотя их значение в тот период времени не было определено. Последующие исследования с использованием более совершенных методов показали четкое наличие ступенеобразных структур (Baatsen, Trombitas, Pollack, 1988; Pollack, 1990). Эти ступенеобразные соединения между соседними параллельными толстыми филаментами назвали А-мостиками (Suzuki, Pollack, 1986). 1-мостики. Совсем недавно была выявлена еще одна структура — I-мостики. I-мостик представляет собой ступенеобразное соединение, ко- 33 Наука о гибкости  торое перекрывает щель между соединительным (титин) и тонким (актин) филаментами. Эти мостики впервые были обнаружены более 20 лет тому назад Францини-Армстронгом (1970) и затем Риди (1971), однако на них не обратили должного внимания. Более поздние исследования подтвердили их структуру. Считают, что I-мостик состоит из тропонина. В настоящее время эта структура изучена недостаточно; предполагают, что одна из ее функций заключается в обеспечении латеральной стабильности и сохранении разделений между филаментами (Pollack ' 34 Глава 3- Сократительные компоненты мышцы
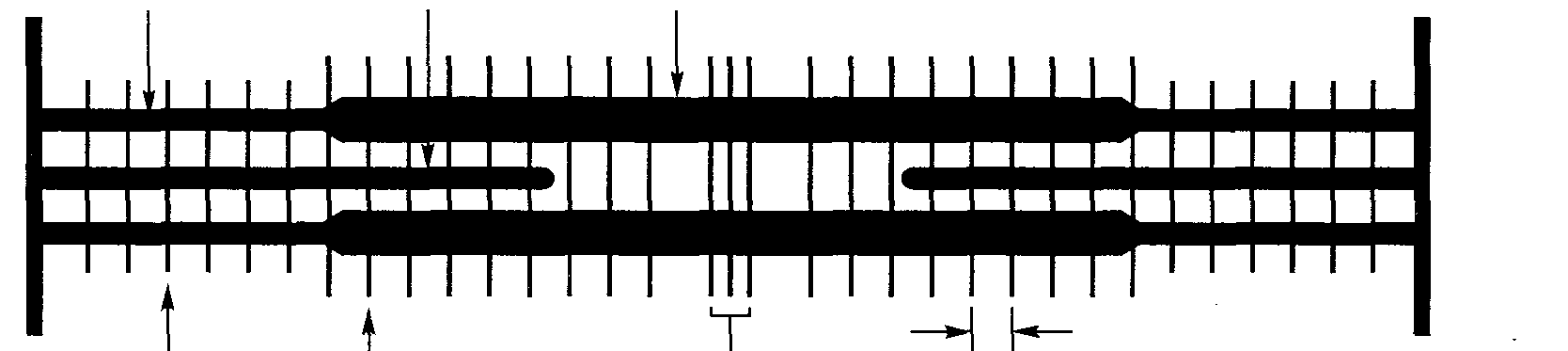 I-мостик А-мостик — 1-диск »-Ц М-мостик А-диск - 43 нм Z-линия • 1-диск -  Рис. 3.8. Диаграммное изображение основных структур саркомера Рис. 3.8. Диаграммное изображение основных структур саркомераПРИНЦИПИАЛЬНАЯ СТРУКТУРА САРКОМЕРА: РАБОЧАЯ МОДЕЛЬ Схематическая модель принципиальных структур саркомера изображена на рис. 3.8 (Pollack, 1990). Мы уже знаем, что саркомер содержит, по меньшей мере, три продольно ориентированные структуры: актин (тонкие филамен-ты), миозин (толстые филаменты) и титин (соединительные филаменты). Кроме того, саркомер включает еще, по меньшей мере, два поперечных соединения, не только между толстыми филаментами в А-диске (М- и А-мости-ки), но и между соединительными филаментами в I-диске (1-мостики). САРКОТУБУЛЯРНАЯ СИСТЕМА  Саркотубулярная система состоит из двух компонентов (рис. 3.9). Первым из них является саркоплазматический ретикулум. Он окутывает каждый сократительный элемент саркомера и является местом хранения кальция. Вторым компонентом является Т-система. Ее название связано с тем, что она состоит из трубочек, расположенных поперечно в саркоплазме (т. е. в цитоплазме и протоплазме саркомера). У Z-ли-нии между саркомерами две части сарко-плазматического ретикулума, связанные с каждым саркомером, соединяясь с попереч-нон трубочкой Т-системы, образуют гриа-ду. Главной функцией Т-системы является обеспечение связи. Когда сарколемма возбуждается поступающим нервным импуль- Рис. 3.9. Саркотубулярная система (Fawcett, 1986) 3* 35 Наука о гибкости сом, она подвергается деполяризации. Одновременно деполяризуется вся Т-система, обеспечивая тем самым передачу электрического импульса всем саркомерам мышечного волокна. Импульсы после этого передаются рукавообразной системе мешочков и трубочек саркоплазматического ретикулума, где содержатся ионы кальция. После деполяризации Т-системы этот электрический разряд передается на мембрану саркоплазматического ретикулума, увеличивая ее проницаемость. В результате этого ионы кальция покидают мешочки саркоплазматического ретикулума. ТЕОРИЯ СОКРАЩЕНИЯ Функция мышцы состоит в производстве или генерации напряжения. Этот процесс генерации напряжения называется сокращением. Главная цель мышечного сокращения — производство движения. Две другие функции, связанные с сокращением — это сохранение положения и производство телом тепла. После инициации мышечного сокращения происходит целый ряд физических и химических явлений. Ультраструктурная (физическая) основа сокращения. Механизм, посредством которого мышца сокращается, расслабляется или удлиняется, можно объяснить ультраструктурой саркомера. Наиболее известной теорией является теория скольжения филаментов (рис. 3.10, а-в). В соответствии с этой теорией, изменения длины саркомера обусловлены (исключительно) относительным скольжением толстого и тонкого филаментов. Точный механизм, регулирующий сократительные элементы, еще не совсем хорошо изучен. По мнению Поллака (1983, 1990), например, эта теория не имеет под собой достаточно прочной основы. Не так давно появилась новая гипотеза, согласно которой после периодов сокращения саркомера следуют паузы, во время которых длина не изменяется или изменяется незначительно, в результате чего форма волны сокращения имеет ступенчатый характер (Pollack и др., 1977). При максимальном сокращении длина саркомера может уменьшиться на 20-50 % по сравнению с его длиной в покое. При пассивном растягивании она может превысить обычную длину на 120 %. Результаты наблюдений показывают, что длина А-дисков и, следовательно, толстых филаментов всегда остается постоянной. Остается постоянным на всех этапах обычного сокращения и расстояние между Z-линией и краем Н-зоны, а это свидетельствует о том, что длина тонких актиновых филаментов также не подвергается изменениям. Исходя из этих наблюдений, ученые пришли к выводу, что изменение длины мышцы обусловлено скольжением толстого и тонкого филаментов относительно друг друга. Таким образом, когда мышца сокращается, актиновый и миозиновый фи-ламенты скользят один относительно другого, в результате чего каждое волокно сокращается (теория скольжения филаментов). Чтобы этот процесс имел место, Z-линия саркомера должна приблизиться к А-диску, что приведет к постепенному сужению и последующему «устранению» I-дисков и Н-зоны. 36 Г л а в а 3 ■ Сократительные компоненты мышцы 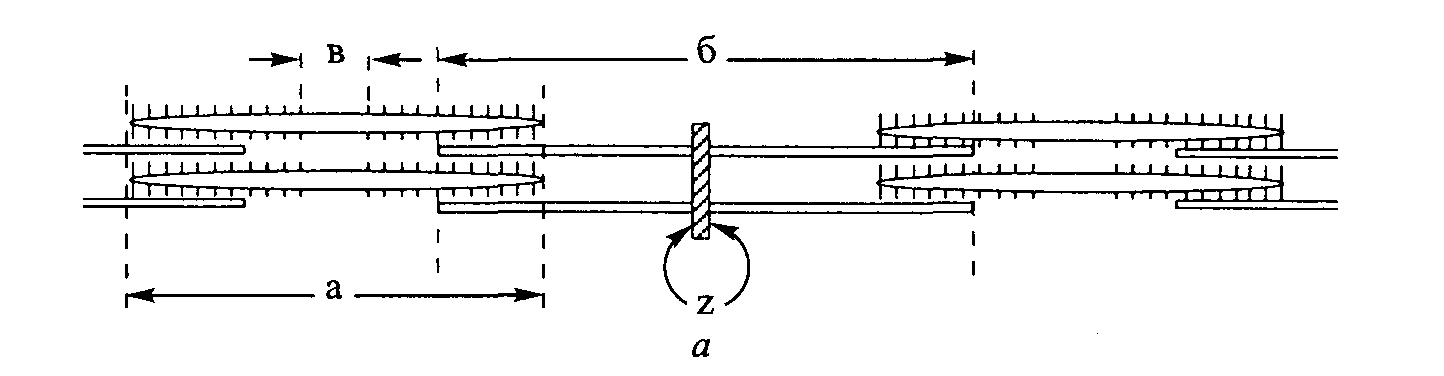 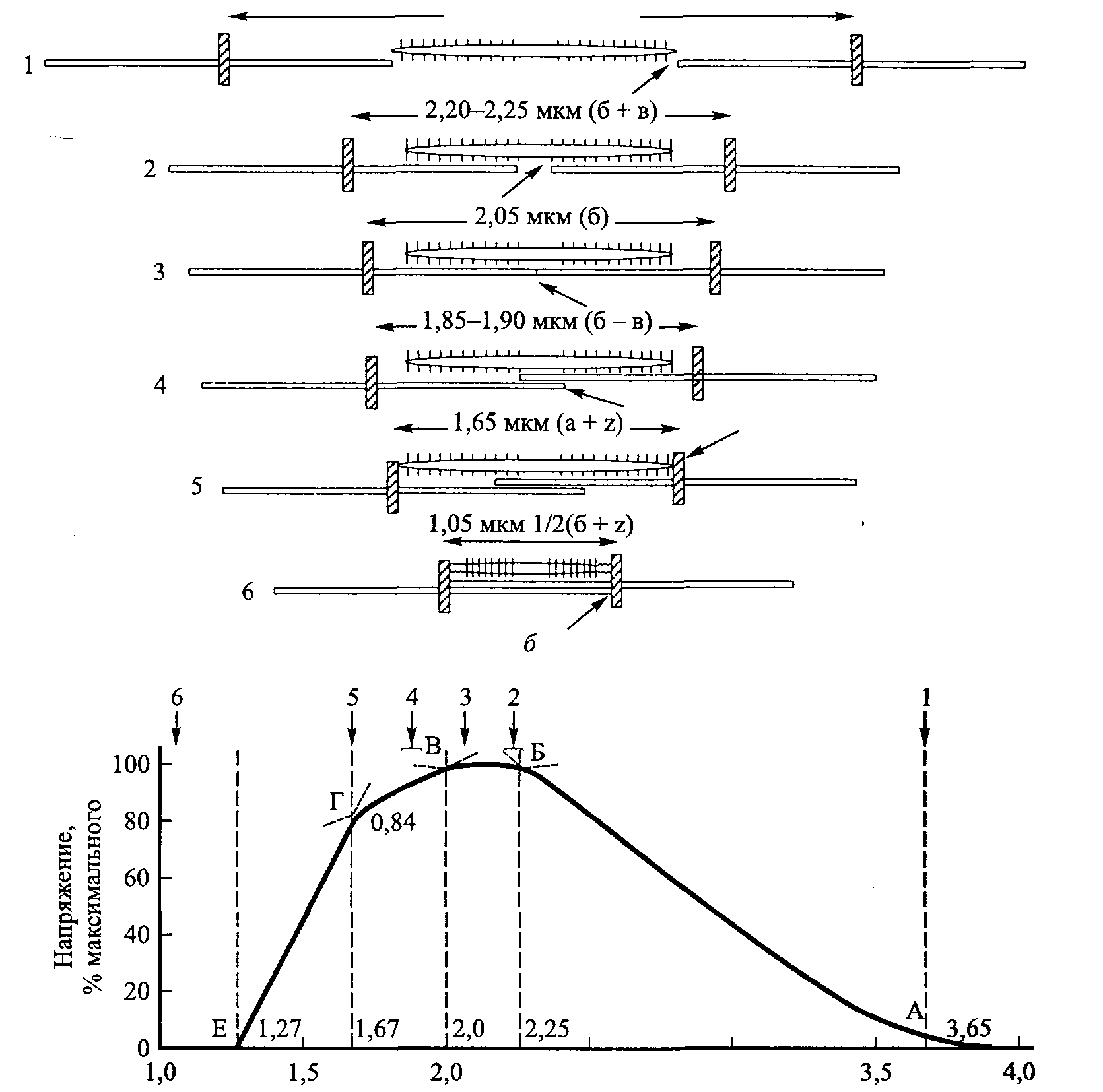 . 3,65 мкм (а + б) - 2,5 3,0 Интервалы между полосами, мкм в Рис. ЗЛО. Схематическое изображение изменений тетанического напряжения в интервалах между полосами. Стрелки вверху расположены напротив интервалов, в которых имеет место взаимное перекрывание филаментов (а). Схематическая диаграмма филаментов с указанием номенклатуры соответствующих измерений (б). Критические этапы увеличения степени взаимного перекрытия толстых и тонких филаментов по мере сокращения саркомера (в) (Gordon, Huxley, Julian, 1966) 37 Наука о гибкости Молекулярная (химическая) основа сокращения. Немедленным источником энергии для осуществления мышечных сокращений служит расщепление аденозинтрифосфата (АТФ), обусловленное нервными импульсами. Когда нервные импульсы поступают в волокно скелетной мышцы, они распространяются по сарколемме и двигаются вовнутрь через Т-трубочки. Это приводит к увеличению проницаемости и вызывает выделение ионов кальция (Са2+) из мешочков саркоплазматического рети-кулума в саркоплазме. Считают, что в состоянии покоя молекулы тропо-миозина находятся сверху активных участков на филаментах актина, что предотвращает привязывание на поперечных мостиках миозина и актино-вом филаменте. После выделения Са2+ они связываются с молекулами тропонина на филаменте актина. Этот процесс называется «включением» активных участков на филаменте актина. Одновременно происходит зарядка незаряженного комплекса поперечного мостика АТФ, что позволяет актину и миозину образовать актомиозиновый комплекс. Это, в свою очередь, активирует ферментный компонент миозинового филамента, который называется миозин АТФ-аза. Миозин АТФ-аза расщепляет АТФ на АДФ и Рн (неорганический фосфат), что сопровождается выделением энергии. В результате выделения энергии изменяется угол поперечных мостиков и они скользят над филаментом миозина к центру саркомера. Мышца сокращается и производит напряжение. Таким образом, очевидно, что активация мышц полностью зависит от нервных импульсов. Без нервного импульса генерирование мышечного напряжения просто невозможно. ТЕОРИЯ МЫШЕЧНОГО РАССЛАБЛЕНИЯ Способность мышцы расслабляться — неотъемлемое условие оптимального движения и состояния здоровья. Поэтому процесс мышечного расслабления тщательно изучался как на физическом, так и на химическом уровнях. Вместе с тем точный механизм расслабления еще не до конца изучен. В следующих разделах мы рассмотрим физическую и химическую основу расслабления. Ультраструктурная (физическая) основа расслабления. Мышечное расслабление является полностью пассивным. Когда в мышечные волокна не поступают нервные импульсы, они расслабляются. Следовательно, расслабление представляет собой прекращение производства мышечного напряжения. Когда поперечные мостики отделяются во время расслабления, внутренняя эластичная сила, накопившаяся в филаментах во время сокращения, выделяется. Таким образом, эластическая тяга эластичных компонентов является именно тем, что возвращает длину миофибрилл к длине, наблюдаемой в состоянии несокращения (Gowitzke и Milner, 1988). Вторая возможная восстанавливающая сила может возникать в результате взаимного наложения тонких филаментов, которые отталкивают друг друга ввиду одинакового заряда. Предполагают, что «такие восстанавливающие силы снижают энергетическую стоимость расслабления» (Pollack, 1990). 38  Глава 3. Сократительные компоненты мышцы Глава 3. Сократительные компоненты мышцыКроме того, эластичность соединительных тканей сухожилий, которые прикрепляют концы мышцы к кости, восстанавливает исходную длину мышцы. Молекулярная (химическая) основа расслабления. Химические реакции, связанные с расслаблением, недостаточно хорошо изучены. По мнению большинства ученых, расслабление обусловлено прекращением процесса сокращения. Во время расслабления сочетания каль-ций-тропонин отделяются и ионы кальция возвращаются в мешочки саркоплазматического ретикулума. Поскольку тропонин уже больше не связан с кальцием, он предотвращает взаимодействие актина с миозином. Это способствует диссоциации актина и миозина и «повторному скольжению» филаментов назад в положение покоя. Иными словами, сокращение «включается» выделением кальция и «выключается» его устранением. ТЕОРИЯ МЫШЕЧНОГО УДЛИНЕНИЯ Мышечные волокна не способны сами по себе удлиняться или растягиваться. Чтобы произошло их удлинение, к мышце должна быть приложена сила извне. Это может быть сила притяжения, сила движения, сила мышц-антагонистов, действующих на противоположную сторону сустава, сила, прилагаемая другим человеком или другой частью своего тела. Теоретическое ограничение реакции на растяжение сократительного компонента мышечной клетки, основанное на теории скольжения филаментов, можно определить путем измерения под микроскопом длины сар-комера, миозиновых филаментов, актиновых филаментов и Н-зоны. Рассмотрим, как изменяется длина саркомера при растяжении по сравнению с длиной в покое (табл. 3.1). Таблица 3.1. Длина сократительных компонентов в покое
При максимальном растягивании саркомера до точки разрыва его длина может достигнуть приблизительно 3,60 мкм. Разрыв саркомера, естественно, нежелателен. Наша главная задача — растянуть саркомер до такой длины, при которой происходит незначительное перекрывание филаментов и хотя бы один поперечный мостик сохраняется между филаментами актина и миозина. Эта длина составляет около 3,50 мкм. Таким образом, при длине саркомера в покое 2,30 мкм его сократительный компонент способен увеличиться на 1,20 мкм, то есть увеличение по сравнению с состоянием покоя составляет свыше 50 %. Если длина саркомера в покое 2,10 мкм, а все остальные факторы остаются постоянными, сократительный компонент мышцы может увеличить свою длину по сравнению с длиной в покое на 67 %. Такая растяжимость дает возможность нашим мышцам двигаться с большой амплитудой. 39 Наука о гибкости ТЕОРИЯ СКОЛЬЖЕНИЯ ФИЛАМЕНТОВ 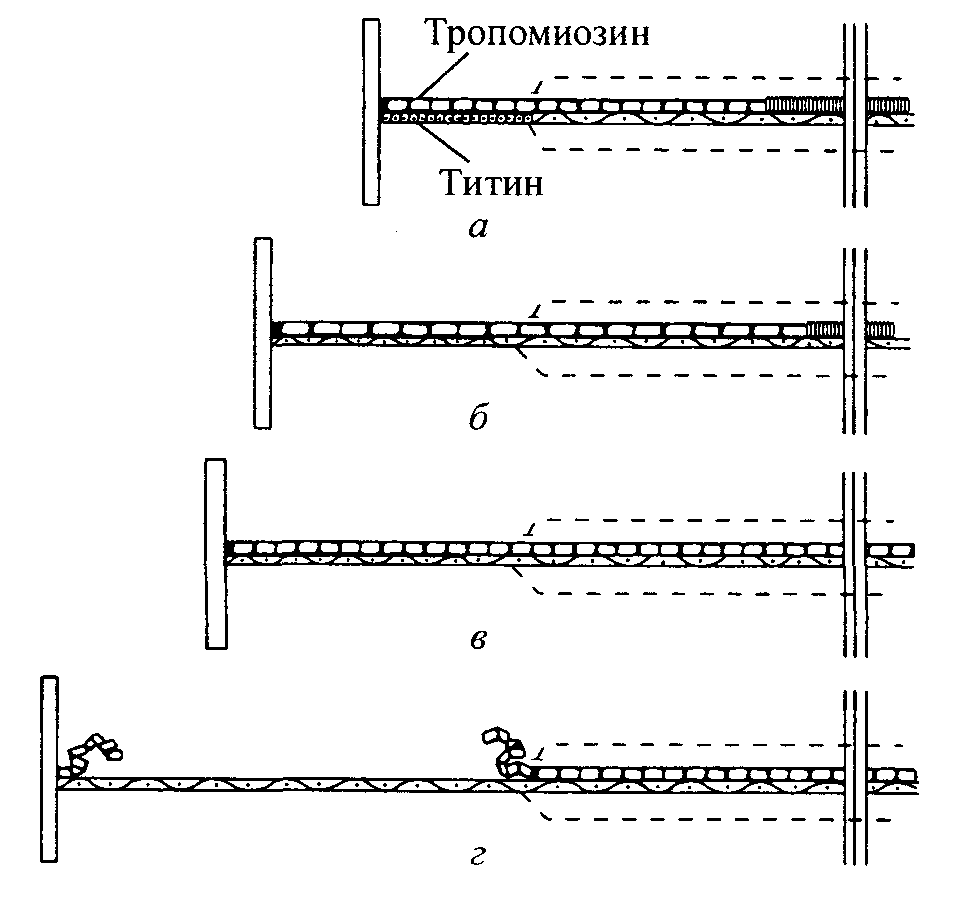 В соответствии с первоначальной теорией скольжения филаментов толстый и тонкий филаменты попросту скользят относительно друг друга при растягивании саркомера. Во время такого изменения длины саркомера длина толстого и тонкого филаментов не изменяется, но степень их взаимного перекрытия становится меньше (см. рис. 3.10). Однако мы знаем, что механизм, посредством которого происходит удлинение саркомера, является более сложным, чем первоначально предполагалось. Например, что-то должно в конечном итоге предотвращать чрезмерное растяжение саркомера. Эту защитную функцию выполняет соединительный филамент. Результаты предыдущих структурных исследований показали, что каждый филамент титина в саркомере состоит из двух сегментов. Сегмент между Z-линией и краем А-диска, как было обнаружено, является достаточно растяжимым. В то же время другой сегмент, который взаимно перекрывается толстыми филаментами, является тугоподвижным и нерастяжимым. На основании этих открытий было предложено несколько рабочих моделей. В модели Поллака (1990; рис. 3.11) предполагается, что соединительный филамент абсорбирует растяжение в двух своих элементах: тро-помиозине и титине. Первоначально растягивание происходит легко (рис. 3.11, а, б). Во время этого незначительного растягивания тропомиозин рекрис-таллизируется и сообщает слабое статическое усилие саркомеру. На этом этапе титин не растягивает- Рис. 3.11. Схематическая иллюстрация влияния растяжения на вытягивание соединительного филамен-та. После полной кристаллизации нити тропомио-зина дальнейшее вытягивание может произойти только после разрыва нити (пунктирной линией отмечены толстые филаменты) (Pollac, 1990) ся настолько, чтобы ощущалась возвратная сила. Таким образом, саркомер растягивается без особого труда. По мере продолжения растягивания происходит кристаллизация всего тропо-миозина. Вследствие этого тропомиозиновая нить становится нерастяжимой и дальнейшее растяжение саркомера невозможным. Таким образом, считают, что именно тропомиозин обусловливает «рабочую» длину саркомера (рис. 3.11, в). Однако даже эта система имеет свои пределы. При продолжении удлинения тропомиозиновая нить рвется (рис. 3.11, г). Разрыв тропо-миозиновой нити не означает разрушение саркомера. 40  Г л а в а 3 ■ Сократительные компоненты мышцы 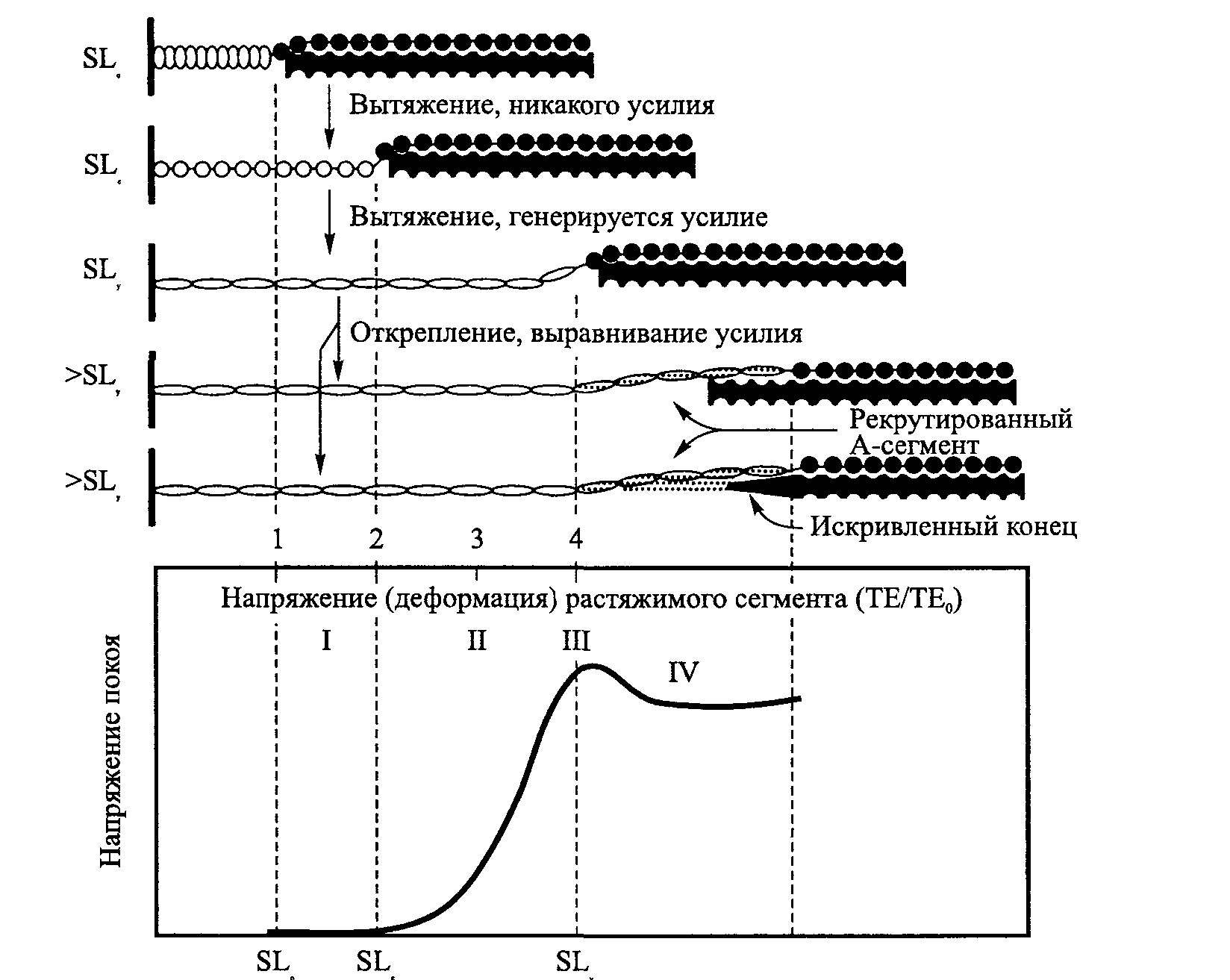 Длина саркомера, мкм Рис. 3.12. Сегментное вытяжение филаментов титина как структурная основа кривых нагрузки-напряжения мышц в покое. Показаны предполагаемые структурные явления, происходящие в филаментах титина, лежащие в основе кривых нагрузки-напряжения (Wang, McCarter, Wright, Beverly and Ramirez-Mitchell, 1991) Специальная «дублирующая» система готова сохранить целостность саркомера во время «ремонта» титиновой нити (рис. 3.11, г). Вскоре после появления модели Поллака в 1990 г. Ванг с коллегами (1991) предложили свою модель. В соответствии с этой моделью по мере растяжения саркомера растяжимый сегмент титина перемещается в результате удлинения. Чем выше степень удлинения, тем более длинным становится растяжимый сегмент вследствие рекрутирования ранее нерастяжимого титина, когда его соединение с толстыми филаментами начинает проскальзывать или когда происходит деформация дистальных концов толстых филаментов (рис. 3.12). Филамент титина, который простирается от Z-линии к М-линии, имеет два механически обособленных сегмента: растяжимый сегмент в I-диске (незаштрихован) и нерастяжимый сегмент, ограниченный взаимодействием с толстыми филаментами (заштрихован). При сокращенной длине саркомера (SLo) титин может быть «дряблым», и растяжение до SLe не приводит к изменению длины контура или производству значительного усилия. 41 Наука о гибкости За пределами SL, линейное вытяжение титанового сегмента приводит к экспоненциальному увеличению напряжения. При SL, растяжимый сегмент становится длиннее вследствие рекрутирования ранее нерастяжимого титина после начала его открепления от толстых филаментов или деформации дис-тальных концов толстых филантов, ведущей к выравниванию напряжения. Предполагают, что чистая контурная длина растяжимого сегмента титина длиннее в саркомере, выражающем более крупную изоформу титина. Вследствие этого SLe и SL увеличиваются, а кривые нагрузки-напряжения различных мышц можно нанести на график как функцию напряжения растяжимого сегмента титина (ТЕ/ТЕ ). Дальнейшее удлинение приводит к разрыву титановой нити. В сущности, тропомиозин можно сравнить с поездом, а титин с рельсами. Когда железнодорожный поезд (т. е. тропомиозин) сходит с рельс, не все оказывается потерянным. Его просто нужно снова поставить на рельсы. Если же повреждаются рельсы, то ничего уже нельзя сделать. Таким образом, именно титин обеспечивает целостность саркомера. ДРУГИЕ ФАКТОРЫ, ОГРАНИЧИВАЮЩИЕ ДИАПАЗОН ДВИЖЕНИЯ Ряд факторов могут ограничивать диапазон движения сустава. Это может быть мышечный дисбаланс, неадекватный мышечный контроль, возраст мышцы или ее иммобилизация. Мышечный дисбаланс. Здоровые мышцы сохраняют структурный гомеостаз. Ключом такого структурного баланса является взаимная тяга мышц-антагонистов, расположенных на противоположной стороне сустава (рис. 3.13). Дисбаланс этих сил тяги может повлиять на диапазон движения. Мышечный дисбаланс может быть обусловлен рядом факторов, включая наличие гипертонических мышц (т. е. мышц, находящихся в состоянии контрактуры или спазма) или слабых мышц. Неадекватный мышечный контроль. Даже если человек от рождения наделен достаточной гибкостью, локальный мышечный контроль может быть неадекватным для выполнения определенных элементов, требующих проявления гибкости. Это объясняется тем, что многие из них состоят из дополнительных компонентов. В данном контексте мы рассматриваем мышечный контроль как наличие адекватного баланса, координации или контроля за частью (частями) тела или достаточной силы для выполнения конкретного элемента, требующего проявления гибкости. Например, чтобы выполнить такой элемент, как «ласточка», требуется умение сохранять равновесие. Кроме того, необходимо обладать достаточной силой, чтобы принять и сохранить необходимое положение. Выполнение более сложных двигательных умений требует соответствующего сочетания всех необходимых качеств и компонентов, подготовленности. Влияние процесса старения на мышцы. Естественный процесс старения ведет к снижению функциональных возможностей мышцы. Если человек ведет малоподвижный образ жизни, страдает какими-нибудь заболеваниями и т. д., этот процесс протекает намного быстрее. С физиологической 42       Г л а в а 3 ■ Сократительные компоненты мышцы 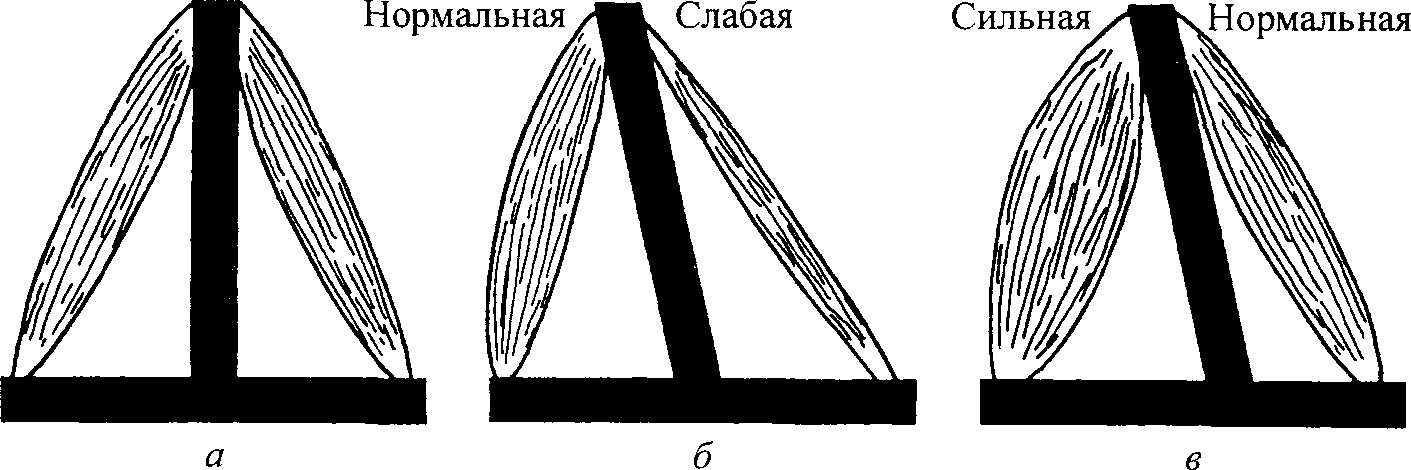 Рис. 3.13. Мышечный баланс: а — мышечный баланс обеспечивает структурный баланс; б — дисбаланс нередко наблюдается при ослаблении одной мышцы; в — иногда дисбаланс обусловлен тем, что одна из мышц оказывается слишком сильной (Walther, 1981) точки зрения наиболее очевидным дегенеративным изменением, связанным с процессом старения, является постепенная атрофия мышечной массы. Она обусловлена снижением размера и количества мышечных волокон (Grab, 1983; E.Gutmann, 1977; Hooper, 1981). Как замечает Уилмор (1991), «... это снижение количества саркомеров может обусловливать снижение подвижности, обычно наблюдаемое у пожилых людей». Отмечаются значительные колебания возраста, в котором проявляются эти изменения, существенно варьируется и степень изменений. С возрастом также сокращается количество нервных клеток в скелетно-мышечной системе (E.Gutmann, 1977). По мере атрофии мышечных волокон происходит их замена жировой и волокнистой (коллагеновой) тканью. Коллаген — главный компонент соединительной ткани — характеризуется исключительно низкой эластичностью. Поэтому вполне очевидно, что даже незначительное увеличение количества коллагена в мышце приводит к существенному снижению ее подвижности. Это явление изучали Альнакиб, Аль-Заид и Голд-спинк (1984), использовав для этого камбаловидную мышцу и длинный разгибатель пальцев крыс. Их исследования подтвердили, что общее содержание коллагена с возрастом постоянно увеличивается. Кроме того, они обнаружили в молодой мышце более низкую интенсивность развития пассивного напряжения на каждую единицу увеличения длины. В мышце взрослого животного пассивное напряжение развивалось с большей интенсивностью. «Данные, касающиеся тугоподвижности мышц и соединительной ткани, характеризуются корреляцией, за исключением данных о камбаловидной мышце старых животных. Пассивное механическое поведение мышцы непосредственно связано с концентрацией коллагена». Таким образом, эти изменения в определенной степени обусловливают возрастное снижение гибкости. Влияние иммобилизации. Способность мышцы адаптировать свою длину в зависимости от положения продемонстрировал в экспериментах 43 Наука о гибкости еще Марви (Marvey, 1887). В последние 20 лет механизмы адаптации длины мышцы изучали как на клеточном, так и на ультраструктурном уровнях. Исследования, проведенные Голдспинком (1968, 1976) и П.Уильямсом и Голдспинком (1971), показали, что увеличение длины мышечного волокна во время нормального развития связано со значительным увеличением количества саркомеров вдоль длины волокон. Так как длина филаментов актина и миозина постоянна, адаптация взрослой мышцы к различной функциональной длине, по-видимому, должна включать производство или удаление определенного количества саркомеров с тем, чтобы сохранить правильную длину саркомера относительно всей мышцы (Goldspink, 1976; Tabary и др., 1972). При иммобилизации камбаловидной мышцы взрослой кошки в удлиненном положении мышца адаптируется к новой длине. Табари с коллегами (1972) обнаружили, что это удлинение осуществляется за счет появления около 20 % новых саркомеров. П.Е.Уильямс и Голдспинк (1973) обнаружили, что новые саркомеры добавляются на концах имеющихся мио-фибрилл. В случае денервации и иммобилизации в удлиненном состоянии производится около 25 % саркомеров (Goldspink и др., 1974). После прекращения иммобилизации «нормальная» и денервированная мышца быстро восстанавливают свою первоначальную длину (Goldspink и др., 1974; Tabary и др., 1972). Совсем недавно было проведено исследование с целью определить, способна ли внеглазная мышечная система трех обезьян адаптироваться таким образом, как мышцы конечности кошек (A.B.Scott, 1994). Исследования показали увеличение длины глазных мышц на 18, 25 и 33 % вследствие наложения швов. При иммобилизации конечности с мышцей в сокращенном положении мышечные волокна теряют до 40 % саркомеров (Tabary и др., 1972). При денервации и иммобилизации в сокращенном положении наблюдали снижение числа саркомеров на 35 % (Goldspink и др., 1974). Однако затем количество саркомеров восстанавливается по мере восстановления длины мышцы (Goldspink и др., 1974; Tabary и др., 1972). Таким образом, адаптация количества саркомеров в зависимости от функциональной длины мышц происходит не под нейронным контролем. Скорее всего, реакция на количество пассивного напряжения, которому подвергается мышца, носит миогенный характер (Goldspink, 1976; P.E.Williams, Goldspink, 1976). Наряду со снижением длины волокон, а также количества и длины саркомеров ученые выявили и уменьшение растяжимости (увеличение пассивного сопротивления) мышц, иммобилизованных в сокращенном положении (Goldspink, 1976; Goldspink, Williams, 1979). Этот процесс происходил независимо от того, была ли мышца денервирована или нет (Goldspink, 1976). Голдспинк и Уильяме (1979) также обнаружили, что потеря соединительной ткани происходит с меньшей интенсивностью, чем потеря сократительной ткани мышцы. Таким образом, относительное количество соединительной ткани увеличивается (Goldspink, 1976; Goldspink, Williams, 1979). Кроме того, П.Е. Уильяме и Голдспинк (1984) установили, что волокна коллагена в иммобилизованной мышце распола- 44 Г л а в а 3 ■ Сократительные компоненты мышцы   гаются под более острым углом к оси мышечных волокон, чем в обычной мышце. Это изменение, очевидно, влияет на эластичность мышцы. гаются под более острым углом к оси мышечных волокон, чем в обычной мышце. Это изменение, очевидно, влияет на эластичность мышцы.Снижение степени растяжимости, вероятно, является защитным механизмом, который не допускает резкого перерастяжения мышцы (Goldspink, 1976; Goldspink, Williams, 1979). Этот механизм особенно важен для сокращенной мышцы (т. е. мышцы, утратившей саркомеры), поскольку растягивание даже в обычном диапазоне движения приведет к перерастяжению сарко-меров и филаменты миозина и актина не смогут осуществить взаимное перекрытие, что вызовет временное повреждение мышцы (Goldspink, 1976; Tabary и др., 1972). С другой стороны, изменения в эластичных свойствах мышцы, иммобилизованной в удлиненном положении, не произойдут, поскольку адаптация обратно пропорциональна, а вероятность перерастяжения мышцы такая же, как и для обычной мышцы (Tabary и др., 1972). Однако указанное выше снижение степени растяжимости не является просто защитной функцией. Главным последствием изменений количества саркомеров и длины мышцы является смещение кривой длины-напряжения мышцы влево (при иммобилизации мышцы в сокращенном положении) или вправо (при иммобилизации в удлиненном положении). Эти изменения длины помогают мышце адаптироваться к генерированию оптимальных уровней напряжения при новом положении и новой длине. На основании приведенных выше результатов П.Е.Уильямс с коллегами (1988) решили определить, обусловливает ли недостаточное растяжение или недостаточная сократительная активность сокращение количества саркомеров, увеличение концентрации коллагена и увеличение тугопод-вижности мышц, которое наблюдается при их иммобилизации в сокращенном положении. Они обнаружили, что аккумуляция соединительной ткани, имеющая место в иммобилизованных мышцах, может быть предотвращена либо путем пассивного растяжения, либо путем активной (электрической) стимуляции. В связи с этим возникает вопрос, являются ли короткие периоды растягивания достаточно эффективными для предотвращения изменений в соединительной ткани мышц, длине волокон и количестве саркомеров, т. е. способствуют ли они сохранению диапазона движений сустава? Исследование, проведенное П.Е. Уильямсом (1988) на мышах, показало, что периоды пассивного растягивания продолжительностью всего 15 мин (через день) обеспечивают нормальные пропорции соединительной ткани. В то же время они не способствуют предотвращению снижения длины мышечных волокон, которое ведет к заметному ограничению диапазона движения. МЕХАНИЗМ ПАССИВНОГО РАСТЯГИВАНИЯ В МИОФИБРИЛЛОГЕНЕЗЕ Из предыдущего раздела мы узнали, что иммобилизация мышцы в удлиненном положении ведет к увеличению длины мышечных волокон, которое, в свою очередь, связано с увеличением числа саркомеров в мио- 45 Наука о гибкости 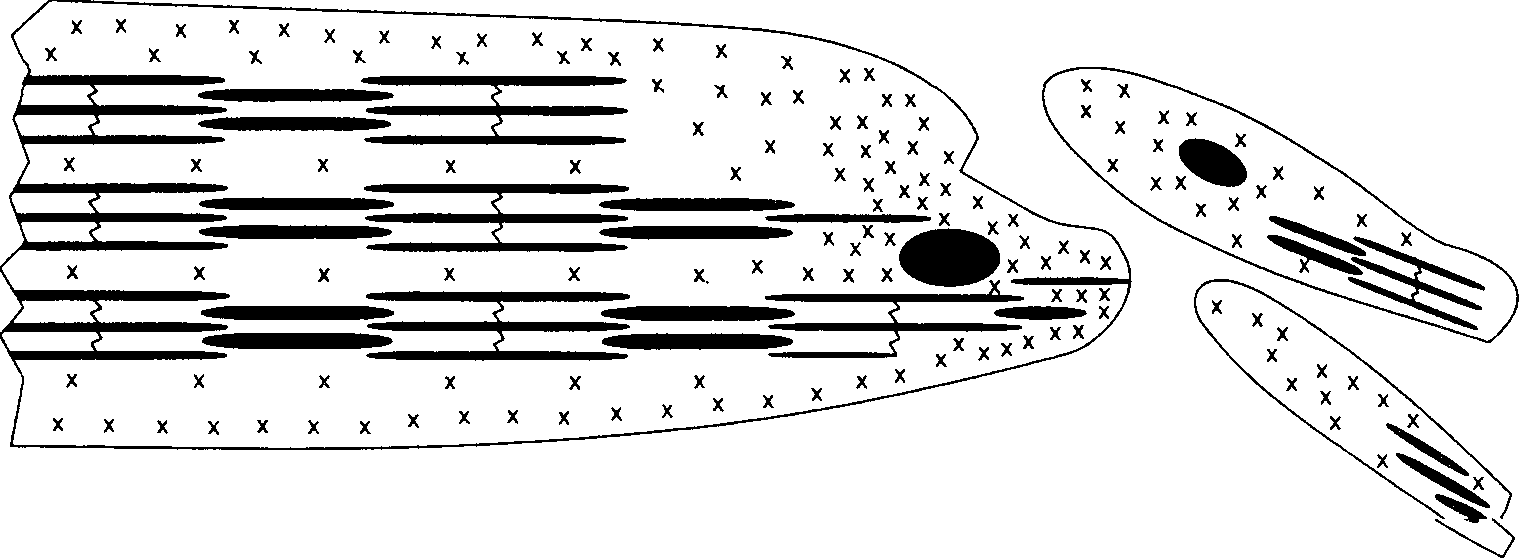 Рис. 3.14. Распределение мРНК у мышечно-сухожильного соединения растянутых скелетных волокон (Russell, Dix Haller and Jacobs-El, 1992) фибриллах и вдоль волокон. Специфический участок вновь синтезированных саркомеров находится вблизи мышечно-сухожильного соединения. В последние годы ученые обратили внимание на механизм клеточного контроля, лежащий в основе удлинения и гипертрофии мышечных волокон (миофибриллогенез). Исследования Дикса и Айзенберга (1990, 1991а, 19916) показали, что накопление мРНК медленного окислительного миозина в конце мышцы в растянутых волокнах является более высоким, чем в контрольных. «Такое локальное накопление мРНК обеспечивает региональный синтез сократительных белков, быструю «сборку» саркомеров и распространение мио-фибрилл» (Dix, Eisenberg, 1990, 1993). В частности, «большое цитоплазма-тическое пространство, в котором содержатся полисомы, «открывается» между миофибриллами и сарколеммами мышечно-сухожильного соединения удлиняющихся волокон, и встречается много формирующихся мио-фибрилл» (B.Russell, Dix, Haller, Jacobs-El, 1992; рис. 3.14). Миозин мРНК (X) накапливается на концах растянутых волокон в увеличенном цитоплаз-матическом пространстве между сарколеммами и миофибриллами (тонкие и толстые филаменты). Эта мРНК способствует локальному синтезу сократительных белков и миофибриллогенезу. Ядра зачастую расположены проксимально к концам этих удлиненных волокон. Растянутые мышцы также удлиняются вследствие появления пролиферирующихся миотрубо-чек (более мелкие клетки справа), которые впоследствии могут слиться с существующими волокнами. Кроме того, растянутые мышцы также удлиняются в результате появления пролиферирующихся миотрубочек (Moss, Leblond, 1971). Каким же образом растягивание увеличивает производство мРНК? Известно, что для роста клеток необходимы гормоноподобные молекулы — факторы роста. Возможные механизмы были предложены Б.Расселлом, Диксом, Халлером, Джекобс-Элемом (1992). Однако этот вопрос требует дальнейших исследований. 46   Глава 3- Сократительные компоненты мышцы Глава 3- Сократительные компоненты мышцыПРЕДЛАГАЕМЫЕ МЕТОДЫ ВЫРАЖЕНИЯ МОДУЛИРУЮЩЕГО ГЕНА ЧЕРЕЗ РАСТЯГИВАНИЕ Мышечные клетки состоят из ряда взаимосвязанных структурных компартментов, участвующих в перцепции механических сигналов во время сокращения и растягивания. Эти единицы представляют собой трехмерную сеть, организация которой специфична ткани и отражает ее индивидуальные функции. В клетках поперечнополосатой мышцы эти компарт-менты являются внеклеточными, цитоплазматическими и ядерными. Каждый компартмент передает информацию через интерфейс хотя бы одной мембраны, определяющий границы конкретного компартмента (Simpson и др., 1994). Эту интеграцию механического стимулирования в пределах трех произвольных компартментов и между ними описывают как систему динамического взаимодействия (Bissell, Hall, Parry, 1982). Совсем недавно было высказано предположение, что такое механическое стимулирование может влиять на генную экспрессию. Предполагаемый «путь» начинается с механического стимулирования, которое передается на внеклеточный матрикс (ВКМ). ВКМ состоит в основном из коллагена, неколлагеновых гликопротеидов и протеогликанов. Затем сигналы из ВКМ проходят через сарколемму (мембрану, окружающую мышечную клетку) в особых участках возле Z-дисков. Частично это взаимодействие обусловлено рецепторами, которые обнаружившие их Темкун с коллегами (1986) назвали интегринами. Эти рецепторы соединяют внешне расположенные компоненты ВКМ с элементами цитоскелета и играют важную роль в передаче механической информации (Ingber и др., 1990; Tamkun и др., 1986). Вместе с тем точный механизм передачи механического стимулирования невыяснен (Goldspink и др., 1992; Simpson и др., 1994). К цитоскелетным компонентам относятся винкулин, Таллин, не-саркомерный актин, титин и десмин. Эти цитоскелетные компоненты играют важную роль в производстве силы и передаче механического напряжения (Price, 1991); кроме того, они обеспечивают позиционной информацией сократительные волокна. Цитоскелет прикрепляется к сократительному аппарату и к ядерному компартменту. Эта взаимосвязь важна для определения расположения ядра в клетке. В настоящее время расположение ядер в поперечнополосатой мышце еще мало изучено, вместе с тем считают, что в других системах оно играет важную роль (Simpson и др., 1994). Расположение ядер способствует установлению региональных доменов белкового синтеза, необходимого для миофибриллогенеза и обмена мио-фибриллярных компонентов (Blau, 1989; B.Russell и Dix, 1992). Кроме того, эти процессы передаются на комплекс ядерной мембраны и затем на ядерный матрикс, который содержит генетический материал, необходимый для клеточных функций. Недавние исследования пространственной и позиционной организации ДНК позволили специалистам предположить, что механическое изменение ядерной мембраны может, в свою очередь, вызывать изменение ДНК; эти силы, таким образом, могут изменять ген- 47  Наука о гибкости Наука о гибкостиную экспрессию (Simpson и др., 1994). Возможно, именно измененная генная экспрессия может обусловливать повышенную гибкость. Главная проблема заключается в том, чтобы выявить механизм (или механизмы), посредством которого мышца и соединительные ткани модулируют свои изоформы (структурные варианты) в ответ на механическое стимулирование. Ввиду экономических, этических, нравственных и философских факторов ученые использовали множество моделей животных для изучения связанных с длиной изменений в мышцах. Ученые указывают на возможность использования ряда полученных результатов в отношении людей. Однако необходимо отметить следующее. Во-первых, не доказана возможность увеличения числа саркомеров у людей при помощи «традиционной» программы упражнений на растягивание. Во-вторых, вряд ли можно считать приемлемыми результаты исследований, предусматривающие иммобилизацию мышцы в удлиненном положении. Средняя продолжительность пребывания мышцы в растянутом положении колебалась от 4 дней до 4 недель. Как можно соотнести данный стимул с выполнением человеком одного цикла из 10 повторений с задержкой в положении растягивания на 10 с? И в-третьих, поскольку во всех исследованиях использовалась тракция (пассивная и статическая сила), какова может быть ее практическая взаимосвязь с развитием активной или баллистической гибкости? РЕЗЮМЕ Мышца — сложная структура, состоящая последовательно из более мелких единиц, которые частично обусловливают гибкость. Открытие третьего филамента, который назвали титином, показало несовершенство теории скольжения филаментов. Было доказано, что именно этот филамент главным образом определяет напряжение саркомера в покое. Результаты многочисленных исследований также продемонстрировали, что мышечной ткани присуща высокая степень адаптации. Теоретический предел удлинения саркомера при сохранении хотя бы одного поперечного мостика между филаментами актина и миозина на 50 % превышает его длину в покое. Таким образом, сократительные элементы мышцы способны увеличивать свою длину более чем на 50 % по сравнению с длиной в покое, что позволяет мышцам двигаться в полном диапазоне. Также было установлено, что количество саркомеров, их длина и длина мышечных волокон могут адаптироваться к функциональной длине всей мышцы. В настоящее время ученые предполагают, что растягивание способно модулировать генную экспрессию и влиять на степень растяжимости мышц.  |
