ГЛАВА 4
СОЕДИНИТЕЛЬНАЯ ТКАНЬ:
ФАКТОР, ОГРАНИЧИВАЮЩИЙ
ГИБКОСТЬ
В этой главе мы ознакомимся с существующей в настоящее время системой знаний о механических свойствах, механической ультраструктуре и биохимических составляющих соединительных тканей и влиянии на них процесса старения и иммобилизации. Наша задача состоит в том, чтобы понять, как воздействуют эти переменные на функцию соединительных тканей, которые в значительной мере определяют степень гибкости человека.
Соединительная ткань содержит множество специализированных клеток. Различные виды клеток выполняют функции защиты, хранения, транспортировки, связывания, соединения, поддержки и ремонта. Остановимся на клетках, выполняющих привязывающие функции.
КОЛЛАГЕН
Коллаген является преобладающим белком в организме млекопитающих. Ученые полагают, что он — основной структурный компонент живой ткани. Коллаген определяют как белок, содержащий три цепочки аминокислот, образующих тройную спираль. Два отличительных физических свойства коллагеновых волокон — высокий предел прочности на разрыв и относительная нерастяжимость.
Коллагеновые волокна, как правило, бесцветные и располагаются пучками. Им свойственна лишь незначительная степень растяжимости. В то же время они характеризуются высоким пределом прочности на разрыв и поэтому являются основными компонентами таких структур, как сухожилия и связки, подвергающиеся силе растяжения.
В настоящее время различают 5 видов коллагена, каждый из которых, в свою очередь, имеет подвиды (Jungueira, Cameiro, Long, 1989). Наиболее распространенной формой коллагена является коллаген типа I. Он содержится в коже, костях, сухожилиях и связках.
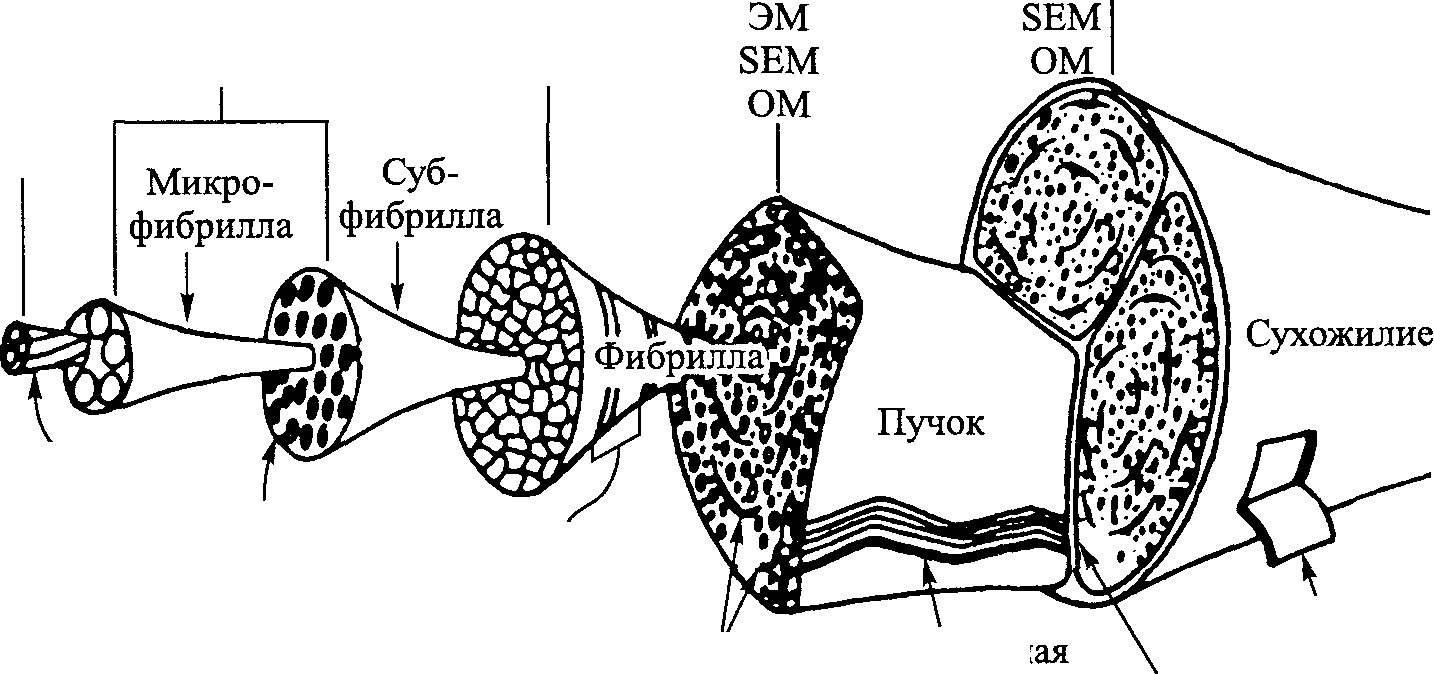
Ультраструктура коллагена. Структурная организация коллагена аналогична структурной организации мышцы (табл. 4.1, рис. 4.1). Электронно-микроскопическое исследование показывает, что отдельные волокна коллагена имеют поперечнополосатую структуру. Характерная структура поперечных полосок коллагена отражает ее ультраструктурную органи-
49
Наука о гибкости
Таблица 4.1. Сравнение структуры коллагена и мышцы
Мышца
Коллаген
Мышца
Мышечный пучок
Мышечное волокно
Миофибрилла
Миофиламент
Саркомер
(функциональная
единица)
Актин
Миозин
Титин
Поперечные
мостики
Сухожилие
Пучок
Фибрилла
Субфибрилла
Микрофибрилла
Молекула коллагена
(функциональная
единица)
Альфа1 цепочки (2)
Альфа2 цепочки (1)
Поперечные связи
зацию. Знание этой структуры имеет большое значение для понимания механизма двух основных физических свойств коллагена, о которых мы говорили выше.
Примечание. Цит. по: Alter M.J. Science of Stretching. - Champaign, IL: Human Kinetics, 1988. — P. 24.
Коллаген сухожилия расположен пучками (см. рис. 4.1). Диаметр пучков колеблется от 50 до 300 мкм. Фибриллы, в свою очередь, состоят из пучков коллагена — субфибрилл, диаметр которых составляет примерно 10-20 нм. Каждая субфибрилла состоит из пучков коллагена, микрофибрилл или филаментов. Их диаметр достигает 3,5 нм. Размеры филаментов в данной ткани колеблются в зависимости от возраста и других факторов. Согласно мнению Ину и Леб-лона (1986), наименее изученным фиброзным компонентом соединительной ткани является коллаген микрофибрилла. Своему названию он обязан Лоу (1961а, 1961 6, 1962). Ину и Леблон (1986) изучали микрофибриллы соединительной ткани мыши под мощным электронным микроскопом. Они выяснили, что микрофибриллы состоят из двух частей: собственно трубочки и поверхностного диска. Поперечное сечение трубочки характеризуется почти пятиугольной стенкой и полостью (просве-
Рентгеновские лучи SEM
35 А
Участки
окрашивания
640 А Периодичность
Ретикулярная мембрана
Волнообразк
 Доказательство: Доказательство:
Тропоколлаген
Рентгеновские Рентге- лучи ЭМ новские лучи
Фибробласты
структура Фасцикулярная мембрана
15 А 35 А 100-200 А 500-5000 А 50-300 мкм 100-500 мкм
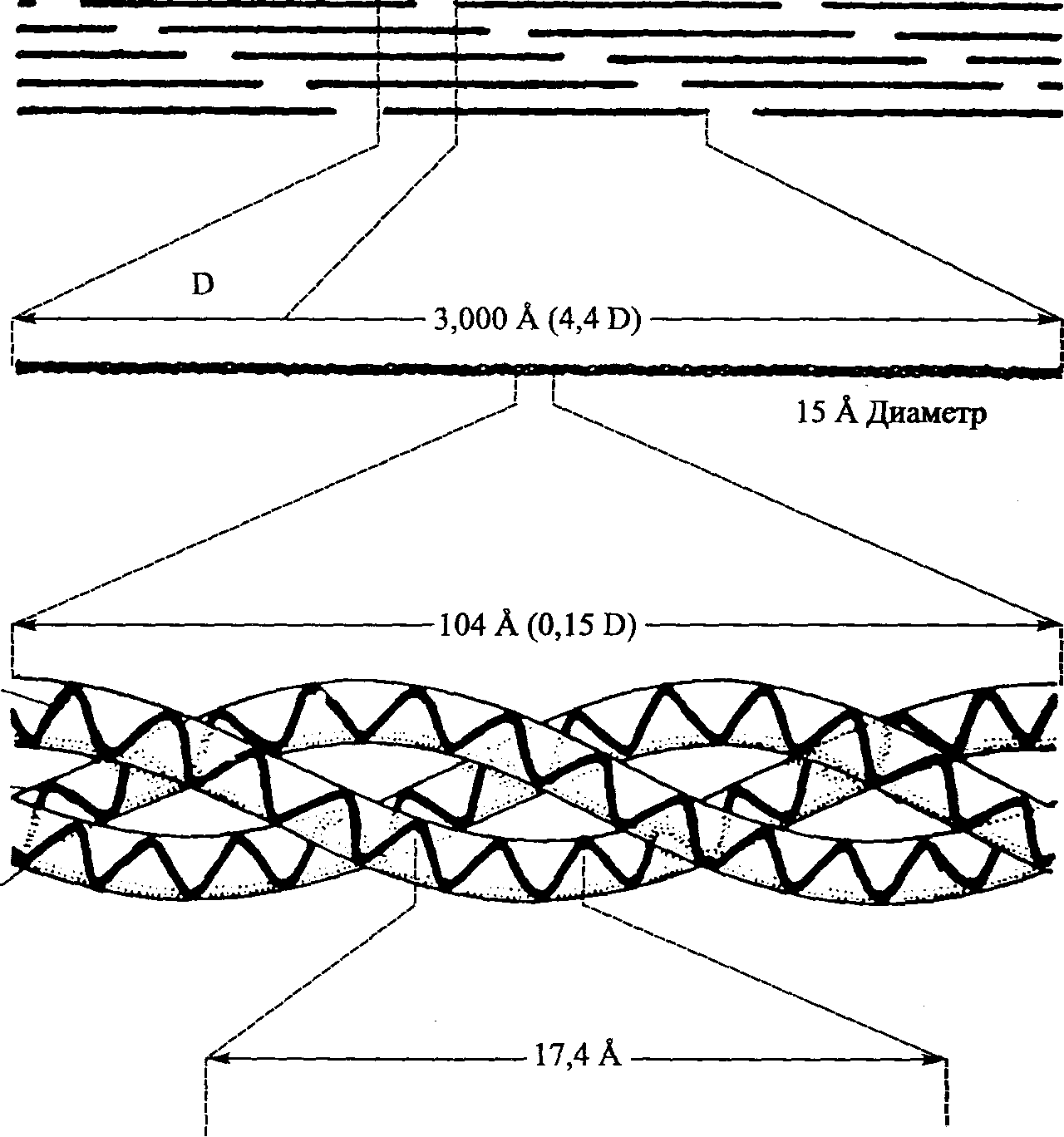
Рис. 4.1. Иерархия коллагена (Kastclic, Galeski, Baer, 1978)
50
 Глава 4 ■ Соединительная ткань: фактор, ограничивающий гибкость Глава 4 ■ Соединительная ткань: фактор, ограничивающий гибкость
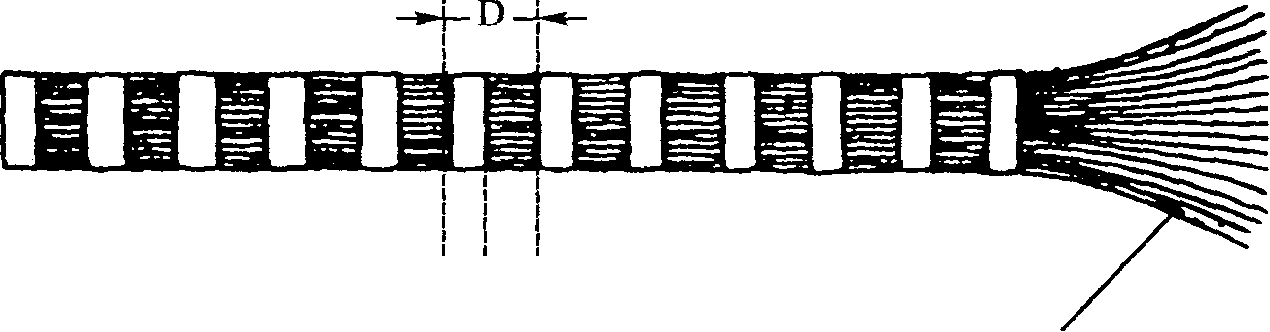
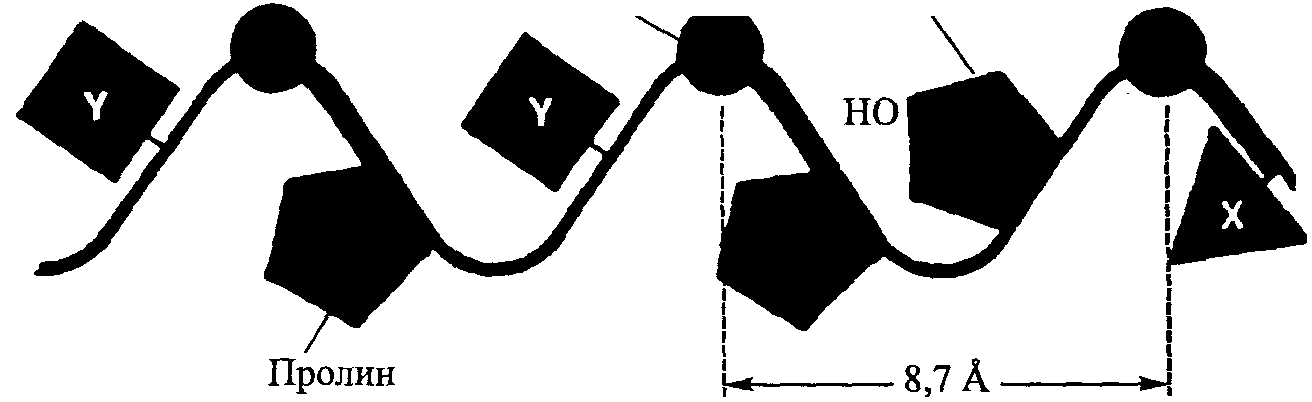
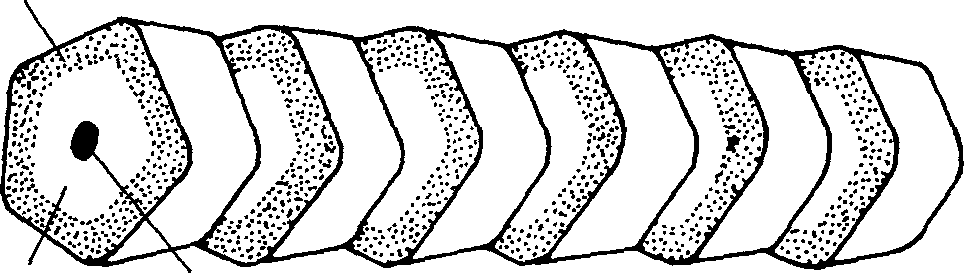 Стенка Просвет Сферула Микрофибриллярная трубочка    Диск Стержень (шип  Трэки Полная микрофибрилла (трубочка + диск) Рис. 4.2. Модель тубулярной части типичной микрофибриллы (я). Она состоит из пятиугольных сегментов, объединенных в столбик. Модель типичной микрофибриллы (б). Диск изображен в форме спирали, однако может иметь другую организацию. X 2 700 000 (Inoue, Leblond, 1986) том), в которой имеется шарик, называемый сферулом. Поверхностный диск представляет собой лентообразную структуру, окутывающую трубочку. Диск имеет плотные края — трэки с шипами, расположенными с определенным интервалом (рис. 4.2). В настоящее время мы не знаем, имеется ли эта структура в микрофибриллах человека. Коллагеновая микрофибрилла состоит из взаимонакладывающихся молекул коллагена, расположенных с одинаковым интервалом друг от друга. Эти единицы аналогичны саркомерам мышечных клеток. Многие крошечные коллагеновые фибриллы (рис. 4.3, а) состоят из волокна коллагена. Поперечные полосы фибриллы — следствие взаимного перекрытия молекул коллагена (рис. 4.3, б). Сама молекула коллагена (рис. 4.3, в) состоит из трех полипептидных цепочек, напоминающих тройную спираль (рис. 4.3, г). Аминокислотная последовательность этих полипептидных цепочек характеризуется наличием глицина в каждой третьей кислоте (рис. 4.3, д). Х-положение после глицина нередко представлено пролином, а Y-положение, предшествующее глицину — гидроксипролином. Молекулы коллагена, в свою очередь, состоят из кольцевидных спиралей аминокислот. Молекулы коллагена очень маленькие, их длина составляет около 300 нм, а диаметр — 1,5 нм (рис. 4,3, в). Взаимное накладывание молекул коллагена и обусловливает наличие поперечной исчерченности. Ее частота (периодичность) в коллагеновых фибриллах колеблется от 60 до 70 нм, в зависимости от источника и степени гидратации. Измерения показывают, что между 51
Наука о гибкости
концом одной коллагеновой молекулы и началом другой (в одной линии) имеется щель примерно 41 нм.
При сильном увеличении можно увидеть, что коллагеновая молекула состоит из трех полипептидных цепочек, представленных в виде ригидной спиралевидной структуры. Из трех переплетенных аминокислотных цепочек в коллагене в организме человека две (альфа1 цепочки) являются идентичными, а одна (альфа2 цепочка) отличается последовательностью аминокислот. Считают, что три цепочки удерживаются вместе водородными связями, образующими поперечные соединения (рис. 4.3, г).
Помимо поперечнополосатой структуры, для соединительных тканей характерны волнообразные ундуляции (колебания) коллагеновых волокон. Явление ундуляции называется «волнистостью» (Portenfield и De Rosa, 1991). «Волнистая» организация коллагена — один из основных факторов, лежащих в основе высокоэластичной реакции соединительной ткани. Коллаген состоит из фибрилл, соединенных в волокна. Механические свойства коллагеновых фибрилл таковы, что каждую фибриллу можно рассматривать как механическую пружину, а каждое волокно — как совокупность пружин. При растяжении волокна его длина увеличивается. Подобно механической пружине, энергия, обеспечиваемая для растягивания волокна, хранится в волокне, и именно выделение этой энергии обусловливает возврат волокна в нерастянутое положение, когда прикладываемую нагрузку убирают (Ozkaya и Nordin, 1991).
Поперечные соединения коллагеновой ткани. Главным фактором, который увеличивает растягивающую силу коллагеновых структур, является наличие внутримолекулярных поперечных соединений между альфа1 и альфа2 цепочками молекулы коллагена, а также межмолекулярных поперечных соединений между коллагеновыми субфибриллами, филаментами и другими волокнами. Эти поперечные соединения связывают молекулы в прочную единицу. Обычно чем меньше расстояние между одним поперечным соединением и другим или чем больше число поперечных соединений на данном расстоянии, тем выше эластичность (R.M.Alexander, 1975, 1988).
Ученые высказывают предположение, что количество поперечных соединений связано с интенсивностью обмена коллагена: коллаген непрерывно производится и расщепляется. Если количество производимого коллагена превышает количество расщепляемого, число поперечных соединений увеличивается и сопротивление структуры растягиванию повышается, и наоборот. По мнению некоторых специалистов, физическая нагрузка или мобилизация снижают число поперечных соединений, увеличивая интенсивность обмена коллагена (W.M.Bryant, 1977; Shephard, 1982). Результаты последних исследований также показывают, что эти два фактора могут играть определяющую роль в предотвращении образования поперечных соединений.
Биохимический состав коллагена. Молекула коллагена представляет собой сложную спиралевидную структуру, механические свойства кото-
52
?
Г л а в а 4 ■ Соединитапьная ткань: фактор, ограничивающий гибкость
 
 Фибрилла Фибрилла
Зона взаимного накладывания 0,4 D
Зона разрыва 0,6 D
Микрофибриллы
 Заполнение молекулами Заполнение молекулами
Молекула коллагена
г
Тройная
спираль
Типичная последовательность
цепочек
Глицин _ Гидроксипролин
Рис. 4.3. Ультраструктура коллагена. Рисунок Б.Тагавы (Ргоскор, Gurman, 1977)
53
Наука о гибкости
Удлиняющее Удлиняющее
растягивание растягивание
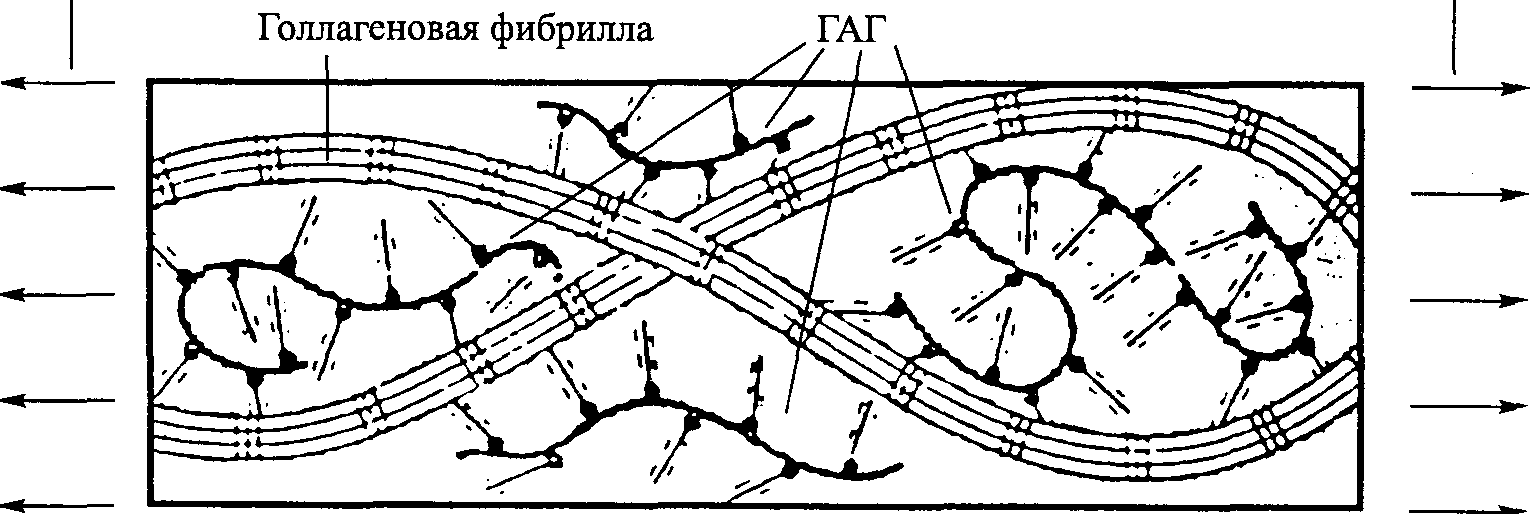
Рис. 4.4. Действие ГАГ. Растягивание прикладывается к коллагеновым фибриллам, однако ГАГ удерживают фибриллы разделенными (Meyers, Armstrong and Mow, 1984)
рой обусловлены как ее биохимическим составом, так и физическим расположением ее индивидуальных молекул. Коллаген состоит из множества сложных молекул — аминокислот, однако из них выделяют три основные. Это аминокислоты: глицин, составляющий 1/3 общего числа, а также пролин и гидроксипролин, каждая из которых составляет примерно 1/4 общего числа (см. рис. 4.3, д). Наличие пролина и гидроксипролина обеспечивает стабильность коллагена и его резистентность к растягиванию. Следовательно, чем выше концентрация этих аминокислот, тем больше сопротивление молекул растяжению. Присутствие азота в составе пролина предотвращает легкую ротацию участков, в которых он содержится (Grant, Prockop и Darwin, 1972).
Влияние на коллаген основных веществ. Главным фактором, влияющим на механические свойства или поведение коллагена, является присутствие основных веществ. Эти вещества широко распространены в соединительной ткани. Во многих участках их называют цементирующими веществами. Они образуют нефиброзный элемент матрикса,в который заключены клетки и другие компоненты. Этот вискозный, гелеподобный элемент состоит из гликозаминогликанов, белков плазмы и множества небольших белков, а также воды.
В соединительной ткани содержится 60-70 % воды. Гликозамино-гликаны обладают большой способностью связывать воду, поэтому их считают частично ответственными за столь высокую концентрацию воды.
Гиалуроновая кислота и «захваченная» ею вода — основной смазывающий материал фиброзной соединительной ткани. В частности, считают, что вместе с водой она выполняет роль смазывающего вещества между коллагеновыми волокнами и фибриллами. Это смазывающее вещество обеспечивает сохранение критического расстояния между волокнами и фибриллами, тем самым способствуя свободному скольжению волокон и фибрилл друг за другом и, возможно, предотвращая чрезмерное образование поперечных соединений (рис. 4.4).
54
   

Г л а в а 4 ■ Соединительная ткань: фактор, ограничивающий гибкость
Электромеханические и физиологические свойства
Прочные кристаллические материалы при деформации демонстрируют электромеханическое явление, которое называется пьезоэлектрическим эффектом (Athenstaedt, 1970). Подобный эффект наблюдается в биологических тканях. Одним из примеров может быть молекулярная структура естественной коллагеновой фибриллы. Тропоколлагеновые молекулы, образующие фибриллу, представляют собой электрически биполярные стержни, имеющие постоянный электрический потенциал в направлении продольной тропоколлагеновой оси (Athenstaedt, 1970). При сжатии соединительной ткани, такой, как хрящ, происходит механичес-ко-электрическая транедукция, приводящая к возникновению существенных электрических потенциалов (Grodzinsky, 1983). В последние годы к пьезоэлектрическому механизму было приковано большое внимание специалистов, особенно с точки зрения его возможной функции в росте и ремоделировании соединительных тканей, а также в лечении переломов костей.
Пьезоэлектрический эффект в биологических тканях называют электрокинетикой или потенциалами движения. Кроме потенциалов течения и токов, деформация биологических тканей может вызвать градиенты гидростатического давления, поток жидкости и деформацию клеток в матрик-
55
Наука о гибкости
се. В настоящее время механизм (или механизмы), обусловливающий эти реакции, не установлен. В то же время известно, что основным источником реакции трансдукции является электрокинетический механизм, или механизм течения потенциалов (Grodzinsky, 1987).
Механические свойства
Можно допустить, что потенциалы течения представляют собой механизм, посредством которого механические силы растягивания трансдукци-руются в различные виды генной экспрессии и, следовательно, в белковый синтез (например, создание особых изоформ титина и других тканей). В этой связи исследование Сатклиффа и Девидсона (1990) показало, что трансдукция механической силы в генную экспрессию эластина клетками гладкой мышцы во время растягивания может способствовать их специальной адаптации.
До настоящего времени в большинстве исследований рассматривали суставной хрящ под действием сил сжатия. Возможность получения весьма важной информации на этой основе объясняется следующим. Во-первых, суставной хрящ относится к категории соединительной ткани. Во-вторых, удлинение происходит одновременно вследствие сжатия. Известно, что электростатические силы можно рассматривать как межмолекулярные взаимодействия, которые существенно влияют на реологическое поведение биологических тканей (Grodzinsky, Lipshitz, Glimcher, 1978). В частности, внеклеточный матрикс выполняет важную функцию сопротивления силам растяжения, сжатия и сдвига. Как уже
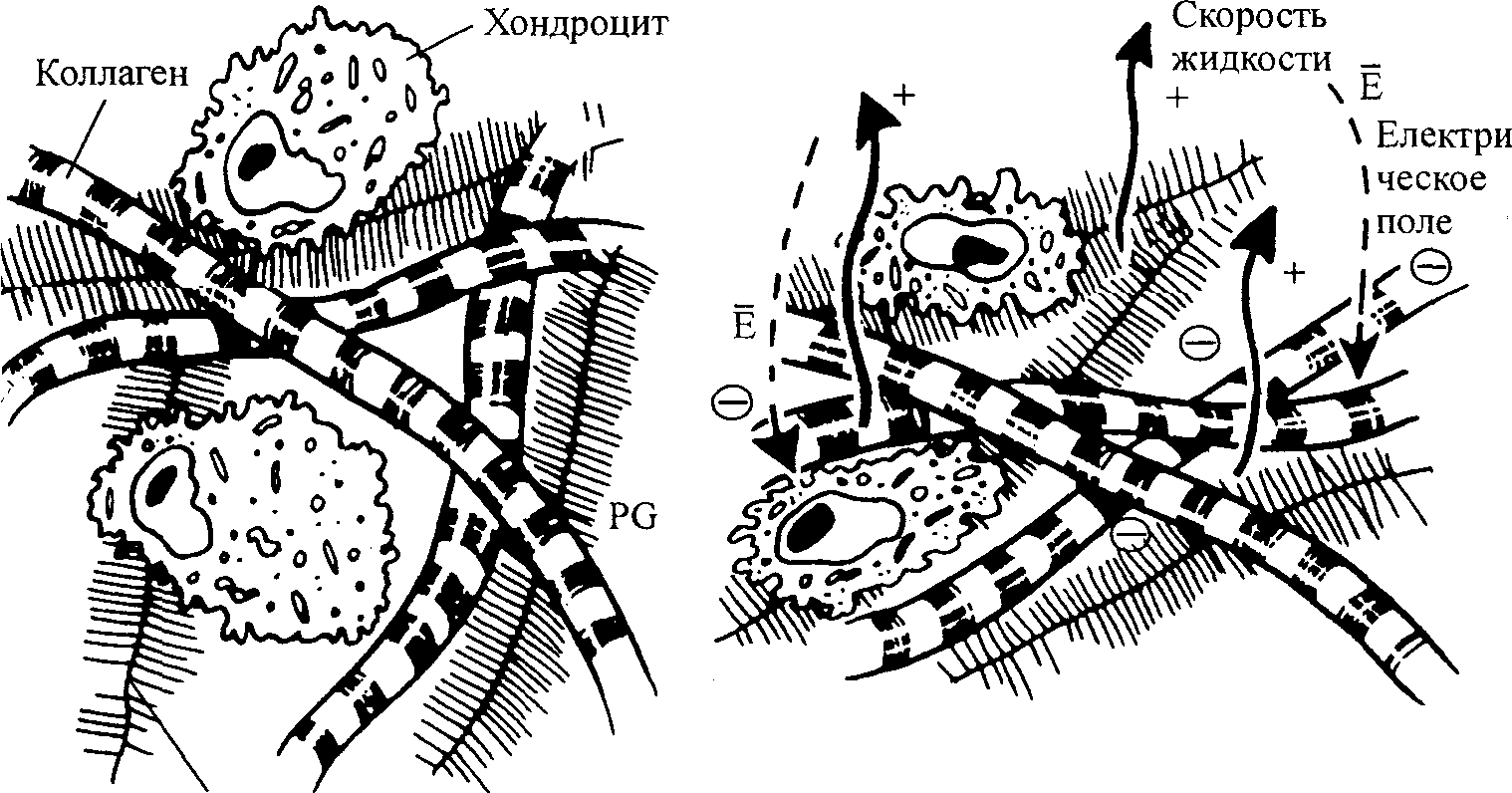
Протеогликан
а б
Рис. 4.5. Схематическое изображение соединительной ткани с коллагеновыми фибриллами, протеогаикановыми кластерами и клетками (а). Динамическое сжатие ткани приводит к деформации, градиентам давления, потоку жидкости и потенциалам течения (и потокам) во внеклеточном матриксе в клеточной среде (б)
56
  Г л а в а 4 ■ Соединительная ткань: фактор, ограничивающий гибкость Г л а в а 4 ■ Соединительная ткань: фактор, ограничивающий гибкость
отмечалось, электростатические силы отталкивания между ГАГ заряженными группами, как правило, делают матрикс более жестким, что повышает его способность противостоять деформации и выдерживать нагрузку (Grodzinsky, 1983, 1987; Muir, 1983; рис. 4.5). Внеклеточный матрикс содержит отрицательный фиксированный заряд, а интерстици-альная жидкость, таким образом, содержит достаточное количество дополнительных (+) контроионов для обеспечения электронейтральности; обусловленные сжатием изменения плотности фиксированного заряда вызывают изменение концентрации всех подвижных видов ионов во внеклеточном матриксе, согласно Доннану и законам электронейтральности. Таким образом, протеогликаны действуют как «молекулярные пружины» (Muir, 1983).
Сравнение влияния статических и динамических
нагрузок
Исследования суставного хряща in vivo показывают, что статическая иммобилизация, пониженная нагрузка или статическое сжатие сустава приводят к появлению участков повышенной фиксированной плотности заряда, повышению концентрации положительных контрионов и осмотического давления. Это ингибирует синтез и обработку протеогликанов (Gray и др., 1988; J.RG.Urban, Bayliss, 1989), а также нарушает питание хряща. С другой стороны, динамическое сжатие приводит к увеличению гидростатического давления, потока жидкости, потенциалов течения и изменению формы клетки, что может стимулировать биосинтез (A.Hall, Urban, Gehl, 1991; Y.-J.Kim и др., 1994). Таким образом, цикличная нагрузка и разгрузка способствуют сохранению здоровья хряща. Вместе с тем, при чрезмерной нагрузке повышается поток жидкости, напряжение и его интенсивность. Высокие уровни напряжения или его интенсивность могут привести к повреждению матрикса, отечности тканей и усилению диффузии в хряще (Sah и др., 1991), что ведет к хроническому повреждению хряща.
Влияние процесса старения на коллаген. Коллаген по мере своего старения претерпевает определенные физические и биохимические изменения. В конечном итоге они отражают снижение минимальной степени растяжимости, которая имела место, и увеличение ригидности. Так, например, процесс старения приводит к увеличению диаметра коллагеновых волокон в различных тканях. Кроме того, с течением времени усиливается процесс кристаллизации фибрилл. Увеличение степени кристаллизации или ориентации еще больше укрепляет межмолекулярные связи и повышает резистентность к дальнейшей деформации. Более того, предполагают, что процесс старения связан с увеличением числа внутри- и межмолекулярных поперечных соединений. Эти дополнительные поперечные соединения явно ограничивают способность скольжения коллагеновых молекул относительно друг друга. Важная роль в процессе старения принадлежит дегидратации. Так, с возрастом снижается количество воды, связанной с соединительными тканями, такими, как сухожилие. По некоторым
57
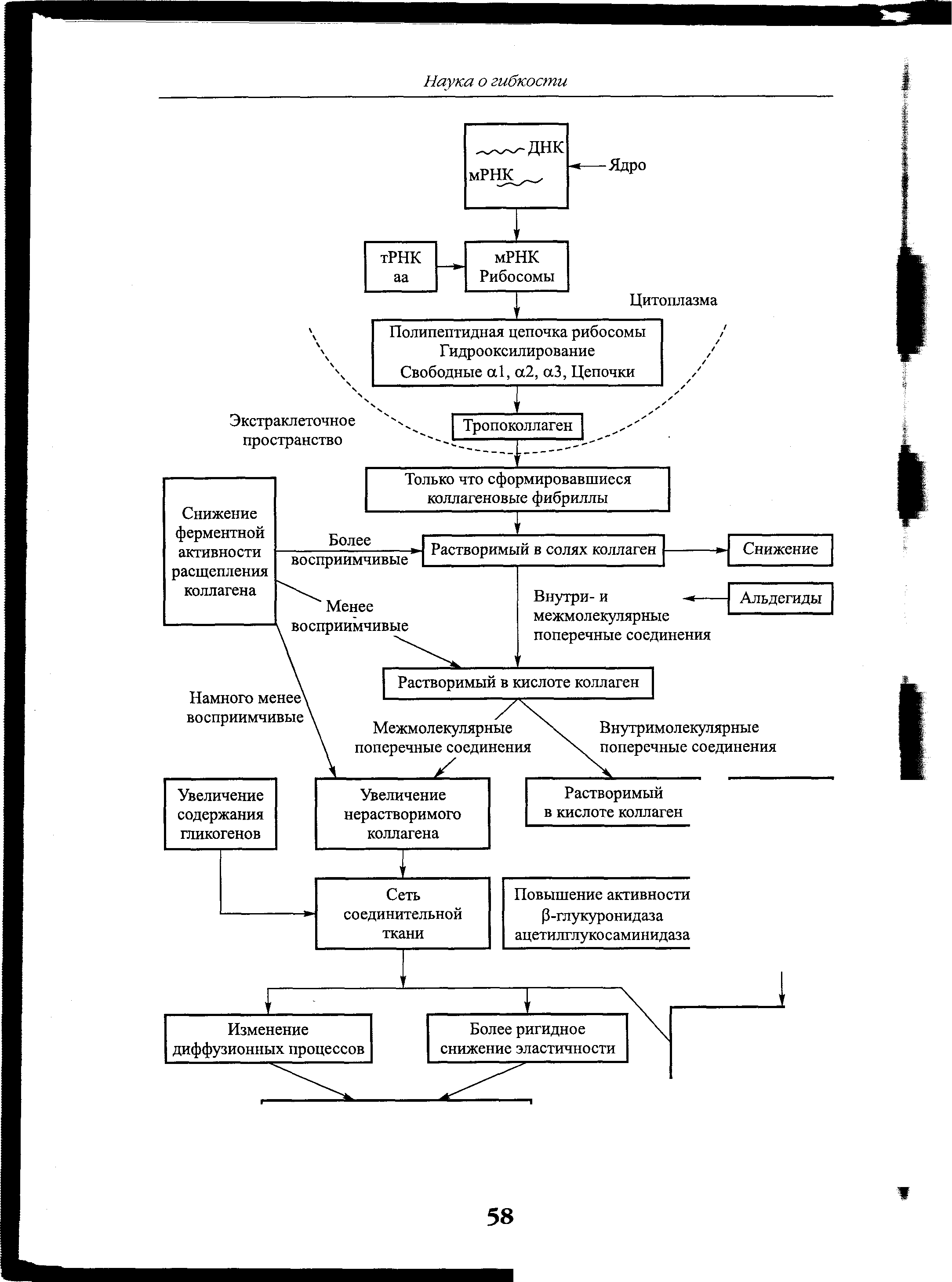



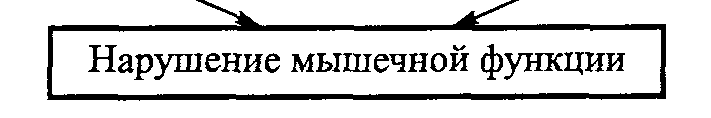
Рис. 4.6. Возрастные изменения в соединительной ткани, вызывающие нарушение мышечной функции (Mohan, Radha, 1981)
  Глава 4 ■ Соединительная ткань: фактор, ограничивающий гибкость Глава 4 ■ Соединительная ткань: фактор, ограничивающий гибкость
оценкам, если в сухожилиях маленьких детей содержание воды составляет приблизительно 80-85 %, то у взрослых этот показатель снижается до 70 % (Elliot, 1965; рис. 4.6).
Ультраструктурная основа и физиологический предел удлинения коллагена. В отличие от саркомера, волокно коллагена является сравнительно нерастяжимым. Волокно коллагена настолько неэластично, что оно даже не растягивается при воздействии на него массы, в 10 000 раз превышающей его собственную (Vevzar, 1963). Исследования показывают, что микроскопические волокна можно растянуть примерно на 10 % их исходной длины, прежде чем они порвутся. На молекулярном уровне степень растяжения коллагеновых фибрилл составляет около 3 % (Ramachandran, 1967). Электронно-микроскопическое исследование показывает, что при удлинении коллагена в нем происходит постепенное изменение внутрифибриллярной периодичности и латеральных измерений. В одном из ранних исследований (Cowan, McGavin, North, 1955) было установлено, что растяжение приводит к повторяющемуся увеличению осевого интервала с 0,286 до 0,310 нм и больше.
Считают, что подобное растяжение первоначально осуществляется в результате распрямления волокон и последующего постепенного скольжения их относительно друг друга. В результате увеличивается степень кристаллизации или ориентации, что, в свою очередь, усиливает межмолекулярную связь и повышает резистентность к дальнейшему удлинению. Кроме того, возрастает взаимопереплетение соседних молекул. Это приводит к увеличению силы интерцепочек, что обеспечивает повышенное сопротивление силам деформации. Дальнейшее растягивание приводит к превышению межмолекулярных связей и разрыву ткани (Laban, 1962; L.Weiss, Greep, 1983).
ЭЛАСТИЧНАЯ ТКАНЬ
Эластичная ткань — основной структурный компонент живой ткани. На микрофотографиях, полученных при помощи электронного микроскопа, видно, что большое количество эластичной ткани находится в сарколемме мышечного волокна (соединительная ткань, окружающая сарко-мер). Таким образом, эластичная ткань играет ведущую роль в определении возможной степени растяжимости мышечных клеток. Отдельные мышечные клетки содержат достаточно большое количество почти «чистых» эластичных волокон. Следовательно, эластичная ткань в значительной мере определяет возможный диапазон движения.
Эластичные волокна выполняют множество функций, включая распространение нагрузки, возникающей в изолированных участках, координацию ритмичных движений частей тела, сохранение энергии путем поддержания тонуса во время расслабления мышечных элементов и т. д. (Jenkins, Little, 1974).
Состав эластичных волокон. Эластичные волокна, в отличие от коллагеновых, менее изучены. В основном это следствие технических трудностей, с которыми сталкиваются ученые при попытке солюбилизи-
59
Наука о гибкости
ровать их (Modis, 1991). Другой причиной является весьма тесная анатомическая, морфологическая, биохимическая и физиологическая взаимосвязь эластичных и коллагеновых волокон. Эластичные волокна могут включать коллагеновые волокна, переплетенные с их основными компонентами.
Оптически эластичные волокна являются однородными. Поэтому они характеризуются высокой рефрактерностью и являются практически изотропными. Если взглянуть на них в электронный микроскоп, мы увидим, что каждое волокно состоит из массы фибрилл, сплетенных в виде каната. Для эластичных волокон, в отличие от коллагеновых, характерно полное отсутствие периодической структуры (т. е. полосатости).
Поперечные соединения эластичной ткани. Предполагают, что эластичные волокна состоят из сети произвольно закрученных цепочек, имеющих ковалентные поперечные соединения. Нековалентные межцепочные силы считаются небольшими при достаточно большом расстоянии между поперечными соединениями (L.Weiss, Greep, 1983). Поэтому эластичные поперечные соединения не превращают молекулы в прочное кана-тообразное соединение типа коллагена. Значение этого различия будет рассмотрено ниже.
Эластин. Термин «эластичная ткань», или «эластичное волокно», имеет структурное значение. В то же время эластин определяет биохимический характер эластичных волокон. Это сложная структура, имеющая механическое свойство эластичности благодаря его биохимическому составу, а также физической конфигурации его отдельных молекул. Как и коллаген, эластин состоит из аминокислот. Однако в отличие от коллагена, он содержит главным образом неполярные гидрофобные аминокислоты, небольшое количество гидроксипролина и совсем не содержит гидроксили-зина. Особенностью эластина является также то, что в его состав входят десмозин и изодесмозин, которые выполняют роль ковалентных поперечных соединений в полипептидных цепочках и между ними. Подобно коллагену, примерно 1/3 остатка эластина представлена глицином, пролин составляет около 11%.
Влияние процесса старения на эластичные волокна. Вследствие процесса старения в эластичных волокнах происходят определенные физические и биохимические изменения. Они утрачивают свою эластичность, подвергаются фрагментации, кальцификации; количество поперечных соединений в них увеличивается. С точки зрения биохимических аспектов, происходит увеличение числа аминокислот, содержащих полярные группы, например, увеличивается содержание десмозина, изодесмо-зина и лизинонорлейцина. Другие изменения включают увеличение процента хондроитинсульфата В и кератосульфата. Вместе же эти изменения обусловливают возрастное снижение эластичности и увеличение ригидности (Bick, 1961; Gosline, 1976).
Ультраструктурная основа и физиологический предел удлинения эластина. Эластичные волокна легко поддаются растягиванию. Однако при устранении силы растягивания они возвращаются практически к исходной длине. Только при растягивании эластичных волокон более чем на
60
Г л а в а 4 ■ Соединительная ткань: фактор, ограничивающий гибкость
 150 % исходной длины они достигают точки разрыва; это происходит при воздействии силы всего лишь 20-30 кг-см 2 (Bloom, Fawcett, 1986). Для объяснения эластичной силы, связанной с эластином, было предложено несколько моделей. Двухфазную модель эластина предложил Партридж (1966), а впоследствии ее использовали Вейс-Фог и Андерсон (1970а, 19706). В соответствии с этой моделью, эластин существует в виде отдельных частиц, прикрепленных друг к другу при помощи поперечных соединений с водой, которая находится в пространстве между частицами. Первоначальная форма частиц сферическая; при растягивании они приобретают овальные очертания. Этому изменению формы противодействует поверхностное напряжение. При устранении растягивания поверхностное напряжение снова возвращает частицам их сферическую форму. Хоев и Флори (1974) подвергли критике эту модель, основываясь на принципах термодинамики. 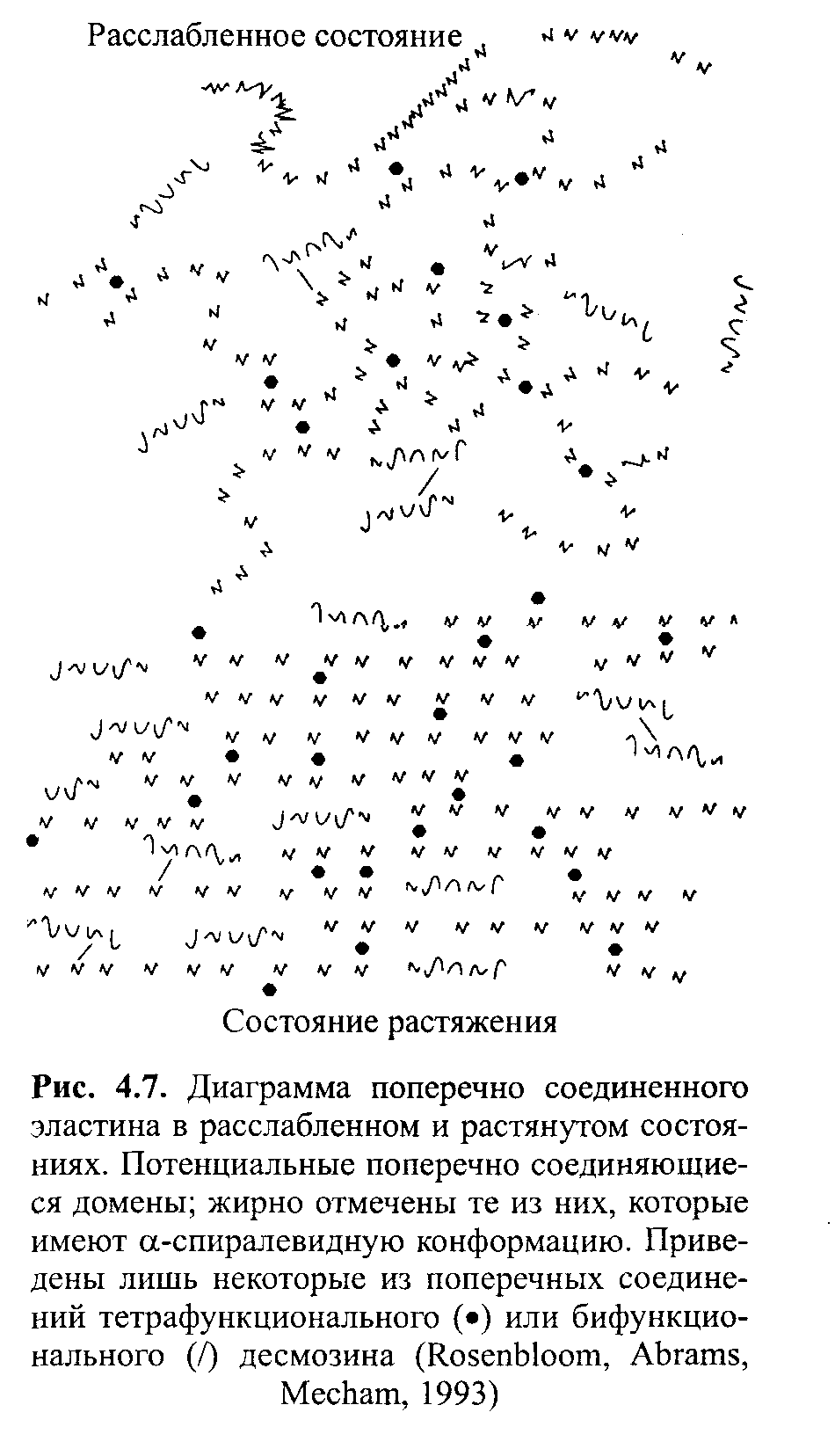 Согласно другой модели, эластин состоит из сети произвольно закрученных цепочек, имеющих ковалентные поперечные соединения. Эти соединения оказывают ограничивающее воздействие на относительное движение эластичных волокон, вследствие чего при растягивании ткани отдельные цепочки оказываются «скованными» и не могут скользить относительно друг друга. (Franz-blau, Faru, 1981). Однако ковалентные силы между цепочками слабые, а расстояние между поперечными соединениями достаточно большое. Вследствие этого минимальная, действующая в одном направлении сила вызывает значительное удлинение цепочек, прежде чем поперечные соединения начинают ограничивать движение. Гидрофобные домены в расслабленном состоянии имеют произвольные кольца (витки), в то же время в р-спиральной конфор-мации может существовать лишь ограниченная часть. В состоянии растяжения воздействующие силы обусловливают относительное размещение цепочек и ограничивают их конфор-мационную свободу (рис. 4.7).
61
Третья модель была предложена Урри (1984). В ее осно-
Наука о гибкости
 ве также лежит энтропический механизм, обеспечивающий эластомерную силу. Однако он основан на иной молекулярной конформации, изложенной вкратце Розенблумом, Эбремсом и Мечем (1993). Энтропическая эластичность обусловлена /3-спиральной структурой с соответственно зафиксированной длиной от одного конца цепочки к другому. Пептидные сегменты между ^/-поворотами свободно подвергаются большой амплитуде и низкочастотным вращательным движениям, которые называются либрация-ми. После растягивания происходит снижение амплитуды либрации, вызывающее значительное сокращение энтропии сегмента, что обеспечивает движущую эластомерную силу для возвращения в расслабленное состояние.Требуется проведение дополнительных исследований, чтобы определить, является ли верной какая-либо из этих моделей. ВЗАИМОСВЯЗЬ МЕЖДУ КОЛЛАГЕНОМ И ЭЛАСТИЧНЫМИ ВОЛОКНАМИКак уже отмечалось выше, эластичные волокна практически всегда находятся в тесной связи с коллагеновыми тканями. Более того, действие этой комбинированной ткани является результатом интеграции разных механических свойств составляющих ее двух видов ткани. С одной стороны, эластичные волокна сами по себе обусловливают как бы обратную эластичность (т. е. способность растянутого материала вернуться в исходное состояние покоя). С другой стороны, коллагеновая сеть обусловливает ограничение деформаций эластичных элементов, а также свойства (предел прочности на разрыв и относительную нерастяжимость) этих составных структур. Вполне логично предположить, что если доминируют коллагено-вые волокна, то превалируют такие свойства, как ригидность, стабильность, предел прочности на разрыв и ограниченный диапазон движения (Eldren, 1968; Goslline, 1976). СТРУКТУРЫ, СОСТОЯЩИЕ ИЗ СОЕДИНИТЕЛЬНОЙТКАНИТело человека содержит множество структур, состоящих из соединительной ткани. Ниже мы рассмотрим те из них, которые представляют для нас наибольший интерес — сухожилия, связки и фасции. Сухожилия. Мышцы прикрепляются к костям при помощи сухожилий. Главная функция сухожилия — передача напряжения от мышцы к кости, обусловливающая производство движения. Сухожилия играют исключительно важную роль в определении качества движения. Верзар (1964) следующим образом объясняет эту концепцию: 62
      Г л а в а 4 ■ Соединительная ткань: фактор, ограничивающий гибкость Г л а в а 4 ■ Соединительная ткань: фактор, ограничивающий гибкость
Важность нерастяжимости, с физиологической точки зрения, состоит в том, что наименьшее мышечное сокращение может быть передано без потерь сочленениям. Если бы сухожилия, т. е. коллагеновые волокна, обладали слабой растяжимостью, выполнение тонких движений, таких, как движение пальцев виолончелиста или пианиста, а также точных движений глаз было бы попросту невозможным.
Основными составными сухожилий являются толстые, плотно уложенные параллельные коллагеновые пучки разной длины и толщины. Для них характерна продольная полосатость, и во многих местах они сливаются друг с другом. Фибриллы, входящие в состав сухожилий, расположены исключительно по направлению к длинной оси, которая также представляет собой направление движения естественной физиологической нагрузки. Сухожилие, таким образом, преимущественно приспособлено противостоять движению в одном направлении. При этом, чем выше соотношение коллагена и эластичных волокон, тем большее число волокон ориентировано в направлении нагрузки (стресса) и тем больше площадь поперечного сечения или ширина сухожилия, а следовательно, тем прочнее сухожилие.
Сухожильный пучок окутан эндотендинием. За ним следуют перитен-диний и эпитендиний.
В сухожилии нагрузка порядка 4 % считается особенно значительной и соответствует пределу прочности и, следовательно, эластичности (Crisp, 1972). Дальнейшее растягивание может привести к травме.
При воздействии напряжения растягивания на сухожилие происходит деформация. При невысоких уровнях напряжения волнистая структура кол-лагеновых пучков сухожилия выпрямляется, обеспечивая быструю и незначительную деформацию. Дальнейшее растягивание приводит к деформации, которая оказывается линейно связанной с количеством напряжения. В этом диапазоне нагрузок устранение воздействия нагрузки приводит к тому, что сухожилие принимает свою исходную длину. Если нагрузки превышают этот диапазон, происходит постоянное изменение длины, сопровождающееся микротравмой структурной целостности сухожилия.
Связки соединяют кости между собой. В отличие от сухожилий, они прикрепляются (входят) к костям с обоих концов. Их функция состоит в удерживании сустава (т. е. места соединения двух и более костей). Имеется весьма обширная информация о видах чувствительных нервных окончаний, находящихся в связках (Brand, 1986; Rowinsky, 1985) и выполняющих роль рецепторов нервной системы. Таким образом, «они могут играть значительно более важную роль в нормальном функционировании суставов, чем считалось, и могут вносить соответственно более значительный вклад в патологические последствия травм» (C.G.Armstrong, O'Connor и Gardner, 1992).
Связки похожи на сухожилия, однако их элементы не так правильно расположены. Как и сухожилия, они состоят главным образом из пучков коллагеновых волокон, расположенных параллельно друг другу или переп-
63
Наука о гибкости
летенных друг с другом. Связки имеют различную форму; для них характерна более значительная «смесь» эластичных и тонких коллагеновых волокон, переплетенных с параллельными пучками. Следовательно, они гибкие и податливые, что обеспечивает свободу движений, и в то же время прочные и нерастяжимые, что обусловливает их резистентность прикладываемым силам.
Биохимический анализ показывает, что связки состоят в основном из коллагеновой ткани. Исключение составляют желтая и выйная связки, которые соединяют пластинки соседних позвонков нижней части спины и шеи соответственно. Эти связки состоят почти полностью из эластичных волокон, поэтому они достаточно эластичны. Другая причина различий между некоторыми связками и сухожилием, касающаяся их высокоэластичных свойств, связана с процентом ГАГ. Исследования, проведенные By, Гомесом и Акесоном (1985), показали, что содержание ГАГ в связке составляет всего 1-1,5 %. Такое же количество ГАГ содержится в коллатеральных связках. Содержание ГАГ в крестообразных связках несколько выше — 2,5-3,0 %. Возникает вопрос: повышает ли более высокий процент ГАГ растяжимость связок?
Джонс и Райт в своем исследовании (1962) установили, что сухожилия обеспечивают всего около 10 % общей резистентности движению. В то же время они выявили, что связки и суставные капсулы обеспечивают около 47 % общего сопротивления движению. Следовательно, эти ткани играют более существенную роль в определении конечной амплитуды движения сустава. Следует отметить, что упражнения на растягивание, используемые обычными людьми, не должны быть направлены на удлинение суставной капсулы и связок, имеющих нормальную длину, поскольку это может дестабилизировать сустав и повысить вероятность травм. Вместе с тем не следует полностью запрещать упражнения на растягивание связок и суставных капсул, так как их выполнение под наблюдением специалистов является во многих случаях весьма эффективным для коррекции неполных вывихов, увеличения диапазона движения, уменьшения боли. Растягивание суставной капсулы является необходимым, если она укоротилась и ограничивает диапазон движения (например, при воспалении капсулы плеча).
Фасция — термин, который употребляется в макроскопической анатомии для обозначения всех фиброзных соединительных структур, не имеющих специального названия. Подобно упомянутым выше тканям, фасция может иметь различную толщину и плотность в зависимости от функциональных потребностей и обычно представлена в виде перепончатых «простыней».
Различают три вида фасций. Поверхностная фасция находится непосредственно под кожей. Она имеет два слоя. Внешний слой называется жировым. Он содержит разное количество аккумулированного жира. Внутренний слой представляет собой тонкую мембрану, которая не содержит жира. Во многих частях тела поверхностная фасция свободно скользит над глубокой фасцией, обусловливая характерную подвижность кожи (Clemente,- 1985). Глубокая фасция находится непосредственно под поверхностной и обычно более плотная и компактная. Она покрывает мышцы, кости, нервы, крове-
64
      Г л а в а 4 ■ Соединительная ткань: фактор, ограничивающий гибкость Г л а в а 4 ■ Соединительная ткань: фактор, ограничивающий гибкость
носные сосуды и органы тела и сливается с ними. Кроме того, она компарт-ментализует тело, отделяя, например, мышцы от внутренних органов. Под-серозная фасция находится в глубине вокруг полостей тела. Она образует фиброзный слой серозной мембраны, окутывающей и поддерживающей внутренние органы. Примером могут служить плевра вокруг легких, перикард вокруг сердца и брюшина вокруг брюшной полости и органов.
Название глубокой фасции, окружающей и увязывающей мышцу в отдельные группы, зависит от местонахождения. Оболочки соединительной ткани, окутывающие всю мышцу, называются эпимизием. Перимизий окутывает пучки мышечных волокон и соединяет их с эпимизием (Borg, Caulfield, 1980). Перимизий не только связывает мышечные волокна в пучки, но и привязывает каждое мышечное волокно, находящееся в пучке, к соседнему (Rowl, 1981). В перимизий можно обнаружить до 150 отдельных волокон. Вокруг каждого мышечного волокна находится эндомизий, который также соединяется с перимизием (Borg, Caulfield, 1980). И наконец, сарколемма, соединительная ткань, покрывает функциональную единицу мышцы — саркомер (рис. 4.8).
Функция фасции
Рис. 4.8. Соединительная ткань мышцы: вся мышца с рассеченным брюшком (а); увеличение поперечного разреза брюшка (б)
65
Как считает Роув (1981), внутримышечная соединительная ткань может выполнять, по меньшей мере, три функции. Во-первых, она создает каркас, связывающий мышцу воедино и обеспечивающий соответствующее расположение мышечных волокон, кровеносных сосудов, нервов и т.д. Во-вторых, она делает возможной безопасную и эффективную передачу сил, непосредственно производимых мышцей или воздействующих на нее. И наконец, она снабжает необходимой смазкой поверхности между мы-
Наука о гибкости
Таблица 4.2. Сопоставление относи- шечными волокнами и пучками мышеч-тельного вклада структур мягких ных волокон, которые позволяют мышце тканей в сопротивление сустава менять свою форму Сопротивление, % Соединительная ткань составляет около 30 % всей мышечной массы. Суставная капсула 47 Именно она позволяет мышцам изме- Мышца (фасция) 41 нять свою длину. При пассивном движе- Сухожилие 10 Кожа 2 нии ф асции МЫШцЫ обусловливают около 41 % общего сопротивления движению (Johns и Wright, 1962). Таким образом, фасция представляет собой второй наиболее важный фактор, ограничивающий диапазон движения (табл. 4.2). Поэтому программа упражнений на растягивание должна быть преимущественно направлена на удлинение фасций. К сожалению, мы еще мало знаем о функциональных взаимосвязях фасции с силами и давлением, производимыми в результате мышечных сокращений (Garfin и др., 1981). Лишь в нескольких исследованиях рассматривали биомеханические влияния фасции на мышцу. Тем не менее, в одной из работ было продемонстрировано значение фасциальных тканей. Гарфин с коллегами (1981) обнаружили, что небольшой разрез эпимизия задних конечностей собаки привел к снижению произведения силы приблизительно на 15 % и снижению давления внутри компартмента во время мышечных сокращений на 50 %. Мышечно-фасциальные ограничения и анатомия фасцииЧасто различные специалисты в области медицины рассматривают тело с миопической точки зрения. По давно сложившейся традиции, хиропрактики занимаются устранением неполных вывихов позвонков, остеопаты — профилактикой и лечением остеопатии, врачи — снятием боли, специалисты в области акупунктуры — воздействием на ключевые точки и т. д. Однако проблема может заключаться не в суставе, мышце или нерве, а в фасции. Фасция обладает способностью адаптироваться к различным условиям. Кроме того, не следует забывать, что фасции являются непрерывными (они могут переходить из одного участка тела в другой) и соприкасающимися. Чтобы лучше понять мышечно-фасциальные взаимодействия, представим себе тело в виде гигантского шара, внутри которого находятся прикрепленные к нему шары меньшего размера. Эти маленькие шары представляют собой различные органы и мышцы тела. Нарушение формы любого из этих шаров приводит к деформации остальных (компенсации). Диагностика мышечно-фасциалъных ограниченийФасциальные взаимосвязи можно продемонстрировать на двух уровнях: визуальном и тактильном. Представьте себе скелет с покрытием, состоящим из мышц и фасций. При растягивании скелета цвет фасциаль- 66
 Г л а в а 4 ■ Соединительная ткань: фактор, ограничивающий гибкость Г л а в а 4 ■ Соединительная ткань: фактор, ограничивающий гибкость
ных соединений становится белым вдоль линий нагрузки (растягивания), их можно пропальпировать. Для этого испытуемый ложится на стол. Исследователь (в данном случае вы) должен поместить свои пальцы испытуемому на голову, закрыть глаза и сконцентрировать свое внимание на любом движении, передаваемом к голове. Попросите испытуемого повернуть голову, и вы ощутите последующее движение, передаваемое к голове. Предложите ему согнуть ноги в коленях, вы снова ощутите слабое движение, передаваемое к голове.
Теперь представьте себе, что вашу машину ударила сзади другая машина. Вы обнаружите значительные повреждения в задней части машины, а также отдельные — в ее передней части. Вы меняете заднее крыло и ремонтируете остальные повреждения. Что же касается больного человека, то его не всегда можно «отремонтировать». Нередко незначительные повреждения остаются незамеченными, что в конечном итоге может сказаться на качестве жизни человека.
Методы устранения дисфункции фасции
В случае инсульта могут возникнуть фасциальные ограничения во всех направлениях: параллельно, перпендикулярно и косо по отношению к мышечным волокнам. Для воздействия на такие ограничения используют биомеханические силы напряжения, сжатия, сгибания, скручивания в различных формах — общий массаж, ролфинг, мобилизация, растягивание (Mottice и др., 1986). Утверждают, что многие из этих методов не изменяют и не модифицируют существенные фасциальные ограничения, которые наблюдаются у значительного процента больных (Barnes, 1991). В последние годы арсенал мануальной терапии пополнил метод мышечно-фасциального облегчения (ММО). Однако на сегодняшний день эффективность этого метода практически не изучена.
Сущность его заключается в следующем. Пациента оценивают путем «чтения тканей» с целью выявить участки симметрии-асимметрии и расслабленности-напряженности. Затем в соответствующем направлении прикладывают силу к мягким тканям и воздействуют на них до их расслабления. Это «размягчение» называют облегчением. Процедуру повторяют до полного удлинения тканей. Более подробно об этом методе можно прочесть в работах Канту и Гродина (1972), а также Манхейма и Лаветта (1989).
ВЛИЯНИЕ ИММОБИЛИЗАЦИИ НА СОЕДИНИТЕЛЬНУЮ ТКАНЬ
В результате аномальных физических и химических состояний фасция может утолщаться, укорачиваться, кальцифицироваться, подвергаться эрозии, что зачастую сопровождается болезненными ощущениями (Mottice и др., 1986). В частности, при иммобилизации суставов на какое-то время элементы соединительной ткани капсул, связок, сухожилий,
67
Наука о гибкости
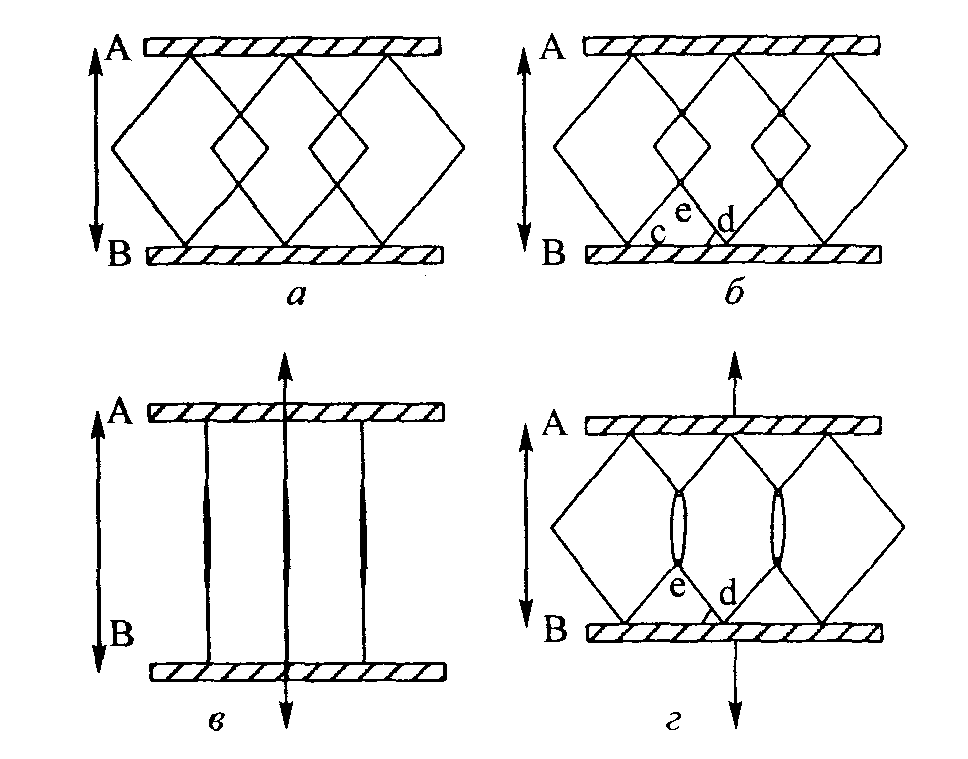
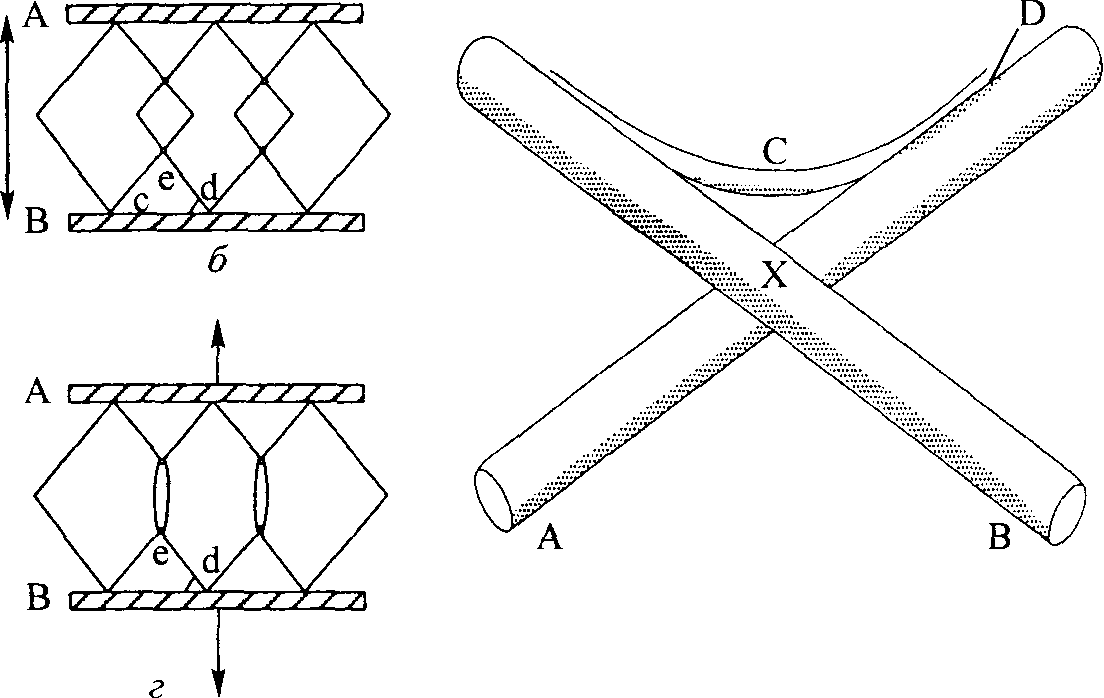 Рис. 4.9. Идеализированная структура коллагено-вых волокон. Фиксированный контакт в стратегических участках (например, точки d и е) может существенно ограничивать растяжение коллаге-нового сплетения: расположение коллагеновых волокон (а); поперечные соединения коллагено-вого волокна (б); нормальное растяжение (в); ограниченное растяжение вследствие поперечного соединения (г) (Akeson, Amcel, Woo, 1980) Рис. 4.9. Идеализированная структура коллагено-вых волокон. Фиксированный контакт в стратегических участках (например, точки d и е) может существенно ограничивать растяжение коллаге-нового сплетения: расположение коллагеновых волокон (а); поперечные соединения коллагено-вого волокна (б); нормальное растяжение (в); ограниченное растяжение вследствие поперечного соединения (г) (Akeson, Amcel, Woo, 1980)
Рис. 4.10. Идеализированная модель взаимодействия поперечных содине-ний коллагена на молекулярном уровне. А и В — предварительно существовавшие волокна; С — вновь синтезированная фибрилла, D — поперечные соединения, созданные в момент включения фибриллы в волокно; X — узловая точка, в которой соседние волокна обычно свободно двигаются один за другим (Akeson, Amcel, Woo, 1980)
мышц и фасции теряют способность растягиваться. Кроме того, иммобилизация сопровождается изменением химической структуры ткани: снижением содержания гиалуроновой кислоты приблизительно на 40 %, концентрации хондроитин-4- и хондроитин-6-сульфата — на 30 % и содержания воды — на 4,4 % (Akeson, Amiel, Laviolette, 1967; Akeson и др., 1977; Akeson, Amiel, Woo, 1980). Если допустить, что расстояние между волокнами сокращается при снижении объема ГАГ и воды, то такое снижение содержания последних приведет к критическому сокращению расстояния между коллагеновыми волокнами. Следовательно, волокна соединительной ткани сблизятся друг с другом и постепенно соединятся, образовав аномальное поперечное соединение. В результате значительно снизится степень растяжимости и увеличится тугоподвижность тканей (рис. 4.9 и 4.10; Akeson, Amiel и Woo, 1980). Отмечая значение иммобилизации и мобилизации, Донателли и Оуэнс-Буркхарт (1982) писали: «Если движение является главным стимулом биологической активности, то количество, продолжительность, частота, интенсивность и время начала движения играют важную роль в желаемом терапевтическом воздействии на структуры соединительной ткани. Эти факторы следует определять, прежде чем мы поймем оптимальные положительные воздействия мобилизации». 68
 Г л а в а 4 ■ Соединительная ткань: фактор, ограничивающий гибкость Г л а в а 4 ■ Соединительная ткань: фактор, ограничивающий гибкость
МЕТАБОЛИЧЕСКИЕ И ПИЩЕВЫЕ ВЛИЯНИЯ НА СОЕДИНИТЕЛЬНУЮ ТКАНЬ
69
Нормальное развитие ткани и лечение повреждений представляют собой весьма динамичную, интегрированную серию клеточных, физиологических и биохимических явлений, происходящих в организме. Два фактора играют существенную роль с точки зрения оптимизации функции, роста ткани и лечения травм: метаболизм и питание (достаточное содержание витаминов А, Е и С, кальция, меди, железа, магния и марганца). Известно, что пищевой дефицит, избыток, или дисбаланс, воздействуют на метаболизм и созревание белков соединительной ткани (рис. 4.11, табл. 4.3). Более того, как показывают исследования, врожденные генетические нару-
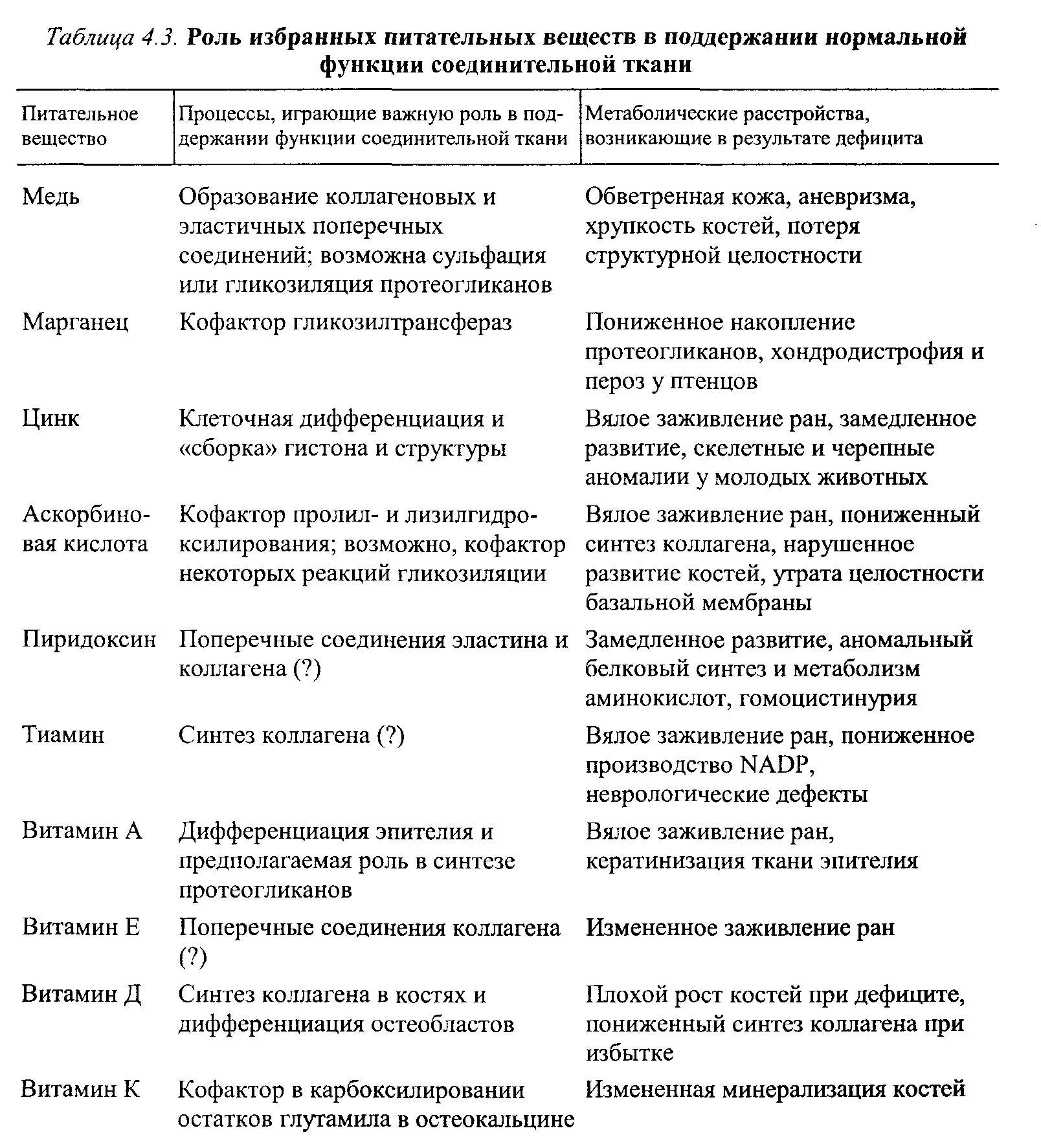
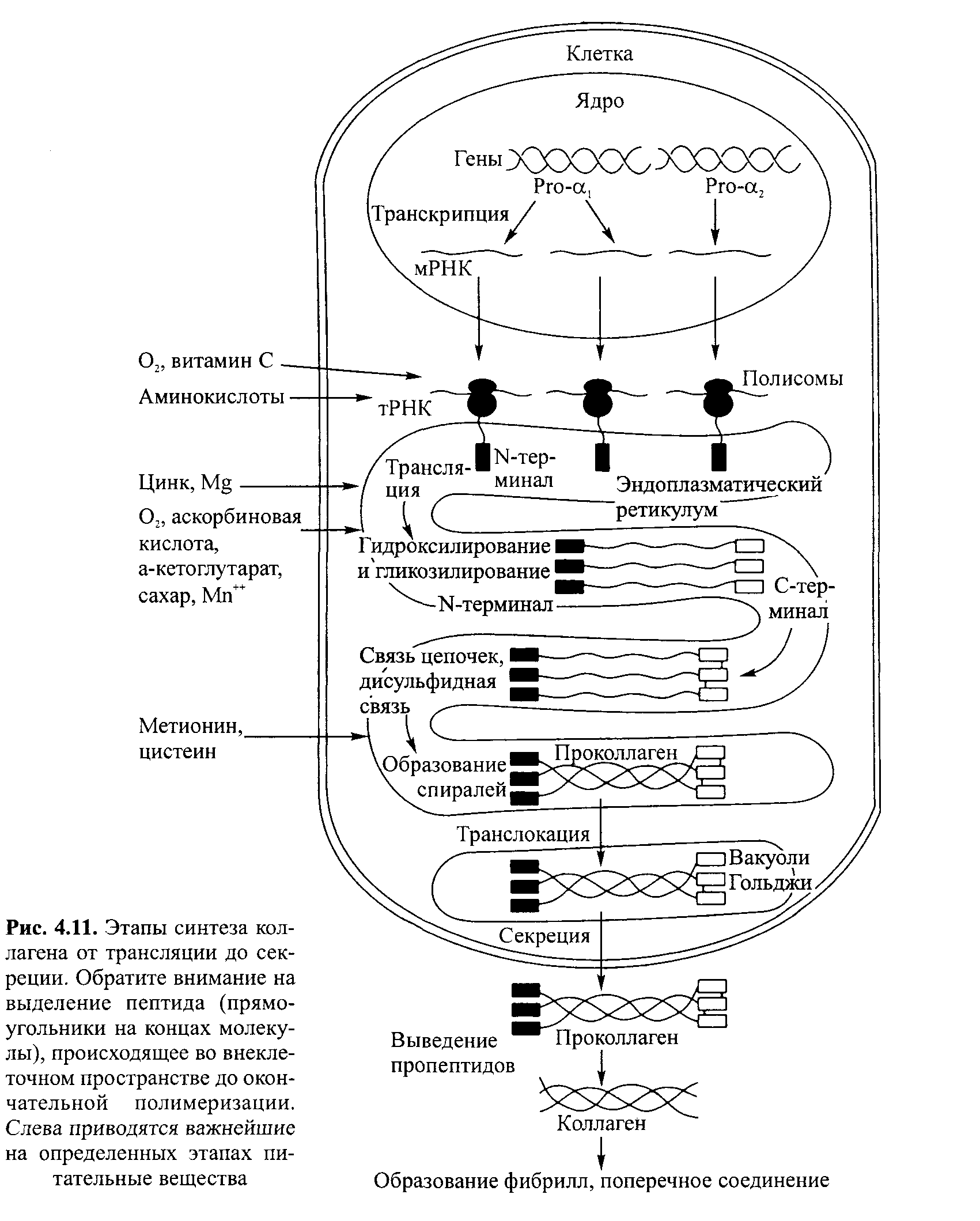
Наука о гибкости
шения влияют на активность ферментов и далее на метаболические пути обмена, участвующие в синтезе соединительной ткани (табл. 4.4). Поскольку в образовании ткани участвуют несколько ферментов, дефекты могут проявиться на любом этапе модификации. В свою очередь, эти дефекты соединительной ткани могут оказать влияние на эластичность, тугопод-вижность, диапазон движения и лечение повреждений.
70
Г л а в а 4 ■ Соединительная ткань: фактор, ограничивающий гибкость
Таблица 4.4. Врожденные и экспериментально вызванные нарушения, влияющие на биосинтез и распад коллагена
  Экспериментально вызванное Экспериментально вызванное
Пути биосинтеза коллагена
Врожденное нарушение
   Аналоги пролина а.а'-дипиридил Аналоги пролина а.а'-дипиридил
Дефицит
аскорбиновой
кислоты
Антимикроту-
булярные агенты,
например
колхинин
р-аминопро-
пионитрил
(Остеолатиризм)
Дефицит меди D-пеницилламин
Регуляция синтеза Синтез про-а-цепочек Сигнальная пептидаза Пролил- и лизилгидроксилаза
Гликозилтрансфераза Образование дисульфидной связи Проколлаген
Внутриклеточная транслокация и
секреция
Внеклеточный проколлаген
Проколлагенпротеаза
Коллаген
Молекулярное комплектование
Коллагеновая фибрилла
Лизилоксидаза, Си2+ Образование поперечных соединений
Коллагеновое волокно Коллагеназа Распад коллагена
Несовершенный остеогенез Эхлерс-Данлоса синдром, тип IV Эхлерс-Данлоса синдром, тип IV (дефицит лизилгидроксилазы)
Несовершенный остеогенез
Эхлерс-Данлоса синдром, тип IV
Эхлерс-Данлоса синдром, тип IV
Дерматоспаракс (у крупного
рогатого скота и овец)
Спондилоэпифизеальная
дисплазия
Эхлерс-Данлоса синдром, тип I, у
человека
Вялая кожа, Х-сцепленный Аневризма у мышей
Болезнь курчавых волос Гомоцистинурия Алкаптонурия Процесс старения Врожденный буллезный эпидермолиз
Более подробную информацию о механизмах влияния изменений рациона питания на метаболизм соединительных тканей можно найти в работе Тинкера и Ракера (1985).
РЕЗЮМЕ
Соединительная ткань играет важную роль в определении диапазона движения. На эту ткань влияют различные факторы, в том числе процесс старения, иммобилизация, метаболические расстройства, дефицит или избыток питательных веществ и т. д. Сухожилия, связки и фасции обусловливают соответственно 10, 47 и 41 % общего сопротивления движению. Поскольку соединительная ткань — один из наиболее подверженных воздействию компонентов, ограничивающих диапазон движения, ее следует оптимально растягивать.
|
 Скачать 10.31 Mb.
Скачать 10.31 Mb. Доказательство:
Доказательство: 


 Диск Стержень (шип
Диск Стержень (шип


 Фибрилла
Фибрилла
 Заполнение молекулами
Заполнение молекулами  150 % исходной длины они достигают точки разрыва; это происходит при воздействии силы всего лишь 20-30 кг-см2 (Bloom, Fawcett, 1986).
150 % исходной длины они достигают точки разрыва; это происходит при воздействии силы всего лишь 20-30 кг-см2 (Bloom, Fawcett, 1986).
 ве также лежит энтропический механизм, обеспечивающий эластомерную силу. Однако он основан на иной молекулярной конформации, изложенной вкратце Розенблумом, Эбремсом и Мечем (1993).
ве также лежит энтропический механизм, обеспечивающий эластомерную силу. Однако он основан на иной молекулярной конформации, изложенной вкратце Розенблумом, Эбремсом и Мечем (1993).
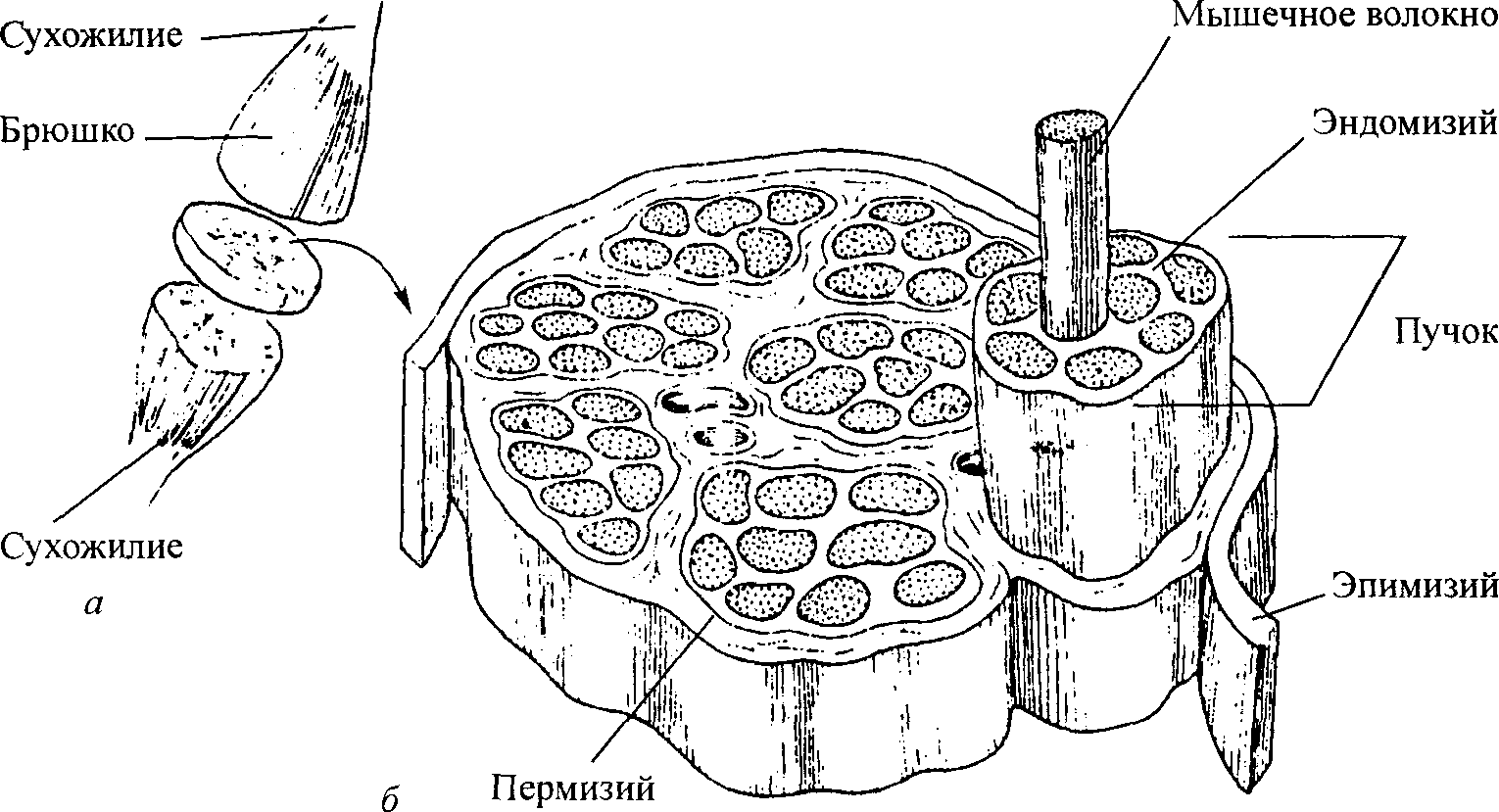

 Рис. 4.9. Идеализированная структура коллагено-вых волокон. Фиксированный контакт в стратегических участках (например, точки d и е) может существенно ограничивать растяжение коллаге-нового сплетения: расположение коллагеновых волокон (а); поперечные соединения коллагено-вого волокна (б); нормальное растяжение (в); ограниченное растяжение вследствие поперечного соединения (г) (Akeson, Amcel, Woo, 1980)
Рис. 4.9. Идеализированная структура коллагено-вых волокон. Фиксированный контакт в стратегических участках (например, точки d и е) может существенно ограничивать растяжение коллаге-нового сплетения: расположение коллагеновых волокон (а); поперечные соединения коллагено-вого волокна (б); нормальное растяжение (в); ограниченное растяжение вследствие поперечного соединения (г) (Akeson, Amcel, Woo, 1980) 
 Экспериментально вызванное
Экспериментально вызванное

 Аналоги пролина а.а'-дипиридил
Аналоги пролина а.а'-дипиридил























