Материаловедение. Материаловедение и защита металлов от коррозии
 Скачать 0.65 Mb. Скачать 0.65 Mb.
|
|
Вопрос 7. Сведения о металлических сплавах. Под металлическим сплавом подразумевают любую многокомпонентную систему, которая обладает металлическими свойствами в зависимости от числа компонентов. В зависимости от числа фаз сплавы бывают однофазными (гомогенными) и многофазные (гетерогенными). По способу получения: 1. Металлургические, которые получают сплавлением компонентов в жидком расплаве с последующей кристаллизацией. 2. Электролитический сплав, получающейся из растворов солей нескольких компонентов при постоянном токе. 3. Химические сплавы, получающиеся спекание порошков различных компонентов при высокой температуре. 4. При возгонке из газового состояния. По характеру взаимодействия и сплавы делятся: 1. Сплав – механическая смесь, компоненты которой неограниченно растворимы в жидком состоянии, но не растворяются и не вступают в химическое взаимодействие между собой в твёрдом состоянии (энергия взаимодействия атомов чистого компонента превышает энергию взаимодействия между компонентами). В твёрдом состоянии такой сплав представляет чередующиеся кристаллы чистого компонента (механическая смесь), каждый из которых сохраняют свой тип кристаллической решётки. Такие сплавы образуются если компоненты имеют решётки различного строения, а также если компоненты имеют один тип кристаллической решетки, но её параметры отличаются более чем на 15%. 2. Сплавы типа химическое соединение. Образующиеся компоненты в неорганическом растворителе в жидком состоянии, но в процессе кристаллизации в строгом соотношение компоненты могут вступать в химическое соединение и образовывать более сложный тип химической решетки, которая отличается от кристаллической решетки чистого компонента. Силы взаимодействия между разными компонентами превосходит силу взаимодействия между одинаковыми атомами. Металлическая связь обладает большей прочностью, поэтому такие сплавы обладают очень высокой твердостью и практически нулевой пластичностью. 3. Сплава типа твердый раствор, компоненты которого растворяется как в жидком, так и в твёрдом состоянии. Один из компонентов создаёт свою пространственную кристаллическую решётку, в которую встраиваются другие компоненты. Твердые раствор делятся на 3 группы: А. Раствор замещения, когда в кристаллической решётке компонента (а), часть узлов запрещается атомами других компонентов (в). Такие сплавы образуются если компоненты имеют один тип кристаллической решетки и параметры решетки отличается менее чем на 8 - 13%. Если примесный атом располагается в строго определенном порядке, решетки называются упорядоченными. Если атомный радиус компонента (б) превосходит радиус (а), то параметры решетки увеличиваются, и она искажается. Если наоборот сжимается. Искажение решетки при образовании сплавов определяется широким диапазоном физико-химических свойств. Б. Твердый раствор внедрения, когда компонент (б) в процессе кристаллизации внедряется в междоузлия компонента А. Условия образования. Р-ры типа внедрения чаще всего образуются при растворении элементов с малыми атомными радиусами (H2, C, N2, B и др.) в металлах переходной группы. Положение атома внедрения между узлами устойчиво, если радиус внедренного атома достаточно мал, чтобы не слишком смещать окружающие его атомы металла, и достаточно велик, чтоб с ними соприкасаться. С. Твердый раствор вычитания. Образуется между атомами металлов растворов в кристаллической решетке которых часть узлов остаются не занятым. Вопрос 8. Диаграмма фазового равновесия сплавов. Правило фаз Гиббса. Г 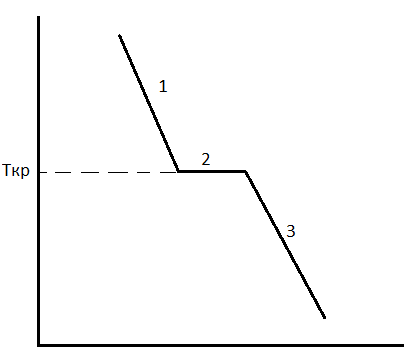 иббсом впервые была дана количественная оценка - соотношение между количество компонентов (К), числом фаз(ф) и количество степеней свободы (с). Компоненты сплава - это любое чистое вещество, а также химическое соединение, которое имеет один тип кристаллической решетки, устойчивое в данном диапазоне температур. Число фаз - однородная часть системы, отделенная от других частей системы поверхностного раздела, при переходе через которую структура и свойства резко меняются. Количество степеней свободы - это внутренние и внешние факторы, которые можно изменить без изменения числа фаз. иббсом впервые была дана количественная оценка - соотношение между количество компонентов (К), числом фаз(ф) и количество степеней свободы (с). Компоненты сплава - это любое чистое вещество, а также химическое соединение, которое имеет один тип кристаллической решетки, устойчивое в данном диапазоне температур. Число фаз - однородная часть системы, отделенная от других частей системы поверхностного раздела, при переходе через которую структура и свойства резко меняются. Количество степеней свободы - это внутренние и внешние факторы, которые можно изменить без изменения числа фаз.Если в системе, на которую действуют два внешних факторов, правило фаз Гиббса: 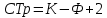 ; ;Если пренебречь изменением давления, то оно мало сказывается на состав сплава тогда: 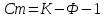 . .1 – охлажденный жидкий расплав (ж). К=1, Ф=1, С=1-1+1=1. Изменение t°С не влияет на количество фаз. 2 – процесс кристаллизации (ж+тв). К=1, Ф=2, С=1-2+1=0. Процесс протекает при изменении t°С. 3 –кристаллизация металла(тв). К=1, Ф=1, С=1-1+1=1 Вопрос 9, 10, 11. Диаграмма фазового равновесия и сплавов. Графическая зависимость изменения фаз состояния сплавов в зависимости от температуры и состава компонентов в сплаве. Это идеальное гипотетическое состояние системы, которое не учитывает эффект перегрева или переохлаждение в процессе кристаллизации реальных сплавов. Такие диаграммы строятся на оси данных кривых охлаждения при различном содержание компонентов. Диаграмма фазового равновесия сплава типа механическая смесь. Кривые охлаждения: 1 – чистый свинец; 2 – чистая сурьма; 3 – сплав Ps-Sb (87-13) А 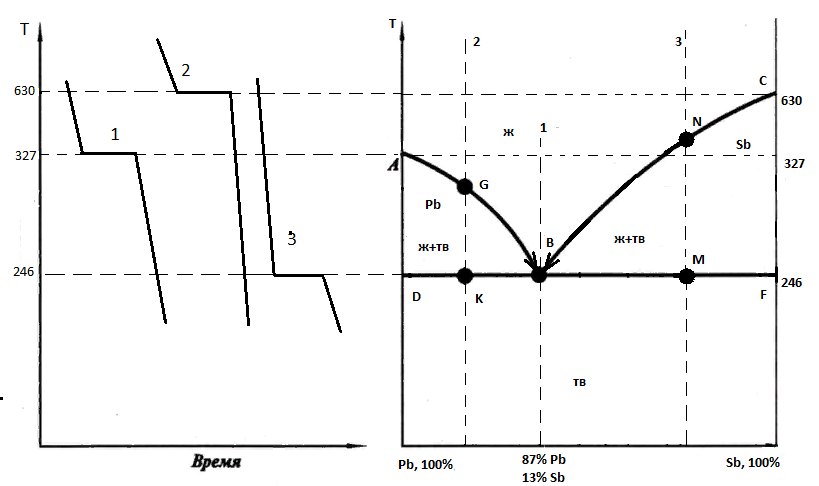 (t=327) – температура плавления чистого Pb; B (min t фазового равновесия) – т. эвтектики; С (t=630) – температура плавления чистой Sb; ABC – соединяет точки температуры начала кристаллизации сплава (линия ликвидуса); DBF – соединяет точки температуры окончания кристаллизации (линия солюдуса) (t=327) – температура плавления чистого Pb; B (min t фазового равновесия) – т. эвтектики; С (t=630) – температура плавления чистой Sb; ABC – соединяет точки температуры начала кристаллизации сплава (линия ликвидуса); DBF – соединяет точки температуры окончания кристаллизации (линия солюдуса)При кристаллизации сплава 1 эвтектическое состояние 87% Pb и 13% Sb. При охлаждении расплава до 246 начинается процесс кристаллизации в результате которого образуются, и растут частицы чистого вещества сурьмы и чистого свинца. Процесс кристаллизации сплава 2 с содержанием Sb меньше 13% начинается в точке G, ниже которой образуется и растворяется кристалл чистого свинца в расплаве. Процент содержания Pb в жидкой фазе уменьшается, а Sb растёт. Кристаллизация идёт вдоль GB и когда соединение Sb достигает 13%, начинается процесс кристаллизации Sb, образуется тонкая мелкодисперсная механическая смесь. В твёрдом состоянии сплав будет состоять из крупных кристаллов Pb, которые окружены мелкодисперсной смесью эвтектического состояния. Процесс кристаллизации сплава 3 с содержанием Sb больше 13% начинается при температуре в точке N. Будут образовываться кристаллической сурьмы. В процессе кристаллизации количество Sb будет уменьшаться в расплаве, а количество содержания Pb расти. Процесс кристаллизации идёт вдоль линии NB с понижением температуры и когда достигается соотношение состава 87:13 начинается кристаллизация остальной жидкой фазы в виде тонкой механической смеси. В твёрдом состоянии сплав состоит из крупных кристаллов Sb окружённые мелкодисперсной смесью эстетического состояния. Диаграмма фазового равновесия сплава типа твердый раствор. П 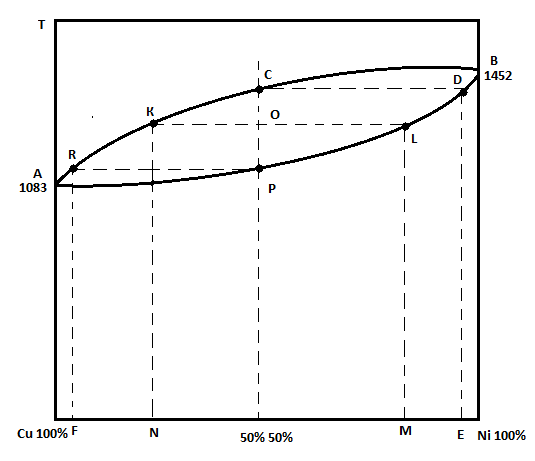 роцесс кристаллизации начинается при температуре в точке C в результате начинается образование кристаллов с содержанием углерода точки D. Образуется преимущественно Ni с его кристаллической решеткой, где часть узлов будет замещаться на атомы меди. При температуре в точке 0 твердой фазе отвечает состояние в точке L, а жидкой фазе состояние в точке К. роцесс кристаллизации начинается при температуре в точке C в результате начинается образование кристаллов с содержанием углерода точки D. Образуется преимущественно Ni с его кристаллической решеткой, где часть узлов будет замещаться на атомы меди. При температуре в точке 0 твердой фазе отвечает состояние в точке L, а жидкой фазе состояние в точке К.Процесс кристаллизации заканчивается в точке P, состав которой соответствуют точки R. Будет идти процесс кристаллизации меди. Таким образом в твёрдом состоянии глубинные зоны будут состоять из кристаллической решётки с параметрами никеля, а часть узлов замещаются атомами меди, а поверхностная зона будет состоять из кристаллической решётки с параметрами меди, часть узлов которых запрещается атомами никеля. 3. Диаграмма фазового равновесия сплава типа химическое соединение. П 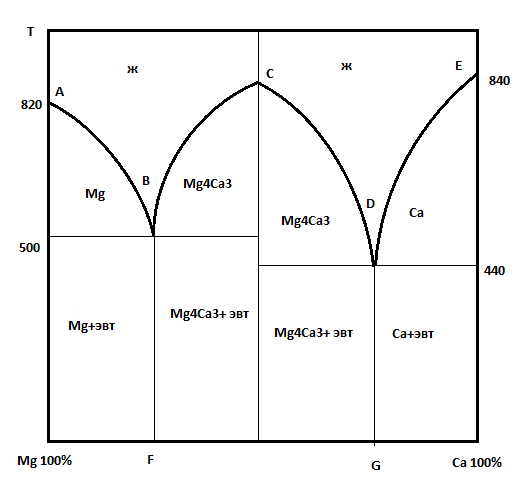 ри строго определенном соотношении компонентов 4:3 Mg и Ca образуют устойчивое химическое соединение Mg4Ca3, которое будет новым компонентом в металлической системе. Поэтому для анализа полной диаграммы можно разделить на две независимые системы. ри строго определенном соотношении компонентов 4:3 Mg и Ca образуют устойчивое химическое соединение Mg4Ca3, которое будет новым компонентом в металлической системе. Поэтому для анализа полной диаграммы можно разделить на две независимые системы.Mg - Mg4Ca3: АВС – ликвидус; FBG – солидус; В – эвтектика. Это сплав в виде мелкодисперсной механической смеси из чередующихся кристаллов Mg и Mg4Ca3. Ca - Mg4Ca3: CDE – ликвидус; KDL – солидус; D – эвтектика. Это сплав чистого Mg4Ca3 и Ca. Вопрос 12. Диаграмма состав-структура-свойства. Закономерность Курнакова. Зависимость изменения свойств твердости (H), удельной электрической проводимости (р) в зависимости от содержания компонентов сплава: А. Механическая смесь. Б. Твердый раствор. В. Химическое соединение. А 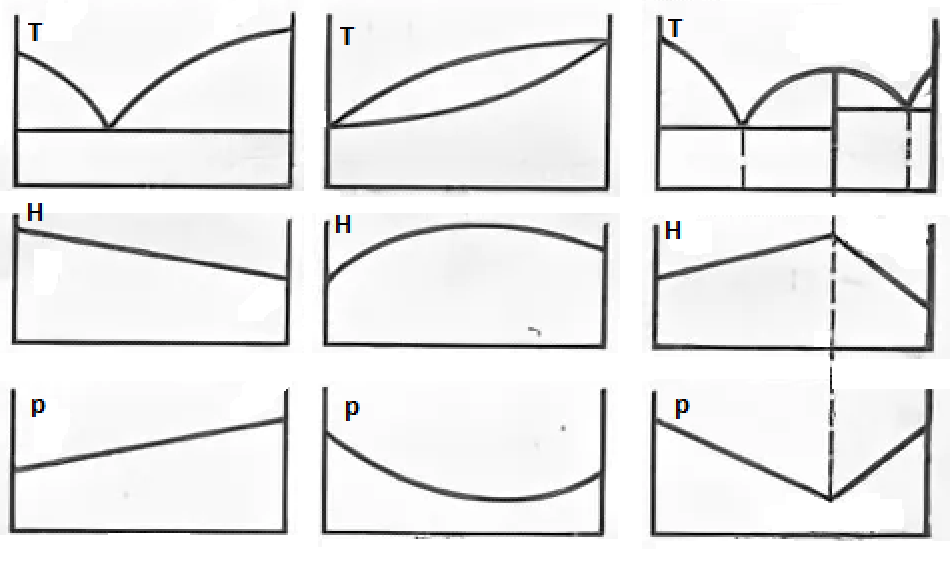 . При образовании сплавов типа механическая смесь каждый из компонентов которого сохраняет свой тип кристаллической решётки. Твердая фаза состоит из чередующихся кристаллов чистых компонентов. Большинство физико-химических свойств прямо пропорциональна содержание второго компонентов в сплаве. . При образовании сплавов типа механическая смесь каждый из компонентов которого сохраняет свой тип кристаллической решётки. Твердая фаза состоит из чередующихся кристаллов чистых компонентов. Большинство физико-химических свойств прямо пропорциональна содержание второго компонентов в сплаве.Б. При образовании сплава типа твердый раствор (замещения или внедрения) происходит искажение кристаллической решетки компонентов растворителя, что вызывает изменение величины свободной энергии. Поэтому в определённой области соотношение компонентов физико-химические свойства могут значительно отличаться от свойств в чистом компоненте. С. Если в процессе кристаллизации образуется устойчивое химическое соединение А-В, которое имеют принципиальное отличие от кристаллической решетки. На диаграмме зависимости наблюдается экстремум, который отвечает чистому компоненты химического соединения. Вопрос 13. Диаграмма фазового равновесия в системе Fe/C. Железо температура плавления 1539. В зависимости от температуры может находиться в двух аллотропных модификациях кристаллической решетки. В зависимости от характера взаимодействия к содержанию углерода, образуются различные сплавы: 1. Феррит - перенасыщенный твердый раствор внедрения атомов С в кристаллическую решётку Fe. Атомы C располагаются только в дефектах кристаллической решетки, поэтому процентное содержание углерода очень мало. Феррит также называют техническим железом, как железо он обладает малой твердостью, высокой пластичностью и ударной вязкостью. 2. Аустенит - это твердый раствор внедрения С в кристаллическую решётку Fe, где он располагается в центре объёма куба. Аустенит образуется из жидкой фазы, существует только в области высоких температур. 3. Цементит - это сплав типа химическое соединение. Решётка близка к октаэдрической, поэтому по свойствам обладает высокой твердостью и нулевой пластичностью, очень хрупкий. 4. Ледебурит - это сплав типа смесь цементита и аустенита. Это эвтектоид с минимальной температурой. Равновесие жидкой твердой фазы. 5. Перлит - это сплав типа механическая смесь феррита и цементит. В данной системе эвтектоид с минимальной температура двух твердых фаз. Имеет высокую прочность, сохраняет небольшую пластичность. Вопрос 14. Диаграмма фазового равновесия Fe/Fe3C Х 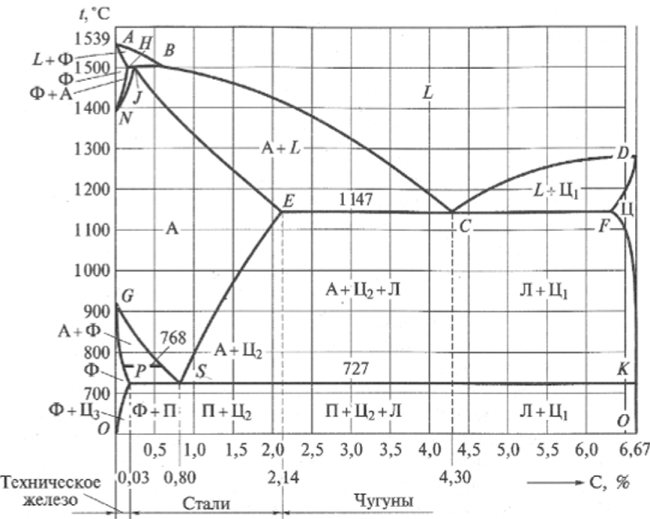 арактеристические точки диаграммы: А (1539°С) – темп. плав. Fe; N (1392°С) и G (911°С) – температура фазового перехода αFe→γFe; С (1147°С) – эвтектика ледебурит; S (727°С) – эвтектоид перлита; М (768°С) – т. Кюри. Ниже этой точки Fe и феррит обладают ферромагнитными св-ми, а выше парамагнитными. Fe3C тоже обладает магнитными свойствами, но в т. Кюри, поэтому с повышением содержания углерода температура в т. Кюри будет снижаться). арактеристические точки диаграммы: А (1539°С) – темп. плав. Fe; N (1392°С) и G (911°С) – температура фазового перехода αFe→γFe; С (1147°С) – эвтектика ледебурит; S (727°С) – эвтектоид перлита; М (768°С) – т. Кюри. Ниже этой точки Fe и феррит обладают ферромагнитными св-ми, а выше парамагнитными. Fe3C тоже обладает магнитными свойствами, но в т. Кюри, поэтому с повышением содержания углерода температура в т. Кюри будет снижаться).Линия ABCD – ликвидус, соединяющая точки начала кристаллизации. AECF – солидус, соединяет точки температуры окончания кристаллизации. Ниже области температур АВ начинается процесс кристаллизации феррита. Ниже ВС в жидкой фазе образуется кристалл аустенита. Ниже линии CD в жидкой фазе кристалл цементита. Обл. ABJ сущ-е высоколин. феррит. Обл. GPO низколин. феррит. Обл. NJESG существование аустенита. Ниже 727°С фазовый переход γFe →αFe, распад аустенита на феррит и цементит – перлитный распад. Сплавы Fe с сод C до 0,06% наз техническим железом, сост из феррита. Сплавы с сод С от 0,06 до 1,14% - стали. С сод от 0,06 до 0,8% доэвтектоидные стали, сост из крупных кристаллов феррита с тонкой механической смесью ф+ц. С сод 0,8-0,81 эвтектоид, сост из чист перлита, 0,81-2,14 эвтектоид, сост из крупных кристаллов цементита, окруженных тонкой механической смесью перлита. От 2,14 чугуны. Вопрос 15, 16, 17. Процесс кристаллизации сталей 1 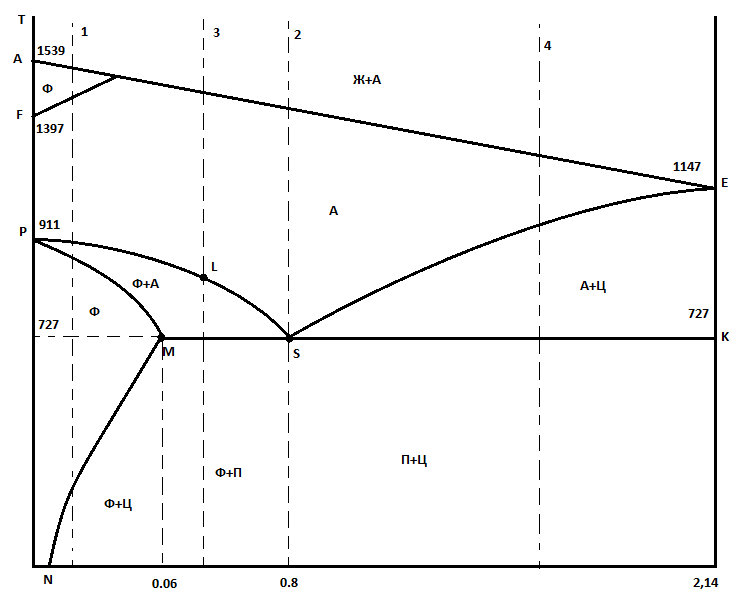 . Процесс кристаллизации расплава с содержанием углерода 0,06% в жидкой фазе начинается с образования и роста кристалла феррита с ОЦР αFe. При t <1392°С идёт полиморфное превращение αFe→γFe с ГЦР в которой равномерно распределяется углерод. И при t <911°С идёт обратное превращение γFe →αFe (распад аустенит). Так как t <727°С количество дефектов в кристаллической решетке феррита уменьшается, поэтому углеводород выходит на поверхность кристаллитов, содержание его повышается и происходит образование химического соединения цементит. В твёрдом состоянии сплав будет состоять из крупных светлых блестящих кристаллов феррита с тонкими серыми прослойками цементита. . Процесс кристаллизации расплава с содержанием углерода 0,06% в жидкой фазе начинается с образования и роста кристалла феррита с ОЦР αFe. При t <1392°С идёт полиморфное превращение αFe→γFe с ГЦР в которой равномерно распределяется углерод. И при t <911°С идёт обратное превращение γFe →αFe (распад аустенит). Так как t <727°С количество дефектов в кристаллической решетке феррита уменьшается, поэтому углеводород выходит на поверхность кристаллитов, содержание его повышается и происходит образование химического соединения цементит. В твёрдом состоянии сплав будет состоять из крупных светлых блестящих кристаллов феррита с тонкими серыми прослойками цементита.2. Процесс кристаллизации эвтектоидной стали с содержанием углерода 0,8% начинается с образования и роста кристалла аустенита. В междоузлии ГЦР внедряется углерод. Кристалл аустенита существует до температуры 720°С ниже которой происходит полиморфное превращение γFe →αFe. Процесс начинает происходить на границе кристаллита, так как температура относительно низкая дефектов кристаллической решетки мало и избыток углерода выходит на поверхность, где химически связывается Fe3C. На химическую реакцию расходуется углерод из близлежащих областей, поэтому в ней образуется феррит. Процесс протекает быстро даже при небольшом переохлаждение 720°С. В холодном состоянии увидим пластинчатую структуру чередующихся пластин феррита и цементита. Чем больше температура переохлаждения, тем меньше пластины и при большей скорости охлаждения образуется структура перлита. 3. Процесс кристаллизации доэвтектоидной стали с содержанием углерода менее 0,8% начинается с образования и роста кристалла аустенита в котором растворяется углерод в решетке железа. Температура существования аустенита ограничена линией GSE. Ниже этой линии начинается распад аустенита и превращение γFe →αFe. Рост кристалла феррита начинается на гране кристаллита (температура относительно невысокая). углерод обладает диффузной подвижностью и уходит в глубь кристаллита. По мере роста кристалла феррита содержание углерода в аустените возрастает. Процесс кристаллизации идёт когда содержание углерода достигает 0.8% и при температуре меньше 727°С оставшийся аустенит подвергается перлитному распаду. Таким образом в охлажденном состоянии сплав будет состоять из кристаллов из кристаллов феррита, окружённых пластинами перлита (если содержание углерода велико, то увидим больше перлитный зон с вкраплениями кристаллов феррита). 4. Процесс кристаллизации заэвтектоидной стали начинается с образования и роста кристалла аустенита. При охлаждении будет устойчив до температуры линии ES, ниже которой начинаются полиморфное превращение γFe →αFe. Так как температура достаточно высока, то углерод будет выходить на поверхность кристалла, где будет образовываться цементит. И по мере охлаждения ниже т.К будет рост кристалла цементита. (содержание углерода в остаточном аустените будет уменьшаться). Процесс будет протекать вдоль линии KS и когда содержание углерода достигнет 0,8% при t <727°С произойдет быстрый перлитный распад. Кристаллы будут состоять из кристалла цементита, окруженных пластинами кристалла перлита. Вопрос 18. Превращения в сталях при нагревании При нагреве стали эвтектоидного состояния, состоящих из перлита, процесс полиморфного превращения феррита в аустенит будет происходить при некотором перегреве после 738°С. Такое превращение протекает быстро, поэтому в начальный момент времени сохраняются кристаллы цементита, распад которых протекает очень медленно. Чем выше температура, тем выше скорость распада цементита. Превращение происходит на границе раздела фаз и освобожденный углерод при распаде цементита диффундирует в соседнее кристаллы низкоуглеводного аустенита. Со временем происходит полный распад цементита. Т.к. подвижность углерода при высокой температуре большая, то происходит выравнивание его содержания во всех кристаллах аустенита. Т.о. образуются одинаковые по структуре и химическому соединению кристаллы стали в аустенитном состоянии. Чем больше содержание углерода, тем больше времени и температуры нужно потратить, чтобы произошел полный распад крупных кристаллов цементита. Рост зерна при нагреве. Так как сталь в аустенитном состоянии состоит из одинаковых по структуре и химическому состоянию кристаллов, которые имеют большую площадь границы раздела фаз. Такая система обладает избыточным запасом энергии. Система стремится к уменьшению запаса энергии, происходит срастание или сплавление за счёт процесса твердофазной диффузии мелких кристаллов в более крупные или поглощение крупными кристаллами более мелких. Т.е. идёт рост зерна при высокотемпературной выдержке. Сплавы бывают наследственно крупнокристаллическими, когда при небольшой температуре перегрева свыше 738°С идёт быстрый рост кристаллитов. Это легированные марганцовые стали. Если наследственно мелкозернистые лигированные стали идёт рост зерна, который при небольшом перегреве протекает очень медленно, но потом быстро ускоряется при температуре больше 1050°С. Крупнокристаллические стали или разнозернистые стали теряют ряд механических параметров. Мало влияют на статические параметры (твёрдость, предел прочности), но под действием перемены температуры, например, при сварке тонкого стального листа, происходит коробление (искривление поверхности). А при закалке возникает закалочные трещины. Чтобы прекратить процесс укрупления зерен при нагреве стали легируют. Основными легирующими компонентами являются Ti, W, Nb, Mo, V которые образуют с углеводородом прочные, тугоплавкие, химические соединения простых карбидов. |
