Материаловедение. Материаловедение и защита металлов от коррозии
 Скачать 0.65 Mb. Скачать 0.65 Mb.
|
|
Вопрос 31. Явление коррозии, коррозионные потери, классификация коррозионных процессов, химическая и электрохимическая коррозия, методы защиты от коррозии. Коррозия — это физико-химический процесс взаимодействия металлов с внешней средой в результате которого происходит изменение свойств металлов (ухудшение функциональных характеристик металла или сплава), а также окружающей среды или все технической системы в целом. Количество металла, превращенного в продукты коррозии за определенное время, относят к коррозионным потерям. Коррозионные потери единицы поверхности металла в единицу времени характеризуют скорость коррозии. Коррозионные процессы классифицируют по механизму взаимодействия металлов с внешней средой; по виду коррозионной среды и условиям протекания процесса; по характеру коррозионных разрушений; по видам дополнительных воздействий, которым подвергается металл одновременно с действием коррозионной среды. По механизму процесса различают химическую и электрохимическую коррозию металлов. Химическая коррозия — это процесс взаимодействия металла с коррозионной средой, при котором окисление металла и восстановление окислительного компонента среды протекают единовременно в одном акте. Продукты взаимодействия пространственно не разделены. Электрохимическая коррозия — это процесс взаимодействия металла с коррозионной средой (раствором электролита), при котором ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциала. По виду коррозионной среды и условиям протекания различают несколько видов коррозии. Газовая коррозия — это химическая коррозия металлов в газовой среде при минимальном содержании влаги (как правило не более 0,1 %) или при высоких температурах. В химической и нефтехимической промышленности такой вид коррозии встречается часто. Например, при получении серной кислоты на стадии окисления диоксида серы, при синтезе аммиака, получении азотной кислоты и хлористого водорода, в процессах синтеза органических спиртов, крекинга нефти и т.д. Атмосферная коррозия — это коррозия металлов в атмосфере воздуха или любого влажного газа. Подземная коррозия — это коррозия металлов в почвах и грунтах. Биокоррозия — это коррозия, протекающая под влиянием жизнедеятельности микроорганизмов. Контактная коррозия — это вид коррозии, вызванный контактом металлов, имеющих разные стационарные потенциалы в данном электролите. Радиационная коррозия — это коррозия, обусловленная действием радиоактивного излучения. Антикоррозийные способы можно сгруппировать, опираясь на следующие методы: 1) электрохимический метод — позволяет уменьшить разрушительный процесс на основе закона гальваники; 2) уменьшение агрессивной реакции производственной среды; 3) химическое сопротивление металла; 4) защита поверхности металла от неблагоприятного воздействия окружающей среды. Защиту поверхности и гальванический метод применяют уже в момент эксплуатации металлических конструкций и изделий. К ним относятся следующие способы защиты: катодная, протекторная, а также ингибиторная. Электрохимическая защита основана на действии электрического тока, под его постоянным воздействием коррозия прекращается. Внедрение ингибиторов в агрессивную среду, которая соприкасается с металлом, позволяет снизить скорость коррозийных процессов. Химическое сопротивление и защита поверхности относятся к пленочным способам сохранения. Они уже могут применяться как на стадии изготовления металлоизделий, так и в момент эксплуатации. Выделяют следующие способы: лужение, оцинковку, покраску и прочее. Краска, как защитное покрытие от ржавчины — самый распространенный и используемый метод. Вопрос 32. Легированные стали с особыми свойствами – коррозионностойкие и жаропрочные. В зависимости от условий эксплуатации подразделяют на три группы: коррозионностойкие стали при электрохимической коррозии в агрессивных средах растворов электролитов; окалиностойкие при высоких температурных условиях; жаропрочные, способные эксплуатироваться длительное время в области высоких температур. Коррозионностойкие стали Коррозионная стойкость к электрохимической коррозии углеродистых сталей достигается за счёт легирования Cr, Ni, Mo, Ti. Стойкость при электрохимической коррозии повышается не плавно с ростом легирующий компонента, а ступенчато (правило Таммона) 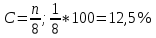 При содержании Cr 12,5% скорость коррозии уменьшается в 10 раз, а при содержании более 25% повышается более чем в 100 раз. У Cr 5 не заполненных подуровней и они связаны пятью электронами с железом, уменьшая их электрохимическую активность. Хром является пассивным элементом, то есть при его содержание более 12,5% образуется сплошная защитная пленка Cr2O3. Поверхность стали приобретает положительное значение потенциала. Поэтому основная распространённая коррозионностойкая сталь - это сталь Х13. С неё начинается класс нержавеющих сталей. Из неё изготавливается большинство элементов нефтегазовой промышленности. Для повышение прочностных характеристик повышается содержание углерода в стали с целью повышения содержание карбидной составляющей. При этом на карбидообразование будет расходоваться Cr, поэтому с ростом содержания углерода коррозионная стойкость может уменьшаться как из-за уменьшения содержания Cr, так и из-за возникновения склонности легирующих сталей к межкристаллитной коррозии. Она обусловлена тем, что в поверхностных зонах кристаллов легированного феррита содержание Cr можно опустить за предел 12,5%, поэтому области теряют коррозионную стойкость и разрушаются. Хромистые стали обладают высокой коррозионной стойкостью в среде кислорода, содержащего кислоты, кроме серной кислоты с высокой температурой, а также в средах содержащий ионы хлора. Для повышения коррозионной стойкости в таких средах стали дополнительные легируют Ni. Хромоникелевые стали устойчивы в растворе H2SO4 и HNO3 с концентрацией больше 10%. Однако в растворе HCl подвергается точечной коррозии. Поэтому дополнительно легируют Ti, предотвращающий межкристаллитную коррозию. Хромоникелевая сталь обладает хорошей пластичностью, высокой коррозионной стойкостью и хорошей свариваемостью. Основной недостаток - высокая стоимость. Окалиностойкие стали Способны эксплуатироваться в области очень высоких температур при малой скорости окисление. Коррозионная стойкость железа при высокотемпературной коррозии на воздухе определяется свойствами образующихся оксидных пленок. У феррита есть критическая температура в 570°С, выше которой скорость коррозии железа многократно возрастает с повышением температуры. Это обусловлено тем, что в области температур меньше 570°С на поверхности железа образуется плёнка их смеси Fe3O4*Fe2O3, которая обладает защитными свойствами благодаря плотной упаковке и малому количеству дефектов кристаллической решетки. При 570°С происходит фазовое превращение в FeO. Существует практически один FeO, который обладает большой дефектностью кристаллической решетки и нарастает с ростом температуры, поэтому резко возрастает Квес Для повышения стойкости стали легируют Cr, Si, Al, так как они водятся в узлы кристаллической решетки оксида железа, уменьшая её дефектность. Также способны образовывать на поверхности сплошную защитную плёнку из оксидов реагирующих компонентов. Данные ионы имеют гораздо меньший радиус, а их оксиды гораздо меньшую электрическую проводимость по сравнению с оксидом железа. Термостойкость повышается до 1000°С. Дополнительный легируют Al, Si способные не только повышает окалиностойкость, но и прочность, твердость стали. Однако резко ухудшаются технологические свойства (плохо обрабатываются резанием и т.д.) Жаропрочные стали Жаропрочность - это способность материала эксплуатироваться требуемое количество часов в высоконагруженном состояние при высокой температуре 500-1000°С. С целью повышения жаропрочности стали дополнительную легируют W, Mo, Nb. Причина потери жаропрочность - это явление ползучести. Под действием механической нагрузки кристалл начинает разрушаться вдоль слабой электроплоскости. Эффект ползучести - это разрушение кристаллитов вдоль линии скольжения. И при повышении температуры процесса разрушение металла будет протекать и по границе зерна карбидной фазы, будет происходить необратимая деформация металлов вдоль линии приложения механической нагрузки. Жаропрочность достигается упрочнением твердого раствора и карбидной фазы. Критерием прочности кристаллической решетки является температура плавления металла. Если условия эксплуатации в области 700-750°С основной легирующий компонент Cr (температура плавления 1900°С) он образует твердый раствор железа и карбида хрома. Дополнительно вводят Ni и Ca для эксплуатации выше 1200°С. Также могут водить Mo, Nb и W (температура плавления больше 2200°С). Структура - это крупные кристаллы, на поверхности которых твердые, прочные, термически стойкая фаза карбидов вольфрама и молибдена. такая структура достигается закалкой и последующим старением. Вопрос 33. Электротехнические сплавы, сплавы с особыми тепловыми и упругими свойствами Область применения таких материалов: 1) регулирование электрической мощности (реостаты); 2) материалы для электронагревательных приборов Реостатные материалы. К реостатным материалам предъявляют требования: Высокое удельное сопротивление; минимальная величина температурного коэффициента электросопротивления (чтобы сопротивление проводника не зависело от температуры). Величина удельного сопротивления у металлов определяется электронным строением, то есть количеством свободных электронов проводимости и строением кристаллической решетки металла или сплава. Аномально высокая электропроводимость для чистого металла связана с упорядоченностью кристаллической решетки, в которой могут свободно перемещаться электроны. Величина проводимости определяется длиной пути свободного движения электрона до огибания какого-либо препятствия. При повышении температуры увеличивается колебательное движение катионов в узлах кристаллической решетки, поэтому путь свободного движения электрона сокращается (приходится больше огибать колеблющиеся катионы) поэтому удельное сопротивление чистых металлов повышается с повышением температуры. При наличии в кристаллической решетке дефектов, атом металла обладает гораздо меньшим электрическим сопротивлением и электропроводность сплавов будет увеличиваться, что связано с искажением кристаллической решетки сплава и уменьшением содержания свободного пробега электрона. Было замечено, что при образовании сплава типа твердый раствор в определённой области соотношения компонентов удельное сопротивление сплава многократно превосходит показания для чистых веществ. Например, Cu и Ni многократно растворяются друг в друге в твёрдом состоянии. Такие сплавы называются никелин. При содержании Ni 39-51% имеет удельное электрическое сопротивление 0,4-0,5 Ом*мм2/м и коэффициент α 10^-4 Ом/К. Констант - это сплав, содержащий 39-41% Ni, иногда легированный Co; около 2% Mn остальное Cu. Их отличительная способность, кроме высокого электросопротивления, является очень низкое значение коэффициента электросопротивления. Данные сплавы пластичны, хорошо вытягиваются в проволоки толщиной до 2мкр., раскатываются в ленты, поэтому служат для изготовления высокопрочных резисторов и реостатов. При повышении температуры на их поверхности образуется оксидная пленка, которая обладает высоким электросопротивлением, что позволяет наматывать реостат из проволочных валиков, примыкающих друг к другу. Манганин. Основной легирующий компонент марганец. Бывают двух типов: 1) с низким содержанием марганца до 12% имеет удельное сопротивление 0,43 Ом*мм2/м; 2) с высоким содержанием 60% у которого α→0. Сплавы для электронагревательных приборов. Кроме высокого удельного сопротивления и малого температурного коэффициента сопротивления, должны обладать высокой окалиностойкостью, которой определяет фактический срок службы нагревательного элемента Компоненты, обеспечивающие окалиностойкость это Cr и Al. Поэтому первый сплав нихром – 55-70% Ni; 23%Cr; 1-2% Mn; ост Fe. (1,1 Ом*мм2/м и низкая α). Способен эксплуатироваться до 1100°С. Их раскатывают в проволоки и фольгу. использовать для электроплит и электропаяльников. На их поверхности образуется оксидная пленка, обладающая высокой электропроводимостью во всём диапазоне температур, поэтому такие сплавы могут соединяться путем крутки. Фехраль: 20-23% Cr; 4-5% Al; 1-2% Mn; ост Fe. Такой сплав обладает значительно меньшей пластичностью, плохо обрабатывается. Изготавливают нагревательный элемент промышленных печей большой мощности, которые эксплуатируются при 1200°С. На поверхности сплава образуется тонкая защитная плёнка из сложного оксида Cr, Ni, Al, который придаёт высокую окалиностойкость. Эта пленка обладает близким значением температурного коэффициента расширения сплава, поэтому не растрескивается не скалывается при большом перепаде температур, что обеспечивает длительный срок эксплуатации элементов. Хромали: 65% Fe; 30% Cr; 5% Al. Такие сплавы очень твердые, хрупкие, поэтому электронагревательные элементы изготавливаются методом литья. Вопрос 34. Цветные металлы и сплавы на основе меди (латуни и бронзы). Их состав, свойства и области применения. Латуни - это двойной сплав меди и цинка в котором содержание Cu находится от 60 до 96%. Простые латуни обладают более высокой прочностью и твердостью по сравнению с медью. Хорошо обрабатываются резанием, имеют высокую пластичность, поэтому детали могут изготавливаться методом холодной штамповки или высадки. Латунь обладает высокой коррозионной стойкостью в пресной и морской воде. Они жаропрочный и окалиностойкие. Для улучшения технических характеристик латуни дополнительно легируют: Pb для улучшения обработки резанием, а также для придания антифрикционных свойств (малые коэффициент трения). Mn и Sn для улучшения прочностных характеристик. Al и Ni для повышения прочности и коррозионной стойкости. Бронзы. Широкое распространение получили оловянные бронзы, в которых содержание Sn 5-2%. Сплав сохраняет достаточную пластичность, поэтому бронза хорошо обрабатывается резанием и давлением. Сплавы с более высоким содержанием Sn 10-20% - это сплавы литейные, детали изготавливаются методом фасонного литья, т.к. имеют малый коэффициент усадки. Оловянные бронзы обладают большей коррозионной стойкостью и прочностью, чем латуни, поэтому используются для изготовления запорной арматуры (краны и вентили). паровых котлов, турбин при высоком давлении и температуре. Основной недостаток - высокая стоимость олова. Широкое распространение находят безоловянные бронзы: 1, Алюминиевые бронзы, в которых содержится Al 2-10%. При содержании Al до 5% сохраняется высокая пластичность, детали изготавливают методом холодной штамповки. Максимальная прочностные характеристики получаются при содержании Al 10%, но очень низкая пластичность, поэтому деталь обрабатывается резанием. Алюминиевые бронзы обладают высокой коррозионной стойкостью в горячей газовой атмосфере и в агрессивных средах. Из них изготавливают аппараты для химической промышленности. 2, Литейные сплавы получаются при легировании Si и Zn. Имеют высокую жидкотекучесть, λ=1,2 - коэффициент усадки уступает оловянным бронзам. 3, Бериллиевые бронзы. При небольшом содержание бериллия обладают высокой коррозионной стойкостью, прочностью, большим модулем упругости, величина которого мало изменяется с повышением температуры до 300-400°С. Наилучшие характеристики сплав преобладает после закалки в холодной воде и отпуске. Из них изготавливают контактные пружины, подвижные детали, так как данные бронза медленно окисляются на воздухе. Вопрос 35. Цветные металлы и сплавы на основе алюминия. Их состав, свойства. Обладают высокой пластичностью, изготавливается холодной штамповкой. 1, Наибольшее распространение получили сплавы с основным легирующим компонентом Cu - дюралюмины. Предельное содержание меди до 5%, далее теряется пластичность. Сплав, с наилучшими прочностными свойствами, приобретает после термообработки (закалки в холодной воде). В отличие от стали дюралюмины после закалки некоторое время сохраняют высокую пластичность, поэтому обработку материала давлением можно проводить после закалки. Максимальная прочность достигается после искусственного старения. 2, Кованые сплавы изготавливают горячей штамповкой и основной легирующий компонент Cu, Mg, Si, Fe. 3, Литейные сплавы изготавливают методом точного литья. Основной легирующий компонент Si (4-13%). Сплавы называются силуины. Имеет высокую жидкотекучесть и небольшой процент усадки 4, Высокопрочные сплавы. Имеют низкий удельный вес 2,85 г/см3, высокие прочностные характеристики, превосходящие высоколегированные хромистые стали. Максимальные характеристики достигаются после закалки в холодной воде и старении. Вопрос 36. Неорганические стекла. Влияние химического состава, структуры (стеклообразователи, модификаторы и компенсаторы) на свойства стекол. Неорганическое стекло - это химическосложная многокомпонентная системы. Это аморфный макроскопический изотермический материал; по физическим характеристикам- это твёрдое и абсолютно хрупкое тело. Стекла получают после охлаждения расплава, после варки неорганического соединения. Данный набор свойств обусловлен аморфной структурой химического соединения. Элементы неорганических стекол образуют между собой прочные полярные связи в соотношение с валентностью электронов. Причины аморфной структуры, когда сохраняется правильное пространственное чередование атомов на ближнем порядке, но нарушается на дальних порядках, вызвана двумя причинами: 1. Особенностью ковалентной связи, которая характеризуется насыщенностью, то есть полное соответствие валентности, и направленностью, которая характеризуются углом, не кратным 90 градусов. 2. Высокая вязкость при охлаждении, что осложняет диффузный процесс при затвердевании. У аморфного тела нет единой температуры плавления или затвердевание, а есть область температур размягчения. Кривые нагревания и охлаждения не совпадают. Аморфное состояние с неполярной симметрией расположение атома обеспечивает макроизотропность, то есть одинаковые свойства во всех пространственных направлениях. Аморфное состояния отличается избыточным запасом свободной энергии по сравнению с кристаллическим состоянием, поэтому стёкла стареют при интенсивном воздействии тепла и света. Система стремится частично за кристаллизоваться за счёт внешней энергии, то есть она становится двухфазной и стёкла теряет прозрачность. Но даже при размягчении данная система имеет высокую вязкость и поэтому стёкла обладают кинетической устойчивостью. Если рассмотреть чистое кварцевое стекло, то в следствии насыщенностью химической связи, такие стёкла обладают следующими физико-химическими свойствами: 1. Температура начала размягчение 1300°С. Температура варки больше 1700°С. Это недостаток кварцевого стекла; 2. В процессе варки возникает процесс электрохимической коррозии; 3. Обладает высокими теплоизоляционными свойствами; 4. Высокое удельное сопротивление, то есть является диэлектриком Стекло - это система многокомпонентная: 1. Стеклообразователь, который даёт жесткоцепную сетчатую структуру. 2. Модификаторы, которые придают стеклу определённые функциональные свойства. Ионы Fe, Cu, Co, Cr - будут получаться цветные стёкла. Pb - изменение коэффициента светопреломления, будет получаться хрусталь. V2O5 - электропроводимость стекла. AgBr – светочувствительность, изменением степени светопоглощения стекла в зависимости от внешней освещённости. Самый большой недостаток кварцевых стекол высокая энергоемкость (высокая температура варки), нетехнологичность процесса. Чтобы понизить температуру вводят Na. При варке получаются натрийсиликатные стекла. Натрий встраивается в решетку стеклообразователя. На молекулярном уровне возникают дефекты, натрия образует связь с кислородом, которая слабее связи SiO, а 3 соседних О˙ не имеют насыщенные ковалентные связи. Поэтому размягчение начинается при меньшей температуре 780°С и начинается с разрыва связи Na2O и дальнейшее образование связей Na2OSi. Натрийсиликатные стекла обладают худшими физико-химическими свойствами: хуже теплоизоляционные свойства, электроизоляционные свойства и прочностью на разрыв, величина коэффициента температурного линейного расширения. Поэтому при резком изменении температуры происходит хрупкое разрушение. 3. Компенсаторы добавляют для снижения вредного воздействия на свойства модификатор. |
