2-курс ПЗ рус блог. Менделевское наследование у человека
 Скачать 437.9 Kb. Скачать 437.9 Kb.
|
|
Практические занятия №7 6.1. Тема: Мультифакториальные болезни Информационно-дидактический блок Большинство генетически детерминированных патологических состояний возникает при участии как генетических, так и средовых факторов. Они называются полигенными (мультифакториальными) болезнями или болезнями с наследственной предрасположенностью. К ним относятся болезни сердца, сахарный диабет, злокачественные опухоли, некоторые психические, аутоиммунные болезни и др. При этих заболеваниях в генотипе определенной части людей (популяции) возникают генетические изменения, характеризующиеся изменениями структуры генов без существенных изменений их функций (без видимых клинических признаков болезни). Генетической основой развития таких болезней является генетический полиморфизм или разнообразие форм генов (аллелей). Каждый человек (генотип), за исключением монозиготных близнецов, характеризуется уникальным набором аллелей (генов) и их комбинацией. В отличие от моногенных болезней, возникающих при мутации одного гена, в патогенезе полигенных болезней принимают участие несколько полиморфных (измененных) генов. Некоторые из этих полигенов запускают патологические процессы, проявляющиеся клинически под влиянием определенных внешнесредовых факаторов. В литературе их называют главными генами, генами-кандидатами, генами-триггерами. Расшифровка генома (молекулы ДНК) человека показала, что изменение даже одной пары нуклеотидов (однонуклеотидный полиморфизм) из около 3 миллиардов пар нуклеотидов может привести к изменению ее функции. Более того, было установлено, что некоторые болезни человека в т.ч. злокачественные опухоли, возникают вследствие эпигеномных (надгеномных) изменений, не изменяющих последовательности нуклеотидов молекулы ДНК (носительницы генетической информации). В зависимости от причин возникновения наследственные болезни делятся на хромосомные, моногенные и полигенные (мультифакториальные). Полигенные (мультифакториальные) болезни представляют собой обширную группу болезней. Полигенными они называются потому что, в их развитии участвуют не один, а несколько генов. Мультифакториальными они называются потому, что клинические признаки болезни возникают только при обязательном воздействии определенных (вредных) факторов среды. В медицине такие болезни называют болезнями с наследственной предрасположенностью. К полигенным болезням относятся болезни сердечно-сосудистой системы (атеросклероз, ишемическая болезнь сердца, артериальная гипертензия), сахарный диабет, злокачественные опухоли, нервно-психические болезни. Генетической основой развития этих болезней является генетическое разнообразие (генетический полиморфизм), обусловленный наличием в популяциях и отдельных особях (генотипах) различных форм (аллелей) одного гена. Взаимодействие человека с окружающей средой приводит к изменению генетического материала (генов и нуклеотидных последовательностей молекулы ДНК в геноме. Генетический полиморфизм характеризуется наличием в популяции аллелей, частота наиболее редкой из которых составляет 1% и более. Аллели с частотой менее 1% относятся к редким вариантам. Расшифровка генома человека привела к установлению конкретных механизмов, лежащих в основе возникновения генетического полиморфизма. Таблица Типы полиморфизма ДНК
Однонуклеотидный полиморфизм (ОНП) представляет собой изменение (замену) одной пары нуклеотидов из 3 млрд. пар нуклеотидов в геноме человека. Частота ОНП составляет в среднем 1:1000 пар оснований, из чего следует что два человека (генома) различаются по примерно 3 млн парам оснований. Инсерции–делеции нуклеотидов (от 2 до 100), обозначаются в литературе термином «инделы». В геноме человека идентифицировано сотни тысяч инделов. Инделы называются простыми, если они имеют только два аллеля (характеризуются наличием или отсутствием короткого сегмента). Они встречаютсяпримерно в 50% всех случаев инсерций-делеций нуклеотидов (ИДН). Другая половина ИДН характеризуется наличием или отсутствием нескольких сегментов, повторяющихся тандемно-мультиаллельные инделы. Мультиаллельные инделы подразделяются на микросателитные и минисателитные полиморфизмы. Микросателлиты – это повторяющиеся от одного до нескольких десятков раз короткие последовательности (блоки), состоящие из 2,3 или 4 нуклеотидов. Разные аллели (формы) генов возникают в результате различий в числе повторов нуклеотидных блоков, содержащихся в микросателлите. В литературе их называют полиморфизмом коротких тандемных повторов (ПКТП-STRP). В геноме человека выявлены десятки тысяч микросателлитных полиморфных локусов. Мини-сателлиты-класс индел-полиморфизма, характеризующийся наличием в молекуле ДНК различного числа (до сотен тысяч) копий 10-100 последовательностей ДНК. Этот класс полиморфизма имеет множество аллелей, различающихся числом тандемно повторяющихся копий (последовательностей) мини-сателлита, называемых переменное число тандемных повторов (ПЧТП-VNTR). Полиморфизм числа копий (ПЧК-CNP)–полиморфизм, обусловленный изменением числа копий больших (содержащих от 200 до 2 млн пар нуклеотидов) сегментов генома. CNP могут иметь только два аллеля (присутствие или отсутствие сегмента) или больше аллелей при наличии или отсутствии 2,3,4 и более копий сегментов ДНК. В конечном итоге результаты исследований по установлению и раскрытию молекулярно-генетических механизмов возникновения генетического полиморфизма привели к коренному изменению представлений о роли генетических факторов в возникновении многих болезней человека, в том числе не только традиционно относящихся к наследственным болезням, но и инфекционным болезням. Генетика заболеваний сердечно-сосудистой системы. Атеросклероз – мультифакториальное заболевание артерий (аорта, крупные магистральные артерии). В патогенезе атеросклероза ведущую роль играют наруения липидного и углеводного обмена, эндотелиальная дисфункция, воспаления и нарушения гемостаза, контролируемые и регулируемые аллельными вариантами многочисленных генов. В целом, наследственная предрасположенность к атеросклерозу в большинстве популяций варьирует от 40 до 60%. Список генов, ассоциированных с атеросклеротическим поражением сосудов, представлен в таблице Таблица Продукты генов, ассоциированных с атеросклеротическим поражением сосудов: коронарной болезнью сердца, инфарктом миокарда, поражением периферических сосудов и инсультом
Для большинства генетически детерминированных болезней характерна генетическая гетерогенность, сущность которой заключается в развитии одинаковых клинических (фенотипических) проявлений болезней, обусловленных мутациями разных генов или различными аллельными формами одного гена. В частности, некоторые (редкие) формы атеросклероза возникают в результате мутаций единичных генов (Наследственные болезни: национальное руководство/под.ред. акад.РАМН Н.П. Бочкова. 2012, с.631) Артериальная гипертензия (АГ) – стойкое повышение артериального давления. Полигенная форма АГ возникает в результате взаимодействия большого количества генов (около 100), контролирующих артериальное давление и различных факторов внешней среды (Наследственные болезни: национальное руководство/под.ред. акад. РАМН Н.П. Бочкова. 2012, с.633-636). В некоторых случаях у больных с артериальной гипертензией выявляется мутации единичных генов (Наследственные болезни: национальное руководство/под.ред. акад. РАМН Н.П. Бочкова. 2012, с.631) В патогенезе этих форм АГ ведущая роль принадлежит мутациям генов, реализующихся фенотипически (клинически) при воздействии определенных средовых факторов (например, избыточное употребление соли, низкая активность ренина в плазме крови). Сахарный диабет 2-го типа – заболевание, относящееся к группе метаболических заболеваний, характеризующихся гипергликемией и возникающих в результате дефектов в секреции инсулина, его действия или влияния обоих факторов (ВОЗ, 1999). Сахарный диабет 2 типа (СД 2) относится к хроническим метаболическим заболеваниям, клинические проявления которого возникают обычно в возрасте 40 лет и старше. Показатели наследуемости СД варьируют в пределах 30-70% (Stuvnovollet.al., 2005). Гены предрасполагающие к СД 2 и их характеристики представлены в таблице (Наследственные болезни: национальное руководство/под ред. акад. РАМН Н.П. Бочкова. 2012, с.638) В последние годы описаны моногенные формы СД2(МОДУ), (Наследственные болезни: национальное руководство/под ред. акад.РАМН Н.П. Бочкова. 2012, с.637) Мутации этих генов приводят к генетическим дефектам В-клеток и нарушению действия инсулина. Практические занятия №9 6.1. Тема: Эпигенетика. 6.4.4. Эпигенетика в медицине. Геномика это направление в молекулярной биологии, занимающееся исследованием структуры и функций всей совокупности генов организма (генома) или значительной их части. Для геномики характерно использование очень больших объемов данных.Геном это вся совокупность наследственного материала, содержащегося в клетке и несущего биологическую информацию, необходимую для развития и функционирования всего организма, это вся ДНК в гаплоидном наборе хромосом данного вида. Формирование геномики как общепринятого научного направления приходится на первые годы XXI в. Это время завершения проекта «Геном человека». После того, как ученым удалось окончательно расшифровать человеческий геном, геномика стала по-настоящему фундаментальной наукой. Геномика подразделяется на несколько почти самостоятельных направлений: структурную, функциональную, сравнительную, эволюционную, медицинскую геномику. Структурная геномика изучает последовательность нуклеотидов в геномах, определяет строение и границы генов, межгенных участков и других структурных генетических элементов. Функциональнаягеномика идентифицирует функции каждого гена и участка генома, их взаимодействие в клеточной системе. Медицинскаягеномика решает прикладные вопросы клинической и профилактической медицины на основе знания генома человека.В настоящее время у клиницистов и генетиков есть все необходимые молекулярные и генетические инструменты, благодаря которым активно изучается геномика человека и ее влияние на течение заболеваний. Основные методы исследования в области геномики полимеразная цепная реакция (ПЦР) и ДНК-секвенирование. Несмотря на все достижения молекулярной биологии, еще недостаточно известно о том, как работают гены. Почему они молчат в одной клетке и активны в другой. Существуют мощные регуляторные системы, которые контролируют работу генов. Изучением механизмов контроля активности генов во времени и пространстве в процессе развития занимается наука эпигенетика. Эпигенетика довольно молодое направление современной науки и изучает закономерности изменения экспрессии генов или фенотипа клетки, вызванных механизмами, не затрагивающими изменение последовательности ДНК. Термин «эпигенетика»был предложен Конрадом Уоддингтоном в 1942 году, как производное от слов генетика и эпигенез. В переводе с греческого предлог «эпи-" означает «над», «выше», «поверх». Если генетика изучает процессы, которые ведут к изменениям в наших генах, в ДНК, то эпигенетика исследует изменения активности генов, при которых структура ДНК остается прежней.С.Г.Инге-Вечтомов (2004) определил эпигенетику как «область генетики, которая изучает механизмы наследственности и изменчивости, в основе которых НЕ лежит изменение первичной последовательности ДНК и РНК». Самое ёмкое и в то же время точное определение эпигенетики принадлежит выдающемуся английскому биологу, нобелевскому лауреату Питеру Медавару: «Генетика предполагает, а эпигенетика располагает». Таким образом, термин «эпигенетика» может быть использован, чтобы описать какие-либо факторы, которые влияют на развитие организма, за исключением самой последовательности ДНК. Предметом эпигенетикиявляется изучение наследованияактивности генов, НЕ связанной с изменением первичной структуры входящей в их состав ДНК. Эпигенетические изменения направлены на адаптацию организма к изменяющимся условиям его существования. Разница между генетическими и эпигенетическими механизмами наследования заключается в стабильности и воспроизводимости эффектов. Генетические признакипередаются по наследству неограниченное число, пока в гене не возникает мутация. Эпигенетические модификации обычно проявляются в клетках в пределах жизни одного поколения организма. Когда данные изменения передаются следующим поколениям, то они могут воспроизводиться в 3–4 генерациях, а затем, если стимулирующий фактор пропадает, эти преобразования исчезают, т.е. эпигенетические изменения обратимы. Совокупность эпигенетических маркеров, определяющих экспрессию генов в клетке, представляет собой эпигеном.. Эпигенетическими маркерами называют наследуемые химические модификации хроматина, которые не изменяют последовательности ДНК, но влияют на ее «активность». Для самой молекулы ДНК это метилирование; для гистонов это ацетилирование, фосфорилирование, метилирование, гликозилирование и др. К эпигенетическим механизмам относят также ремоделирование хроматина, разные варианты гистонов и посттранскрипционную регуляцию с помощью микроРНК. Все это, так или иначе, связано с активацией или репрессией генов, хотя механизмы данных процессов довольно сложные и неоднозначные. Эпигенетические преобразования могут влиять на фенотип. Эпигенетическая регуляция генов осуществляется на нескольких уровнях: на уровне ДНК, гистонов и других белков, РНК. Существует три основных механизма эпигенетической регуляции:
Первой обнаруженной эпигенетической модификацией было метилирование ДНК.Метилирование означает добавление метиловой группы к какому-либо другому химическому соединению, в данном случае к ДНК. Метиловая группа состоит всего из одного атома углерода, присоединенного к трем атомам водорода СН3(рисунок 1). Реакция обеспечивается ферментами метилтрансферазами: DNMT1,DNMT3А,DNMT3В. DNMT сокращенное обозначение ДНК-метилтрансферазы (от английского DNA methyltransferase). В большинстве случаев эти ферменты добавляют метиловую группу только к цитозину(Ц), за которым следует гуанин (Г). Последовательность Ц и Г принято записывать как CpG.CpG - это сокращение для цитозина и гуанина , разделенных фосфатом, связывающим эти два нуклеотида вместе в ДНК. Такое CpG-метилирование является эпигенетической модификацией, которая также может называться эпигенетической меткой. Химическая группа присоединяетсяк ДНК, но при этом не меняет присущую ей генетическую последовательность. 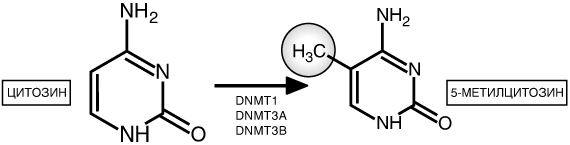 Рис. 1. Химическая структура цитозинаи его эпигенетически модифицированной разновидности5-метилцитозина. Цитозин- единственное из четырех оснований ДНК, подвергаемое метилированию для получения 5-метилцитозина. Такая реакция метилирования осуществляется в наших клетках, как и в клетках большинства других организмов, с помощью одного из трех ферментов — DNMT1, DNMT3A или DNMT3B. Фундаментальная работа по определению роли метилирования в клетках млекопитающих была выполнена в лаборатории Эдриана Бёрда. В 1985 году Эдриан Бёрд опубликовал в журнале Cell основополагающую статью, в которой показал, что большинство участков CpG не распределяются по всей ДНК случайным образом. Вместо этого, подавляющая часть пар CpG концентрируется непосредственно против хода транскрипции определенных генов, в области промотора. Промоторами называются участки генома, в которых связываются транскрипционные комплексы ДНК и начинается копирование ДНК для образования мРНК. Области с высокой концентрацией участков CpG в ДНК называются островками или мотивами CpG. У приблизительно 60 процентов генов, кодирующих белки, промоторы располагаются внутри островков CpG. Когда эти гены активны, уровни метилирования в островках CpG низкие. Островки CpG оказываются высокометилированными только в тех случаях, когда эти гены репрессированы. Разные типы клеток экспрессируют различные гены, поэтому нет ничего удивительного в том, что модели метилирования островков CpG также различаются в клетках разных типов. Было доказано, что именно от уровня метилирования ДНК будет зависеть, насколько активно она будет транскрибирована. Чем более метилирована оказывалась ДНК, тем менее продуктивной была ее транскрипция. Иными словами, была установлена прямая взаимосвязь между высокими уровнями метилирования ДНК и количеством репрессированных генов. В большинстве случаев метилирование островка CpG в начале гена подавляет его. Эдриан Бёрд также показал, что когда происходит метилирование ДНК, она связывает белок, называемый МеСР2 (от английского MethylCpGbindingprotein 2 — метил CpG связывающий белок 2). Роль его состоит в том, чтобы позволить клетке интерпретировать имеющиеся модификации на каком-либо участке ДНК. Когда МеСР2 связывается с 5-метилцитозином в промоторе гена, он притягивает к себе другие белки, также способствующие подавлению определенного гена. Кроме того, он может остановить связывание транскрипционного механизма ДНК с промотором гена, а это, в свою очередь, останавливает продукцию РНК. На участках, где гены и их промоторы очень сильно метилированы, связывание МеСР2 выглядит как часть процесса, при котором этот участок хромосомы почти навсегда перестает функционировать. ДНК становится невероятно туго закрученной, и механизм транскрипции генов не может получить доступа к парам оснований для создания копий мРНК. Для чего это нужно? Если взять, например нейроны головного мозга 85- летнего человека, то получается, что на протяжении восьми с лишним десятилетий благодаря метилированию ДНК некоторые участки генома остаются в чрезвычайно туго сжатом состоянии, что позволяет нейронам полностью подавлять определенные гены. Именно поэтому клетки нашего головного мозга никогда не продуцируют, например, гемоглобин или пищеварительные ферменты. Или, стволовые клетки кожи, которые делятся очень часто, но производят при этом всегда только новые клетки кожи, а не клетки каких-либо других типов, например костные. Мутация в гене, вырабатывающего белок МеСР2 приводит, например, к синдрому Ретта, характеризующемуся тяжелыми клиническими нарушениями, умственной отсталостью, слабоумием. Несмотря на то, что их клетки сохраняют полную способность к нормальномуметилированию ДНК, они не в состоянии правильно расшифровать эту часть эпигенетического кода. Но как передается схема метилирования ДНК от материнской клетки дочерним клеткам? Каким образом может быть сохранена модель метилирования ДНК при ее репликации? Механизм показан на рисунке 2. Когда половинки двойной спирали ДНК разделяются, каждая из них копируется по принципу комплементарности оснований. После разделения двойной спирали родительской ДНК на этапе 1 и репликации обеих цепочек ДНК на этапе 2 новые цепочки «проверяются» ферментом ДНК-метилтрансфераза 1 (DNMT1). DNMT1 может определить, что метиловая группа на каком-либо цитозиновом мотиве одной цепочки молекулы ДНК не соответствует только что синтезированной цепочке. Тогда DNMT1 присоединяет метиловую группу на новую цепочку (этап 3). Это происходит только в тех случаях, когда основания Ц и Г стоят друг за другом в мотиве CpG. Благодаря этому процессу обеспечивается сохранение модели метилирования ДНК при ее репликации и делении клетки.DNMT1 способен определить, метилирован ли мотив CpG только на одной цепочке. Когда DNMT1 обнаруживает этот дисбаланс, он восстанавливает «пропущенное» метилирование на только что скопированной цепочке. 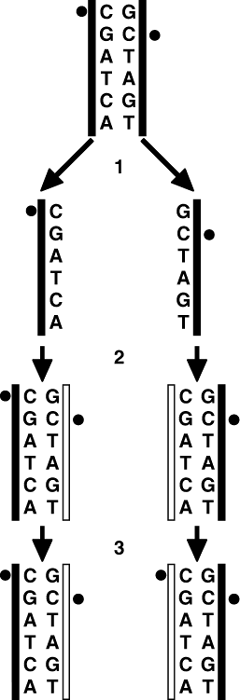 Рис. 2. На этой схеме показано, каким образом может быть сохранена модель метилирования ДНК при ее репликации. Метиловая группа представлена черным кружком. Таким образом, дочерние клетки в итоге получат те же модели метилирования ДНК, какие были у родительской клетки. Как следствие, они будут подавлять те же гены, что и родительская клетка, и клетки кожи всегда будут оставаться клетками кожи. И нейроны, и клетки кожи прибегают к метилированию ДНК для подавления разных наборов генов в разных клетках, обеспечивая индивидуальность клеток. В противном случае, экспрессировались бы всегда одни и те же гены в одинаковой степени, и тогда они неизбежно порождали бы одни и те же типы клеток, а не нейроны или клетки кожи. Т.е. два типа клеток используют один и тот же механизм для получения настолько разных результатов благодаря метилированию ДНК, который затрагивает различные области генома в клетках разных типов. Метилирование играет важную роль в клеточной дифференцировке — процессе, благодаря которому «универсальные» эмбриональные клетки развиваются в специализированные клетки тканей и органов. Мышечные волокна, костная ткань, нервные клетки — все они появляются благодаря активности строго определенной части генома. Также известно, что метилирование играет ведущую роль в подавлении большинства разновидностей онкогенов, а также некоторых вирусов. Метилирование ДНК имеет наибольшее прикладное значение из всех эпигенетических механизмов, так как оно напрямую связано с пищевым рационом, эмоциональным статусом, мозговой деятельностью и другими внешними факторами.
Сегодня главное внимание в эпигенетике и регуляции генов сосредоточено на четырех конкретных гистоновых белках, а именно Н2А, Н2В, H3 и Н4 с которыми тесно связано ДНК. Эти гистоны имеют так называемую глобулярную структуру, поскольку они упаковываются в компактную шарообразную форму. Но у каждого такого шарика есть также подвижная свободная цепочка аминокислот, которая называется гистоновым отростком. Два экземпляра каждого из этих четырех гистоновых белков группируются вместе и образуют плотную структуру, называемую гистоновымоктамером или нуклеосомой. Вокруг каждой нуклеосомы обернуты 147 пар оснований ДНК. На рисунке 3 показана упрощенная схема строения нуклеосомы, на которой белая лента изображает ДНК, а серые завитки представляют гистоновые отростки(указаны стрелкой). 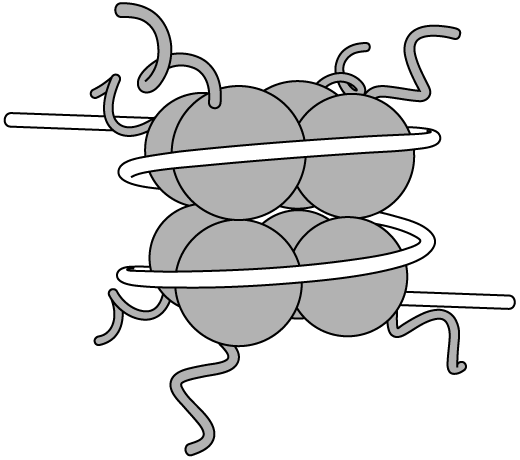 Рис. 3. Гистоновыйоктамер (по две молекулы гистонов Н2А, Н2В,H3 и Н4), туго упакованный и обернутый ДНК, образует основную единицу хроматина под названием нуклеосома. ДНК туго обернута вокруг нуклеосом, а те плотными слоями уложены друг на друга. Определенные участки наших хромосом почти постоянно находятся в таком плотно упакованном состоянии. Преимущественно, это те участки, которые не несут в себе информацию о генах. В большинстве случаев, они представляют собой структурные участки, расположенные, например, на самых кончиках хромосом, или области, важные для разделения хромосом после копирования ДНК при делении клеток. Участки ДНК, подвергаемые действительно активномуметилированию, также имеют такие сверхплотные структуры, и метилирование играет очень важную роль в формировании этих образований. Это один из тех механизмов, которые обусловливают репрессию определенных генов на протяжении всей жизни клетки. Что касается участков, которые не скручены туго, в которых находятся активные гены или же способные к последующей активации, то здесь на первый план выходят гистоновые белки. Функции их неизмеримо расширяются, теперь они не являются только лишь молекулярными катушками, на которые могла бы наматываться ДНК. Оказалось, что гистоновые белки претерпевают в клетках химическую модификацию, и эта модификация повышает экспрессию генов, если они находятся возле специфически измененных нуклеосом. Эта гистоновая модификациябыланазванаацетилированием. Ацетилирование представляет собой присоединение химической ацетил-группы(остатка уксусной кислоты СН3СО), в данном случае, аминокислоте, на свободном отростке одного из гистонов. На рисунке 4 показано строение аминокислоты лизина и ацетил-лизина. Как и метилирование ДНК, ацетилирование лизина представляет собой эпигенетический механизм для изменения экспрессии генов, не влияющий на исходную последовательность генов. 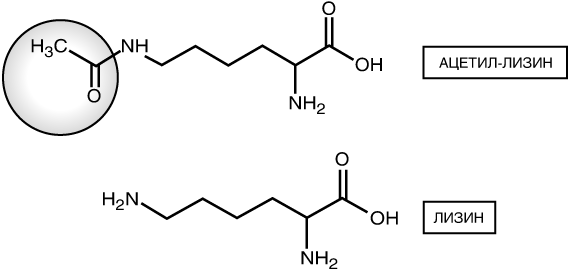 Рис. 4. Химическое строение аминокислоты лизин и ее эпигенетически модифицированной формы ацетил-лизин. Если метилирование ДНК репрессирует гены, то ацетилирование гистонов активирует их. На сегодняшний день известно уже более 50 различных эпигенетических модификаций гистоновых белков. Все эти модификации меняют экспрессию генов, но не всегда одинаково. Одни модификации гистонов усиливают этот процесс, тогда как другие ослабляют его. Шаблон, по которому происходят модификации, стали называть гистоновым кодом. Но проблема, с которой столкнулись эпигенетики, оказалась в том, что прочесть этот код невероятно сложно. Предсказать, как разнообразные комбинации гистоновых модификаций повлияют в своей совокупности на экспрессию генов, практически невозможно. Во многих случаях бывает вполне понятно, чего ожидать от какой-либо одной модификации, но делать сколько-нибудь точные предположения об их комбинированном влиянии не представляется возможным. Кроме гистоновых белков, существует свыше 100 белков, которые связываются с эпигенетическими метками, притягивают другие белки и выстраивают комплексы, активирующие или репрессирующие экспрессию генов подобно тому, как МеСР2 помогает подавить экспрессию генов при метилировании ДНК. Гистоновые модификации принципиально отличаются от метилирования ДНК. Метилирование ДНК представляет собой очень стабильное эпигенетическое изменение. Если какой-либо участок ДНК стал метилированным, то он и останется метилированным в подавляющем большинстве случаев. Вот почему эта эпигенетическая модификация настолько важна для того, чтобы нейроны всегда оставались нейронами и т.д. Большинство гистоновых модификаций значительно более вариативно. Некая модификация может быть произведена на каком-либо гистоне определенного гена, затем удалена, а позже возвращена обратно. Это происходит в результате реакции на самые разнообразные стимулирующие сигналы, поступающие в ядро клетки извне. Природа этих стимуляторов может варьироваться до безграничных пределов. В некоторых типах клеток гистоновый код может меняться, реагируя на гормоны. В головном мозге гистоновый код может меняться в ответ на прием наркотических препаратов, тогда как в клетках, выстилающих пищеварительный канал, схема эпигенетических модификаций будет меняться в зависимости от количества жирных кислот, вырабатываемых бактериями кишечника. Такие изменения гистонового кода являются одним из ключевых способов взаимодействия внешних факторов (окружающей среды) и внутренних (наших генов) для нормального функционирования организма. Гистоновые модификации также позволяют клеткам «испытывать» определенные модели экспрессии генов, особенно в процессе развития. Если репрессия генов идет на пользу клетке, то гистоновые модификации могут продолжаться достаточно долго, чтобы вызвать метилирование ДНК. Гистоновые модификации притягивают белки-дешифраторы, которые выстраивают комплексы из других белков на нуклеосоме. В некоторых случаях эти комплексы могут включать в себя DNMT3А или DNMT3B —два фермента, доставляющие метиловые группы на мотивы CpG в ДНК. В таких ситуациях DNMT3 А или DNMT ЗВ могут «вытягиваться» из комплекса на гистоне и метилировать соседнюю ДНК. Если метилирование ДНК оказывается достаточным, экспрессия гена будет подавлена. В чрезвычайных обстоятельствах вся область хромосомы может стать сверхплотной и оставаться подавленной на протяжении многочисленных делений клетки или даже сохраняться таким десятилетиями в таких неделящихся клетках как нейроны. Почему организм для регулирования экспрессии генов создал в процессе эволюции такие сложные схемы гистоновых модификаций? Одна из причин этого, вероятно, состоит в том, что благодаря ее сложности появляется возможность производить предельно выверенную, точную настройку экспрессии генов. Благодаря этому процессу клетки и организмы могут соответствующим образом корректировать экспрессию генов для адекватного реагирования на изменения окружающей среды, такие как недостаток питательных веществ или воздействие вирусов.
Оказалось, что не только ДНК является обладательницей регулирующих метильных модификаций; такие же модификации может нести и скопированная с ДНК матричная РНК, на которой и происходит синтез белка.Почти любая человеческая мРНК имеет от 3 до 6 метильных групп, прикреплённых к азотистому основанию аденозину. Точно так же мРНК модифицируется почти у всех млекопитающих и многих других животных. Принцип такой же, как при метилировании ДНК. По-видимому, степень модификации мРНК может определять энергетический баланс в организме и в каких-то случаях вести к ожирению. Кроме 3 видов РНК (тРНК ,рРНК, мРНК), сейчас стали известны другие виды РНК, такие как некодирующие РНК или нкРНК. Эти нкРНК встречаются по всему геному. Они продуцируются из интронов. Раньше считалось, что сплайсированные от интронов частички мРНК разрушаются клетками. Теперь же представляется более вероятным, что, по крайней мере, некоторые из них (если не большинство) в действительности обрабатываются клеткой и становятся полноправными функциональными нкРНК. нкРНКмогут как снижать, так и повышать экспрессию генов.Точный механизм, с помощью которого нашинкРНК способны влиять экспрессию генов, неизвестен. Существует также особый класс коротких (19-25 нуклеотидов) молекул РНК, не несущих какой-либо закодированной информации. Их называют микроРНК (миРНК). Они могут распознавать некоторые дефектные иРНК и связываться с частично комплементарными областями в молекуле целевой информационной РНК. В результате трансляция становится невозможной даже чисто по техническим причинам. Дефектная РНК поступает на деградацию. Считают также, чтомиРНК играют главные роли в регуляции плюрипотентности клеток и их дифференциации. Эпигенетика в практической медицине Эпигенетические модификации контролируют все стадии развития и функциональную активность клеток. Нарушение механизмов эпигенетической регуляции напрямую или косвенно связано с множеством заболеваний. К заболеваниям с эпигенетической этиологией относят болезни импринтинга. При геномном импринтинге один и тот же ген фенотипически проявляется по-разному в зависимости от того, от отца или матери он попадает к потомку. То есть, если ген наследуется от матери, то он уже метилирован и не экспрессируется, тогда как ген, наследуемый от отца не метилирован, и экспрессируется. Наиболее активно изучается геномный импринтинг при развитии различных наследственных заболеваний, которые передаются только от предков определенного пола. Например, ювенильная форма болезни Гентингтона проявляется только при наследовании мутантного аллеля от отца, а атрофическая миотония — от матери. И это при том, что сами гены, вызывающие эти заболевания, абсолютно одинаковы независимо от того, наследуются ли они от отца или матери. Различия заключаются в «эпигенетической предыстории», обусловленной их пребыванием в материнском или, наоборот, отцовском, организмах. Другими словами, они несут «эпигенетический отпечаток» пола родителя. При нахождении в организме предка определенного пола они метилируются (функционально репрессируются), а другого – деметилируются(соответственно, экспрессируются), и в таком же состоянии наследуются потомками, приводя (или не приводя) к возникновению определенных заболеваний. При болезнях генного импринтинга наблюдается моноаллельная экспрессия в локусах хромосом одного из родителей. К ним относят, например.синдром Прадера–Вилли (делеция в отцовской хромосоме 15) — проявляется черепно-лицевым дисморфизмом, низким ростом, ожирением, мышечной гипотонией, гипогонадизмом, гипопигментацией и задержкой умственного развития; синдром Ангельмана (делеция в 15-й материнской хромосоме), основными признаками которого являются микробрахицефалия, увеличенная нижняя челюсть, выступающий язык, макростомия, редкие зубы, гипопигментация. К заболеваниям, где нарушение генной регуляции является частью патогенеза, можно отнести некоторые виды опухолей, сахарный диабет, ожирение, бронхиальную астму, различные дегенеративные и другие болезни. Эпигоном при раке характеризуется глобальными изменениями в метилировании ДНК, модификации гистонов, а также изменением профиля экспрессии хроматин-модифицирующих ферментов.В настоящее время уже разработаны и внедрены в практику противоопухолевые лекарственные препараты, основанные на подавлении активности ДНК-метилтрансфераз, что приводит к снижению метилирования ДНК, активации генов-супрессоров опухолевого роста и замедлению пролиферации опухолевых клеток. Изменения экспрессии тех или иных генов могут происходить и в результате действия на клетку факторов внешней среды. В развитии сахарного диабета 2-го типа и ожирения играет роль так называемая «гипотеза экономного фенотипа», согласно которой недостаток питательных веществ в процессе эмбрионального развития приводит к развитию патологического фенотипа. К числу важнейших факторов, влияющих на эпигеном, относятся питание, физическая активность, токсины, вирусы, ионизирующая радиация и др. Особенно чувствительным периодом к изменению эпигенома является внутриутробный период (особенно охватывающий два месяца после зачатия) и первые три месяца после рождения. В период раннего эмбриогенеза геном удаляет большую часть эпигенетических модификаций, полученных от предыдущих поколений. Но процесс репрограммирования продолжается в течение всей жизни. Изучение эпигенетических механизмов помогает понять, что очень многое в жизни зависит от нас самих. В отличие от относительно стабильной генетической информации, эпигенетические «метки» при определенных условиях могут быть обратимыми. Этот факт позволяет рассчитывать на принципиально новые методы борьбы с распространенными болезнями, основанные на устранении тех эпигенетических модификаций, которые возникли у человека под воздействием неблагоприятных факторов. Применение подходов, направленных на корректировку эпигенома, открывает большие перспективы перед медициной. Практические занятия №10 6.1. Тема: Фармакогенетика. . Повседневная практика показывает, что эффективность одних и тех же лекарственных средств у различных больных неодинакова. То же можно сказать и о переносимости лекарств. Относительно недавно было установлено, что во многом эти различия определяются генетическими факторами. Изучение генетической обусловленности реакции организма человека на лекарственные средства, ее сущности и последствий, а также методов диагностики, профилактики и коррекции необычного ответа организма на действие лекарственных препаратов составляет предмет фармакогенетики. Термин «фармакогенетика» предложил Фогель (1959). Он впервые отметил существование генетического контроля над реакцией организма на введение многих лекарственных средств. Характер взаимодействия лекарства и организма зависит от множества причин и условий, например таких, как биологическая активность и биодоступность лекарственного вещества, аллергизация организма, состояние органов обезвреживания и выделения, физиологическое и патологическое состояние организма и т. д. Фармакогенетика изучает только те типичные и атипичные реакции организма на лекарственные средства, которые являются наследственными. Наследственная индивидуальная чувствительность к лекарственным препаратам определяется двумя основными критериями: 1. Фармакокинетика - включает этапы всасывания, распределения, метаболизма/биотрансформации и выведения лекарственных средств. Все перечисленные этапы находятся под контролем соответствующих генов, поэтому полиморфизмы различных генов могут влиять на данные фармакокинетические процессы. Доказано, что наибольшее клиническое значение имеют полиморфизмы генов, контролирующих синтез и работу ферментов биотрансформации лекарственных средств, а также транспортных белков переносчиков, то есть транспортеров, участвующих в процессах всасывания, распределения и выведения лекарственных средств. 2. Фармакодинамика - изучает локализацию, механизм действия и фармакологические эффекты лекарственных средств, силу и длительность их действия (т.е. вследствие аллельных вариаций наблюдаются различия в мишенях (рецепторах, энзимах) или метаболических путях). Генетический полиморфизм определяет три главных фенотипа метаболизаторов (лиц, принимающих лекарства): экстенсивные, медленные и быстрые. Экстенсивные метаболизаторы - индивиды с нормальной скоростью метаболизма рассматриваемых лекарственных средств. К этой группе принадлежит большинство населения. Они являются чаще всего гомозиготами по «дикому» аллелю соответствующего фермента. Медленные метаболизаторы (иногда нулевые) характеризуются сниженной скоростью метаболизма рассматриваемого лекарственного средства. С генетической точки зрения они являются гомозиготами (при аутосомно-рецессивном типе наследования) или гетерозиготами (при аутосомно-доминантном типе наследования) по мутантному («медленному») аллелю соответствующего фермента. У таких лиц синтез фермента отсутствует или синтезируется неактивный («дефектный») фермент, в результате чего лекарственное средство накапливается в высоких концентрациях, что и приводит к появлению нежелательных побочных реакций. Отсюда ясно, что для медленныхметаболизаторов доза лекарства должна быть меньшей или назначают другое лекарство. Быстрые (или сверхактивные) метаболизаторы характеризуются повышенной скоростью метаболизма определенных лекарств. В основном это гомозиготы (при аутосомно-рецессивном типе наследования) или гетерозиготы (при аутосомно-доминантном типе наследования) по «быстрому» аллелю соответствующего фермента. Достаточно часто встречаются индивиды с копиями функциональных аллелей, что также приводит к повышенному метаболизму лекарства. Быстрый метаболизм лекарства не позволяет при стандартных дозах достичь его терапевтической концентрации в крови, поэтому доза лекарства для быстрых метаболизаторов должна быть выше, чем для нормальных метаболизаторов. Наследственные факторы, определяющие необычные реакции на лекарственные средства, в основном являются биохимическими. Чаще всего это дефект ферментов, катализирующих превращения лекарства. Влияние ферментов на характер, степень и продолжительность вызываемой лекарственным препаратом реакции опосредовано через метаболизм лекарственных средств. Атипичные реакции на лекарства, связанные с генетически обусловленными аномалиями метаболических путей, можно подразделить на две основные группы:
| |||||||||||||||||||||||||||||||||||||||||||||||||
