2-курс ПЗ рус блог. Менделевское наследование у человека
 Скачать 437.9 Kb. Скачать 437.9 Kb.
|
|
Генетика развития человека: Доимплантационное развитие Онтогенез человека начинается с процесса оплодотворения или слияния двух гамет –яйцеклетки и сперматозоида. Женская гамета образуется в результате оогенеза, мужские-сперматогенеза, оба эти процесса начинаются во время внутриутробного развития будущих родителей и продолжаются до их полового созревания. Созревание яйцеклетки начинается еще внутриутробно, а сперматогонии вступают в мейоз только в период полового созревания. Доимплантационное развитие длится 6-7 суток и начинается с образования пронуклеусов: мужского и женского. Мужской пронуклеус образуется из головки сперматозоида, который проник в ооплазму. Женский пронуклеус образуется из хромосом ооцита после отделения второго полярного тельца. Формирование пронуклеусов заканчивается через 12 часов после оплодотворения.Через 30 часов после оплодотворения происходит сингамия – слияние пронуклеусов. Затем идет первое деление дробления, которое повторяется каждые 18 часов. В течение трех первых делений дробления все бластомеры круглой формы, одинаковы по морфологии и ростовым потенциям. Через 4-5 дней после оплодотворения образуется бластоциста. Во время дробления зародыш продвигается по маточной трубе в направлении матки и на 5-6-ой день в стадии бластоцисты проникает в матку. Генетические механизмы регуляции дробления Первые деления дробления зиготы человека идут за счет генетической информации ооцита, накопленной еще в оогенезе. Это рибонуклеопротеиновые комплексы, необходимые для синтеза новых белков, питательных веществ и энергии для обеспечения начальных этапов эмбриогенеза. Вначале синтез белков идет на матрицах РНК, то есть на хромосомах ооцита, которые синтезированы в оогенезе, поэтому ее называют материнская РНК. Процесс переключения индивидуальной генетической программы с материнской РНК на геном самого зародыша идет постепенно. Установлено, что геном зародыша человека начинает контролировать индивидуальное развитие со стадии 4-8 бластомеров, то есть после 2-3х делений дробления. В пронуклеусах и ядрах бластомеров идут процессы эпигенетичекогорепрограмирования генома (ЭРГ) с деметилированием и реметилированием ДНК. Таким образом, со стадии 8 бластомеров включается генетическая программа онтогенеза. Известно около 100 генов, которые экспрессируются на самых ранних стадиях эмбриогенеза человека. Это гены «стволовости» -(stemnessgenes) гены: ОСТ4, Nanog, SOX2, PODX1, TERT и другие. Они обеспечивают плюрипотентность и пролиферацию. Нарушение доимплапнтационного развития является результатом генетической неполноценности гамет, нарушений процесса оплодотворения, либо экспрессии генов,отвечающих за ранние этапы онтогенеза. К наиболее частым нарушениям доимплантационного развития относится отсутствие или задержка дробления, полиспермное оплодотворение, фрагментация и гибель бластомеров. Имплантация и формирование плаценты Имплантация –это внедрение зародыша в стенку матки. Происходит имплантация на 4-5-й день после оплодотворения. Контакт бластоцисты с клетками эндометрия матки является сигналом к «хэтчингу» - выходу бластоцисты из оболочки и началу экспресси генов. Для имплантации обязательна строгая синхронизация программ развития клеток зародыша и стенки матки. Десинхронизация ритмов развития зародыша и стенки матки приводит к нарушению имплантации и прерыванию беременности, поэтому период имплантации считают первым критическим периодом развития онтогенеза человека. Идентифицированы гены, критичные для процессов имплантации и плацентации: ОСТ4, , Nanog, SOX2, - тотипотентность клетки зародыша. ELF5-первичная дифференцировка MMP- процесс инвазии ТБ (трофобласта) BPM- 4 – пролиферация клеток Нарушения функции генов, отвечающих за имплантацию и плацентацию, приводят к тяжелым осложнениям при беременности, включая гестоз (преэклампсию), привычное невынашивание беременности, преждевременные роды. Процессы раннего морфогенеза обеспечивают гены, отвечающие за синтез сигнальных молекул (СМ) и гены ТФ. Шведский ученый Я.Э. Эндстрим назвал эти гены «генами-господами», которые руководят работой структурных генов- «генов-рабов». Гены сигнальных молекул – это пять основных семейств: SHH,TGF-β,FGF,EGF,IGF. Ген SHH (Sonic Hedgehog-«шумный ежик») был обнаружен вначале у дрозофилы (Hh). Мутация этого гена приводит к появлению личинок дрозофилы с колючками на теле. У человека и млекопитающих эти гены участвуют в регуляции гаструляции, нейруляции и закладки осевого комплекса органов. Ген SHH описан у человека в 1995 г., находится в локусе 7q36. Он является главным регулятором эмбриогенеза человека и млекопитающих, экспрессия гена начинается на стадии нейрулы в клетках хорды, в стенках нервной пластинки и энтодерме. Ген SHH играет большую роль в дифференцировке нервной трубки, переднего мозга, нейронов радужки глаза, мезодермы, конечностей, сердца. Мутации гена SHH вызывает голопрозэнцефалию (неразделение переднего мозга на 2 полушария, циклопию и другие аномалии головного мозга), полидактилию. Белок, секретируемый геном SHH активирует другой сигнальный белок семейства TGF – Nodal, запускает каскад генов, определяющих право-левую ассиметрию зародыша, что приводит к аномалиям развития сердца. Органогенез включает весь период эмбрионального развития до завершения I-го триместра беременности (90-й день развития). Генетический контроль органогенеза проводят регуляторные гены, ТФ и сигнальные молекулы. Это гены семейства НОХ и другие гомеобоксные гены. Они (СМ) определяют общий план строения организма. Мутации трех ФТ (SIX3, ZIC2, TGIF), четырех СМ (SHH, TGFβ, GLI2, TDGF1 ) приводят к голопрозэнцефалии, мутация гена MTHFR- к гидроцефалии, spina bifida. Также ранние этапы эмбриогенеза млекопитающих и человека контролируют гомеобоксные гены: HOX, PAX, SOX. Семейство HOX состоит из 38 генов, образующих 4 кластера: А,В,С,Д. Находятся они на разных хромосомах – 7,17,12,2. Есть прямая зависимость между положением генов в кластере и расположением зон их экспрессии по оси тела: HOX-1 находится в области передней части головы, HOX-5 в грудном отделе, HOX-7 в поясничном отделе, HOX-9-12 в задних отделах туловища. Мутации генов семейства HOX – приводят к нежизнеспособности эмбриона. Высокая степень гомологии HOX генов разных кластеров приводит к тому, что один HOX-ген может компенсировать утрату функции других HOX генов. Например, ген 13 из HOX D очень похож на ген 13 из HOX А и ген 13 из HOX С. Мутация в гене 13 HOX А приводит к укорочению первого и пятого пальцев кистей и стоп в сочетании с гипоспадией у мальчиков или двурогой маткой у девочек. Мутация в гене 13 HOX D приводит к синполидактилии – появлению дополнительного пальца между 3 и 4-м, фаланги которых частично срослись. Семейство PAX включает 9 генов, которые контролируют развитие органов чувств, развитие мозга, закладку осевого комплекса органов. Гены семейства РАХ аналогичны генам групп pair-rule (гены сегментации) у дрозофилы и называются pair-ВОХ генами. У человека мутации четырех РАХ –генов связаны с определенными аномалиями развития: - мутация в РАХ3 приводит к синдрому Ваарденбурга І типа, (АД тип наследования, нейросенсорная глухота, белая прядь в волосах, гетерохромия – аномальная пигментация радужки). - мутация в РАХ 2 приводит к отсутствию почек и мочеполовых протоков в сочетании со структурными дефектами в сетчатке глаза и зрительных нервах. - мутация в РАХ6 приводит к аниридии. Семейство SOX включает более 20 генов, которые являются гомологами гена SRY, расположенного на У хромосоме и играющего роль в первичной детерминации пола. Мутация гена SOX9 приводит к множественным аномалиям скелета и внутренних органов. Гомолог SOX9 у мыши – ген SOX9 также необходим для нормального развития скелета. ВЫВОД: Таким образом, за развитие зародыша отвечают многие тысячи генов, решающая роль принадлежит генам, контролирующим синтез сигнальных молекул (индукторов дифференцировки) и генам ТФ. К генам сигнальных молекул относятся гены семейств Hedgehog (SHH), трансформирующие ростовые факторы, факторы роста фибробластов, эпидермальный фактор роста. ТФ включают семейства гомеобоксных генов: НОХ, РАХ, SОХ. Регуляция активности генов возможна на уровне транкрипции ДНК, созревания иРНК (сплайсинг, кэпирование, полиаденилирование), транспорта зрелой РНК из ядра в цитоплазму, считывания генетического кода мРНК на рибосомах во время трансляции, процессинга синтезированного полипептида и формирования функционального активного белка. Регуляция генетической программы онтогенеза происходит через включение и выключение генов в строго определенном месте или на определенной стадии онтогенеза и в конкретных клетках Генетические механизмы онтогенеза основаны на процессах активации и репрессии генов. Индуктором для активации регуляторных генов зиготы служит позиционная информация яйцеклетки материнского организма. В онтогенезе животных, также человека есть процесс сегментации или процесс разделения зародыша на сегменты. Контролируют сегментацию два вида генов: сегрегационные гены и гомеозисные гены. Сегрегационные гены определяют количество сегментов. Мутации сегрегационных генов несовместимы с жизнью и приводят к гибели зародыша на ранних стадиях развития. Гомеозисные гены контролируют направление развития каждого сегмента. Мутации гомеозисных генов приводят к изменению направления детерминации, к появлению структур нехарактерных для данного сегмента. Например, развитие структур головы на грудных сегментах. В процессе детерминации и дифференцицации ключевым является дифференциальная экспрессия генов. Активация одних генов запускает экспрессию других. Запускающие гены называют» гены – господа» (mastergenes), структурные гены называют «гены – рабы» (slavesgenes). Между ними находятся регуляторные гены. Гены, транскрибировавщиеся в эмбриональном периоде репрессируются к моменту рождения и активизируются гены характерные для взрослого организма. Примером являются гены гемоглобина: эмбриональный гемоглобин сменяется фетальным, фетальный сменяется гемоглобином взрослого. У эмбрионов человека активно функционируют ς (дзета) – глобиновый ген из ς– семейства и ε (эпсилон) – глобиновый ген из β-семейства, обеспечивающие образование эмбрионального ς2 ε2-гемоглобина. На более поздних стадиях онтогенеза у плода эти гены репрессируются, но дерепрессируются, другие гены, определяющие синтез фетального гемоглобина α2 γ2. После рождения начинают экспрессироваться δ (дельта) и β(бета) – глобиновые гены, обеспечивающие синтез гемоглобина взрослого человека. Дифференциальная экспрессия генов является главным механизмом цитодифференцировки. Уровни регуляции дифференциальной экспрессии генов соответствуют этапам реализации информации в направлении ген → полипептид → признак. 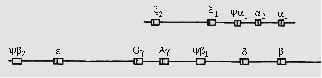 Рис. 1. Семейство глобиновых генов человека Различают два вида эукариотических генов: гены «домашнего хозяйства» (housekeeping) и гены «роскоши» (genesofluxury). Гены домашнего хозяйства имеются во всех типах клеток и выполняют функцию поддержания универсальных клеточных функции и обеспечивают предварительную дифференциацию. Гены роскоши имеются в отдельных типах клеток и выполняют специализированные клеточные функции, обеспечивают окончательную дифференциацию клеток. Гены онтогенеза представляют сложную систему, работающую по иерархическому принципу: гены с материнским эффектом –«гены господа» -регуляторные гены – структурные гены. Надо отметить, что реализация генетической программы онтогенеза человека идет не только под контролем индивидуальных генов, но и всего генома. Это повторяющиеся последовательности ДНК, эпигенетические изменения (метилирование ДНК, гистоновый код) и регуляторные интерферирующие (малые) РНК. Геномная регуляция онтогенеза гораздо сложнее. Различают регуляционное и мозаичное развитие. Для клеток раннего эмбриона характерна тотипотентность или проспективная потенция – возможность специализироваться в различных направлениях. Это состояние называется регуляционным развитием. Разрушение или удаление части эмбриона на этапе регуляционного развития не приводит к нарушению развития конечных структур. На поздних этапах развития (начиная с гаструляции) свойство тотипотентности утрачивается и клетки развиваются в конкретном направлении- это мозаичное развитие. Утрата части эмбриона на этом этапе приводит к нарушению развития конечных структур. Проблема реализация генетической информации во время онтогенеза имеет важное значение для изучения патологии ранних стадий онтогенеза, ВПР и мультифакториальных заболеваний. Ранние этапы онтогенеза, начинающиеся с оплодотворения, наиболее важны, потому что именно на ранних этапах идут наиболее драматичные события, обусловливающие патологию развития человека, возникновения ВПР и наследственных болезней. На ранних этапах онтогенеза возникает индивидуальный геном с дальнейшей программой развития нового организма, идет жесткий отбор генетически наполноценных особей. Знание механизмов реализации генетической программы онтогенеза в норме и в патологии необходимо для практических врачей при разработке методов диагностики и лечения врожденных дефектов. Практические занятия №14 6.1. Тема: Профилактика наследственных болезней (МГК) Информационно-дидактический блок Медико-генетическое консультирование (МГК) - специализированный вид медицинской помощи - наиболее распространенный способ профилактики наследственных болезней. Медико-генетические консультирование - это процесс, в результате которого больные с риском наследственного или предположительно наследственного заболевания или их родственники получают сведения о последствиях данного заболевания, вероятности его развития и наследования, а также способах его предупреждения и лечения. Группу риска (соответственно нуждающихся в МГК) составляют следующие лица: - состоящие в кровнородственном браке - имеющие родственников с наследственными или предположительно наследственными болезнями. - с первичным бесплодием в сочетании с недоразвитием вторичных половых признаков - женщины с привычным невынашиванием (многократные выкидыши, мертворождения) или с неблагоприятным течением беременности (угроза выкидыша, многоводие, недоразвитие плода и т.д.) - подвергавшиеся неблагоприятным факторам окружающей среды (облучение, прием некоторых лекарств, профессиональные вредности, тяжелые инфекции), особенно женщины в начальные сроки беременности - женщины старше 35 лет и мужчины старше 40 лет - гетерозиготные носители рецессивных болезней, выявленные скрининговыми методами - дети с задержкой психического и физического развития, неврологическими расстройствами, нарушениями внутренних органов и зрения, отклонениями в половом развитии, и т.д. Эти же причины являются общими показаниями для проведения МГК. Таким образом, основная задача МГК - составление медико-генетического прогноза для обратившейся семьи, который включает в себя три элемента (этапа): - точный диагноз заболевания, - расчет генетического риска - заключение и рекомендации. 1-й этап - Диагностика болезни - осуществляется с помощью специальных методов генетического анализа. Генеалогический анализ - это первый и наиболее важный этап в медико-генетическом консультировании, позволяет определить характер наследования признака, что очень важно при расчете риска. При этом выявляются все возможные родственные связи (вторичный брак, кровнородственный брак, внебрачные дети и т.д.), с максимально точным описанием признаков. Цитогенетический метод обязателен для точного диагноза при хромосомной болезни. Обследуются, как правило, пробанд, его родители, сибсы и, при необходимости, другие родственники. По показаниям, применяются биохимические, иммуногенетические, молекулярно-биологические и др. методы. При необходимости, назначаются консультация других специалистов (невропатолога, эндокринолога, ортопеда, окулиста и т.д.). 2-й этап- Оценка генетического риска и прогноз потомства Генетический риск - это вероятность проявления определенной болезни у консультирующегося или у его потомства, выраженная в процентах или шансах. Определяется, в основном, двумя способами: 1- теоретические расчеты или расчеты менделевского риска, основанные на генетических закономерностях (когда точно установлен тип наследования). Применяется при моногенных болезнях. В этом случае основную трудность составляют определение типа наследования и генотипов пробанда. 2 - эмпирический риск, основанный на фактических наблюдениях и результатах популяционно-статистических исследований. При этом используются специальные таблицы эмпирического риска. Применяется для большинства мультифакториальных (полигенных) болезней и хромосомных синдромов. В общем случае считается, что: - риск менее 5 % - низкий и не является противопоказанием для рождения детей. - риск от 6 до 20 % - средний - рождение здорового ребенка возможно, но необходима пренатальная (дородовая) диагностика, о которой будет сказано ниже. - риск более 20 % - высокий, при невозможности проведения пренатальной диагностики иметь ребенка не рекомендуется. 3-й этап - заключение и рекомендации. Объяснение результатов должно проводиться в максимально доступной форме с учетом уровня образования, социально-экономического положения семьи, структуры личности и взаимоотношений членов семьи. Окончательное решение о деторождении принимают сами пациенты. При этом, роль врача в принятии решения заключается в квалифицированном совете. Если пациенты, несмотря на высокий риск, выражают желание иметь детей, рассматривается вопрос о проведении пренатальной диагностики. |
