Методические рекомендации по выполнению лабораторных и практических работ по учебной дисциплине ен. 01 Химия
 Скачать 0.55 Mb. Скачать 0.55 Mb.
|
Экспериментальная частьОзнакомьтесь с правилами по технике безопасности при работе в химической лаборатории и распишитесь в журнале по ТБ. Ход работы Приготовление рабочего раствора щелочи. 1. Рассчитать навеску щелочи КОН для приготовления 200 мл 0,1 Н раствора. Определяем эквивалентную массу КОН Э(КОН) = М/ 1г*экв = 56:1=56 г 56 г в 1 литре раствора, то раствор 1 Н X г -//- 0,1 Н Х г = 56 * 0,1 = 5,6г 5,6 г КОН содержится в 1 л раствора X г КОН содержится в 0,2 литра Х= 5,6 * 0,2 = 1,12г QКОн=1,12 г 2. Приготовить раствор: А) взвесить навеску; Б) перенести ее в мерную колбу аккуратно без потерь; В) растворить дистиллированной водой до метки 200 мл, последние капли воды добавлять пипеткой. Приготовление стандартного раствора щавелевой кислоты. 1. Рассчитать навеску для приготовления 100 мл 0,1 н раствора щавелевой кислоты Н2С2O4 •2Н2O Определим эквивалентную массу. Э (Н2С2О4 • 2Н2О) = М/2; Э (Н2С2О4•2Н2О) = 63 г Определим навеску Q (массу) кислоты для приготовления 100 мл 0,1 н раствора. Рассуждения такие же, как и для КОН. В результате получим: Q(Н2С2О4 •2Н2О) = 63-0,1-0,1= 0,633 г = 630 мг. 2. Приготовить раствор кислоты: А) взвесить навеску; Б) перенести её в мерную колбу; В) растворить дистиллированной водой до метки 100 мл Оформите результаты лабораторной работы в тетради. Сделайте выводы. Лабораторная работа № 21 Определение нормальности и титра раствора щелочи Цель: научиться работать с химическим оборудованием и реактивами, приобрести навык приготовления растворов, проведения титрования и вычислений в объемном анализе. Оборудование и реактивы: весы, разновесы, бюксы или тигли, мерные колбы, бюретки, пипетки, колбы, воронки; КОН (сухой), (Н2С2О4 • 2Н2О)= (сухая), фенолфталеин. Экспериментальная частьОзнакомьтесь с правилами по технике безопасности при работе в химической лаборатории и распишитесь в журнале по ТБ. Ход работы 1.Определить нормальность и титр раствора по щавелевой кислоте (см. лабораторную работу №20) 2. Подготовить посуду для анализа: бюретку, пипетки, колбы для титрования. 3. Колбы для титрования 9\(3 штуки) заполнить кислотой. Пипеткой в каждую отмерить по 10 мл кислоты и добавить 2-3 капли фенолфталеина 4. Бюретку через воронку заполнить щелочью, установить уровень на 0 при снятой воронке 5. Титровать каждую колбу до появления бледно-розовой окраски, которая не исчезает в течение 30 сек. Данные титрования занести в таблицу:
6. Расчеты: А) V ср щелочи = V 1+ V 2+ V3/3 Б) нормальность кислоты определим из соотношения Vщ / Vк = Нк / Нщ Нк = Vщ - Нщ / Vк В)Титр кислоты Т = Э - N/1000 Т= Нк • Экислоты / 1000; Т = Н - 56/1000 =....г/мл Т=Q/V ; Т=1,12/200 = 0,0056г/мл Выводы: Тк= экв/л Нк= г/мл Оформите результаты лабораторной работы в тетради. Сделайте выводы. V.ПРАКТИЧЕСКИЕ РАБОТЫ Практическая работа № 1 Расчёты осмотического давления, температур кипения и замерзания растворов Цель: Приобрести навыки расчёта концентраций растворов, осмотического давления, температур кипения, замерзания, pH среды; закрепить теоретические знаний о растворах. Ход работы Теоретическая часть 3 Зависимость растворимости газов от давления определяется законом Генри. Закон Генри: растворимость газов при постоянной температуре прямо пропорциональная давлению газа над раствором. C=K*P где C – концентрация газа в растворе; K – коэффициент пропорциональности, которая зависит от природы газа и жидкости; P – давления газа над раствором. 3.Степень электрической диссоциации – отношение числа диссоциированных частиц (n) к исходному числу частиц (N) растворённого вещества при определённой температуре. a= 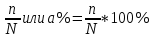 Изотонический коэффициент и показывает, в сколько раз величины ∆tз.эксп., ∆tк.эксп,что наблюдаются на опыте больше тех, которые рассчитаны за формулами для растворов неэлектролитов: i= 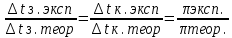 Таким образом, для растворов электролитов 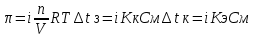 Между изотоническим коэффициентом и степенью диссоциации существует связь: i=1+(n-1)a где n - число ионов на которые распадается электролит. Из уравнения вытекает: a = 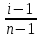 Задача 1. Вычислить, сколько глицерина C3H5(OH)3 нужно растворить в 200 г воды, чтобы раствор замерзал при — 5°С. Криоскопическая постоянная воды 1,86 град. Решение: Молярная масса глицерина: М = (12×3)+(16×3)+(8×1) = 92 г/моль Воспользуемся II законом Рауля: ΔTкрист = K·m, где K — криоскопическая константа, M(в-ва) — моляльность вещества в растворе. Моляльность раствора равна: m = n/G = g/M·G ΔTкрист= 1000·K· g/M·G, где g – масса растворенного вещества, г. G – масса растворителя, г. Температура кристаллизации Ткрист чистой воды = 0 °С. Значит понижение температуры кристаллизации составит ΔТкрист = 0 – (–5) = 5 °С. 5 = 1000·1,86·g/200·0,92 g = 49,5 г Таким образом, масса глицерина равна 49,5 г Ответ: m (глицерина) = 49,5 г Задача 2. Из скольких атомов состоит молекула иода в спиртовом растворе, если раствор 6,35 г йода в 100 г этанола кипит при 78,59оС? Решение: Из закона Рауля следует, что: ΔTкип= 1000·Е· g/M·G, где Е – эбулиоскопическая постоянная, g – масса растворенного вещества, G – масса растворителя, М – молярная масса растворенного вещества. Найдем молярную массу растворенного вещества, используя справочные данные: Е (этанола) = 1,2 Ткип (этанола) = 78,39ºС ΔTкип = 78,59 – 78,39 = 0,2ºС М = 1000·Е· g/G·ΔTкип М = 1000·1,2·6,35/100·0,2 = 381 г/моль Атомная масса йода равна 126,9, N = 381/126,9 = 3 Следовательно, молекула иода состоит из 3 атомов Ответ: 3 атома Задача 3. Сколько граммов глюкозы С6Н12О6 было растворено в 0,5л воды, если температура кипения полученного раствора составила 1020С? Решение: Из закона Рауля следует, что: ΔTкип= 1000·Е· g/M·G, где Е – эбулиоскопическая постоянная, g – масса растворенного вещества, G – масса растворителя, М – молярная масса растворенного вещества. Найдем молярную массу растворенного вещества, используя справочные данные: Е (воды) = 0,516 Ткип (воды) = 100ºС M(глюкоза) = 12·6+1·12+16·6 = 180 г/моль G (воды) = V·ρ = 500 ·1= 500 г ΔTкип = 102-100 = 2ºС g = G·ΔTкип·M/1000·Е g = 500·2·180/1000·0,516 = 348,8 г. То есть масса глюкозы равна 348,8 г. Ответ: m (глюкозы) = 348,8 г. Задача 4. В каком количестве воды надо растворить 6,84 г глюкозы С6Н12О6, чтобы давление пара воды, равное при 65оС 250 гПа, снизилось до 248 гПа? Решение: Согласно I закону Рауля (p0 – p)/p0 = nв-ва/(nв-ва + nр-ля) nв-ва = mв-ва /Mв-ва M(глюкоза) = 12·6+1·12+16·6 = 180 г/моль nв-ва = 6,84/342 = 0,02 моль Подставляем известные данные в уравнение: (250 – 248)/248 = 0,02/(0,02+nр-ля), отсюда находим nр-ля = 2,45 моль nр-ля = mр-ля /Mр-ля mр-ля = nр-ля· Mр-ля Mр-ля = 1·2+16 = 18 г/моль mр-ля = 2,45·18 = 44,1 г. Значит, глюкозу надо растворить в 44,1 г. воды. Ответ: m (воды) = 44,1 г. Задача 5. Сколько воды надо прибавить к 2 л раствора сахара, чтобы понизить его осмотическое давление в 3 раза? Решение: Из уравнения Вант – Гоффа следует: π = C· R·T, Поскольку R и T – величины постоянные, то осмотическое давление будет зависеть только от С. При уменьшении π в з раза, С также уменьшится в 3 раза. Предположим, что исходная молярная концентрация составляла: С = n/V = ½ = 0,5 М После разбавления в 3 раза концентрация составила: С = 0,5/3 = 0,1667 М Найдем количество воды, необходимое для получения раствора с концентрацией равной 0,1667, составив уравнение: С = n/V; 0,1667 = 1/(2+х); х = 4 Таким образом к раствору сахара необходимо прибавить 4 л воды. Ответ: V(воды) = 4 л Пример 6. Раствор, содержащий 5,0 г нелетучего вещества (B) В 25,0 г CCL4 (А), кипит при 81,5°С. Определить молярную массу растворенного вещества, если температура кипения чистого углерода равна 76,8°С, а эбуллиоскопическая постоянная КЭ= 5,02. Решение:tk= iКэСм Дtk= i * КЭ *m( B)*1000/МВ*m(A) МВ= КЭ *1000/Дtm(A)=5,02*5,0*1000/(81,5-76,8)*25,0=213,6 г/моль Ответ: 213,6 г/моль. Практическая часть В соответствии с заданием преподавателя решить задачи и выполнить тестовые задания. Задачи: Вычислить осмотическое давление 25%-ного раствора сахара при 150С ( =1,105 г/см3). Сколько граммов глюкозы С6Н12О6 следует растворить в 260 г воды для получения раствора, температура кипения которого превышает температуру кипения чистого растворителя на 0,050С? Давление пара воды при 250С составляет 3167Па. Вычислить для той же температуры давление пара раствора, в 450 г которого содержится 90 г глюкозы С6Н12О6. Температура кипения эфира 34,60С, а его эбуллиоскопическая константа 2,160С. Вычислить молекулярную массу бензойной кислоты, если известно, что 5%-ный раствор этой кислоты в эфире кипит при 35,530С. Вычислить давление пара 10% -ного водного раствора сахара С12Н22О11 при 1000 С. Раствор, содержащий 6,15 г растворенного вещества в 150 г воды, замерзает при - 0,930. Определить молекулярную массу растворенного вещества. При растворении 2,76 г. глицерина С3Н8О3 в 200 г воды температура замерзания понизилась на 0,2790. Определить молекулярную массу глицерина. Найдите относительную молярную массу неэлектролита, если его 10%-ный раствор кипит при 100,60С. Тестовые задания: Вариант 1 1) Осмотическое давление раствора неэлектролита можно рассчитать по формуле: а) P1V1=P2V2 б) 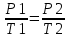 в) в)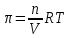 г) π г) π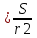 2) Математическое выражение закона разбавления Оствальда а) 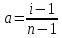 б) K б) K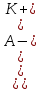 в) Ph=-lg[H+] г) в) Ph=-lg[H+] г)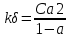 3) Для криоскопического определения молярной массы неэлектролита пользуются формулой: а) M= 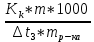 б) M= б) M=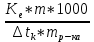 в)M= в)M=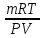 г) M= г) M=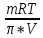 3) Математическое выражение, которое объединяет изотонический коэффициент со степенью диссоциации: а) a= 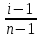 в) Kδ=Ca2 в) Kδ= в) Kδ=Ca2 в) Kδ=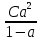 г) i= г) i= 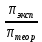 Вариант 2 1) Для растворов электролитов осмотическое давление выражается уравнением: а) π=CRT б) π= 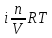 в) π= в) π=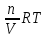 г) ∆P=P0 г) ∆P=P0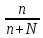 2) Укажите закон заведения Оставльда: а) Kδ= 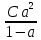 б) E=E0+ б) E=E0+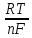 lgC в) lgC в)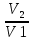 = =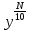 г) рН=-lg[H+] г) рН=-lg[H+]3) Снижение давление пара над раствором описывает уравнение: а)∆t3= 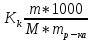 б)P= б)P=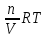 в) π=CRT г) ∆P= в) π=CRT г) ∆P=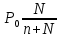 4) Укажите формулы неэлектролита: а) NH4OH б) C6H6 в) NaCl г )CH3COOH Практическая работа № 2 Решение задач на расчёт энтальпий химических реакций Цель: Закрепить теоретические знания по термохимии; научиться записывать термохимические уравнения, решать задачи на расчёт энтальпий химических реакций. Ход работы |
