методичка химия. Методические указания и варианты контрольных заданий к самостоятельной работе студентов по дисциплине Аналитическая химия для студентов хтф направления
 Скачать 234 Kb. Скачать 234 Kb.
|
РАСЧЕТЫ РЕЗУЛЬТАТОВ ТИТРИМЕТРИЧЕСКОГО АНАЛИЗАВ титриметрическом анализе рассчитывают массу определяемого вещества по известным объемам реагирующих веществ и известной концентрации одного или нескольких рабочих растворов. Прямое титрование – наиболее распространенный и удобный прием, когда к анализируемому раствору добавляют рабочий раствор. Массу определяемого вещества m(A) определяют в данном случае по формуле (6) 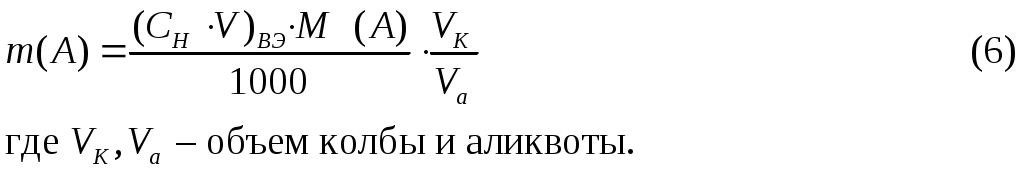 Титрование заместителя (косвенный метод) применяют, когда нет подходящей реакции или индикатора для прямого тестирования. В этом случае используют какую-либо реакцию, в которой анализируемое вещество замещают эквивалентным количеством другого вещества, а последнее титруют рабочим раствором. Массу определяемого вещества m(A) рассчитывают по формуле (6). Обратное титрование (титрование остатка) используют в тех случаях, когда прямое титрование невозможно или когда анализируемое вещество неустойчиво. При этом применяют два рабочих раствора. К раствору определяемого вещества (А) добавляют избыток рабочего раствора (В), а когда реакция заканчивается, остаток В титруют рабочим раствором С. Таким образом, масса определяемого вещества (А) рассчитывается в этом случае по формуле: Пример 3. При определении содержания CaO в образце мела навеску в 0,1500 г обработали 50,00 мл 0,0999 М HCI, избыток кислоты оттитровали 10,00 мл NaOH (К=1,01). Вычислить массовую долю CaO в образце мела. Решение: Из условия задачи видно, что определение CaO проводилось методом обратного титрования. Поэтому для расчета массы CaO в образце мела выбираем формулу (7): 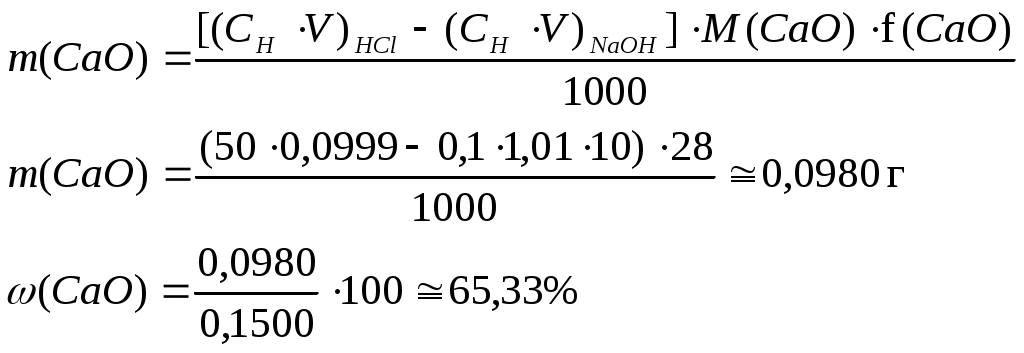 При выполнении расчетов следует учитывать некоторые математические правила. Если точность анализа не ограничивается заранее, то следует иметь в виду, что концентрация вычисляется до четвертой значащей цифры после запятой, процентное содержание – до сотых долей. Каждый результат не может быть точнее, чем это позволяют измерительные приборы, и математическими расчетами точность анализа повысить нельзя. Лишние цифры рекомендуется округлять. ЛИТЕРАТУРАВ.П. Васильев. Аналитическая химия, 1989, М.: Высшая школа, ч. 1, - 320 с. Ю.А.Золотов.Основы аналитической химии.М.: Высшая щкола,1999-351с. Вариант №1К 55,00 мл 0,1925 М HCl прибавили 50,00 мл раствора HCl с Т=0,02370 г/мл. Вычислить молярную концентрацию и титр полученного раствора. Вычислить молярную концентрацию и титр раствора HCl, если на титрование 0,4217 г буры израсходовано 17,50 мл этой кислоты. К раствору, содержащему NH4NO3 добавили 20 мл 0,1 н раствора NaOH. После нагревания (удаления выделившегося NH3), остаток NaOH оттитровали 5 мл 0,1 н. HCl. Вычислить содержание NH4NO3 в растворе. К навеске 0,1275 г K2Cr2O7 прибавили избыток КУ и выделившийся I2 оттитровали 22,85 мл Na2S2O3. Определить Т(Na2S2O3/I2) и молярную концентрацию раствора тиосульфата натрия. Вариант №2Какой объем 4,000 М HCl надо прибавить к 500,0 мл раствора HCl с Т(HCl/CaO)=0,08400 г/мл, чтобы получить раствор с Т(HCl/CaO)=0,09000 г/мл? Навеску H2C2O42H2O массой 0,6000 г растворили в мерной колбе вместимостью 100,0 мл. На титрование 20,00 мл полученного раствора израсходовали 18,34 мл NaOH. Определить молярную концентрацию раствора NaOH и его титр по H2C2O4. Хром, содержащийся в 1,87 г технического хромита (FeOCr2O3) окислили до шестивалентного состояния ( Для стандартизации раствора тиосульфата натрия 0,1000 г KBrO3 растворили в разбавленной HCl, добавили избыток КУ и выделившийся йод оттитровали, израсходовав 39,7 мл тиосульфата натрия. Рассчитать нормальную концентрацию Na2S2O3. |
