МУ бт микр. лаб 2014. Методические указания к лабораторным работам по дисциплине биотехнология микроорганизмов для студентов специальности 5В070100 Биотехнология
 Скачать 0.8 Mb. Скачать 0.8 Mb.
|
Правила работы в микробиологической лаборатории
В микробиологической лаборатории строго соблюдают ряд предосторожностей и поддерживают определенный режим. Работают в белых халатах, шапочках или косынках. На рабочем месте не должно быть лишних предметов. Все принадлежности располагают на определенных местах. Пробирки и колбы с культурами микроорганизмов должны иметь четкие надписи чернилами по стеклу, емкости с реактивами и растворами — этикетки. При работе со спиртовками остерегаются воспламенения паров спирта. Нельзя зажигать спиртовку от другой горящей спиртовки. Гасят пламя спиртовки только специальными колпачками. При воспламенении ватных пробок на них не дуют, так как это усиливает горение. Для предупреждения доступа воздуха горящие пробки вводят в пробирки, колбы или накрывают сверху полотенцем. До и после работы тщательно моют и дезинфицируют поверхность стола, на котором проводится исследование микроорганизмов. Микробная масса не должна загрязнять руки, стол и окружающие предметы. Петли, иглы, пинцеты после каждого соприкосновения с микроорганизмами прожигают в пламени спиртовки или газовой горелки и ставят в специальный штатив. Пролившуюся микробную взвесь обезвреживают, используя дезинфицирующие средства. По окончании работы загрязненную микроорганизмами посуду немедленно стерилизуют кипячением или автоклавированием, чтобы уничтожить живые клетки, и только после этого ее можно мыть. Поверхность плотных сред с микробами заливают дезинфицирующим раствором. Через сутки среды можно выбрасывать и мыть посуду. Использованные пипетки помещают в 3 %-ный раствор хлорамина, после чего моют и стерилизуют. Предметные и покровные стекла после работы помещают в дезинфицирующий раствор, затем тщательно моют в проточной воде. Посуду моют только в резиновых перчатках. Неаккуратное обращение с микроорганизмами может привести к образованию в воздухе микробного аэрозоля. При работе с бактерицидными лампами пользуются темными или простыми защитными очками. Нельзя смотреть на свет лампы незащищенными глазами, так как это может привести к потере зрения. Строгого соблюдения правил предосторожности требует обращение с аппаратами, работающими под давлением, напряжением или при высокой температуре. В лаборатории не разрешается курить, есть, пить, много ходить, вносить в нее посторонние предметы. Категорически запрещается выносить микробные культуры за пределы лабораторного помещения. Следует строго соблюдать личную гигиену — тщательно дезинфицировать и мыть руки с мылом после окончания работы и перед едой. В специальном журнале студенты и сотрудники делают запись о проведении инструктажа и ознакомлении с режимом работы в лаборатории. Контрольные вопросы: 1.Конструкция и принцип работы термостата. 2. Конструкция и принцип работы автоклава. 3. Конструкция и принцип работы сушильного шкафа и центрифуги. 4. Предназначение лабораторного рН-метра и рефрактометра. 5.Что представляют собой фильтры Зейтца. 6. Устройство электронного микроскопа. 7. Приготовление препаратов для электронной микроскопии. Лабораторная работа №2 Тема: Подготовка и стерилизация посуды, инструментов и приборов. Цель работы: Знать виды стерилизации посуды, инструментов и приборов. Задание:
Материалы и оборудование: Каждому студенту – пробирки по 2 шт., чашки Петри – 2 шт., пипетки 1 шт, колбы разные вместимостью 100 мл, 50 мл, 25 мл, бумага оберточная, фильтры бумажные и ватно-марлевые, вата и марля для приготовления ватно-марлевых пробок. Теоретическая часть Стерилизация стеклянной посуды Стеклянную посуду стерилизуют сухим жаром в сушильном шкафу при температуре 165-170 ºC в течение 1,5-2 ч или путем автоклавирования. Посуду перед стерилизацией тщательно моют и высушивают. Пробирки и колбы закрывают ватными пробками. Пробки завертывают по 10-20-40 шт в бумагу. На колбы надевают бумажные колпачки, предохраняющие горлышко от пыли. В концы пипеток, которые кладут в рот, вставляют ватные тампоны. Пипетки заворачивают в длинные полоски бумаги шириной 4-5 см и помещают в специальные металлические или картонные пеналы с крышкой. При работе пипетки вынимают из пакета только за верхний конец, где вставлен ватный тампон. Чашки Петри завертывают в бумагу каждую отдельно или вместе по 2-3 шт. Подготовленную посуду размещают на решетчатых полках в сушильном шкафу или загружают в автоклав, но не слишком плотно, чтобы обеспечить циркуляцию горячего воздуха или сухого насыщенного пара и равномерный нагрев посуды. Сушильный шкаф должен быть плотно закрыт. Если шкаф не снабжен терморегулятором, необходимо все время следить за температурой. Повышать температуру более 175 ºC не следует, так как бумага и пробки начинают разрушаться. Чтобы предохранить посуду от растрескивания, по окончании стерилизации сушильный шкаф охлаждают до 100-70 ºC, после чего посуду можно вынимать. Для сохранения стерильности посуду разворачивают непосредственно перед работой. Стерилизация инструментов и приборов Для стерилизации мелких металлических инструментов (петли, иглы, ланцеты, пинцеты, ножницы) применяют прокаливание в пламени горелки или спиртовки (фламбирование) непосредственно перед использованием. На пламени кратковременно обжигают горлышки пробирок, колб, бутылок, а также ватные пробки при пересевах культур и разливе сред. В пламени погибают и вегетативные клетки, и споры микроорганизмов. Приборы для культивирования микроорганизмов, детали к этим приборам, резиновые пробки, соединительные шланги стерилизуют автоклавированием, предварительно завернув в плотную бумагу. Чистые центрифужные пробирки, изготовленные из термолабильных пластмасс, стерилизуют ультрафиолетовым облучением (мощность лампы 15 Вт, длительность обработки устанавливают экспериментально) и хранят в стерильной посуде. Контрольные вопросы:
Лабораторная работа № 3 Тема: Питательные среды и техника их приготовления. Цель работы: Ознакомление с техникой приготовления и основными компонентами, которые используются для приготовления питательных сред. Задание:
Материалы и оборудование: рефрактометр, рН – метр, плитки электрические 2 шт, кастрюли для варки мяса, колбы емкостью 250-500 мл термостойкие, бумажные фильтры, емкость для выращивания солода, дистиллированная вода, раствор едкого натра 1%, йод медицинский, мясо говядина 500 гр, пептон 50 гр, поваренная соль 50 гр. Теоретическая часть. К питательным средам предъявляются следующие требования: 1. Они должны содержать источники азота и углерода, неорганические соединения, микроэлементы, а также факторы роста, витамины, в основном группы В. В качестве универсального источника азота используют пептоны. Пептоны – это продукты гидролизного расщепления мяса или казеина. В них содержатся полипептиды, аминокислоты и основные минеральные вещества. В качестве универсального источника углерода в питательные среды добавляют углеводы (сахара) – глюкозу, лактозу, сахарозу; органические кислоты – молочную, лимонную и др.; многоатомные спирты – манит, глицерин, сорбит и др. 2. Питательные среды должны иметь определенную реакцию среды. Так, для большинства кокковых, гнилостных и патогенных микроорганизмов оптимум рН 7,0-7,4, плесневые грибы, дрожжи, молочнокислые микроорганизмы лучше развиваются при рН 6,0. 3. Питательная среда должна быть стерильной, т.е. не содержать микроорганизмов. 4. Питательная среда должна быть влажной, так как питание у микроорганизмов осуществляется по законам диффузии и осмоса. Многие среды должны быть прозрачными для того, чтобы можно было различить на них рост микроорганизмов и наблюдать за физиологическими изменениями, происходящими в результате их жизнедеятельности. Стерилизация питательных сред Стерилизацией или обеспложиванием (sterilis - бесплодный)называют полное уничтожение вегетативных клеток микроорганизмов и их спор в каком – либо материале (питательной среде, посуде, приборе, инструменте, перевязочном материале и т.д.). Выбор способа стерилизации зависит от свойств стерилизуемого объекта. Автоклавирование. Питательные среды стерилизуют главным образом в автоклавах насыщенным паром под давлением 0,05-0,2 МПа. Температура насыщенного пара при различных давлениях показана ниже:
Автоклав работает при высоких давлениях и температурах и к его обслуживанию допускаются только специально подготовленных лиц. При работе с автоклавом строго соблюдают правила, указанные в прилагаемой к аппарату инструкции. Подготовку автоклава к работе и процесс стерилизации осуществляют следующим образом. Тщательно проверяют исправность аппарата. В водопаровую камеру через воронку заливают дистиллированную воду до тех пор, пока ее уровень не дойдет до верхней метки водомерного стекла. После этого кран перекрывают. Питательные среды в пробирках или колбах, закрытых ватными пробками с бумажными колпачками, завернутую в бумагу посуду и другой стерилизуемый материал помещают на решетчатую подставку и накрывают бумагой. Автоклав закрывают крышкой, равномерно завинчивают зажимы, не допуская перекосов и не плотностей. Открывают спускной кран пароотводной трубы, включают автоклав в электрическую сеть и начинают прогрев. Образующийся пар должен вытеснить из автоклава весь воздух, так как температура чистого насыщенного пара выше температуры смеси пара с воздухом. После полного удаления воздуха и влажного пара непрерывную струю свистящего сухого пара выпускают еще 10-15 мин и перекрывают спускной кран. Пар выпускают через резиновый шланг, надетый на пароотводную трубку и опущенный в сосуд с водой. За повышением рабочего давления в автоклаве следят по манометру. Время стерилизации отсчитывают с момента установления необходимого давления. Излишний пар, образующийся в результате нагрева, выпускается предохранительным клапаном, как только стрелка манометра переходит черту требуемого давления. По истечении времени стерилизации автоклав выключают из электрической сети, нагревание прекращают и ждут момента, когда давление по манометру упадет до нуля. Только после этого можно открыть спускной кран, осторожно выпустить из автоклава остаток пара, затем отвинтить и откинуть крышку. Если спускной кран открыть раньше, чем стрелка займет нулевое положение, может произойти бурное вскипание жидких сред и смачивание ватных пробок. Резкое снижение давления может привести к выталкиванию пробок и даже выплескиванию жидкости из сосудов. Нельзя преждевременно отвинчивать и открывать крышку, так как вырывающиеся струи пара могут вызвать ожоги обслуживающего персонала и окружающих. Автоклаву дают несколько остыть и вынимают простерилизованный материал. Оставлять автоклав закрытым до полного охлаждения не рекомендуется, так как пар конденсируется и влага пропитывает ватные пробки. В нерабочем состоянии автоклав держат открытым и свободным от воды. Для проверки стерильности питательные среды помещают на 2-3 сут в термостат при 30ºC, и если обнаруживают рост микроорганизмов, среды готовят заново. Для контроля соответствия показаний манометра температуре, внутри автоклава пользуются веществами, имеющими определенную точку плавления. Например, бензонафтол плавится при 110 ºC, антипирин – при 113 ºC, резорцин и сера – при 119 ºC, бензойная кислота – при 120 ºC. В стеклянную ампулу или пипетку Пастера длиной 5-6 см, запаянную с одного конца, насыпают одно из указанных веществ, и прибавляют несколько кристаллов сухого анилинового красителя (фуксина, сафранина или метиленового синего). Трубочку запаивают и помещают в автоклав между стерилизуемыми предметами. Если температура соответствует давлению, контрольное вещество расплавится и окрасится в цвет взятого красителя. Температура и продолжительность автоклавирования определяются составом питательных сред и их рН. Субстраты, легко разрушающиеся при нагревании до 120 ºC, стерилизуют при 0,05 МПа. При кислой реакции некоторые вещества, входящие в состав питательной среды, в процессе автоклавирования гидролизуются. Во избежание этих явлений, растворы некоторых компонентов (сахара, многоатомные спирты, витамины, аминокислоты) стерилизуют отдельно при значениях рН, обеспечивающих их устойчивость, и добавляют после стерилизации. Такой способ обеспложивания называется раздельной стерилизацией. Стерилизация текучим паром (дробная стерилизация). Данный способ применяют для стерилизации питательных сред, изменяющих свой состав и свойства под действием температур выше 100 ºC. Сущность дробной стерилизации состоит в том, что нагревание среды (или ее компонентов) проводят при 100 ºC три раза по 30 мин трое суток подряд. Кратковременное прогревание среды кипячением уничтожает в основном термолабильные вегетативные клетки микроорганизмов. Поэтому между нагреваниями питательные среды выдерживают при комнатной температуре (или в термостате при 30 ºC) и дают возможность прорасти оставшимся жизнеспособным спорам. Образовавшиеся из термоустойчивых спор вегетативные клетки погибают при повторном кипячении. Продолжительность нагревания может быть увеличена до 45-60 мин, что зависит от объема жидкости. Дробную стерилизацию питательных сред проводят в аппарате Коха или в автоклаве с закрытой, но не завинченной крышкой. Так как нагревание ведут в парах кипящей воды, способ называют стерилизацией текучим паром. Дробной стерилизации подвергают среды, в состав которых входят сахара, многоатомные спирты, желатин. Стерилизация путем прерывистого нагрева была предложена английским физиком Джоном Тиндалем и получила название тиндализации. Среды необратимо изменяющиеся при кипячении, осторожно прогревают при более низкой температуре: при 60-80 ºC в течение 5 сут подряд по 30-60 мин или при 56-58 ºC на протяжении 6-7 сут, в первые сутки – 2 ч, в последующие – по 1 ч. Температурную обработку сред ведут на водяной бане или в ультратермостате, где температура автоматически поддерживается на определенном уровне с помощью специального устройства. В промежутках между нагревами среды выдерживают в обычном термостате при 30 ºC. Пастеризация. Пастеризация, или неполная стерилизация, предложена Луи Пастером. Она предназначена для уничтожения в основном аспорогенных микроорганизмов однократным прогреванием при температуре 60-75 ºC и выдержке 15-30 мин или при 80 ºC в течение 10-15 мин. Пастеризации подвергаются продукты и среды, которые при воздействии боле высоких температур претерпевают глубокие изменения, теряют качество и питательную ценность. Пастеризацию широко применяют в пищевой промышленности. Стерилизация фильтрованием. Стерилизацию жидких питательных сред, не выдерживающих даже незначительного нагревания, производят фильтрованием через специальные мелкопористые бактериальные фильтры. На бактериальных фильтрах задерживаются механические взвешенные примеси, в том числе и клетки микроорганизмов. Исключение составляют вирусы и фаги. Фильтрованию подвергают среды с белками, антибиотиками, витаминами, летучими веществами, а также культуральные жидкости с целью освобождения от клеток и сохранения всех продуктов метаболизма в неизменном виде. Фильтры изготавливают из положительно заряженных материалов. Техника приготовления основных питательных сред Для культивирования микробов в лабораторных условиях готовят питательные среды с учетом потребности в питательных веществах каждого вида в отдельности. Питательная среда в своем составе должна содержать углерод, водород, кислород, азот, фосфор, серу, магний, железо, микроэлементы и биостимуляторы роста. Различают питательные среды естественные (молоко, яйца, картофель и т. п.), искусственные, приготовленные из продуктов животного или растительного происхождения, и синтетические (среды Чапека, Сабуро). По консистенции среды могут быть жидкими, полужидкими и плотными. Для приготовления плотных сред в жидкие среды добавляют агар-агар или желатин. Агар-агар представляет собой продукт переработки высушенных морских водорослей рода анфельция, состоящий в основном из полисахаридов. В холодной воде агар-агар набухает и размягчается, в горячей (90—100° С) расплавляется, образуя клееобразную массу. Застывает агар-агар при 40° С, образуя студень. Как питательное вещество агар-агар микробами не используется. Желатин получают путем вываривания кожи, костей и сухожилий животных. При нагревании с водой желатин образует коллоидный раствор, застывающий при 18—20° С в однородный коллоидный студень и расплавляющийся при 25—27° С. В бактериологической практике обычно применяют среды из продуктов животного и растительного происхождения, содержащие пептоны, экстрактивные вещества мяса, кровь, сыворотку, сусло, углеводы и т. п. Необходимые питательные вещества должны содержаться в среде в доступной форме и в определенных соотношениях. Питательные среды должны быть стерильными (должно быть обеспечено получение чистых культур микроорганизмов), прозрачными (выросшие на них микроорганизмы должны быть хорошо видны и иметь определенную величину рН). Хранят готовые среды в прохладном месте, в плотно закрывающихся шкафах или ящиках, что предохраняет их от быстрого высыхания. Надолго хранившихся средах микробы развиваются слабо или совсем не растут. Питательные среды принято делить на три группы: 1) стандартные (универсальные) — предназначаются для культивирования большинства микробов; 2) специальные элективные, избирательные — предназначаются для выращивания только определенного вида микробов, рост других микроорганизмов на этих средах подавляется; 3) дифференциально-диагностические — предназначаются для изучения биохимических свойств микробов с целью дифференцирования различных видов микроорганизмов. СТАНДАРТНЫЕ ПИТАТЕЛЬНЫЕ СРЕДЫ Мясопептонный бульон (МПБ). В состав МПБ входят мясная вода, пептон и поваренная соль. Для приготовления мясной воды используют свежее мясо крупного рогатого скота или лошадей. Мясо освобождают от костей, жира и сухожилий и пропускают через мясорубку. Полученный фарш заливают водой из расчета 1:2 (например, 1 кг фарша заливают 2 л воды). Ставят на 18—20 ч в прохладное место (4—6° С), затем кипятят в течение часа и фильтруют через ватно-марлевый фильтр. Фарш отжимают, к фильтрату добавляют воды до первоначального объема, разливают его по колбам или бутылям и стерилизуют в автоклаве при избыточном давлении 0,1 МПа в течение 30 мин. Или заливают двукратным количеством воды, кипятят в течение часа, дают остыть, фильтруют через ватно-марлевый фильтр. Фарш отжимают, к фильтрату добавляют воды до первоначального объема и стерилизуют его в течение 30 мин при избыточном давлении 0,1 МПа. При варке мясной воды на поверхности жидкости появляется некоторое количество жира, который необходимо снять. Для приготовления МПБ к мясной воде добавляют 1% пептона и 0,5% химически чистой поваренной соли, кипятят 10 мин, фильтруют через бумажный фильтр, устанавливают рН 7,2—7,4 прибавлением щелочи или двууглекислой соды и снова кипятят 10 мин. Профильтрованный бульон должен быть цвета соломы и совершенно прозрачным. Бульон разливают по пробиркам и колбам, закрывают ватными пробками, пробки обвязывают пергаментной бумагой и стерилизуют 20—30 мин при избыточном давлении 0,1 МПа. Мясопептонный агар (МПА). К мясопептонному бульону добавляют 2—3% нарезанного агар-агар; нагревают в автоклаве или в текучепаровом аппарате до полного расплавления агар-агара. Устанавливают рН 7,2—7,4. Дают остыть до 50° С, осветляют путем добавления белка одного куриного яйца, разведенного двойным количеством дистиллированной воды . Ставят на 20 мин в автоклав при избыточном давлении 0,1 МПа для свертывания белка и тем самым осветляют среду, фильтруют через слой марли и ваты (рис. 1). Можно пользоваться другой методикой. К мясопептонному бульону добавляют 2—3% нарезанного агар-агара, нагревают до полного расплавления его. После остывания застывший плотный агар вынимают из посуды и отрезают нижнюю часть, содержащую осадок. Затем вновь расплавляют, разливают по пробиркам и стерилизуют при избыточном давлении 0,1 МПа в течение 20 мин. Необходимо, чтобы прозрачность агара позволяла свободно читать напечатанный на бумаге шрифт при наложении на него бактериологической чашки с агаром, налитым слоем толщиной 20 мм. После стерилизации для того, чтобы агар в пробирках застыл столбиком, их оставляют в вертикальном положении. Если нужно приготовить агар скошенной формы, пробирки с расплавленным агаром располагают в наклонном положении так, чтобы среда заняла две трети пробирки, и в таком виде оставляют до застывания среды (рис. 2). При этом пробирки необходимо предохранять от действия солнечного света. 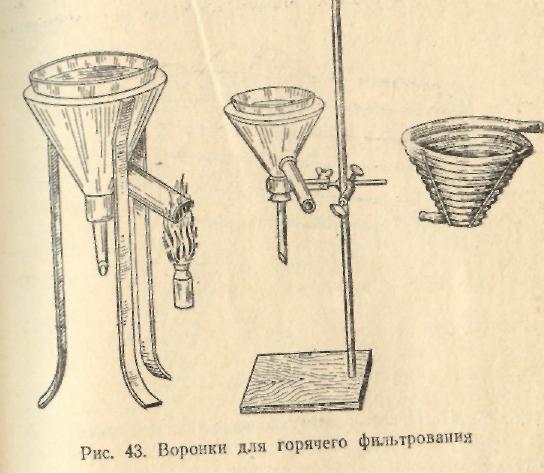  Мясопептонный желатин (МПЖ). К мясопептонному бульону добавляют 10% зимой и не менее 18—20% летом измельченного желатина и подогревают в текучепаровом аппарате до полного растворения желатина. Подщелачивают среду до рН 7,2 путем добавления 10%-ного раствора NaОН. После охлаждения до 60° С осветляют яичным белком (в таком же количестве, как и для МПА), подогревают в текучепаровом аппарате 20—30 мин. В горячем виде фильтруют через ватный или марлевый фильтр и разливают по пробиркам. Стерилизуют дробно по 15—20 мин три дня подряд при температуре 100° С. Картофельная среда. Отбирают крупный картофель, промывают щеткой под водопроводной водой, удаляют кожуру и поврежденные места. Клубни снова моют под струей водопроводной воды и помещают в 1%-ный раствор двууглекислой соды на 2—3 ч для нейтрализации кислой среды. Из картофеля пробником вырезают столбики, диаметр которых должен соответствовать ширине пробирок. Столбики помещают в чашки с водой и разрезают по диагонали на две части, подсушивают фильтровальной бумагой и половинки помещают в пробирки с перехватом внизу (в нижнюю часть этих пробирок стекает вода, выделяемая при стерилизации). За неимением специальных пробирок используют обычные пробирки, поместив на дно стеклянные или деревянные палочки, а на них — картофель. Стерилизуют при избыточном давлении 0,1 МПа в течение 20—25 мин. Пептонная вода. Приготовляют ее различными способами. В 1 л дистиллированной воды растворяют 5 г химически чистой поваренной соли и 10 г пептона и стерилизуют в автоклаве при избыточном давлении 0,1 МПа в течение 10 мин. Для выращивания гнилостных бактерий пептонную воду готовят несколько иначе: в 1 л дистиллированной воды растворяют 30 г пептона. Стерилизуют при избыточном давлении 0,1 МПа в течение 20 мин. Концентрированная глюкозопептонная среда. В 1 л воды растворяют 100 г пептона и 50 г поваренной соли, нагревают до кипения, отфильтровывают, добавляют 50 г глюкозы, устанавливают рН 7,4— 7,6 (с помощью насыщенного раствора углекислой соды), разливают по 10 мл в колбы и склянки емкостью 250 мл с поплавками и стерилизуют 3 дня по 30 мин текучим паром. Разведенная глюкозопептонная среда. В 1 л воды растворяют 10 г пептона и 5 г поваренной соли, нагревают до кипения и добавляют 5 г глюкозы. Устанавливают рН среды 7,4—7,6, разливают по 10 мл в пробирки с поплавками и стерилизуют 3 дня по 30 мин текучим паром. Сухой питательный агар. Содержит рыбный или мясной бульон, агар, хлористый и фосфорнокислый натрий. К 5 г порошка агара добавляют 100 мл холодной дистиллированной воды. Тщательно взбалтывают и нагревают при помешивании до полного растворения агара, не допуская пригорания. По мере надобности раствор фильтруют, разливают по пробиркам, стерилизуют при избыточном давлении 0,1 МПа в течение 20 мин. СПЕЦИАЛЬНЫЕ (ЭЛЕКТИВНЫЕ) ПИТАТЕЛЬНЫЕ СРЕДЫ Среды для выращивания анаэробных микробов. Мясопептонный печеночный бульон Кита - Тароцци (МППБ). Свежую или замороженную печень (лучше крупного рогатого скота) режут на мелкие куски, заливают равным по массе количеством водопроводной воды, варят в течение часа, фильтруют через вату и добавляют к 1 части полученного экстракта 3 части мясопептонного бульона. Смесь нагревают до кипения, добавляют химически чистую поваренную соль (на 1 л среды 1,25 г) и доводят рН до 7,6—7,8, после чего кипятят в течение 15 мин и фильтруют через бумажный или увлажненный ватный фильтр. К профильтрованному бульону добавляют мелко нарезанные кусочки (по 1,5— 2 г) печени, из расчета на 1 л бульона 100 г печени (печень предварительно очищают от пленок и промывают водой). В пробирку помещают несколько таких кусочков, наливают высоким столбиком 7—10 мл бульона, на поверхность его наслаивают вазелиновое или парафиновое масло. Бульон с кусочками печени стерилизуют под избыточным давлением 0,1 МПа в течение 30 мин. С целью удаления из пробирки кислорода перед посевом среду кипятят 10 мин и быстро охлаждают водой. Полужидкий агар для анаэробов. К МПБ добавляют 0,25—0,75% агар-агара и 1% глюкозы; рН среды 7,4. Среду разливают высокими столбиками в пробирки. Стерилизуют дробно текучим паром по 15—20 мин в течение 3 дней. Среды для выращивания молочнокислых бактерий. Молоко (цельное). Нагревают до кипения. Наливают в тубусную склянку и ставят на 10—20 ч в холодное место для отстаивания сливок. По истечении этого времени через кран тубуса разливают обезжиренную часть молока по пробиркам, закрывают ватными пробками. Стерилизуют дробно при 100° С три дня по 20 мин или при 112° С однократно 30 мин. Обезжиренное молоко. Для получения обезжиренного молока цельное молоко сепарируют и далее поступают так же, как при использовании цельного молока. Гидролизованное молоко (по Богданову). Берут 1 л прокипяченного и остуженного до 45° С обезжиренного молока, устанавливают рН 7,6—7,8, добавляют 0,5 г порошка панкреатина (разведенного предварительно в небольшом количестве теплой воды) или 2—3 г измельченной поджелудочной железы и через несколько минут 5 мл хлороформа. После этого бутыль тщательно встряхивают, плотно закрывают корковой пробкой и помещают на 3 суток в термостат при температуре 40° С при ежедневном встряхивании жидкости. По истечении указанного срока с целью удаления хлороформа бутыль открывают, жидкость фильтруют и разбавляют в 2—3 раза водопроводной водой. Доводят рН среды до 7,0— 7,2 и стерилизуют. Агар из гидролизованного м о л о к а. К гидролизованному молоку прибавляют 1,5—2% агара, расплавляют, разливают по пробиркам и стерилизуют под избыточным давлением 0,1 МПа в течение 15 мин. На этой среде хорошо растут молочнокислые палочки. Сывороточный агар. На 100 мл водопроводной воды берут 7,5 г агара, кипятят до полного растворения, добавляют воды до первоначального объема (т. е. в объеме, равном объему испарившейся воды), прибавляют 400 мл заранее приготовленной молочной сыворотки, подвергают действию текучего пара в течение 30 мин, фильтруют через слой ваты, разливают по пробиркам и стерилизуют под давлением 0,05 МПа в течение 30 мин. Капустная среда. 200 г измельченной капусты (или люцерны) заливают 100 мл воды и кипятят в кастрюле 10 мин, отжимают через двойной слой марли. Полученную жидкость фильтруют и разводят в 2 раза водопроводной водой. Добавляют 2% глюкозы и 1% пептона, разливают по пробиркам и стерилизуют три избыточном давлении 0,05 МПа в течение 15 мин. Среда для выращивания осмофильных дрожжей. Примерно в 1 л дистиллированной воды вносят 200 г предварительно подогретого меда, 1 г двуфосфорнокислого калия, 0,5 г сульфата магния, 0,5 г виннокислого аммония, 0,1 г хлористого натрия и 0,1 г хлористого калия. Все компоненты смешивают и стерилизуют под избыточным давлением 0,1 МПа в течение 20 мин. Среда для выращивания галофилов. Используют обычные мясопептонные среды с добавлением от 10—15 до 20—30% поваренной соли. Кроме того, при изготовлении плотных питательных сред увеличивают и процентное содержание агара. Стерилизацию проводят под избыточным давлением 0,1 МПа в течение 20 мин. Среды обогащения. Среда Мюллера. К 4,5 г химически чистого мела, предварительно простерилизованного сухим жаром, добавляют 90 мл МПБ и стерилизуют под избыточным давлением 0,1 МПа в течение-20 мин. Готовят: а) раствор гипосульфита (50 г чистого кристаллического гипосульфита заливают до 100 мл дистиллированной водой, стерилизуют текучим паром в течение 30 мин); б) раствор йода (20 г металлического йода и 25 г йодистого калия заливают до 100 мл дистиллированной водой). Перед посевом к бульону с мелом стерильно добавляют 10 мл раствора гипосульфита и 2 мл раствора йода. При добавлении каждого ингредиента смесь взбалтывают. Разливают по стерильным пробиркам или колбам. Среда Киллиана. К 100 мл обычного МПБ стерильно добавляют перед использованием 1 мл водного раствора (1:1000) бриллиантового зеленого. ДИФФЕРЕНЦИАЛЬНО-ДИАГНОСТИЧЕСКИЕ (ЦВЕТНЫЕ) ПИТАТЕЛЬНЫЕ СРЕДЫ Среда Эндо. К 100 мл нейтрального расплавленного 3%-ного мясопептонного агара прибавляют 1 мл 10%-ного водного раствора кристаллического углекислого натрия, выдерживают в текучепаровом аппарате в течение 10 мин при температуре 100° С, охлаждают до 60° и стерильно прибавляют 1 г химически чистой лактозы, растворенной в 5 мл стерильной воды, и смесь фуксина с безводным сульфитом натрия. Смесь готовят следующим образом. Растворяют 0,5 г сульфита натрия в 5 мл стерильной воды и добавляют к 1 мл насыщенного спиртового раствора основного кристаллического фуксина до тех пор, пока жидкость не станет бесцветной или слегка розоватой. Обесцвеченную смесь фуксина с сульфитом добавляют к расплавленному агару, и последний принимает розоватый цвет. После тщательного перемешивания (следят за тем, чтобы не образовывалась пена) среду разливают по чашкам. При остывании среда делается цветной, в толстых слоях имеет розоватый оттенок. На этой среде можно легко отличить кишечную палочку, паратифозных бактерий. Готовят среду перед посевом. Во избежание покраснения ее защищают от света. Выпускается в виде сухого порошка. Способ приготовления указывается на этикетке. Среда Гисса. Для изготовления индикатора Андредэ берут 100 мл дистиллированной воды, 0,5 г фуксина кислого и 16 мл 4%-ного водного раствора едкого натра. Выдерживают на водяной бане 10 мин. Хранят в темном месте. Среду с индикатором Андредэ приготовляют следующим образом. Готовят пептонную воду. Для этого берут 1% пептона и 0,5% поваренной соли на определенный объем дистиллированной воды. Кипятят до растворения пептона, фильтруют через бумажный складчатый фильтр, устанавливают рН 7,0—7,2. После подщелачивания 10%-ным раствором NаОН снова кипятят в течение 10 мин, фильтруют и к готовой 1%-ной пептонной воде (рН 7,0—7,2) добавляют 1% индикатора Андредэ. К среде с индикатором добавляют требуемые углеводы или многоатомные спирты в количестве 0,5% — 1% (лактозу, глюкозу, сахарозу, маннит, дульцит и др.). Среды разливают по пробиркам, снабженным для учета образования газа бродильными трубочками. Вместо трубочек иногда помещают кусочки ваты — 0,02 г на пробирку. Проводят дробную стерилизацию при температуре 100° С в течение 20 мин три дня подряд. Правильно приготовленная среда имеет соломенно-желтый цвет. Среда Кесслера. В 1 л водопроводной воды вносят 50 мл свежей бычьей желчи и 10 г пептона. Кипятят на водяной бане 15 мин, постоянно взбалтывая. После полного растворения среду фильтруют через вату и добавляют 10 г лактозы. Доводят рН до 7,7. К 1 л среды добавляют 4 мл 1 %-ного водного раствора генцианвиолета и разливают в пробирки с поплавками. Стерилизуют в автоклаве при избыточном давлении 0,1 МПа в течение 15 мин. ОПРЕДЕЛЕНИЕ рН ПИТАТЕЛЬНЫХ СРЕД Для культивирования микробов на искусственных питательных средах особое значение имеет концентрация водородных ионов, так как каждый вид микроба может развиваться только при определенной кислотности или щелочности. Большинство бактерий приспособлено к росту и размножению в нейтральной или слабощелочной среде (рН 7,0—7,6). Для определения реакции питательной среды применяют два метода: электрометрический (с помощью рН-метра) и колориметрический. В лабораторной практике чаще всего используется наиболее простой колориметрический метод по Михаэлису, основанный на изменении цвета индикатора вследствие диссоциации его в зависимости от концентрации водородных ионов в среде. При определении рН по Михаэлису применяют индикаторы нитрофенолового ряда. Ввиду того, что для выращивания микробов готовят среды слабощелочной реакции, при определении рН среды в качестве индикатора используют метаннитрофенол, который позволяет определять рН в пределах от 6,8 до 8,4. Растворы индикатора готовят на дистиллированной воде и хранят во флаконах из темного стекла с притертой пробкой. Контрольные вопросы:
Лабораторная работа № 4 |
