Курс_Модел2_2 (1). Методические указания к выполнению курсовой работы дисциплины моделирование технологических процессов и основы оптимизации для студентов, обучающихся по направлению
 Скачать 3.02 Mb. Скачать 3.02 Mb.
|
|
Регулирование состава очищенного газа на выходе абсорбционной установки. Отклонения качественных характеристик очищенного газа от требуемых значений возможны в результате наличия возмущений на входе установки (состав, расход, теплофизические свойства исходной газовой смеси и абсорбента), а также отклонений (температура и давление в аппарате). В этой связи целесообразно применение системы регулирования степени извлечения изменением расхода абсорбента и его температуры. Для поддержания температуры абсорбента его подают в холодильный аппарат, в котором он охлаждается в результате переноса тепла через поверхность стенок холодному теплоносителю (хладагенту). Необходимое количество хладагента G определяется путем расчета тепловой нагрузки на холодильник: 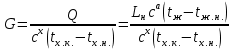 где Q – тепловая нагрузка на холодильник (кВт); cа, cх – массовые теплоемкости абсорбента и хладагента при средней температуре (кДж/(кг·К)); tж, tж.н.–начальнаятемпература (на входе холодильника) и конечная температура (на входе абсорбера) абсорбента; tх.к, tх.н. –конечнаяи начальная температуры хладагента. 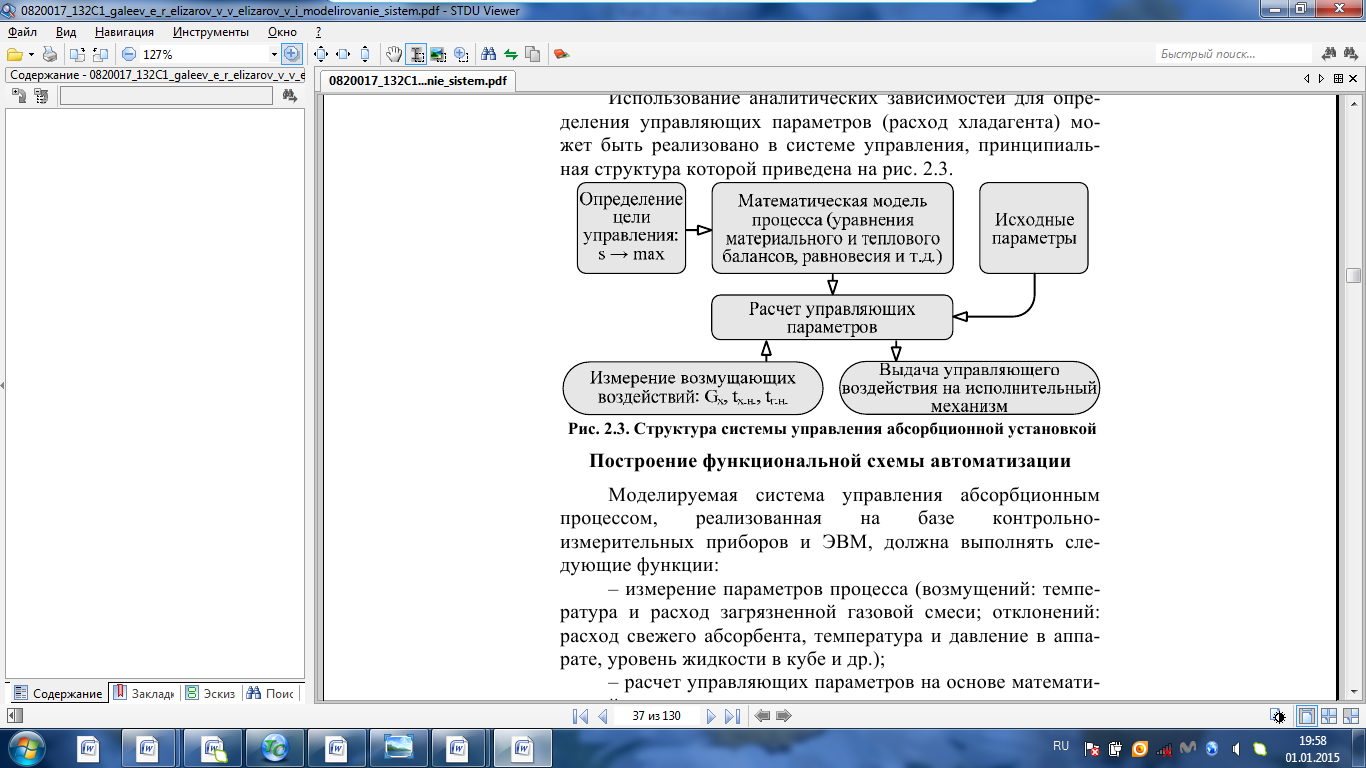 Рис. 2.3. Структура системы управления абсорбционной установкой Использование аналитических зависимостей для определения управляющих параметров (расход хладагента) может быть реализовано в системе управления, принципиальная структура которой приведена на рис. 2.3. Варианты заданий 2а – 2к Тема курсовой работы: моделирование системы управления процессом абсорбции на основе анализа статических режимов работы установки. Задание: – для процесса абсорбции паров н-гексана из смеси с метаном парафинистым поглотительным маслом определить зависимость степени извлечения гексана от значений управляющих параметров процесса (расход абсорбента, расход хладагента в теплообменник для охлаждения абсорбента); – определить оптимальный технологический режим работы установки, обеспечивающий максимальную степень извлечения гексана, построить профили концентрации и температуры по высоте абсорбционной колонны; – зависимость степени извлечения от значений управляющих параметров представить в табличном и графическом виде; – разработать презентацию курсовой работы и подготовить доклад к защите. Исходные данные и допущения: 1) параметры исходной газовой смеси (гексан – метан): концентрация гексанаyн, расход Vн, температура tг.н.,теплота испарения гексанаrрm, мольная теплоемкость газообразного метана cmи, мольная теплоемкость жидкого гексанаcmp; 2) параметры абсорбента (поглотительное масло): концентрация гексанаxн, расход Lнmn÷Lнmax,начальная температура tж, требуемая температура на входе абсорбера tж.нmin ÷ tж.нmах, мольная теплоемкость cmа, молярная масса Mка; 3) пренебречь зависимостью теплоемкости и теплоты испарения компонентов от температуры (в расчетах использоватьзначения этих параметров при температуре 30 оС); 4) количество тарелок в абсорбере N; 5) кпд тарелки η (табл. 2.1); 6) зависимость концентрации распределяемого компонента в газовой фазе, равновесной с жидкостью, от температуры жидкости tj (оС) и концентрации xj на j-ой ступени: 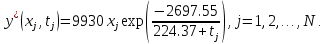 Таблица 2.1
III. МОДЕЛИРОВАНИЕ СИСТЕМЫ УПРАВЛЕНИЯ ПРОЦЕССОМ РЕКТИФИКАЦИИ План выполнения работы 1. Изучение процесса ректификации: – основные определения и закономерности; – математическая модель; – алгоритм расчета статической модели. 2. Постановка задачи моделирования в соответствии с заданием на курсовую работу. 3. Разработка моделирующей программы: – алгоритм процедуры расчета установки в области изменения состава [Fxmin,Fxmax] и расхода [Fmin,Fmax] исходной смеси; – код моделирующей программы. 4. Анализ и представление результатов моделирования. 5. Анализ процесса ректификации с точки зрения задач управления. 6.Разработка презентации курсовой работы (не более 8 слайдов, в т.ч. постановка задачи, математическая модель процесса, алгоритмы расчета, результаты моделирования и др.). 7. Подготовка доклада к защите (длительность доклада не более 3-4 мин.). Рекомендуемая литература: [1, 5 – 8, 10, 11]. Краткое описание процесса Ректификация – процесс разделения жидких и паро-жидкостных смесей путем многократного частичного испарения жидкости и конденсации паров. Процесс осуществляется путем контакта потоков пара и жидкости, имеющих различную температуру, и проводится обычно в колонных аппаратах (рис. 3.1). 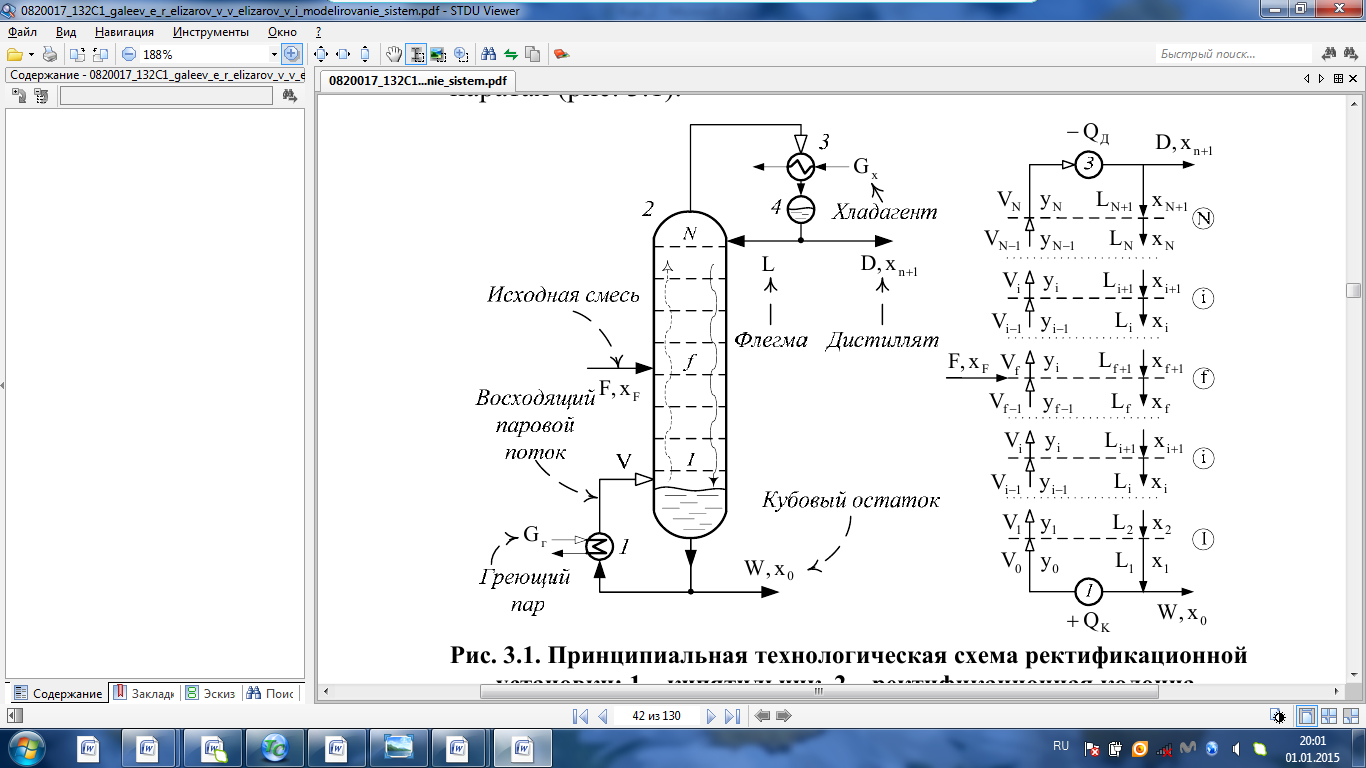 Рис. 3.1. Принципиальная технологическая схема ректификационнойустановки: 1 – кипятильник, 2 – ректификационная колонна, 3 – дефлегматор, 4 – флегмовая емкость При каждом контакте из жидкости испаряется преимущественнолегколетучий, или низкокипящий, компонент (НК), которым обогащаются пары, а из паров конденсируется преимущественно труднолетучий, или высококипящий, компонент (ВК), переходящий в жидкость. Такой двусторонний обмен компонентами, повторяемый многократно, позволяет получить, в конечном счете, пары, представляющие собой почти чистый НК. Эти пары после конденсации в отдельном аппарате даютдистиллят (ректификат) ифлегму – жидкость, возвращаемую для орошения колонны и взаимодействия с поднимающимися парами. Пары получают путем частичного испарения снизу колонны остатка, являющего почти чистым ВК [1, 8]. Процесс ректификации широко применяется в различных областях химической, нефтехимической и пищевой промышленности для выделения компонентов в чистом виде. Процесс ректификации может осуществляться в аппаратах с непрерывным контактом фаз (насадочных колоннах) либо в аппаратах со ступенчатым контактом фаз (тарельчатые колонны). При рассмотрении непрерывной ректификации будем пренебрегать разделяющим действием кипятильника и дефлегматора, т.е. кипятильник и дефлегматор будем считать аппаратами соответственно полного испарения и полной конденсации. Расчет ректификационной установки заданной конструкции при известных характеристиках исходного сырья проводится с целью определения расходов флегмы и дистиллята, а также тепловой нагрузки на теплообменное оборудование. Математическое описание процесса ректификации Процесс массообмена протекает на каждой тарелке вследствие разности рабочих и равновесных концентраций НК в паре и в жидкости. По мере движения к кубу колонны жидкость обедняется (исчерпывается), а пар при движении вверх обогащается (укрепляется) НК. При построении математической модели примем следующие допущения: – исходная бинарная смесь и флегма подаются в колонну в виде жидкости при температуре кипения; – расход пара по высоте колонны постоянный: Vi= V, (i = 0,1,..., N); – расход жидкости по высоте укрепляющей секции колонны постоянный: Li= L, (i=f +1,f+2,...,N); – расход жидкости по высоте исчерпывающей секции колонны постоянный: Li=F+L, (i =1,2,...,f); – в паровой фазе в зоне массообмена принимается полное вытеснение, а в жидкой фазе – полное перемешивание. При принятых допущениях уравнения материального баланса для исчерпывающей части колонны, расположенной, ниже тарелки питания (1 (L+F)x1− Vy0 − Wx0 = 0 (куб колонны); (3.1) (L+F)(xi+1−xi)+V(yi−1−yi)=0, i =1,2,...,f−1. (3.2) Длятарелкипитания: FxF+ Lxf+1–(L+F)xf +V (yf– 1 − yf)= 0, i = f. (3.3) Для укрепляющей части (f < i ≤ N): L(xi+1 − xi)+V(yi −1 − yi) = 0, i = f+1,f+2,...,N; (3.4) VyN – (L + D)xN+1= 0 (дефлегматор). (3.5) В выражениях (3.1) – (3.5): F – количество исходной смеси, D – отбор дистиллята, W – отбор кубового продукта, V – количество пара, уходящего с тарелки (паровой поток в колонне), L – количество жидкости, стекающей с тарелки, кмоль/ч; xF – концентрация НК в питании (исходной смеси), x0, xN+1 – концентрации НК в кубовом продукте и дистилляте, xi – концентрация НК в жидкости, стекающей с i-ой тарелки, yi – концентрация НК в паре уходящего с i-ой тарелки, мол.доли (рис. 3.1). Принятые допущения позволяют свести процесс массообмена на тарелке к схеме Мерфри [10], т.е. к массообмену при движении некоторого объема паровой фазы через слой жидкости одинаковой концентрации. В этом случае имеем соотношение: 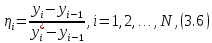 где ηi – локальный кпд тарелки, или КПД Мерфри;yi∗ – концентрация НК в паре, равновесном с жидкостью состава xi, покидающей тарелку, мол.доли. Из уравнений (3.6) выразим yi: yi=yi–1+η(yi–yi–1), (3.7) где η – средний кпд колонны. Расчет равновесных составов паровой и жидкой фаз осуществляется по уравнению 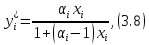 где αi – коэффициент относительной летучести разделяемой cмеси на i-ой тарелке (в расчетах примем α = const ). Записывая приведенные выше уравнения последовательно для тарелок i= 1,2,..., N с учетом равенств: для куба y0=x0, (3.9) для конденсатора yN = xN+1, (3.10) и используя уравнения общего материального баланса колонны F=D+ W, (3.11) L = RD= V – D, (3.12) FxF = DxN+1 + Wx0, (3.13) получим математическое описание стационарного режима работы ректификационной колонны. В выражении (3.12) R – флегмовое число, характеризующее отношение расхода флегмы к расходу дистиллята. Решением системы уравнений (3.1) – (3.13) являются величины xi и yi (i=0,1,..., N +1), т.е. значения концентраций НК на тарелках и в продуктах разделения. |
