Курс_Модел2_2 (1). Методические указания к выполнению курсовой работы дисциплины моделирование технологических процессов и основы оптимизации для студентов, обучающихся по направлению
 Скачать 3.02 Mb. Скачать 3.02 Mb.
|
|
IV. МОДЕЛИРОВАНИЕ СИСТЕМЫ УПРАВЛЕНИЯ РЕАКЦИОННЫМ ПРОЦЕССОМ План выполнения работы: 1. Изучение реакционного процесса: – основные определения процесса, классификация химических реакторов; – основные понятия химической кинетики; – математическая модель химического реактора; – алгоритм расчета реактора. 2. Постановка задачи моделирования в соответствии с заданием на курсовую работу. 3. Разработка моделирующей программы: – алгоритм расчета уравнений кинетики и теплового баланса; – алгоритм поиска управляющих параметров процесса (расходы реагента, теплоносителя, температуры теплоносителя); – код моделирующей программы. 4. Анализ и представление результатов моделирования. 5. Анализ реакционного процесса с точки зрения задач управления. 6. Разработка презентации курсовой работы (не более 8 слайдов, в т.ч. постановка задачи, математическая модель процесса, алгоритмы расчета, результаты моделирования и др.). 7. Подготовка доклада к защите (длительность доклада не более 3-4 мин.). Рекомендуемая литература: [5 – 7, 12 – 16]. Основные определения процесса, классификация химических реакторов Химический реактор – это аппарат, в котором осуществляются химические реакции с целью получения необходимых веществ в условиях технологического процесса [13]. Наиболее простой мерой скорости и глубины протекания реакционного процесса служит степень превращения и выход продукта, которые получают определением соотношения количеств исходных веществ и продуктов или же их концентраций в исходной и прореагировавшей газовой (жидкой) смеси. Степень превращения определяют по основному исходному веществу. Основным исходным называют вещество, по которому идет расчет, как правило, это наиболее дорогое из веществ, присутствующее в исходной смеси [14]. Для модельной реакции aA+ bB→dD (а) например, для окисления диоксида серы по реакции 2SO2+ O2 → 2SO3 основным исходным веществом будет SO2, а дешевое – кислород воздуха присутствует в большом избытке. Общую степень превращения α определяют как отношение массы превратившегося вещества А ( 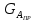 )к общей массе его в исходной смеси )к общей массе его в исходной смеси 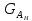 , , 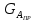 включает массу вещества А превратившегося как в целевой продукт, так и в побочные (если они получаются): включает массу вещества А превратившегося как в целевой продукт, так и в побочные (если они получаются):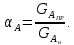 Для газофазных процессов общую (действительную) степень превращения (конверсии) обычно определяют по замеренным в опыте объемным концентрациям исходного вещества на входе в реактор 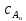 и на выходе из него и на выходе из него 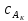 с поправкой β на изменение объема смеси вследствие реакции: с поправкой β на изменение объема смеси вследствие реакции: 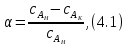 Многие процессы органического синтеза являются многомаршрутными, т.е. протекают одновременно по нескольким параллельным и последовательным реакциям с получением побочных продуктов. Селективностью (избирательностью) процесса называют отношение количества основного исходного вещества, превратившегося в основной продукт, к общему количеству превратившегося вещества [14]. Выражая химические процессы, в которых кроме целевого продукта D получается один или несколько побочных продуктов N, балансовым уравнением aA+Bb→Dd + nN (б) получаем выражение селективности 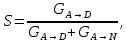 где GA→D – количество основного исходного вещества А, превратившегося в целевой продукт D; GA→N – количество A, превратившегося в побочные продукты. Селективность можно определить также через степень превращения вещества А: 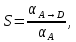 где αA→D – степень превращения вещества А в целевой продуктD. 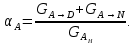 Выходом продукта называют отношение количества полученного продукта к количеству, которое получилось бы при полном протекании реакции [14]. Общий выход продукта xп вычисляют как отношение количества полученного целевого продукта GD к максимально возможному GM при полном превращении исходного А в D по реакции (а) или (б) 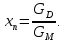 Условия работы химических реакторов весьма разнообразны: от давления в несколько тысяч мегапаскалей до глубокого вакуума; от глубокого холода до нескольких тысяч градусов; от высоких до низких скоростей потоков вещества через реактор; при наличии нескольких фаз и сложного состава реакционных сред. В реакторных устройствах при проведении собственно химического превращения осуществляются различные физические процессы (гидродинамические, тепловые, диффузионные и др.), с помощью которых создаются необходимые условия. Для осуществления физических процессов в реакторных устройствах используются различные конструктивные элементы (мешалки, контактные устройства, теплообменники и др.). Так как сочетаний этих элементов и реакционных процессов может быть много, то и количество реакторных устройств также значительно. Наиболее рациональные признаки классификации химических реакторов следующие [15]: – способ организации процесса; – режим движения реакционной смеси; – тепловой режим в реакторе; – фазовый состав реакционной смеси; – конструктивные характеристики реактора. Способ организации процесса. В реакторе периодического действия рабочий цикл включает загрузку реагирующих веществ, проведение химического или физико-химического превращения, выгрузку продуктов реакции или физико-химического превращения, подготовку реактора к новому циклу. Производительность такого аппарата ниже производительности реактора непрерывного действия. В реакторе полунепрерывного действия одну из операций (подачу сырья или вывод готового продукта) проводят периодически. Так, в некоторых случаях накопление целевого продукта отстает от всех предыдущих операций, и тогда целевой продукт выдают по мере его накопления, периодически. Если целевой продукт необходим непрерывно, его подают непрерывно, а сырье – периодически. Производительность такого аппарата также ниже производительности аппарата непрерывного действия, но степень превращения может быть выше, чем в аппарате непрерывного действия. В реакторе непрерывного действия все операции по получению целевого продукта (подача реагентов, химическое или физико-химическое превращение, вывод получаемого продукта) выполняют одновременно. Затраты времени на загрузку, выгрузку и подготовку аппарата к проведению реакции отсутствуют. На крупнотоннажных химических производствах большая часть или все операции переработки сырья непрерывны. Режим движения реакционной смеси. В зависимости от гидродинамического режима реакторы подразделяют на реакторы смешения и реакторы вытеснения. В полной мере практически невозможно исключить в реакторах вытеснения некоторое смешение реагирующих компонентов по длине (высоте) реактора. В реакторах смешения также нельзя полностью исключить небольшие зоны неравенства концентраций. Поэтому модели таких реакторов принято называть реакторами идеального смешения (РИС) и реакторами идеального вытеснения (РИВ). С внесением необходимых поправок модели РИС и РИВ можно использовать на практике. Процесс смешения в РИС должен быть организован таким образом, чтобы в любой точке аппарата были абсолютно одинаковые условия по концентрации реагентов, продуктов реакции, степени превращения, температуре, скорости химического или физико-химического превращения и т.д. Тепловой режим в реакторе. Химические или физико-химические превращения, проводимые в реакторах, всегда происходят с выделением или поглощением некоторого количества тепла. По этому признаку реакторы делят на изолированные от окружающей среды – адиабатические, в которых все количество тепла, выделившееся в системе в результате реакции, остается в самой системе (за исключением небольших потерь), и изотермические, когда химическое или физико-химическое превращение необходимо проводить при определенной (заданной) температуре, и в реакторе должен быть организован теплообмен. Возможен политропический (промежуточный) режим, когда температура в реакторе непостоянна. В реакторах такого типа часть тепла при необходимости подводят к реакционной смеси или, наоборот, отводят от реакционной смеси в зависимости от свойств системы. Фазовый состав реакционной смеси. В зависимости от фазового состава реакционной смеси различают аппараты для проведения гомогенных процессов для систем газовых, жидкостных и одного твердого тела; реакторы для гетерогенных процессов для систем газ – жидкость, газ – твердое тело, газ – жидкость – твердое тело, жидкость – жидкость (несмешивающиеся), жидкость – твердое тело, два твердых тела; для систем с числом фаз большетрех.К последним относятся и реакторы для гетерогенно-каталитических систем. 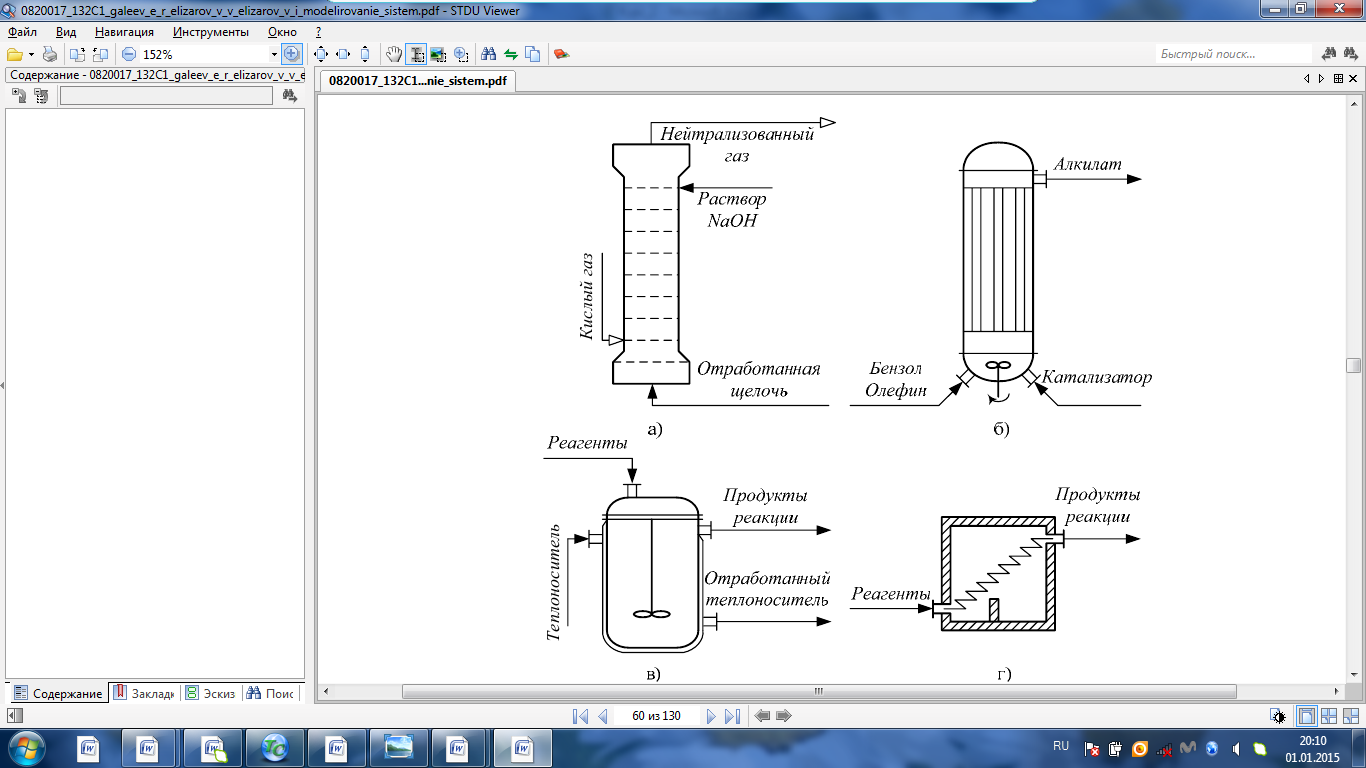 Рис. 4.1. Реакторы: а – колонный, б – трубчатый, в – реакционная камера, г – печь Конструктивные характеристики реактора. По конструкции реакторы могут быть разделены на [13]: 1) реакторы типа колонны (рис. 4.1 а); 2) реакторы типа теплообменника (рис. 4.1 б); 3) реакторы типа реакционной камеры (рис. 4.1 в); 4) реакторы типа печи (рис. 4.1 г). Расчет реакторных устройств заданной конструкции проводится с целью определения требуемого количества катализатора, расходов теплоносителя и реагирующих веществ, температуры и давления в аппарате, длительности проведения реакции, при которых будет достигнута наибольшая степень превращения исходных компонентов. Основные понятия химической кинетики Предметом химической кинетики является исследование закономерностей протекания химических процессов во времени (их скоростей в зависимости от ряда факторов – температуры, давления, концентраций и др.) и механизмов химических реакций (отдельных стадий и промежуточныхвеществ).Химическая кинетика позволяет рассчитывать время достижения заданных степеней превращения исходных веществ в процессах и минимизировать это время путем оптимального варьирования факторов, влияющих на скорость реакции [16]. По фазовому принципу химические реакции подразделяютсянагомогенные и гетерогенные. По термическим показателям реакции делятся на экзотермические, эндотермические, автотермические, изотермические и со смешанным циклом по теплоте реакции. Экзотермические реакции протекают с выделением тепла. Следовательно, в реакторах, в которых протекают такого рода реакции, необходимо предусматривать отвод тепла. Эндотермические реакции протекают с поглощением тепла, поэтому при осуществлении такого рода реакций в реакторах предусматривается подвод тепла. Тепловым эффектом химической реакции называется количество теплоты, выделяемой или поглощаемой в результате химического процесса при постоянном давлении или объеме, равенстве температур исходных веществ или продуктов [13]. Скорость химической реакции r характеризует интенсивность протекания процесса. В общем случае под скоростью реакции понимают число актов (химических превращений) в единицу времени в единице реакционного пространства. Для гомогенных процессов реакционное пространство является трехмерным и представляет собой объем реактора (V), для гетерогенных процессов оно двумерное (площадь поверхности границы раздела фаз S). На практике пользуются не числом актов реакции, поскольку эта величина очень большая, а пропорциональными ей параметрами – количеством вещества n, молярной концентрацией с, степенью превращения α. Для статических условий мгновенная скорость гомогенной химической реакции есть изменение количества вещества какого-либо компонента реакционной системы в единицу времени в единице объема: 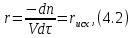 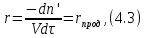 где rисх, rпрод –скорости по исходному веществу А и продукту A’ (моль/(л·с)); n, 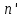 – количество исходного вещества и продукта (моль); V – реакционный объем (л). – количество исходного вещества и продукта (моль); V – реакционный объем (л). В ходе реакции количества исходных веществ во времени убывают (dn/dτ< 0),количества продуктов реакции увеличиваются (dn’/dτ> 0). Скорость является положительной величиной, поэтому в уравнении (4.2) перед производной поставлен знак минус, а в выражении (4.3) плюс. При постоянстве объема системы (V = const) 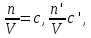 где с, c’ – концентрации исходного вещества и продукта (моль/л). Тогда скорость реакции 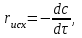 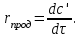 Скорость реакции часто выражают через степень превращения. Из (4.1) следует c = (1− α)cн. Тогда 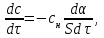 Для гетерогенных процессов 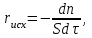 где S – площадь поверхности границы раздела фаз (м2). В данном случае размерность скорости реакции – моль/(м2·с). 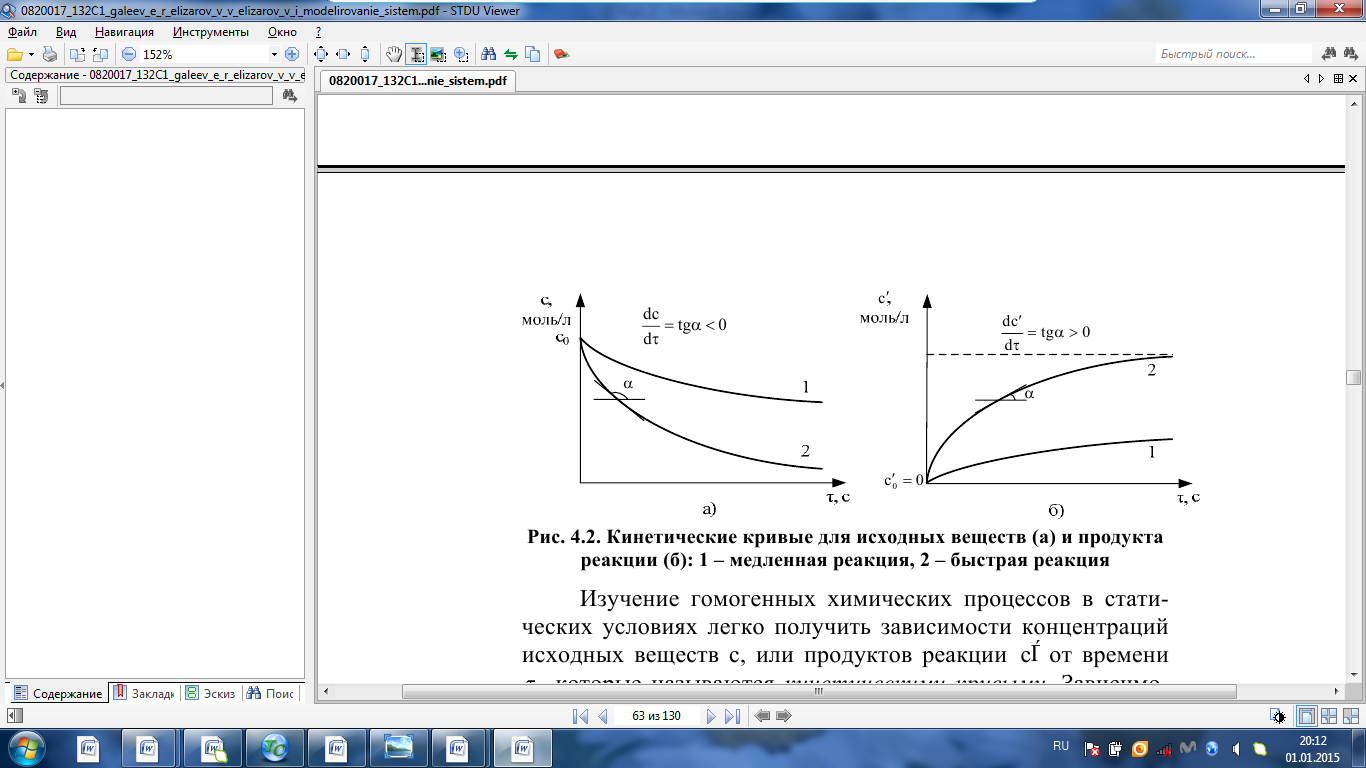 Рис. 4.2. Кинетические кривые для исходных веществ (а) и продукта реакции (б): 1 – медленная реакция, 2 – быстрая реакция Изучение гомогенных химических процессов в статических условиях легко получить зависимости концентраций исходных веществ с, или продуктов реакцииc’от времени τ, которые называются кинетическими кривыми. Зависимости c = f(τ) иc’ = f’(τ) изображены на рис. 4.2. В соответствии с изменением концентраций исходных веществ и продуктов во времени функции c = f(τ) являются убывающими, а c’ = f’(τ) – возрастающими. Кинетические кривые 1 и 2 относятся к медленной и быстрой реакциям соответственно ( r1< r2 ). Производные концентрации по времени, входящие в выражение для мгновенной скорости реакции, находятся как тангенсы углов наклона касательных к кинетическим кривым в соответствующих точках. Элементарные химические реакции. Закон действующих масс Элементарной называется химическая реакция, протекающая в одну стадию (элементарный акт). Большинство химических реакций являются не элементарными, а сложными, поскольку они протекают во времени через несколько отличающихся друг от друга элементарных стадий и промежуточных веществ, совокупность которых называют механизмом сложной реакции. В сложных реакциях наряду с расходованием реагентов Аи образованием продуктов A′ на отдельных стадиях возможно образование и расходование промежуточных веществ A∗, которые в случае достаточной химической устойчивости могут быть выделены и идентифицированы. С позиций кинетической обратимости все реакции можно разделить на двусторонние (кинетически обратимые), протекающие одновременно как в прямом, так и в обратном направлениях, и односторонние (кинетически необратимые), которые идут в одном направлении до практически полного исчерпывания хотя бы одного из реагентов. Химическую реакцию принято записывать в виде стехиометрического уравнения, представляющего собой количественное соотношение (в молях) между исходными реагентами и продуктами: 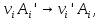 где νi, νi‘ – стехиометрические коэффициенты для исходных веществ и продуктов. В общем случае для статических условий скорость реакции зависит от температуры, концентраций исходных веществ и продуктов, а также других факторов (катализатор, облучение и др.): r=(T,c,c’). Рассмотрим необратимую элементарную реакцию 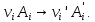 Согласно закону действующих масс, при постоянной температуре скорость элементарной химической реакции пропорциональна произведению концентраций реагирующих веществ в степенях, равных их стехиометрическим коэффициентам. Это так называемая кинетическая форма закона действующих масс (ЗДМ). 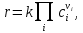 где k – коэффициент пропорциональности, называемый константой скорости химической реакции. При единичных концентрациях реагирующих веществ скорость реакции численно равна константе скорости, поэтому k иногда называют удельной скоростью химической реакции. При данной температуре k является для рассматриваемой реакции величиной постоянной, не зависящей от концентраций реагентов. Рассмотрим необратимые элементарные реакции разного вида и применим к ним закон действующих масс: 1) A1 → продукты, r = k 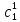 ; ;2) A1 + A2 → продукты, r = k 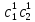 ; ;2A1→ продукты, r = k 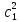 ; ;3) A1+A2+A3 → продукты, r =k 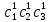 ; ;2A1 +A2→ продукты, r = k 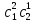 ; ;3A1 → продукты, r = k 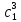 ; ;Частным кинетическим порядком реакции по i-му компоненту ( 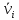 νi) называется показатель степени при концентрации этого компонента в уравнении основного постулата химической кинетики. В случае элементарной реакции он совпадает со стехиометрическим коэффициентом при реагенте νi) называется показатель степени при концентрации этого компонента в уравнении основного постулата химической кинетики. В случае элементарной реакции он совпадает со стехиометрическим коэффициентом при реагенте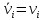 и является целым положительным числом. и является целым положительным числом.Общим кинетическим порядком реакции называется сумма частных порядков 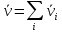 (для прямой реакции), (для прямой реакции),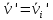 (для обратной реакции). (для обратной реакции).В общем случае для сложной реакции νi ≠ 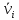 ′ и кинетическое уравнение записывается в виде ′ и кинетическое уравнение записывается в виде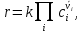 где 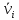 – показатель концентрационной зависимости скорости (частный порядок реакции) по i-му компоненту, определяемый экспериментально. Для сложных реакций – показатель концентрационной зависимости скорости (частный порядок реакции) по i-му компоненту, определяемый экспериментально. Для сложных реакций 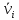 может быть целым числом и дробным, положительным и отрицательным. может быть целым числом и дробным, положительным и отрицательным.Рассмотрим зависимость скорости химической реакции от температуры. Температура оказывает на скорость более сильное влияние, чем концентрации реагирующих веществ. При этом температура влияет на скорость через константу скорости: k=k(T). Исторически известны два вида зависимости константы скорости от температуры: эмпирическое правило Вант-Гоффа и более строгое уравнение Аррениуса. В области умеренных температур для гомогенных и многих гетерогенных реакций справедливо правило Вант-Гоффа: при постоянных концентрациях реагирующих веществ увеличение температуры на 10 °С (или 10 К) приводит к возрастанию скорости реакции в 2-4 раза. Болеестрого зависимость константы скорости от температуры выражается уравнением Аррениуса: 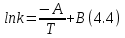 которое показывает, что логарифм (натуральный или десятичный) константы скорости линейно зависит от обратной абсолютной температуры. В уравнении (4.4) А и В – эмпирические константы для данной реакции, которые находят графическим способом. Для этого в так называемых аррениусовыхкоординатах 1/T – ln k строят график по экспериментальным значениям константы скорости изучаемой реакции при различных температурах. Опытные точки в пределах статистического разброса данных находятся на прямой линии (рис. 4.3). 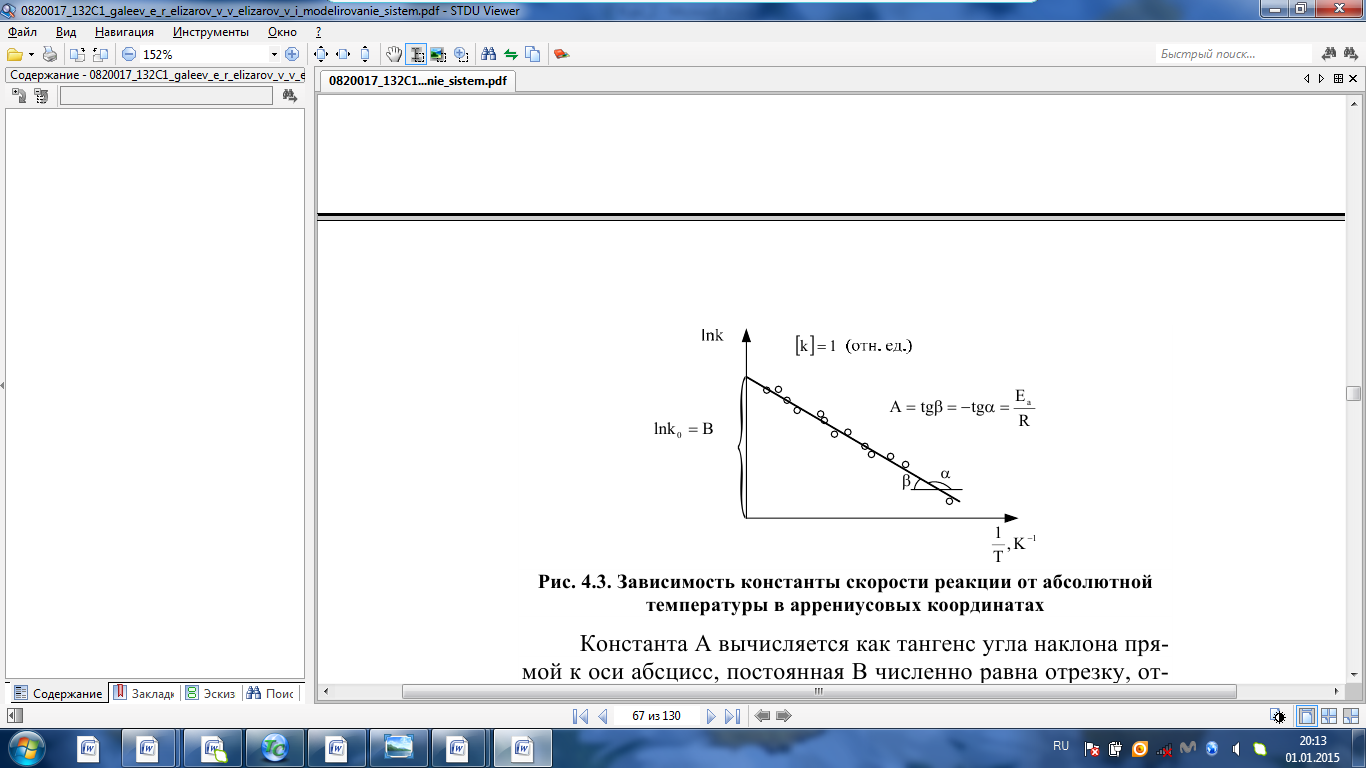 |
