Методические указания по выполнению лабораторных работ по механике и молекулярной физике, входящих в первую часть физического практикума по дисциплине "Физика"
 Скачать 2.35 Mb. Скачать 2.35 Mb.
|
Определение показателя адиабаты методом Клемана и ДезормаЦель работы: определить показатель адиабаты и сравнить его величину с теоретическим значением. Оборудование: стеклянный баллон, кран, насос, манометр. Теоретическое введение Среди процессов, происходящих с газами, часто встречается и очень важен адиабатический процесс, протекающий без передачи тепла. Чтобы получить его уравнение, воспользуемся первым началом термодинамики. Его формулировка: теплота, сообщаемая системе (газу), идет на изменение внутренней энергии системы и на совершение системой работы над внешними силами (против действия внешних сил) Для записи передаваемого тепла удобно ввести понятие теплоемкости Величина теплоемкости зависит от способа, которым системе сообщается тепло. Процессы с постоянной теплоемкостью называются политропическими. Одним из таких процессов является процесс нагревания идеального газа при постоянном объеме (изохорический процесс). Молярная теплоемкость такого процесса обозначается Так как работа, совершаемая газом при увеличении его объема на dV равна Отсюда, изменение внутренней энергии одного моля идеального газа будет Тогда первое начало термодинамики для идеального газа можно записать в виде: Процесс, протекающий при постоянном давлении, называется изобарическим,а молярная теплоемкость для такого процесса обозначается СР . Найдем связь между теплоемкостями для упомянутых процессов. Для этого нам понадобится уравнение состояния для одного моля идеального газа где R- универсальная газовая постоянная. Отсюда, при p=const, находим, что Эта связь молярных теплоемкостей называется уравнением Майера. Теперь рассмотрим адиабатический процесс, для которого В уравнении состояния (2) для одного моля идеального газа меняются все термодинамические параметры, p, V, и T. Вычисляя дифференциал, получим Отношение Отсюда Используя уравнение состояния (2) можно записать уравнение Пуассона через другие термодинамические переменные: 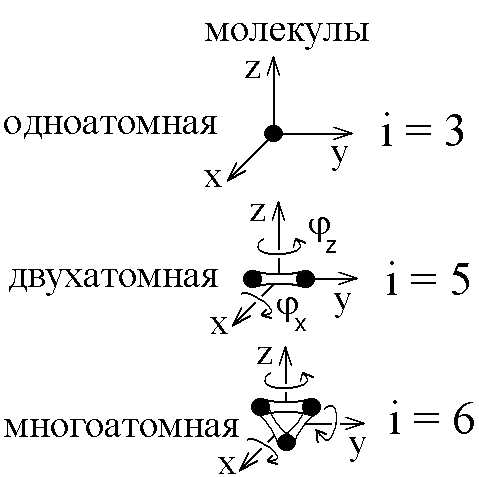 Рис. 1 Идеальный газ – это совокупность не взаимодействующих друг с другом на расстоянии молекул. Такие молекулы к тому же не деформируются, т.е. имеют постоянную форму и очень малый размер. Размером одноатомной молекулы вообще пренебрегают, считая ее материальной точкой, способной двигаться в трех независимых направлениях, т.е. имеющей i = 3 степени свободы. Двухатомные и многоатомные молекулы имеют дополнительные вращательные степени свободы, показанные на рис. 1. Внутренняя энергия идеального газа складывается только из кинетической энергии его молекул. Скорости молекул такого газа различны, но подчиняются распределению Максвелла. С его помощью можно вычислить среднюю энергию, приходящуюся на 1 степень свободы молекулы: Сравнивая с термодинамической формулой Для одноатомного газа Воздух является смесью многих газов - двухатомных N2 , O2 ,…, трехатомных - СО2, Н2О и т.п. Так как доля многоатомных и одноатомных газов в нем мала, то можно ожидать, что величина 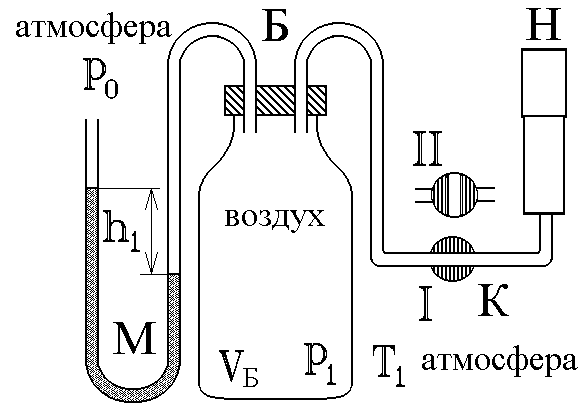 Рис. 2 Для экспериментального определения показателя адиабаты воздуха используется установка, изображенная на рис.2. Она состоит из большого стеклянного баллона Б, соединенного через кран К с насосом Н или атмосферой. Манометр М служит для измерения разностей давлений газа в баллоне и в атмосфере. В условиях эксперимента воздух можно считать идеальным газом. Повернем кран К в положение I, соединяя баллон с насосом, и начнем накачивать воздух в баллон. Так как этот процесс происходит достаточно медленно, то за счет теплообмена через стеклянные стенки баллона успевает установиться тепловое равновесие. Температура воздуха внутри баллона после накачивания будет равна комнатной температуре Т1 . Но давление внутри возрастет до величины где p0 - давление воздуха в окружающей атмосфере, а Вытащим теперь трубку крана К, соединяя баллон с атмосферой. Воздух очень быстро выходит через отверстие, расширяясь, теплообмен не успевает произойти и процесс можно считать адиабатическим. В соответствии с уравнением (3-6) при резком уменьшении давления уменьшится и температура: воздух в баллоне будет охлажден до температуры ниже комнатной! В момент, когда давление воздуха в сосуде сравнивается с атмосферным ( Процессы, протекающие в системе, изображены на рис. 3. В момент окончания адиабатного расширения в баллоне останется часть воздуха с массой m1 , занимавшая первоначально объем V1, меньший объема баллона VБ . 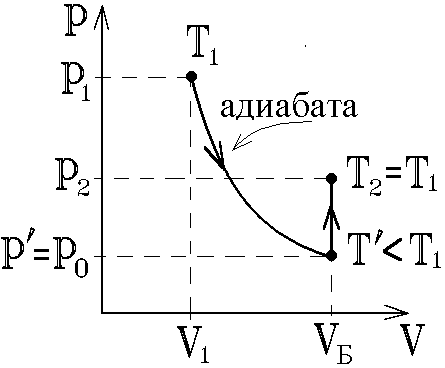 Рис. 3 Запишем для этой части уравнения адиабатического (6) и изохорического процессов: 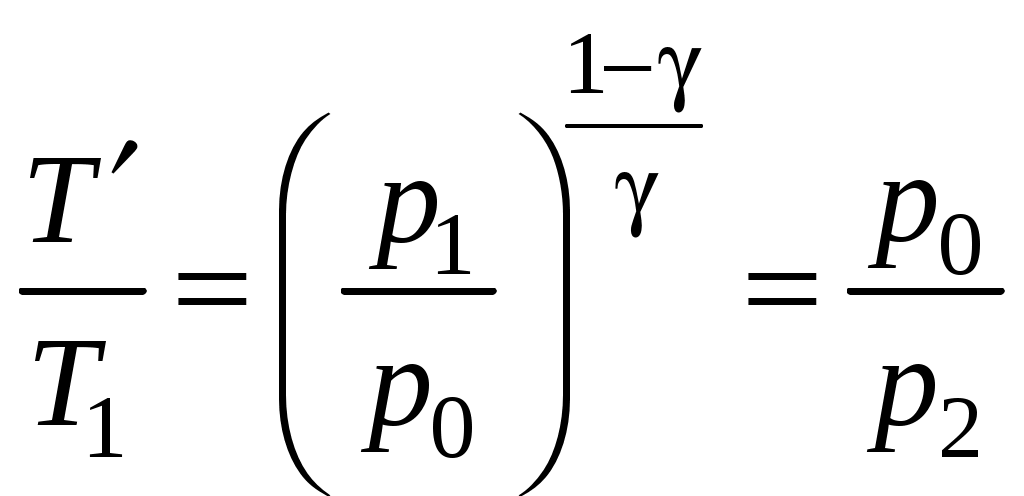 . (10) . (10)Логарифмируя последнее уравнение (10), получим 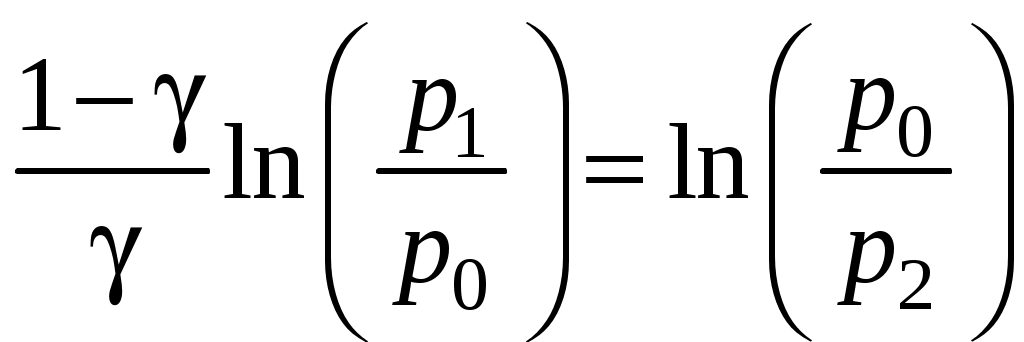 , откуда , откуда Подставляем сюда формулы (8) и (9): 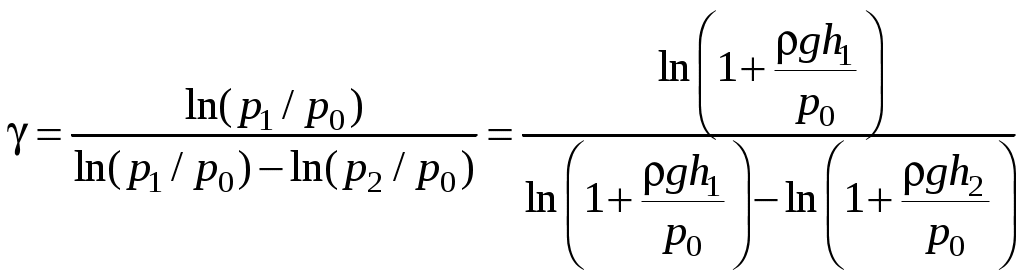 . (12) . (12)Но уровни жидкости (воды с плотностью Такой показатель позволяет описать многие свойства исследуемого газа, но точность его определения в данном эксперименте не слишком высока, и поэтому возникают отклонения от теоретически ожидаемого значения Порядок выполнения работы 1. Установить пробку крана К так, чтобы баллон Б, который находится под столом, сообщался с насосом Н (в положение I на рис. 2). 2. Осторожно накачать воздух в баллон. Когда разность уровней жидкости в коленах манометра достигнет 3. Через некоторое время, когда давление окончательно установится и разность уровней в манометре перестанет уменьшаться, измерить 4. Вынуть пробку крана, давая воздуху в сосуде расшириться наружу. Разность уровней жидкостей в манометре резко уменьшится двумя, следующими друг за другом скачками. Как только при втором скачке уровни жидкостей станут одинаковыми, (h=0) пробку следует немедленно и плотновставить в кран К в положение II, закрывая баллон. Об этом моменте выравнивания давления внутри и вне баллона можно судить и по прекращению звука издаваемого выходящим воздухом. Перед дальнейшим выполнением работы несколько раз потренируйтесь в выполнении пунктов 1 - 4, чтобы научиться вставлять пробку быстро и в нужный момент. 5. После того, как баллон будет закрыт пробкой, уровни жидкости в манометре снова начнут расходиться. Следует подождать, когда давление окончательно установится и разность уровней в манометре перестанет увеличиваться. Затем записать установившуюся разность уровней 6. Опыт повторить не менее N = 9 раз для разных значений начальной величины Для каждого опыта вычислить Таблица 1
7. Определить погрешность полученного значения показателя адиабаты 8. По формуле (7) вычислить теоретическое значение показателя адиабаты Контрольные вопросы Сформулируйте I-е начало термодинамики и запишите его для идеального газа. Какой газ можно считать идеальным? От каких термодинамических параметров зависит внутренняя энергия идеального газа и что она описывает? Какие величины входят в уравнение состояния идеального газа? Каков его вид? Дайте определение теплоемкости. Чем она отличается от молярной и от удельной теплоемкостей? Почему для разных процессов величина теплоемкости одной и той же система различна? Какие величины связывает уравнение Майера и как его получить? Какой процесс называется адиабатическим? политропическим? Докажите, что изобарический, изотермический и изохорический процессы являются политропическими. Как на практике осуществить адиабатический процесс с газом? Выведите уравнение Пуассона (3-5) для адиабатического процесса. Получите из него уравнение (3-6) с помощью уравнения состояния. Что такое показатель адиабаты? Какие процессы с воздухом в баллоне Б на рис.3- 2 происходят при выполнении работы: а) при накачивании воздуха? б) при открывании крана К? в) при его последующем закрывании? Почему именно эти процессы? Выведите уравнения (3-11) и (3-13) для определения показателя адиабаты Литература 1. Савельев И.В., Курс общей физики, 1973, гл. XI, 2. Колмаков Ю.Н., Пекар Ю.А., Лежнева Л.С., Термодинамика и молекулярная физика, 1999, гл. I, 4 -9. Лабораторная работа № 14 | ||||||||||||||||||||
