Методическое пособие по педиатрии ббк. Методическое пособие по педиатрии включает в себя материал, соответствующий требованиям Программы для студентов по Педиатрии
 Скачать 5.78 Mb. Скачать 5.78 Mb.
|
|
Анамнез, клиника. Клинические признаки клапанного СА могут проявиться в любом возрасте. При небольшом СА порок может протекать бессимптомно и проявляться только систолическим шумом с максимумом во втором-третьем межреберье справа от грудины; который хорошо проводится на сосуды шеи. При умеренном СА отмечается повышенная утомляемость, приступы сердцебиения, снижение толерантности к физическим нагрузкам. При выраженном СА дополнительно появляются обморочные состояния (из-за нарушения периферического кровотока), боли в сердце, связанные с относительной коронарной недостаточностью гипертрофированного миокарда при интенсивной нагрузке. При СА возможна внезапная смерть из за острой коронарной недостаточности и аритмий. Сердечная недостаточность долго не проявляется из-за хороших компенсаторных возможностей левого желудочка. Однако если она развилась, состояние больных и прогноз жизни резко ухудшаются, летальный исход возможен в пределах 2-3 лет. Объективно – область сердца не изменена, границы относительной сердечной тупости в пределах возрастной нормы, т.к. развивается концентрическая гипертрофия левого желудочка (уменьшение объёма камеры сердца без её расширения). Пальпаторно: систолическое дрожание во втором межреберье справа от грудины при клапанном и надклапанном стенозе и в третьем-четвёртом межреберье слева – при подклапанном стенозе. Аускультативно – грубый «скребущего» характера систолический шум во втором межреберье справа от грудины при клапанном и надклапанном стенозе и в третьем-четвёртом межреберье слева – при подклапанном стенозе. Шум хорошо проводится на сосуды шеи. Систолическое артериальное давление и пульсовое давление снижается по мере прогрессирования стеноза. В соответствии с этим снижается наполнение пульса. При надклапанном стенозе выявляется феномен асимметрии артериального давления между правой и левой руками более 10 мм рт. ст. При этом артериальное давление на правой руке значительно выше, чем на левой. Диагноз СА устанавливается при наличии систолического дрожания во втором и в третьем-четвёртом межреберье справа от грудины, грубого «скребущего» характера систолического шума во втором и в третьем-четвёртом межреберье слева межреберье справа от грудины. Лабораторные исследования ЭКГ. При тяжелом клапанном СА выявляется: - гипертрофия левого желудочка; - систолическая перегрузка и перенапряжение миокарда левого желудочка по типу strain: депрессия сегмента ST более 2 мм в левых отведениях и инверсия зубца Т. Депрессия сегмента ST и зубца Т, возникающая или усиливающаяся при физической нагрузке, свидетельствует о развитии умеренного градиента давления между левым желудочком и аортой. При умеренных и легких стенозах ЭКГ обычно нормальная. Рентгенологически при тяжелом СА и левожелудочковой сердечной недостаточности выявляется усиление легочного рисунка по венозному руслу. В прямой проекции сердце имеет характерную «аортальную» конфигурацию - хорошо выражена талия сердца, верхушка закруглена и приподнята над диафрагмой. При клапанном СА по правовому контуру определяется постстенотическое выбухание восходящей аорты. Во 2-ой косой проекции определяется увеличение левого желудочка за счёт наслоения заднего контура сердца на позвоночник и расширение восходящей аорты. ДЭхоКГпри клапанном СА выявляет выбухание створок в просвет аорты с турбулентным потоком крови через клапан. При подклапанном СА выявляется фиброзная или фиброзно-мышечная обструкция выводного отдела левого желудочка. При надклапанном СА определяется обструкция в виде «песочных часов» с уменьшением восходящего отдела аорты, при наличии фибромышечной диафрагмы, диаметр восходящего отдела аорты не изменен, в просвете сосуда определяется мембрана сразу над синусами Вальсальвы. Ранним признаком развивающейся сердечной недостаточности является диастолическая дисфункция левого желудочка. Дифференциальный диагноз проводят с КоА, СЛА, ДМЖП, ДМПП, с гипертрофической кардиопатией – идиопатическим гипертрофическим субаортальным стенозом, с приобретенным стенозом аортального клапана. Лечение. Показанием к операции являются: - «критический» СА у детей раннего возраста с систолическим градиентом давления в системе «левый желудочек - аорта» более 80 мм рт. ст. (III стадия), с клиническими проявлениями левожелудочковой или тотальной сердечной недостаточности; - выраженный стеноз с градиентом систолического давления от 50 – до 80 мм рт. ст. (II стадия) с жалобами на ангинозные боли в сердце, обмороками и синкопальными состояниями, возникающими при физической нагрузке. У новорожденных при критическом СА проводят медикаментозную терапию, до стабилизации состояния (ИВЛ, мочегонные, допамин 6-8 мкг/кг/мин). При дуктус-зависимом кровообращении проводят инфузию простагландинов группы Е и далее баллонную дилатацию клапанного стеноза. При клапанном СА баллонная вальвулопластика или вальвулотомия по комиссурам на открытом сердце являются паллиативными, т.к. после этого клапан часто становиться несостоятельным в плане его запирательной функции и со временем прогрессирует аортальная недостаточность. У 50-70% больных в дальнейшем проводится протезирование клапана. При подклапанном СА проводится полная резекция фиброэластической мембраны, а при фибромышечном стенозе – резекция фиброзной ткани с частичной миотомией. При развитии аортальной недостаточности у пациентов в возрасте 10-21 года проводится протезирование аортального клапана. При надклапанном СА проводится аортотомия и резекция места надклапанной обструкции. При диффузном сужении аорты проводится реконструктивная операция. Осложнения до операции:прогрессивный стеноз устья коронар-ных артерий; инфекционный эндокардит; внезапная смерть. Осложнения после операции: прогрессирование послеоперационной недостаточности аортального клапана, рестеноз, инфекционный эндокардит, недостаточность кровообращения, летальный исход операции при диффузном надклапанном сужении аорты, ятрогенный дефект межжелудочковой перегородки, атриовентрикулярный блок. Прогноз. При легком и умеренном надклапанном стенозе жизненный прогноз благоприятный. При тяжелом надклапанном стенозе послеоперационная выживаемость составляет за 15 лет 85%. При субаортальном стенозе внезапная сердечная смерть у неоперированных больных наблюдается у 2-10% больных. При естественном течении субаортального стеноза более, чем у 60% развивается аортальная регургитация. Субаортальный стеноз может вновь появиться после успешно проведенной хирургической резекции. Поздняя послеоперационная смертность возникает при резидуальном субаортальном стенозе и повторных хирургических вмешательствах. Высокая частота рецидивов (10–50% за 10-летний период) наблюдается, если у пациента градиент субаортальной обструкции до операции превышал 50 мм рт. ст.; если возраст пациента менее 10 лет. Вопросы к экзамену. Стеноз аорты. Гемодинамические нарушения. Клиническая картина. Диагностика. Лечение. Прогноз. Коарктация аорты (КоА) – ВПС при котором имеется сужение или полный перерыв аорты, наиболее часто в области перешейка, немного дистальнее отхождения левой подключичной артерии. В 2% случаев расположение КоА бывает в грудном отделе аорты на уровне диафрагмы или в брюшном отделе на уровне почек. Эпидемиология. КоА встречается в 6-15% от всех ВПС, как изолированный порок, и в сочетании с другими ВПС (чаще всего с двустворчатым аортальным клапаном, аортальным стенозом, ДМЖП). КоА выявляется в 3–5 раз чаще у мальчиков. У каждого четвертого пациента с КоА имеется аномалия ЖКТ, мышечной, скелетной и мочевыделительной систем. Этиология. Согласно гемодинамической теории КоА возникает в результате уменьшения потока крови через дугу и перешеек аорты. Во внутриутробном периоде перешеек получает относительно меньшее количество крови. Нисходящая аорта получает кровь из правого желудочка через артериальный проток. Левый желудочек снабжает кровью восходящую аорту и брахиоцефальные артерии, и лишь небольшая часть крови поступает к перешейку. Такие ВПС как ДМЖП, двустворчатый аортальный клапан, аортальный стеноз уменьшают левожелудочковый объём и также приводят к формированию КоА. Этим объясняется частое сочетание КоА с этими ВПС. Если к 2,5-3 месяцам жизни ребенка диаметр перешейка не превысит 80% от диаметра нисходящей аорты на уровне диафрагмы, то это рассматривается как КоА. По отношению к ОАП различают три варианта локализации КоА в области перешейка:
При постдуктальной КоА протяженность участка сужения может быть чуть больше 1мм, в виде «песочных часов». При предуктальной КоА протяженность участка сужения чаще бывает 1-2 см, по типу гипоплазии перешейка аорты. Гемодинамика. Перегрузка левого желудочка при КоА развиваться постепенно или остро, что приводит к его гипертрофии. У 15-20% детей грудного возраста дополнительно развивается эндомиокардиальный фиброэластоз из-за гипертрофии желудочков с развитием относительной коронарной недостаточности и хронической ишемии миокарда. При остром развитии клиники КоА быстро развиваются застойные явления и шок. При постепенном развитии КоА компенсаторно формируются артериальные коллатерали (подключичные, межреберные, внутренние грудные и др.). Коллатеральное кровообращение улучшает выживаемость больных. В организме ребенка устанавливается два режима кровообращения: проксимальнее и дистальнее места сужения аорты. Проксимальнее места сужения аорты возникает артериальная гипертензия. Повышается САД, ДАД и среднее гемодинамическое артериальное давление. Величина артериального давления может достигать 200 мм рт. ст. Это обусловлено не только механическим фактором – нарушением оттока крови из восходящей аорты, но и действием вазоренального фактора – активацией ренин-ангиотензин-альдостероновой системы на фоне почечной ишемии. Также активируется симпатическая нервная система, приводящая к увеличению числа сердечных сокращений и артериального давления. Повышается уровень вазопрессина, который способствует задержке свободной жидкости в организме и повышает ОЦК. Из-за перегрузки сопротивлением вслед за гипертрофией левого желудочка, возникает гипертрофия левого предсердия. Дистальнее места сужения аорты устанавливается режим артериальной гипотензии. САД в сосудах нижней половины тела и нижних конечностях становится равно или ниже, чем в сосудах верхних конечностей. Однако ДАД может быть повышенным во всех участках аорты, а пульсовое артериальное давление – уменьшенным. По мере взросления ребенка коллатеральные сосуды претерпевают изменения. Они становятся широкими, извитыми. Извилистость межреберных артерий приводит к деформации краёв нижних ребер (узуры). Возникают аневризмы аорты, подключичных артерий, сосудов головного мозга. При сочетании КоА и ОАП изменения гемодинамики зависят от степени стеноза аорты, локализации и ширины ОАП. При постдуктальной КоА создается высокий градиент давления между аортой и легочной артерией, что приводит к большому сбросу крови через ОАП и гиперволемии малого круга кровообращения. Быстро развивается лёгочная гипертензия. В этом случае также быстро развивается систолическая артериальная гипертензия. ДАД снижено из-за большого лево-правого шунта. При предуктальной КоА и ОАП шунт лево-правый, также развивается гиперволемия малого круга кровообращения. Смена шунта на право-левый возможна при высокой лёгочной гипертензии и выраженной КоА. При этом развивается цианоз нижней половины туловища и нижних конечностей. При сочетании КоА с ДМЖП сброс крови в правый желудочек большой и лёгочная гипертензия развивается быстрее и принимает злокачественный характер. САД в восходящей аорте длительно остается умеренно повышенным из-за уменьшения её кровенаполнения. Сочетание КоА с фиброэластозом эндомиокарда сопровождается выраженной кардиомегалией за счёт дилатации и гипертрофии левого желудочка и левого предсердия, ранней, рефрактерной к терапии недостаточности кровообращения, нарушениями ритма сердца, тромбоэмболическими осложнениями. Анамнез, клиника зависят от степени КоА, сопутствующих аномалий, сроков появления артериальной гипертензии, осложнений коарктации аорты. Кроме того, клиническая картина порока сильно различается у больных раннего возраста и у более старших детей. Б 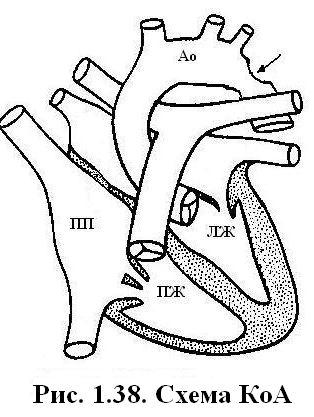 ольшинство детей с КоА рождается с нормальной массой тела или с умеренной пренатальной гипотрофией. Рано появляются признаки сердечной недостаточности: быстрая утомляемость при кормлении, беспокойство, бледность. При гиперволемии малого круга кровообращения отмечаются рецидивирующие пневмонии. Одышка резко выражена, в легких выслушиваются стойкие мелкопузырчатые застойные хрипы. Верхушечный толчок усилен, разлитой. Границы относительной сердечной тупости расширены в поперечнике. Второй тон усилен над легочной артерией, при сердечной недостаточности часто возникает трёхчленный ритм галопа. Шумовая симптоматика при КоА у грудных детей не характерна, особенно при сердечной недостаточности. Во втором-третьем межреберье слева от грудины может выслушиваться систолический или систолодиастолический шум ОАП. ольшинство детей с КоА рождается с нормальной массой тела или с умеренной пренатальной гипотрофией. Рано появляются признаки сердечной недостаточности: быстрая утомляемость при кормлении, беспокойство, бледность. При гиперволемии малого круга кровообращения отмечаются рецидивирующие пневмонии. Одышка резко выражена, в легких выслушиваются стойкие мелкопузырчатые застойные хрипы. Верхушечный толчок усилен, разлитой. Границы относительной сердечной тупости расширены в поперечнике. Второй тон усилен над легочной артерией, при сердечной недостаточности часто возникает трёхчленный ритм галопа. Шумовая симптоматика при КоА у грудных детей не характерна, особенно при сердечной недостаточности. Во втором-третьем межреберье слева от грудины может выслушиваться систолический или систолодиастолический шум ОАП. На радиальных, сонных и локтевых артериях пульс хорошего наполнения и напряжения, а на бедренных артериях и на сосудах тыла стопы у 2/3 больных пульсация резко ослаблена или отсутствует. Однако при дифференцированном цианозе пульс на ногах и бедренных артериях может быть лишь умеренно ослабленным (при выраженной предуктальной КоА и смене шунта на право-левый). САД на руках на 30-60% выше нормы, артериальное давление на ногах снижено. У старших детей КоА часто обнаруживается случайно в школьном возрасте при измерении артериального давления. До выявления артериальной гипертензии дети обычно жалоб не предъявляют и развиваются в соответствии с возрастом. Характерны жалобы на боль и слабость в мышцах нижних конечностей, иногда на судороги в икроножных мышцах, особенно после интенсивных физических нагрузок связанные с синдромом артериальной гипотензии в нижней половине тела. При физической нагрузке также отмечаются сжимающие и колющие боли в сердце из-за коронарной недостаточности и ишемии гипертрофированного левого желудочка. САД на верхних конечностях превышает возрастную норму на 30-80% и значительно повышается после физической нагрузки. ДАД повышенно умеренно. Пульсовое давление значительно увеличено до 80-100 мм рт. ст. Из-за артериальной гипертензии развивается ангиопатия сетчатки. САД на ногах снижается на 20-40 мм рт. ст. и становиться меньше, чем на руках. ДАД остается нормальным, пульсовое давление значительно снижено. Верхушечный толчок резко усилен, приподнимающий. Границы относительной сердечной тупости умеренно расширены влево и вверх за счёт левого желудочка и левого предсердия. Второй тон над аортой усилен за счёт гипертензии в восходящей аорте. Выслушивается средней интенсивности систолический шум вдоль левого края грудины. Шум проводится на сосуды шеи и на спину между левой лопаткой и позвоночником на уровне II-V грудных позвонков (т.е. на уровне КоА), особенно при задержке дыхания на выдохе. Диагноз КоА устанавливается при выявлении артериальной гипертензии, снижении АД на нижних конечностях, наличии средней интенсивности систолического шума вдоль левого края грудины. Лабораторные исследования ЭКГ выявляет признаки перегрузки левого желудочка с явлениями его субэндокардиальной ишемии, отклонение ЭОС влево. Сочетание КоА с другими ВПС проявляется усилением гипертрофии левых или правых отделов сердца в зависимости от характера порока и степени легочной гипертензии. Относительно часто выявляются признаки перегрузки левого или правого предсердий. Рентгенологическиепризнаки у детей старшего возраста включают узурацию нижних краев ребер. Сердце может иметь шаровидную конфигурацию с приподнятой верхушкой. У детей грудного возраста отмечаются признаки кардиомегалии, венозного застоя в легких. Сердце в основном имеет «аортальную» конфигурацию, но может быть и овоидной формы. ДЭхоКГ визуализирует область сужения аорты, определяет градиент давления в участке сужения сосуда, выявляет сопутствующие сердечные аномалии. Дифференциальный диагнозКоА проводят с гипертрофической кардиомиопатией, артериальной гипертензией, клапанным стенозом аорты. Лечение. Основным показанием к операции у грудных детей является наличие КоА с недостаточностью кровообращения. До операции проводится терапия дигоксином, при низком сердечном выбросе – допамином, при застойной сердечной недостаточности – диуретиками. У новорожденных с предуктальной КоА применяют простагландины группы Е для сохранения открытого артериального протока. У детей старшего возраста до операции артериальную гипертензию корригируют β-адреноблокаторами. Постоперативная гипертензия устраняется путем в/в введения нитропруссида или β-адреноблокаторов - эсмолола. Многие пациенты после операции нуждаются в продолжении гипотензивной терапии несколько месяцев или лет ингибиторами АПФ, иногда в комбинации с β-адреноблокаторами. Операция заключается в резекции суженного участка аорты с анастомозом конец-в-конец. Осложнения. КоА является «пожизненным» заболеванием, осложнения могут наблюдаться как до операции, так и через много лет после хирургического лечения. Наиболее частые осложнения: рекоарктация аорты, аневризма аорты, мозговые аневризмы с разрывом и высокой смертностью, паралич, гипертрофическая кардиомиопатия у новорожденных детей с критическим сужением аорты, аритмии, инфекционный эндокардит. Прогноз. Изолированная КоА приводит к смерти у более 40% детей в течение первого года жизни. При сочетании КоА с другими ВПС умирают до 90% детей, несмотря на медикаментозную терапию. Основные причины смерти – недостаточность кровообращения и почечная недостаточность. У детей, у которых не была выполнена хирургическая коррекция порока средняя продолжительность жизни составляет 35 лет. Меньше, чем 20% без хирургической коррекции доживает до 50 лет. Факторы, которые влияют на смертность: возраст пациента, масса тела, наличие или отсутствие значимых сердечно-сосудистых аномалий, артериальная гипертензия, внутричерепные кровоизлияния, разрыв или расслоение аортальной стенки, инфекционный эндокардит, застойная сердечно-сосудистая недостаточность. Если КоА устранена хирургическим путем в возрасте до 14 лет, то 20-летняя выживаемость составляет 91%; если – после 14 лет – 79%. После хирургической коррекции КоА 97–98% пациентов имеют СН I степени (I ФК по NYHA), так как у них наблюдается нарушенная диастолическая функция и гипертрофия левого желудочка, несмотря на хорошие гемодинамические показатели в покое. Во время беременности у женщин с неоперированной КоА высокий риск осложнений как у матери так и у плода. Материнская смертность составляет в этих случаях 3–8%. Даже, если КоА была своевременная устранена, у беременной сохраняется высокий риск расслоения аорты, разрыва церебральных аневризм в третьем триместре беременности из-за гемодинамических и гормональных изменений в этот период. Все беременные женщины, у которых в анамнезе была КоА, представляют собой группу риска по течению беременности. Наличие значительной КоА, в том числе резидуальной или повторной, является противопоказанием к беременности. Вопросы к экзамену. Коарктация аорты. Гемодинамические нарушения. Клиническая картина. Диагностика. Лечение. Прогноз. Полная транспозиция магистральных сосудов (ПТМС) – ВПС, при котором аорта отходит от морфологически правого желудочка и несёт венозную кровь к тканям организма, а легочная артерия отходит от морфологически левого желудочка и несёт артериальную кровь к лёгким. Эпидемиология.ЧастотаПТМС составляет 12-20% среди всех ВПС, и 23% среди критических ВПС. ПТМС чаще обнаруживается у мальчиков. С большой частотой ПТМС сопутствуют ДМЖП, стеноз легочной артерии, аномалии коронарного кровообращения. Г 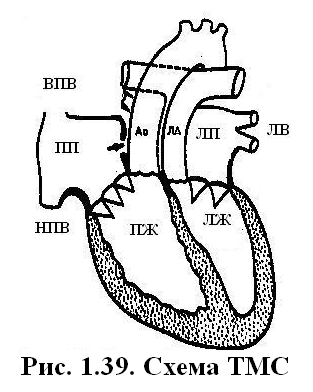 емодинамика. Во внутриутробном периоде, в отсутствии функционирования малого круга кровообращения ПТМС практически не влияет на развитие плода. Ребенок рождается в срок, с хорошим весом. емодинамика. Во внутриутробном периоде, в отсутствии функционирования малого круга кровообращения ПТМС практически не влияет на развитие плода. Ребенок рождается в срок, с хорошим весом.После рождения, при данном пороке аорта, отходящая от правого желудочка, несёт венозную кровь, которая, пройдя системный круг, возвращается через полые вены в правое предсердие. Артериальная кровь лёгочной артерии, отходящей от левого желудочка, пройдя через лёгкие, возвращается в левое предсердие. Большой и малый круг кровообращения разобщены. В большом круге кровообращения постоянно циркулирует кровь с низким содержанием кислорода, а в малом круге кровообращения – с высоким. Жизнь возможна при наличии коммуникаций между ними: ОАП, ДМЖП, ДМПП. Шунтирование крови при ТМС всегда двухстороннее. При рождении в связи с падением лёгочного сосудистого сопротивления происходит веноартериальный сброс крови через ОАП. Резко возрастает объём циркулирующей крови в малом круге кровообращения, что приводит к сбросу крови слева направо через ДМПП. Двунаправленный сброс крови происходит при наличии ДМЖП: справа налево - во время систолы и слева направо – во время диастолы. При сопутствующем стенозе лёгочной артерии или высокой лёгочной гипертензии шунтирование через ДМЖП происходит в другом порядке: слева направо – в систолу и справа налево – в диастолу. Значительная гиперволемия малого круга кровообращения возникает при большом диаметре ОАП или ДМЖП. При наличии ДМЖП у больных с ПТМС высокая лёгочная гипертензия развивается быстрее (уже к 3-4месяцам), чем при бледных пороках с обогащением малого круга кровообращения и быстро приобретает склерозирующий характер. Компенсаторно у пациентов с ПТМС развивается полицитемия, полиглобулия, коллатеральное кровообращение через бронхиальные сосуды лёгких, увеличивается объём циркулирующей крови. В связи с тем, что правый желудочек функционирует в режиме большого круга кровообращения, против высокого периферического сопротивления в аорте, он значительно гипертрофируется. Гипертрофия левого желудочка наступает позже из-за увеличенного легочного кровотока и перегрузки объёмом. Более быстрая и выраженная гипертрофия левого желудочка наступает при сопутствующем стенозе лёгочной артерии. Однако все эти механизмы не могут компенсировать выраженной артериальной гипоксемии и гипоксии. У больных с ПТМС существует резкий контраст между газовым составом крови в легочных венах и аорте. В крови, оттекающей от легких рО2 составляет 100-110 мм рт. ст., рСО2 – 15-25 мм рт. ст. В большого круга кровообращения рО2 крови составляет 35–37 мм рт. ст., рСО2 – около 45 мм рт. ст. Поэтому уже через несколько часов после рождения ребенка развивается дефицит кислорода, возрастают анаэробный метаболизм и продукция лактата, истощаются запасы гликогена. Развиваются метаболический ацидоз и нарушения функции клеток. Анамнез, клиника. ПТМС, проявляется уже в роддоме цианозом. Тяжесть цианоза зависит от количества коммуникаций. Самый тяжёлый цианоз («чугунный») отмечается при наличии только ООО. Быстро прогрессирует гипотрофия и отставание в физическом и психомоторном развитии. Появляются признаки хронической гипоксии – изменения концевых фаланг пальцев и ногтей («барабанные палочки» и «часовые стёкла»). Кардиомегалия развивается к месячному возрасту из-за гипертрофии и дилатации правого желудочка. Границы сердца расширены в поперечнике. У более старших детей развивается центральный сердечный горб. Определяется систолическое дрожание. I тон на верхушке громкий, II – акцентирован, особенно при ДМЖП. Шум проявляется не всегда в первые дни жизни, и соответствует по топике сопутствующей коммуникации. При ТМС с ДМЖП и подклапанным стенозом лёгочной артерии, так же как и при тетраде Фалло, могут наблюдаться гипоксемические кризы. Генез этих кризов, как и при тетраде Фалло, связан со спазмом мышц выходного отдела левого желудочка, при котором резко нарушается и без того сниженный легочный кровоток и усиливается гипоксемия. Развивается ранняя рефрактерная сердечная недостаточность. Диагноз ПТМС основывается на выявлении у ребенка с цианозом и недостаточностью кровообращения кардиомегалии, органических шумов различной локализации (компенсирующие ВПС). Лабораторные исследования ЭКГ: ЭОС отклонена вправо. Отмечаются признаки гипертрофии правого желудочка и правого предсердия. При наличии ДМЖП и ОАП – определяются признаки гипертрофии левого желудочка. Рентгенологически при ПТМС легочный рисунок чаще всего усилен по артериальному руслу, особенно при ТМС в сочетании с ДМЖП и ОАП. Определяется кардиомегалия (по форме сердце чаще напоминает «яйцо, лежащее на боку»). Сосудистый пучок в переднезадней проекции узкий, в боковой – широкий. При сочетании ТМС с ДМЖП и подклапанным стенозом легочной артерии лёгочный рисунок обеднён. Оба желудочка увеличены, однако кардиомегалия менее выражена, чем при большом ДМЖП и гиперволемии малого круга кровообращения. ДЭхоКГ выявляет аорту, отходящую от правого желудочка и лёгочную артерию, отходящую от левого желудочка. Нередко обнаруживаются сопутствующие аномалии: ДМЖП, ОАП, стеноз легочной артерии, аномалии коронарного кровообращения. Дифференциальный диагноз необходимо проводить с тетрадой Фалло, атрезией лёгочной артерии, общим артериальным стволом, тотальным аномальным дренажом лёгочных вен. Лечение ПТМС на первом этапе направлено на предупреждение закрытия ОАП, особенно при ТМС с ДМЖП и обструкцией выводного тракта левого желудочка (проводится инфузия простагландина Е1). Также важно корригировать метаболический ацидоз и анемию, сердечную недостаточность, объем циркулирующей крови. У новорожденных с выраженной гипоксемией проводится паллиативная операция под контролем ультразвука – закрытая атриосептостомия с помощью специального баллона (процедура Рашкинда) для увеличения межпредсердного сообщения. В случаях ригидной межпредсердной перегородки возможно применение ножевой атриосептостомии или дилатация отверстия баллоном высокого давления. Показанием для радикальной оперативной коррекции является сам порок с выраженной гипоксемией. К вмешательствам, полностью устраняющим гипоксемию, относятся операция анатомической коррекции порока (артериальное переключение с реимплантацией венечных артерий, операция Жатене) и операция Мастарда и Сеннинга (предсердное переключение или гемодинамическая коррекция) в пределах первого месяца жизни. При наличии ДМЖП или лёгочного стеноза нагрузка на левый желудочек сохраняется. Поэтому анатомическая коррекция с закрытием ДМЖП возможна и в более поздние сроки (в 3-6 мес.). Операция по предсердному переключению заключается в том, что в условиях искусственного кровообращения и регулируемой гипотермии проводится атрисептопластика. При этом создается канал для дренирования крови из легочных вен и коронарного синуса через трикуспидальный клапан в правый желудочек, а крови из полых вен через митральный клапан – в левый желудочек, переводя ПТМС в корригированную. У детей более старшего возраста с ДМЖП и выраженным легочным стенозом выполняют операцию Растелли. Коррекция заключается в том, что создается внутрисердечный «туннель» для оттока крови из левого желудочка в аорту и имплантируется кондуит между правым желудочком и лёгочным стволом. Осложнение. После гемодинамической коррекции (предсердное переключение) системным остаётся правый желудочек. При данном типе операции не бывает долговременного хорошего результата. В условиях высокого давления насосная функция правого желудочка постепенно снижается, нарушается функция трикуспидального клапана, и при этом часто возникают нарушении ритма. Прогноз. 30% детей с ПТМС умирают на первой неделе, 50% - в периоде новорожденности и 90% - в течение первого года жизни, до двух лет доживают не более 7% больных. При сочетании ПТМС с большим ДМЖП и умеренным стенозом лёгочной артерии (что является наилучшей корригирующей комбинацией), при естественном течении порока больные доживают до 4-5 лет. Основными причинами смерти являются тяжёлая гипоксия и ацидоз, сердечная недостаточность, застойно-бактериальные пневмонии. Вопросы к экзамену. Транспозиция магистральных артерий. Анатомические варианты порока. Гемодинамические нарушения. Сроки выявления. Клиническая картина. Диагностика. Сроки хирургического лечения. Врожденные пороки сердца с цианозом Тетрада Фалло (ТФ) – многокомпонентный ВПС, включающий в себя стеноз выводного отдела правого желудочка, ДМЖП, декстрапозицию аорты и гипертрофию правого желудочка. Эпидемиология. ЧастотаТФсоставляет 11-13% среди всех ВПС по клиническим данным, и 4% среди критических ВПС. ТФ входит в десятку наиболее распространённых ВПС. В 40% случаев ТФ сочетается с другими сердечными аномалиями. Этиология. В основе нарушений эмбриогенеза лежит ротация артериального конуса против часовой стрелки и смещение конусной перегородки вперед и влево. Это не позволяет соединиться аорте с межжелудочковой перегородкой (МЖП) и формирует ДМЖП, а устье аорты оказывается расположенным над МЖП («сидящая верхом» над перегородкой аорта). Кроме того, смещение конусной перегородки вперёд и влево приводит к сужению и обструкции выходного тракта правого желудочка. Декстрапозиция аорты при ТФ является не истинной, а вторичной и рассматривается как смещение её устья вправо по отношению к межжелудочковой перегородке. При этом фактически аорта часто отходит не только от левого, но и правого желудочка. Гипертрофия правого желудочка формируется как компенсаторный механизм из-за систолической перегрузки сопротивлением. Г 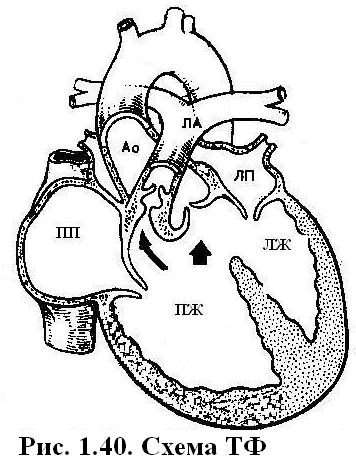 емодинамика. Из четырёх компонентов порока определяющим является степень стеноза выходного отдела правого желудочка. Наиболее частым вариантом обструкции правого желудочка выявляется изолированный инфундибулярный стеноз. Реже отмечается сочетание инфундибулярного стеноза и клапанного стеноза лёгочной артерии. Стенозирование легочной артерии расценивается как умеренное при уменьшении диаметра устья лёгочной артерии и её ствола менее 80% диаметра устья аорты. При уменьшении этих параметров менее 50% диаметра аорты – как тяжёлый стеноз. емодинамика. Из четырёх компонентов порока определяющим является степень стеноза выходного отдела правого желудочка. Наиболее частым вариантом обструкции правого желудочка выявляется изолированный инфундибулярный стеноз. Реже отмечается сочетание инфундибулярного стеноза и клапанного стеноза лёгочной артерии. Стенозирование легочной артерии расценивается как умеренное при уменьшении диаметра устья лёгочной артерии и её ствола менее 80% диаметра устья аорты. При уменьшении этих параметров менее 50% диаметра аорты – как тяжёлый стеноз.При умеренной выраженности стеноза, из-за малого сопротивления кровотоку сосудов лёгких, кровь из правого желудочка поступает в лёгочную артерию и не сбрасывается в аорту и в левый желудочек через ДМЖП. На начальных этапах течения порока из-за более высокого давления в левом желудочке возможен лево-правый сброс крови через ДМЖП. По мере роста ребенка на первом году жизни, увеличения размеров камер сердца и ударного объёма крови, значительно возрастает относительная степень стеноза лёгочной артерии. Это приводит к существенной систолической перегрузке сопротивлением правого желудочка, и он гипертрофируется. При большом ДМЖП систолическое внутрижелудочковое давление в нём сравнивается с давлением в левом желудочке. К 6-10 месяцем жизни сначала появляется транзиторный сброс крови справа налево (при крике, натуживании, сосании), а затем формируется постоянный право-левый шунт с развитием артериальной гипоксемии. Величина шунта в зависимости от степени стеноза может составлять от 30% до 80% минутного объёма малого круга кровообращения. При этом развивается гиповолемия малого круга кровообращения. Левое предсердие из-за недогруженности малого круга кровообращения гипоплазировано. В фазе первичной адаптации при значительном стенозе лёгочной артерии, выживаемость детей зависит от наличия ОАП, через который кровь из аорты поступает в малый круг кровообращения и степени развития коллатерального кровообращения. При ТФ существует также и гемическая компенсация артериальной гипоксемии за счёт высокой полицитемии (эритроцитемии) и увеличения содержания гемоглобина. При физической нагрузке увеличивается минутный объем кровотока и венозный возврат крови к правому желудочку, что ещё больше увеличивает степень относительного стеноза и способствует большему сбросу крови справа налево через шунт. Это приводит к усилению гипоксемии. При длительном существовании некорригированного порока из-за высокого давления в правом желудочке и дистрофических изменений в миокарде (обычно после 3-6 лет) возможно развитие сердечной недостаточности. Анамнез, клиника. На внутриутробное развитие плода ТФ не оказывает существенного влияния, дети рождаются с нормальной длиной и массой тела. В первые 4-6 недель у них нет ни цианоза, ни отдышки, сосание и прибавка в массе тела удовлетворительные. Первым признаком порока может быть систолический шум легочного стеноза или шум незаращенного ОАП. После 6-8 недель появляются одышка и бледность при сосании и плаче. Цианоз вначале транзиторный, после года цианоз быстро нарастает и у 60-70% больных становится постоянным и тотальным. Его интенсивность варьирует от бледно-фиолетового до сине-малинового или чугунно-синего. Цианоз не связан с недостаточностью кровообращения, а обусловлен повышенным содержанием в артериальной крови восстановленного гемоглобина. Хроническая гипоксия органов приводит к их дисфункции, отставанию в физическом и умственном развитии. У большинства больных имеются изменения концевых фаланг конечностей в виде «барабанных палочек» и ногтей в виде «часовых стёкол». Также часто встречаются нарушения со стороны костно-мышечной системы: уплощение грудной клетки, сколиоз, неправильный рост зубов, слабо развитая мышечная масса. При физикальном обследовании пульс удовлетворительного наполнения, САД умеренно снижено. Во втором-третьем межреберье пальпируется систолическое дрожание, возможна эпигастральная пульсация. Границы сердца могут быть умеренно расширенными в поперечнике. Первый тон не изменен, второй тон ослаблен над лёгочной артерией (из-за гиповолемии малого круга кровообращения). Во втором-третьем межреберье слева выслушивается грубый, скребущий систолический шум лёгочного стеноза. Шум проводится на сосуды шеи и в межлопаточное пространство. Шум ДМЖП в третьем-четвёртом межреберье слева от грудины может быть очень умеренным или вообще не выслушиваться из-за малого градиента давления между желудочками. На спине в межлопаточном пространстве может выслушиваться систолодиастолический шум коллатерального кровотока. Характерным клинико-гемодинамическим синдромом при ТФ является одышечно-цианотический приступ. Первые приступы возникают на 3-6 месяце жизни, и учащаются к 1-3 годам. Внезапно, после физической или эмоциональной нагрузки возникает резко выраженная одышка (до 70-80 в 1 минуту у детей младшего возраста), усиливается тотальный тёмно-фиолетовый цианоз. Возможно развитие комы и судорог. Приступы различны по тяжести и продолжительности – от 10-15 секунд до 2-3 мин и обычно спонтанно прекращаются. После приступа больные жалуются на резкую слабость. Иногда отмечаются нестойкие гиперкинезы. В редких случаях могут быть тяжелые нарушения мозгового кровообращения и летальный исход. Генез приступов связывают с мышечным спазмом в инфундибулярном отделе правого желудочка, который приводит к почти полной обструкции выходного тракта и сбросу всей венозной крови через ДМЖП и резчайшей гипоксемии. К 4-6 годам частота и интенсивность приступов уменьшается или они полностью исчезают. Диагноз ТФ устанавливается у детей с тотальным цианозом, одышечно-цианотическими приступами и выслушиванием шумов в сердце органического характера. Лабораторные исследования ЭКГ. ЭОС отклонена вправо. Признаки гипертрофии правого желудочка, а затем правого предсердия. Рентгенологически при ТФ определяется форма сердца в виде «деревянного башмачка». Сердце, как правило, небольших размеров из-за отсутствия дилатации полостей. Лёгочный рисунок обеднён. ДЭхоКГ позволяет выявить ДМЖП, смещение аорты, стеноз лёгочной артерии, степень его выраженности, увеличение толщины межжелудочковой перегородки и передней стенки правого желудочка. При ДЭхоКГ обнаруживается турбулентный поток крови через ДМЖП и в лёгочной артерии, градиент давления между правым желудочком и лёгочной артерией. Дифференциальный диагнознеобходимо проводить с атрезией лёгочной артерии, общим артериальным стволом, аномалией Эбштейна, единственным желудочком сердца, двойным отхождением магистральных сосудов от правого желудочка. Лечение при ТФ направлено на коррекцию гипотрофии, анемии, улучшение реологических свойств крови (назначение антиагрегантов и антикоагулянтов). При одышечно-цианотическом приступе проводят оксигенотерапию, подкожно вводят кордиамин, промедол, капельно трансфузию «поляризующей смеси», при судорогах – ГОМК; при развитии гипоксической комы – анаприлин. Для профилактики гипоксических приступов назначают β-адреноболкаторы (обзидан, индерал, анаприлин). При некупирующемся одышечно-цианотическом приступе экстренно проводят паллиативную операцию – наложение системно-лёгочного анастомоза. Радикальную операцию, как правило, выполняют в сроки от 6 месяцев до 3-х лет. Цель операции – закрыть ДМЖП и устранить обструкцию выходного отдела правого желудочка. Некоторые кардиохирурги прибегают к радикальной операции до 3-6 месяцев, независимо от симптоматики. Осложнения. При ТФ возможны такие осложнения как абсцесс головного мозга, кровоизлияние в головной мозг, бактериальный эндокардит. Осложнения радикальной операции: остаточный стеноз лёгочной артерии, реканализация ДМЖП, нарушения ритма и проводимости, в том числе внутрижелудочковые (полная блокада правой ножки пучка Гиса, частичная блокада левой ножки пучка Гиса). При развитии полной АВ-блокады – проводится имплантация электрокардиостимулятора. Прогноз. Средняя продолжительность жизни неоперированных больных с ТФ –12 лет. На первой неделе жизни погибают около 6% больных; к концу первого года жизни – до 25%; к 40 годам – 95%. В старшем возрасте основные причины смерти - сердечная недостаточность, аритмии, внезапная смерть. Паллиативные операции хоть и удлиняют продолжительность жизни, однако не улучшают прогноз. После радикальной операции, проведенной без послеоперационных осложнений, прогноз у пациентов удовлетворительный. Послеоперационная выживаемость к 36 годам составляет 85%. Вопросы к экзамену. Тетрада Фалло. Анатомические составляющие порока. Гемодинамические нарушения. Сроки выявления. Клиническая картина. Причины отсутствия сердечной недостаточности. Изменения показателей периферической крови. Диагностика. Сроки выявления цианоза. Лечение. Купирование одышечно-цианотических приступов. Показания к кардиохирургической коррекции. Атрио-вентрикулярная коммуникация, открытый атриовентрикулярный канал (АВК) – ВПС, составными компонентами которого являются первичный дефект межпредсердной перегородки, расщепление створок митрального и трикуспидального клапанов, дефект межжелудочковой перегородки. Порок может быть частичным и полным. При полной АВК определяются оба септальных дефекта и единый атриовентрикулярный клапан. При частичной АВК – первичный ДМПП с разделенными отверстиями для митрального и трикуспидального клапанов, которые сформированы на одном уровне (в норме трикуспидальный клапан смещён верхушке сердца). АВ-клапаны, при этом варианте порока, прикреплены к верхнему краю межжелудочковой перегородки. Расщепление створки митрального клапана может быть в виде небольшого диастаза или доходить до её основания. От краев расщепления нередко отходят дополнительные хорды, прикрепленные к межжелудочковой перегородке, также возможны аномалии папиллярных мышц. Эпидемиология. Частота АВК среди всех ВПС составляет 3-4%, и 6% среди критических ВПС. У 60-70% детей с АВК выявляется полная форма порока, 50% этих больных имеют синдром Дауна. Г 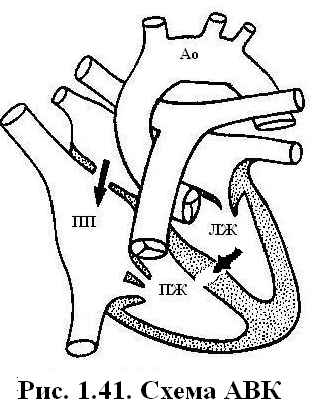 емодинамика. При частичной АВК нарушения гемодинамики определяются регургитацией на митральном клапане и шунтированием крови через дефект межпредсердной перегородки. В большинстве случаев имеется большой сброс крови слева направо, гиперволемия малого круга кровообращения и объемная перегрузка обоих желудочков. В период систолы желудочков происходит обратный сброс крови из левого желудочка в левое предсердие из-за недостаточности митрального клапана, а затем из левого предсердия в правое предсердие через ДМПП. емодинамика. При частичной АВК нарушения гемодинамики определяются регургитацией на митральном клапане и шунтированием крови через дефект межпредсердной перегородки. В большинстве случаев имеется большой сброс крови слева направо, гиперволемия малого круга кровообращения и объемная перегрузка обоих желудочков. В период систолы желудочков происходит обратный сброс крови из левого желудочка в левое предсердие из-за недостаточности митрального клапана, а затем из левого предсердия в правое предсердие через ДМПП. Умеренная легочная гипертензия может быть следствием как постоянной гиперволемии в малом круге кровообращения, так и венозного застоя при малых размерах ДМПП, приводящих к повышенному давлению в левом предсердии. Высокая легочная гипертензия развивается на поздних стадиях заболевания. При полной форме АВК нарушения гемодинамики определяются недостаточностью атриовентрикулярных клапанов и шунтированием крови через дефекты межпредсердной и межжелудочковых перегородок. При этой форме порока нагрузка на сердце возникает уже внутриутробно и может приводить к появлению сердечной недостаточности и водянке плода. Из-за большого лево-правого сброса крови, которая вновь поступает в легочную артерию, развивается объемная перегрузка правых и левых отделов сердца. Давление в правом и левом желудочках рано становится равным, что приводит к раннему развитию высокой легочной гипертензии. Клиника. При частичной форме АВК клиническая симптоматика определяется в первую очередь степенью митральной недостаточности. При её небольшой величине порок протекает как простой ДМПП, но проявляется в более ранние сроки. При значительной регургитации клапана, уже в периоде новорожденности могут появиться признаки выраженной сердечной недостаточности, возникают ОРИ, со склонностью к затяжному течению, дети с первых месяцев жизни отстают в физическом развитии. При общем предсердии у детей развивается умеренный цианоз. При физикальном обследовании определяется левосторонний сердечный горб, систолическое дрожание в IV межреберье и/или над верхушкой сердца. Аускультативно выслушивается два шума: шум относительного стеноза лёгочной артерии во II межреберье слева от грудины (шум изгнания) и на верхушке и вдоль левого края грудины систолический шум митральной недостаточности. При полной форме АВК основное ухудшение наступает к концу первого месяца жизни, когда снижается резистентность легочных сосудов и нарастает легочный кровоток. Сразу после рождения ребенка отмечается быстрая утомляемость при кормлении, потливость, нарастают признаки сердечной недостаточности. Дети отстают в физическом развитии, у них возникают повторные ОРИ и пневмонии. Как правило, рано формируется сердечный горб. При нагрузке происходит кратковременная смена шунта на право-левый сброс крови, что сопровождается появлением цианоза. При физикальном обследовании, пальпаторно определяется систолическое дрожание. Аускультативно – тоны сердца усилены, при развитии высокой легочной гипертензии выслушивается акцент второго тона над легочной артерией, вдоль левого края грудины грубый систолический шум (дефект межжелудочковой перегородки), систолический шум клапанной недостаточности, проводящийся в левую аксилярную область. Однако шум недостаточности митрального клапана может быть перекрыт шумом ДМЖП. Высокая легочная гипертензия (синдром Эйзенменгера) развивается уже к концу первого года жизни, а концу второго возникают необратимые изменения в сосудах лёгких. Особенно подвержены этим изменениям больные с трисомией по 21 паре хромосом - болезни Дауна в связи с тем, что АВК сочетается с хронической бронхолегочной патологией. Причинами смерти при АВК являются тяжелая сердечная недостаточность, высокая легочная гипертензия, фатальные аритмии. Диагноз АВК можно заподозрить при наличии сердечной недостаточности, горба, грубых систолических шумов, цианоза. Лабораторные исследования ДЭхоКГ. Диагностика частичной и полной формы АВК в основном основывается на данных ДЭхоКГ. При частичной форме АВК определяется первичный ДМПП, атриовентрикулярные клапаны расположены на одном уровне, расщепление передней створки митрального клапана и регургитация на нем. Количественно оценивается давление в правом желудочке и лёгочной артерии и степень регургитации на митральной клапане. При полной АВК также выявляется полная морфологическая и гемодинамическая характеристика порока: первичный ДМПП, ДМЖП, наличие общего атриовентрикулярного клапана (со створкой, пересекающей межжелудочковую перегородку). Определяется направление шунта, давление в правом желудочке и лёгочной артерии и степень регургитации на митральном и трикуспидальном клапанах. Рентгенологически при частичной форме АВК лёгочный рисунок варьирует; характерно его усиление, как по артериальному, так и по венозному руслу. Форма сердца различна. Выраженная митральная недостаточность сопровождается увеличением левого предсердия и левого желудочка. При небольшой степени преобладают признаки увеличения правого предсердия. При полной форме АВК легочный рисунок значительно усилен по артериальному руслу, меньше - по венозному. Могут выявляться признаки высокой лёгочной гипертензии, тень сердца увеличена в размерах за счёт всех камер сердца. ЭКГ при частичной форме АВК выявляет отклонение электрической оси влево, в том числе и у новорожденных. Левограмма чаще всего сочетается с признаками перегрузки правого желудочка. В случае значительной недостаточности митрального клапана начинают преобладать признаки перегрузки левого предсердия и левого желудочка. При полной форме АВК обнаруживают отклонение электрической оси сердца влево в сочетании с выраженными перегрузками обоих желудочков и левого предсердия. Дифференциальный диагноз неполной формы АВК проводят с врожденной митральной недостаточностью, с полной формой АВК. При полной форме АВК – с большим дефектом межжелудочковой перегородки, единственным желудочком сердца. Лечение. Медикаментозное лечение при АВК направлено на купирование признаков сердечной недостаточности с включением в схему лечения дигоксина, при необходимости – ингибиторов АПФ и мочегонных препаратов. Плановое хирургическое вмешательство при неполной форме АВК показано в возрасте 1-2 лет. При выраженной митральной недостаточности или общем предсердии – хирургическая коррекция проводится раньше. Коррекция заключается в пластике дефекта межпредсердной перегородки и реконструкции расщепленных створок митрального и трикуспидального клапанов. Хирургическое лечение при полной форме АВК возможно только в раннем возрасте (чаще в первые месяцы жизни), до развития синдрома Эйзенменгера. Суть радикальной операции состоит в том, что проводится разделение общего атриовентрикулярного канала на митральную и трикуспидальную части, закрытие одной или двумя заплатами септальных дефектов. Осложнения. При выраженных формах порока высока вероятность быстрого развития сердечной недостаточности, возникновений нарушений ритма сердца, инфекционного эндокардита. Прогноз при АВК остается неудовлетворительным. При естественном течении порока в течение первых шести месяцев жизни погибает до 27% больных, до конца первого года жизни – 40%. В течение последующих четырёх лет умирают ещё 10%. В единичных случаях больные доживают до зрелого возраста, однако являются тяжелыми инвалидами. После адекватно выполненной радикальной операции, при полном АВК в раннем детстве, в последующие годы жизни требуются повторные операции по реконструкции атриовентрикулярных клапанов. Прогноз определяется размерами ДМПП и степенью митральной недостаточности. Прогноз после радикальной оперативной коррекции при неполном АВК удовлетворительный, выживаемость больных через 20 лет составляет 94%. Остаточная митральная регургитация не влияет на прогноз, в редких случаях требуется повторная операция на клапане или его протезирование. Послеоперационная летальность при полной форме АВК составляет 50%.  ЧАСТЬ II. НЕОНАТОЛОГИЯ Часть II. НЕОНАТОЛОГИЯ Глава VIII. Болезни системы крови |
