Методическое пособие по педиатрии ббк. Методическое пособие по педиатрии включает в себя материал, соответствующий требованиям Программы для студентов по Педиатрии
 Скачать 5.78 Mb. Скачать 5.78 Mb.
|
Возможные варианты питания ребенка в зависимости от гестационного возраста и наличия заболеваний:
– грудное вскармливание; – женское молоко с обогащенным белково-минеральным фортификатором (до достижения массы 3000-4000 г); – женское молоко + назначение глицерофосфата кальция;
– грудное молоко + специализированная смесь для недоношенных детей (а также СЗВУР, недостаточная прибавка массы тела, необходимость уменьшить объем питания); –специализированная смесь для недоношенных детей. Специализированные смеси для недоношенных детей, имеют в названии приставку «пре– (premature)». Состав специализированных смесей откорригирован в соответствии с повышенными питательными потребностями по особым ингредиентам. Для новорожденных, находящихся в очень тяжелом состоянии для начального энтерального питания при отсутствии грудного молока можно использовать смеси на основе полного гидролиза сывороточного белка (около 30% от общего объема питания). При отсутствии или недостаточности грудного молока в дальнейшем недоношенным детям целесообразно назначение смесей с добавлением пребиотических волокон-олигосахаридов. При необходимости введения дополнительных продуктов питания необходимо проводить расчеты питания на их откорригированный возраст и принимать индивидуальные решения с учетом особенностей состояния ребенка. Усилители женского молока: «Пре-Семп», Семпер, Швеция, S-26-SMA», Вайет Ледерли, США. Смеси на основе полного гидролиза белка: «Алфаре» (Нестле, Швейцария), «Нутрилон Пепти ТСЦ» (Нутриция, Голландия). Зондовое кормление. Показания для проведения зондового питания: отсутствие сосательного и/или глотательного рефлекса вследствие выраженной морфо-функциональной незрелости; тяжелая внутриутробная или постнатальная инфекция, сопровождающаяся интоксикацией; внутричерепная родовая травма, родовая травма шейного отдела позвоночника, спинного и продолговатого мозга; ишемически-гипоксическое поражение центральной нервной системы (внутричерепное кровоизлияние, отек мозга); пороки развития твердого и мягкого неба, верхней губы; тяжелая дыхательная и сердечно-сосудистая недостаточность. Противопоказания для зондового питания: ближайший послеоперационный период после хирургических операций на желудочно-кишечном тракте; язвенно-некротический энтероколит, парез кишечника, мелена новорожденных, состояние тяжелой гипоксии, некорригируемая ИВЛ, наличие грубых нарушений водно-электролитного и кислотно-основного равновесия, использование миорелаксантов при ИВЛ. Зонд недоношенному ребенку вводится через нос или рот. Размеры зонда подбираются в зависимости от массы тела ребенка. Необходимо удостовериться, что зонд находится в желудке. Для этого провести оттягивание поршнем шприца желудочного содержимого. При обычном (дробном) зондовом питании, под действием силы тяжести, длительность кормления должна составлять не менее 10-15 мин. При постоянном зондовом питании объем и скорость введения питания назначается врачом (см. «алгоритм зондового питания»). При дробном кормлении после окончания введения молока постоянный зонд промывают 1-2 мл стерильной воды. Используемые в настоящее время мягкие зонды (силикон, полиуретан, бесфтолатный поливинилхлорид) целесообразно устанавливать не менее, чем на 7-14 дней и дольше, поскольку частое извлечение и установка зонда неприятны для ребенка и могут вызвать осложнения. После кормления следует поместить ребенка на правый бок или с приподнятым головным концом. Необходимое количество молока для зондового кормления рассчитывают калорийным методом. Суточный объем пищи = количество ккал в сутки Выделяют несколько этапов зондового питания. I. Адаптация к объему питания. Гастральное дробное (7-8 раз в сутки) питание: недоношенным с ОНМТ в первые 2 кормления дают стерильную воду или 5% раствор глюкозы, далее половинное грудное молоко. Детям с ЭНМТ, как правило, можно начинать энтеральное питание с этапа гастрального непрерывного питания с начальной скоростью инфузии 1 мл/кг/час. Объем первых 2-3 кормлений определяется исходной массой тела (табл. 4-13). В дальнейшем объем питания увеличивают. При появлении признаков замедленного опорожнения желудка дробное кормление заменяют непрерывным, оставляя объем и темп его увеличения прежним. Одновременно начинают стимуляцию деятельности кишечника: медикаментозную (прозерин 0,05% 0,05-0,1 мл Показание к переводу на непрерывное дуоденальное питание – сохраняющиеся 12 часов признаки дисфункции желудочно-кишечного тракта. Суточный объем и темп его увеличения прежние. Если на фоне указанных мероприятий в течение 12 часов сохраняются явления дисфункции кишечника, следует начинать непрерывное дуоденальное питание минимальным объемом, сочетая его с парентеральным. Возможен перевод на полное парентеральное питание в течение нескольких суток. При появлении признаков непереваривания грудного молока или энтеритного синдрома дробное кормление заменяют на непрерывное с добавлением медикаментов (панкреатин 0,1 При отсутствии положительной динамики грудное молоко частично заменяют элементной смесью. Суточный объем и темп его увеличения – по схеме. Сохраняющиеся указанные нарушения служат показателем для «разгрузки» энтерального питания на 1–2 сут. с переводом больного на сочетанное зондовое или полное парентеральное питание. В настоящее время даже детям с ОНМТ или ЭНМТ пытаются организовать грудное вскармливание. При наличии грудного молока этапы полного зондового питания и отмены зондового питания необходимо проводить с учетом Протокола грудного вскармливания недоношенных (цит. по Шабалову Н.П.), который предусматривает 4 этапа. На 1-м этапе – во время с зондового кормления сцеженным грудным молоком (этап полного зондового питания) ребенку дают сосать пустышку. 1. Начальный этап зондового питания 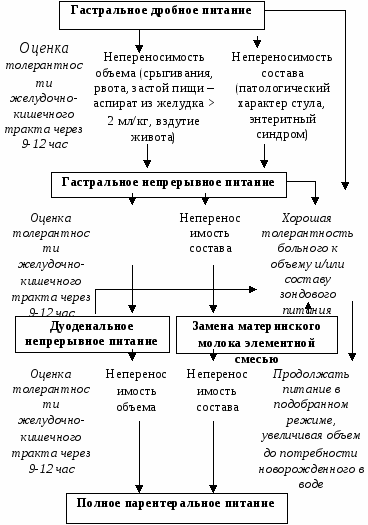 На 2-м этапе – у младенца с глотательным рефлексом (этап отмены зондового питания) осуществляют непитательное прикладывание к груди на 5-10 минут наряду с продолжающимся зондовым кормлением. На 3-м этапе – ребенок сосет и трубочку для кормления и сосок грудной железы одновременно. На 4-м этапе – ребенок высасывает норму молока из груди, таким образом, осуществляется переход не к искусственному, а к грудному вскармливанию. Рис. 2.2. Алгоритм зондового питания критически больных новорожденных (А.К. Любшис, 1987) 2. Этап полного (сбалансированного) зондового питания  3. Этап отмены зондового питания  Контроль эффективности питания недоношенных младенцев: ежедневное взвешивание (для детей с массой <750 г возможно взвешивание 1 раз в неделю с тщательным учетом гидробаланса); измерение окружности головы еженедельно, измерение длины тела ежемесячно; контроль уровня глюкозы (у здоровых через 2 часа после рождения, у больных через 30 минут после рождения; далее через каждые 4-6 часов до достижения возраста 48 часов), ежедневное измерение при интенсивном лечении уровня мочевины, K+, Na+, Ca2+ (сыворотки и мочи), альбумина, КОС; у условно здоровых и хорошо растущих недоношенных детей эти показатели следует исследовать еженедельно. Парентеральное питание (ПП) показано при наличии противопоказаний к энтеральному питанию: крайне тяжелое состояние недоношенного ребенка (независимо от гестационного возраста), пороки развития ЖКТ, выраженный геморрагический синдром. ПП не физиологично. ЭП следует вводить, когда ребенок сможет усваивать хотя бы минимальные количества молока («трофическое» питание). Ранее введение ЭП, преимущественно нативного материнского молока, даже по 1–3 мл за кормление не вносит существенного вклада в энергообеспечение, однако улучшает продвижение пищи по пищеварительному тракту, ускоряет процесс перевода ребенка на энтеральное питание за счет стимуляции желчеотделения, снижает вероятность развития холестаза. При применении ПП количество вводимых аминокислот увеличивают с 0,5 до 2,5 г/кг в сутки, при стабильном состоянии для глубоконедоношенных детей дозу аминокислот увеличивают до 3,0–3,5 г/кг в сутки. Жиры начинают вводить постепенно, начиная с 0,5 г/кг в сутки. Суточная доза липидов 0,5–1,0 г/кг восполняет потребность в незаменимых жирных кислотах. Полная суточная доза жиров – 2–4 г/кг. Введение этой дозы обеспечивает энергетические потребности роста, весовую прибавку и снабжение организма оптимальным количеством ω-6 и ω-3 незаменимых жирных кислот. Полная суточная доза глюкозы – 12–15 г/кг, энергетическое обеспечение составляет до 80–110 ккал/кг. Необходимую дозу глюкозы рассчитывают по скорости ее утилизации (скорость у недоношенных – 4,0–5,0 мг/кг в минуту в первые сутки жизни, затем постепенно увеличивается на 0,5–1,0 мг/кг до максимального уровня 11–12 мг/кг в минуту). Оценка эффективности применения ПП при критических состояниях у новорожденных: при отсутствии патологии почек используют метод оценки инкремента мочевины (разница концентрации мочевины до введения и после введения аминокислот). Чем ниже инкремент, тем выше эффективность ПП. Особенности развития недоношенных детей Физическое развитие недоношенных детей зависит от степени недоношенности (табл. 2.14). Чем меньше масса и длина тела при рождении, тем интенсивнее увеличиваются эти показатели в течение года. Длина тела недоношенного к концу первого года жизни достигает 65-75 см, т.е. увеличивается на 30-35 см (у доношенных – на 25 см). В тоже время недоношенные дети в первые 2-3 года жизни отстают от доношенных сверстников. Выравнивание показателей физического развития происходит на 2-3 году жизни, а в некоторых случаях и в возрасте 5-6 лет. Табл. 2.20. Средняя месячная прибавка массы у недоношенных детей
Отдаленные последствия недоношенности Осложнения неонатального периода отмечаются у 40-50% детей с низкой массой тела. Одна треть таких детей не проявляет нормальной и необходимой для постнатальной реакции адаптации гипофизарно-адреналовой системы на родовой стресс – плазматический уровень кортизола у них снижен сразу после рождения, и лишь у одной трети уровень этого адаптивного стероида в крови повышен. У детей с низкой массой тела при рождении особенно велик риск возникновения таких заболеваний, как перинатальные энцефалопатии (внутричерепные кровоизлияния, гипоксически-ишемические энцефалопатии), синдром дыхательных расстройств, общий отечный синдром, гипербилирубинемия и «ядерная желтуха», некротизирующий энтероколит, анемия, а также пневмония, сепсис, менингит. Особенно высока у таких детей частота поражения ЦНС, в том числе внутрижелудочковых кровоизлияний, которые являются одной из главной причин летальности в неонатальном периоде и инвалидности в последующие годы. Гипоксически-ишемические поражения мозга (малые инфаркты, очаги размягчения, перивентрикулярная лейкомаляция) у выживших детей представляют собою одну из главных причин психоневрологических нарушений, минимальных мозговых дисфункций, повышений судорожной готовности в процессе роста ребенка. Частота детского церебрального паралича, зарегистрированного к 2 годам жизни, составляет у них 14-16% при частоте около 0,2% среди всех новорожденных. Около 60% выживших недоношенных детей имеют нейросенсорные или неврологические нарушения, а 52% требуют повторных госпитализации по поводу различных заболеваний в течение первых 2 лет жизни. Относительный риск умственной отсталости с IQ менее 85 составляет 2,8-3,0. Ретинопатия (ретролентарная фиброплазия) выявляется у 25% детей с низкой массой тела, У большинства из них в последующие периоды жизни регистрируются снижение остроты зрения, а у 4-5 % детей с очень низкой массой тела – слепота. Тугоухость и нейросенсорная глухота (порог слуховой чувствительности снижен до 30 децибел) регистрируется примерно у 20% таких детей, причем у 2-4 % –имеет место выраженная глухота. Тугоухость часто является причиной задержки развития речи. У детей, родившихся с низкой массой тела, особенно часто развивается респираторной дистресс-синдром и формируется бронхолегочная дисплазия - важнейшая причина хронической дыхательной недостаточности в раннем возрасте. Среди выживших детей с экстремально низкой массой тела частота бронхолегочной дисплазии достигает 70%. У 60% детей, родившихся с низкой массой тела, в школьном возрасте отмечены аномалии поведения, возникают серьезные проблемы обучения, связанные со сниженными познавательными функциями ЦНС. Низкая иммунологическая реактивность детей с низкой массой тела определяет их высокую склонность к инфекционно-воспалительным заболеваниям - пневмонии, септицемии, менингитам. Примерно 1/3 детей с очень низкой массой тела при рождении становятся инвалидами детства. У недоношенных детей в 10-12 раз чаще выявляют пороки развития. Недоношенные новорожденные и дети с низкой массой тела при рождении составляют группу наибольшего риска перинатальных потерь и инвалидности в дальнейшем. В силу незрелости всех органов и систем течение неонатального периода и адаптации у недоношенных детей имеет свои особенности. Период адаптации к внеутробной жизни у недоношенных новорожденных завершается к концу 1-го месяца жизни. У данного контингента детей отмечают выраженную незрелость основных механизмов антибактериальной защиты. Течение приспособленного периода к внеутробной жизни у детей со сроком гестации менее 34-нед нередко сопровождается электролитным дисбалансом. Хроническая внутриутробная и постнатальная гипоксия, нарушение проницаемости гематоэнцефалического барьера – факторы, определяющие большую чувствительность ЦНС к гипербилирубинемии по сравнению с доношенными детьми. У недоношенных, особенно со сроком гестации менее 30 недель, обнаруживают транзиторный гипотиреоз. Микробиоценоз кишечника у детей, родившихся раньше срока, определен микрофлорой родовых путей матери, госпитальной флорой, характером вскармливания и антибактериальной терапии; формирование его не завершается к исходу неонатального периода (предпосылка для возникновения бактериальной инфекции). Профилактика преждевременного рождения детей предусматривает охрану здоровья будущей матери (предупреждение формирования хронических заболеваний, абортов, генитальной патологии, борьба с вредными привычками, полноценное питание беременной и др.). ОСОБЕННОСТИ ТЕЧЕНИЯ НЕКОТОРЫХ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ У НЕДОНОШЕННЫХ Гипоксически-ишемическая энцефалопатия у недоношенных имеет более серьезный прогноз, чем у доношенных детей. В остром периоде постасфиктических состояний у недоношенных часто развиваются: бронхолегочная дисплазия, некротически-язвенный энтероколит, внутрижелудочковые кровоизлиянии, инфекционные осложнения. Значительно чаще, чем у доношенных детей развивается полиорганная недостаточность. Большая часть недоношенных детей требует проведения реанимационных мероприятий уже в родильном зале. Неблагоприятные исходы энцефалопатий у недоношенных с низкой массой тела регистрируются значительно чаще, чем у доношенных Так, грубая задержка психомоторного развития, слепота, нарушения слуха выявляются в возрасте 1 года в 47% случаев. Для детей, родившихся с экстремально низкой массой тела резко повышается риск тяжелых поражений нервной системы. Продолжительность жизни у таких детей ниже, чем у здоровых сверстников. В тоже время вероятность благополучного исхода у детей с экстремально низкой массой тела при рождении в настоящее время повысилась. Типичным осложнение гипоксических состояний у недоношенных детей является перивентрикулярная лейкомаляция. Специфических для этого патологического состояния клинических проявлений нет. У таких детей выявляют мышечную гипотонию, судороги, гипорефлексию и др. По данным УЗИ (по de Vries L.S., 1994) выделяют следующие стадии этого состояния: - первая степень – преходящее повышение эхоплотности перивентрикулярных зон более 7 дней; - вторая степень – повышение перивентрикулярной эхоплотности в сочетании с мелкими локальными фронтопариетальными кистами; - третья степень – повышенная перивентрикулярная эхоплотность в сочетании с обширными перивентрикулярными кистозными поражениями; - четвертая степень – повышенная перивентрикулярная эхоплотность с распространением в белое вещество мозга и кистами белого вещества. У детей, перенесших перивентрикулярную лейкомаляцию часто выявляют ДЦП, расстройства интеллекта, стойкие двигательные нарушения. Для недоношенных детей с массой тела при рождении менее 1500 г характерно формирование ретинопатии недоношенных. В развитии этого патологического состояния важное значение имеет повреждающая роль гипоксии, недостаточность антиоксидантной защиты недоношенного и патологическое влияние на зрение высоких концентраций кислорода. Развитие детей, родившихся недоношенными имеет существенные особенности. Одним из важнейших факторов, оказывающих неблагоприятное влияние на развитие недоношенных детей, является срок гестации. Важную роль в формировании прогноза у недоношенных принадлежит качеству оказания медицинской помощи недоношенным детям. У детей, родившихся с экстремальной низкой массой тела, физическое развитие детей в возрасте 3 и 5 лет существенно отстает от физического развития доношенных. В тоже время к 8-9 годам грубые отставания в физическом развитии постепенно сглаживаются. Неблагоприятное влияние на физическое развитие детей, родившихся недоношенными, оказывает ЗВУР. При его наличии нарушения роста бываю более значительными. К школьному возрасту эти различия сохраняются. Структура соматической патологии у детей родившихся недоношенными следующая. На первом месте стоит патология органов дыхания. Несколько реже эта категория детей страдает заболеваниями нервной системы, анемиями, инфекционными болезнями и заболеваниями органов пищеварения. Неблагоприятное влияние на частоту перечисленной патологии оказывает наличие ЗВУР. Гипогликемия новорожденных у недоношенных детей выявляется в 4 раза чаще, чем у доношенных детей. Еще чаще гипогликемия обнаруживается при сочетании недоношенности с ЗВУР. Неонатальная гипокальциемия часто развивается у недоношенных (89% у детей с очень низкой массой тела) в первые 3 дня жизни. Поздняя неонатальная гипокальциемия у недоношенных связана в развитием рахита, нарушениями минерализации костей, недостаточным поступлением кальция с питанием. В связи с недостатком кальция у недоношенных может развиться остеопения. Главным признаком в этом случае является низкое содержание минерального компонента. Вместе с дефицитом кальция у недоношенных детей часто развивается и дефицит магния. На 3-4 неделе жизни у недоношенных детей, находящихся на искусственном вскармливании, возможно развитие позднего ацидоза недоношенных, что сопровождается одышкой, плохой прибавкой в массе тела эксикозом. Особенности проявлений внутричерепных кровоизлияний у недоношенных детей. Родовые травмы у недоношенных встречаются чаще, чем у доношенных. У многих недоношенных детей возможно бессимптомное течение родовых травм, или наличие слабо выраженной клинической картины. Одной из особенностей является преобладание в клинической картине дыхательных расстройств, что требует проведения дифференциального диагноза с СДР, пневмониями. Многие варианты внутричерепных кровоизлияний у недоношенных детей протекают достаточно однотипно, с преобладанием синдрома общего угнетения, выраженной мышечной гипотонией, угнетением сосательного и глотательного рефлекса, частыми срыгивания и рвотам. В других случаях, наоборот, преобладают симптомы возбуждения, частое развитие гидроцефального синдрома. Анемия у недоношенных требует более раннего лечения и упорного лечения. При уровне гематокрита менее 40%, количестве эритроцитов менее 3,9 млн., и гемоглобине ниже 130 г/л показано переливание эритроцитарной массы. Синдром дыхательных расстройств встречается тем чаще, чем ниже срок гестации. Так при сроке гестации менее 27 недель СДР развивается у 80-90% недоношенных, в то время как при сроке гестации 37 недель и более – у 1-2%. Клинические проявления СДР у недоношенных детей имеют ярко выраженные особенности: «хрюкающий выдох», раздувание щек, парадоксальное дыхание. Клиника СДР нередко сочетается с внутрижелудочковыми кровоизлияниями, перивентрикулярной лейкомаляцией, геморрагическим синдромом, полиорганной недостаточностью. Лечение СДР у недоношенных включает создание температурной защиты, использование сурфактанта (в том числе и в профилактических целях). Для определения тактики дыхательной терапии при СДР у недоношенных используют гипероксидный тест (исследование напряжения кислорода в крови после ингаляции 60% кислорода). Одной из причин, утяжеляющих течение СДР, пневмонии является функционирование боталлова протока. Для коррекции указанных нарушений используют введение индометацина, ипубруфена или хирургическое закрытие артериального протока. Бронхолегочная дисплазия – патологическое состояние, связанное с кислородозависимостью недоношенных детей. Данное патологическое состояние развивается тем чаще, чем ниже масса ребенка при рождении. Считают, что бронхолегочная дисплазия – это вариант хронической обструктивной болезни легких. К ранним проявлениям этого заболевания относят постепенно развивающуюся зависимость ребенка от кислорода, невозможность перехода к более низким параметрам оксигенотерапии. Дыхательная недостаточность часто протекает по обструктивному типу. Типичны приступы апноэ, эпизоды брадикардии. При рентгенологическом исследовании в легких выявляют плотные очаги (участки фиброза), чередующиеся с эмфизематозными участками («пчелиные соты»). Характерным является кардиомегалия с размытыми контурами сердца. Пневмонии у недоношенныхдетей развиваются значительно чаще чем у доношенных. Основными особенностями пневмоний у недоношенных считают:
Гипербилирубинемические состояния у недоношенных детей развиваются чаще и протекают тяжелее, чем у доношенных. В частности одним из факторов риска развития билирубиновой энцефалопатии является масса тела при рождении 1500 г и менее. У недоношенных детей гипербилирубинемия чаще, чем у доношенных требует проведения лечебных мероприятий (фототерапия, заменное переливание крови). Сепсис недоношенных детейпредставляет собой серьезную проблему в неонатологии. В отличие от доношенных детей, сепсис у недоношенных чаще вызывается грамотрицательными микроорганизмами. В клинической картине сепсиса у недоношенных преобладает подострое течение заболевания с появлением в первые дни заболевания таких неспецифических проявлений как: плохой аппетит, снижение сосательного рефлекса, снижение массы тела, появление приступов апноэ и эпизодов брадикардии, мышечной гипотонии, гипорефлексии, срыгиваний, рвоты, дисфункции кишечника, генерализованных отеков, снижения температуры тела, длительного сохранения желтухи. Для недоношенных детей характерен гипоергический вариант течения сепсиса. Основными проявлениями этого варианта течения сепсиса являются: лейкопения, выраженная анемия нормохромного характера, относительный нейтрофилез, моноцитопения, снижение количества эозинофилов, снижение уровня фибриногена, склонность к гипокоагуляции, склонность к развитию отеков, частое выявление пневмонии, инфекции мочевых путей. Вопросы к экзамену. Недоношенные дети. Понятие о недоношенности. Причины недонашивания. Критерии недоношенности. Группы недоношенных детей в зависимости от массы тела и гестационного возраста при рождении. Факторы, способствующие повышенной заболеваемости и летальности недоношенных. Физическое и нервно-психическое развитие недоношенных детей. Выхаживание и вскармливание недоношенных детей с различной массой тела в родильном доме и на втором этапе выхаживания. Принципы кувезного содержания. Особенности ухода. Расчет питания. Методика вскармливания. Используемые смеси для недоношенных детей. Онтогенетические особенности иммунной системы недоношенных детей в зависимости от гестационного возраста, влияющие на течение инфекционного процесса. Особенности клинической картины, течения, диагностики и лечения инфекционных заболеваний (врожденных инфекций, пневмоний, гнойно-септических заболеваний). Выхаживание и вскармливание больных недоношенных новорожденных. Особенности клинической картины, течения, диагностики и лечения гипоксических и травматических поражений нервной системы у недоношенных новорожденных. Выхаживание. Вскармливание. системы у недоношенных новорожденных. Выхаживание. Вскармливани е. | |||||||||||||||
