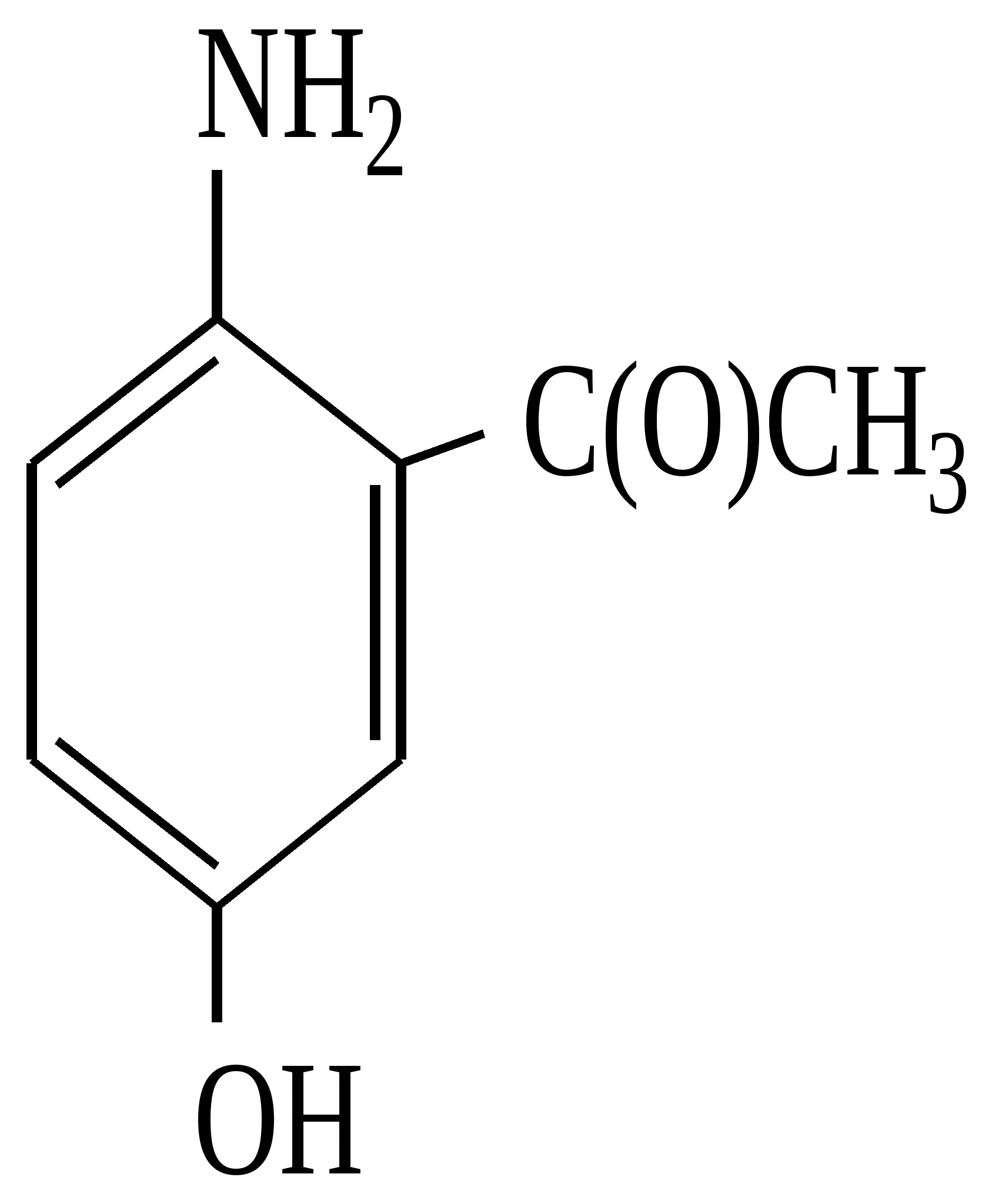Методичні вказівки для студентів 2 курсу фармацевтичного факультету
 Скачать 2.54 Mb. Скачать 2.54 Mb.
|
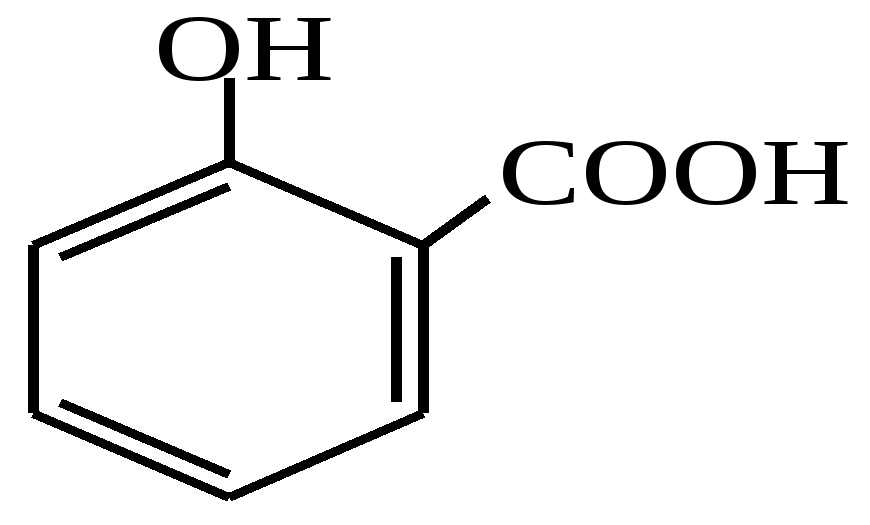
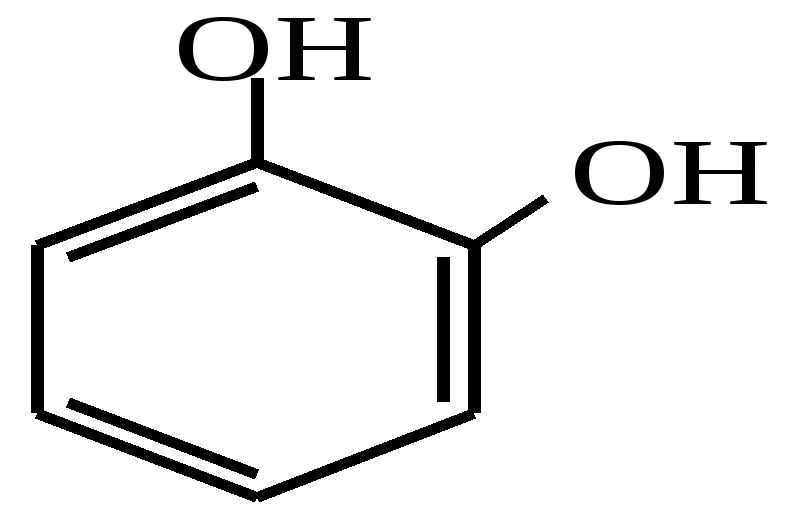
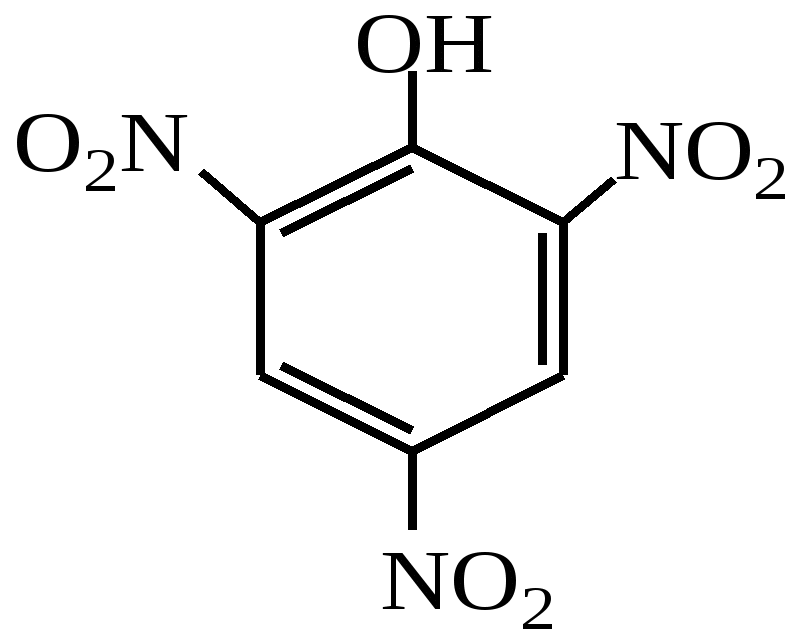
Заняття №13Феноли. амінофенолиАктуальність теми Феноли мають гідроксильну групу при sp2- гібридизованому атомі вуглецю, тому істотно відрізняються за своїми фізичними і хімічними властивостями від спиртів. Фенол має антисептичні властивості. У вигляді 5 % розчину (карболова кислота) використовується як дезінфікуючий засіб. Знайшов широке застосування у виробництві пластмас, барвників, вибухових речовин, лікарських засобів. Похідні фенолу - крезоли і тимол - дезінфікуючий та антисептичний засоби, пікрінова кислота (2,4,6- тринітрофенол) та - нафтол - реагенти у фармацевтичному аналізі. Поліатомні феноли, наприклад, пірокатехін, резорцин також проявляють антисептичні властивості. Крім того, пірокатехін є вихідною речовиною в синтезі адреналіну, резорцин використовують при лікуванні шкірних захворювань. Похідне пірокатехіну - адреналін є гормоном групи катехоламінів, який виробляється наднирниками. Він бере участь у регуляції вуглеводневого та жирового обмінів і здатний викликати звуження дрібних кровоносних судин, підвищувати артеріальний тиск, стимулювати діяльність серця. Амінофеноли, які мають у своєму складі гидроксі- та аміногрупу, також знайшли своє застосування у медичній практиці. Наприклад, п-ацетиламінофенол (парацетамол) використовується як жарознижуючий та болезаспокійливий засіб. Велике значення у синтезі лікарських препаратів і барвників мають ефіри амінофенолів. Ацетильне похідне етилового ефіру амінофенолу - фенацетин - застосовується як жарознижуючий і антиневралгічний засіб. Вивчення одно- та поліатомних фенолів, уміння інтерпретувати їх хімічну будову і властивості необхідні студентові фармацевтичного факультету для вивчення таких дисциплін, як фармацевтична хімія, токсикологічна хімія, фармакологія. Вони дають змогу визначити взаємозв’язок між їх будовою та дією на організм, розробляти і удосконалювати нові методи синтезу лікарських речовин. ЦІЛІ НАВЧАННЯ Загальна ціль: Вміти інтерпретувати хімічні властивості фенолів для використання в фармацевтичній хімії, фармацевтичному та токсикологічному аналізі. Конкретні цілі Вміти:
ЗМІСТ НАВЧАННЯ Основні теоретичні питання:
4. Способи добування і хімічні властивості амінофенолів. 5. Реакції ідентифікації фенолів. Значення похідних фенолів в фармацевтичній хімії. Граф логічної структури 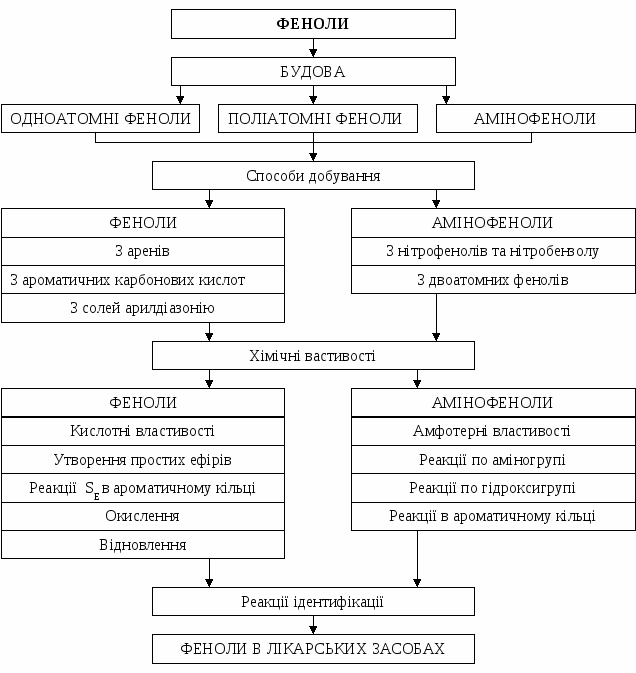 Джерела інформації Обов'язкова література:
Додаткова література:
ОРІЄНТОВНА ОСНОВА ДІЇ (ООД) Інструкція з виконання лабораторних дослідів Хімічні властивості фенолів та амінофенолів Принцип методу: особливості хімічних властивостей фенолів та амінофенолів витікають з особливостей будови, тобто наявності гідроксигрупи, що є зв’язаною з ароматичною системою. Це й факт змінює як властивості самої гідроксигрупи, так і властивості бензольного кільця. Для сполук цього класу легко протікають електрофільного заміщення в бензольне кільце. Деякі з них, наприклад бромування, можуть бути використані для ідентифікації фенолів. Ціль: за допомогою характерних реакцій практично довести хімічні властивості представників класів фенолів та амінофенолів . Обладнання та реактиви: штатив з пробирками, склянки 25 мл, пальник, універсальний індикаторний папір, фенол, предметне скло, конц. H2SO4, 10 %-ний р-н NaNO2, 10 %-ний р-н HCl, 10%-ний р-н NaOH, 5%-ний р-н NaOH, 15%-ний р-н NaOH, яєчний білок, р-ни – і –нафтолів, 10 %-ний р-н аміаку, 1%-ний р-н FeCl3, бромна вода, р-н п-діазобен-золсульфокислоти, сульфанілова кислота, реактив Марки. Методика виконання: Опит 52. Розчинність фенолу у воді Фенол є безбарвною кристалічною речовиною з характерним запахом. Фенол розчиняється у воді і розчиняє воду. Залежно від співвідношення фенол-вода утворюються: рідкий фенол (у 100 г фенолу розчиняється 8 г води) і фенольна, або карболова, вода (1 г кристалічного фені i розчиняється в 15 г води при 20 °С). У пробірці збовтують 1 краплю рідкого фенолу і 1 краплю води. Спостерігають утворення каламутної рідини - емульсії фенолу, яка при стоянні поступово розшаровується: внизу - розчин води у фенолі, вгорі - розчин фенолу у воді. По каплях при збовтуванні додають воду до тих пір, поки не утворюється прозорий розчин фенолу у воді (фенольна вода). Відмічають характерний запах фенолу. Фенольну воду зберігають для проведення наступних дослідів. Опит 53. Доказ кислотного характеру фенолу У пробірці збовтують 10 крапель фенольної води, додають 1 краплю рідкого фенолу. Спостерігають утворення каламутної емульсії фенолу у воді, яка при додаванні 1 краплі 10 %-ного розчину натрію гідроксиду миттєво перетворюється на прозорий розчин натрію фен оксиду. Червоний лакмусовий папір, змочений отриманим розчином натрію феноксиду, забарвлюється в синій колір. Водні розчини фенолятів частково гідролізуються. Опит 54. Розкладання натрію феноксиду кислотою В пробірку з прозорим розчином натрію феноксиду, отриманого в попередньому опиті, додають 1-2 краплі 10 %-ного розчину хлоридної кислоти. Спостерігають помутніння рідини внаслідок виділення вільного фенолу. Феноксиди як сполуки, утворені слабкою кислотою, розкладаються сильнішими кислотами. Опит 55. Осадження білку фенолом У пробірку поміщають 1 мл розчину яєчного білку і по краплях додають насичений водний розчин фенолу. Спостерігають помутніння розчину і утворення пластівців або згустків, що обумовлено денатурацією білку. Білки з фенолами утворюють малорозчинні продукти конденсації за участю аміногруп білкових молекул. Опит 56. Кольорові реакції фенолів із ферруму (III) хлоридом У пробірку поміщають 3 краплі прозорої фенольної води і додають 1 краплю 1 %-ного розчину ферруму (III) хлориду. Спостерігають появу фіолетового забарвлення, обумовленого утворенням суміші комплексних сполук C6H5OFeCl2, (C6H5O)2FeCl, (C6H5O)3Fe. Інтенсивність забарвлення розчину посилюється при розбавленні водою, слабшає або повністю зникає при додаванні етанолу. Реакцію виконують з 1 %-ными водними розчинами пірокатехіну, резорцину, гідрохінону, пірогалолу і 1 %-ными спиртовыми розчинами – і –нафтолів. Відмічають різне забарвлення розчинів. Кольорова реакція із ферруму (III) хлоридом використовується для ідентифікації фенолів. Опит 57. Індофенолова проба У пробірку поміщають 1 краплю фенольної води, 3 краплі 10 %-ного розчину аміаку і додають 3 краплі бромної води. Через декілька хвилин у відбитому світлі спостерігають появу поступово синього забарвлення розчину, що посилюється, обумовленого утворенням індофенолу. Індофенолова проба використовується для ідентифікації фенолів. Опит 58. Реакція Ліберману У пробірку поміщають 0,5 мл концентрованої сульфатної кислоти, 2-3 краплі 10 %-ного розчину фенолу і 1 краплю 10 %-ного розчину натрію нітриту. При струшуванні суміш забарвлюється в синьо-фіолетовий колір. Забарвлену суміш виливають в склянку з 5 мл води – з'являється рожево-червоне забарвлення розчину. При додаванні 5 %-ного розчину натрію гідроксиду розчин забарвлюється в синій колір. Реакція Ліберману заснована на конденсації продукту нітрозування фенолу (п-бензохінонмонооксиму) з надлишком фенолу у присутності концентрованої сульфатної кислоти. Індофенол, що утворюється, відноситься до групи хінонімінових барвників і змінює забарвлення залежно від рН середовища. Реакція Ліберману характерна для фенолів, вільних в орто- і пара-положеннях. Опит 59. Бромування фенолу У пробірку поміщають 1 краплю рідкого фенолу і 2 краплі води. Вміст пробірки збовтують і до емульсії, що утворилася, додають 6-7 крапель бромної води. Спостерігають виділення білого осаду 2,4,6-трибромфенолу. При наступному додаванні надлишку бромної води спостерігають перетворення білого осаду на світло-жовтий за рахунок окислення 2,4,6-трибромфенолу і утворення 2,4,4,6-тетрабромциклогексадієн-2,5-ону-1. Для видалення надлишку брому вміст пробірки кип'ятять впродовж 1 хв. і охолоджують. Осад, що розчинився при нагріванні, знову виділяється при охолодженні. Для відновлення 2,4,4,6-тетрабромциклогексадієн-2,5-она-1 до суспензії при енергійному збовтуванні додають 2 краплі 10 %-ного розчину калію йодиду і 0,5 мл бензолу. Спостерігають червоно-фіолетове забарвлення бензолового шару (вільний йод) і виділення 2,4,6-трибромфенолу. Гідроксильна група в молекулі фенолу, чинячи сильний електронодонорний вплив, активує бензолове кільце в реакції бромування і сприяє одночасному заміщенню атомів гідрогену в положеннях 2,4,6 у відсутність каталізатора. Ця реакція використовується для ідентифікації фенолів з вільними орто- і пара- положеннями. Опит 60. Утворення азобарвника У пробірку поміщають декілька кристалів фенолу і добавляют 1,5 мл 15 %-ного розчину натрію гідроксиду. За допомогою скляної палички на фільтрувальний папір наносять 2 краплі отриманого розчину, а поруч – 2 краплі розчину п-діазобен-золсульфокислоти, отриманою при змішуванні в окремій пробірці 0,1 г сульфанілової кислоти, 5 мл води і 0,5 мл 10 %-ного розчину натрію нітриту. На межі зіткнення розчинів спостерігають появу червоно-помаранчевого забарвлення. Реакція азосполучення солей діазонію з фенолами в лужному середовищі з утворенням азобарвника протікає легко, є високочутливою і використовується для ідентифікації фенолів. Опит 61. Реакція конденсації фенолу з реактивом Марки На предметне скло поміщають декілька кристалів фенолу і змочують 1-2 краплями реактиву Марки. При стоянні з'являється вишнево-червоне забарвлення, обумовлене утворенням арилметанового барвника. Ця реакція використовується для ідентифікації фенолів. Хід роботи:
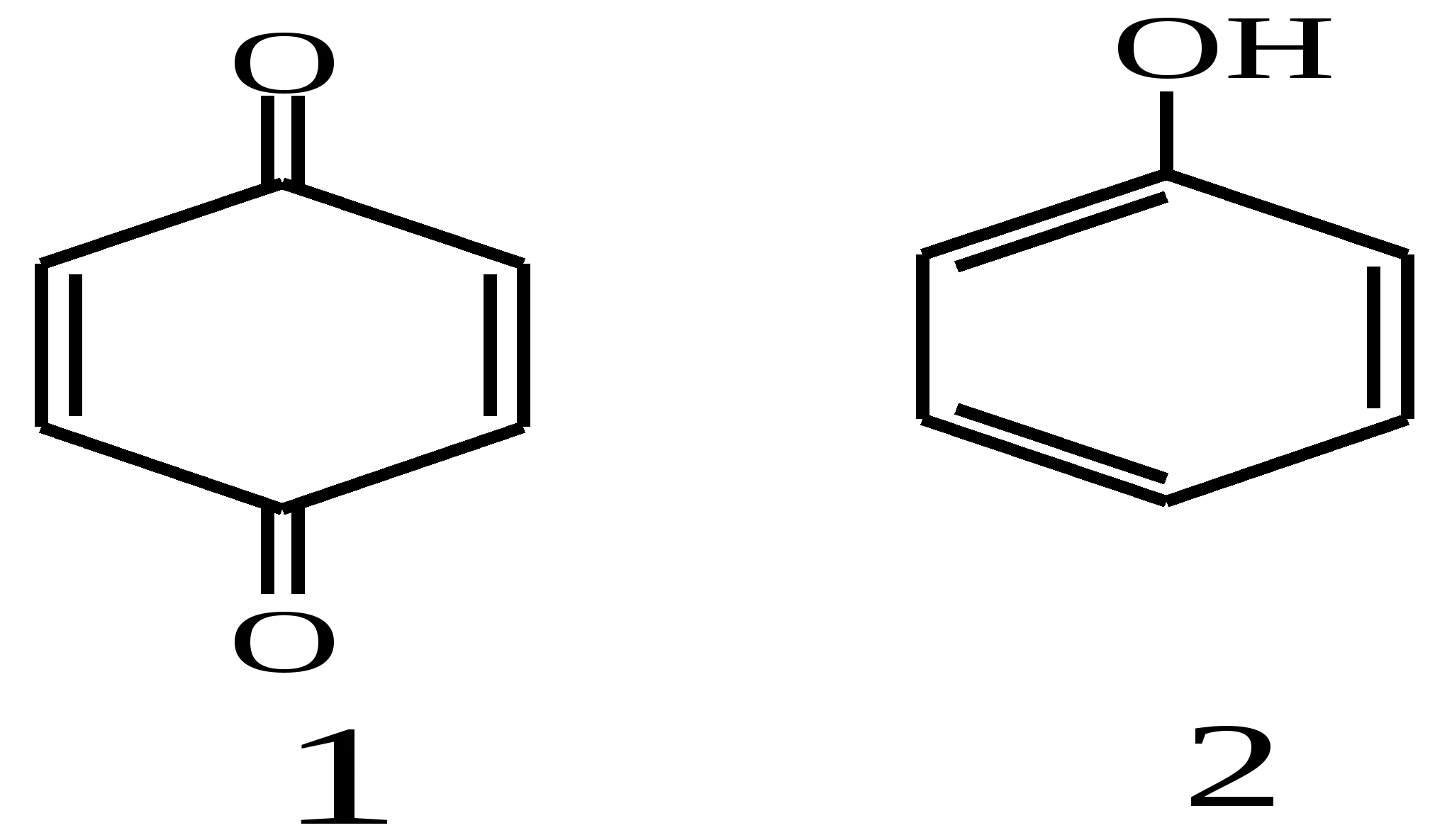
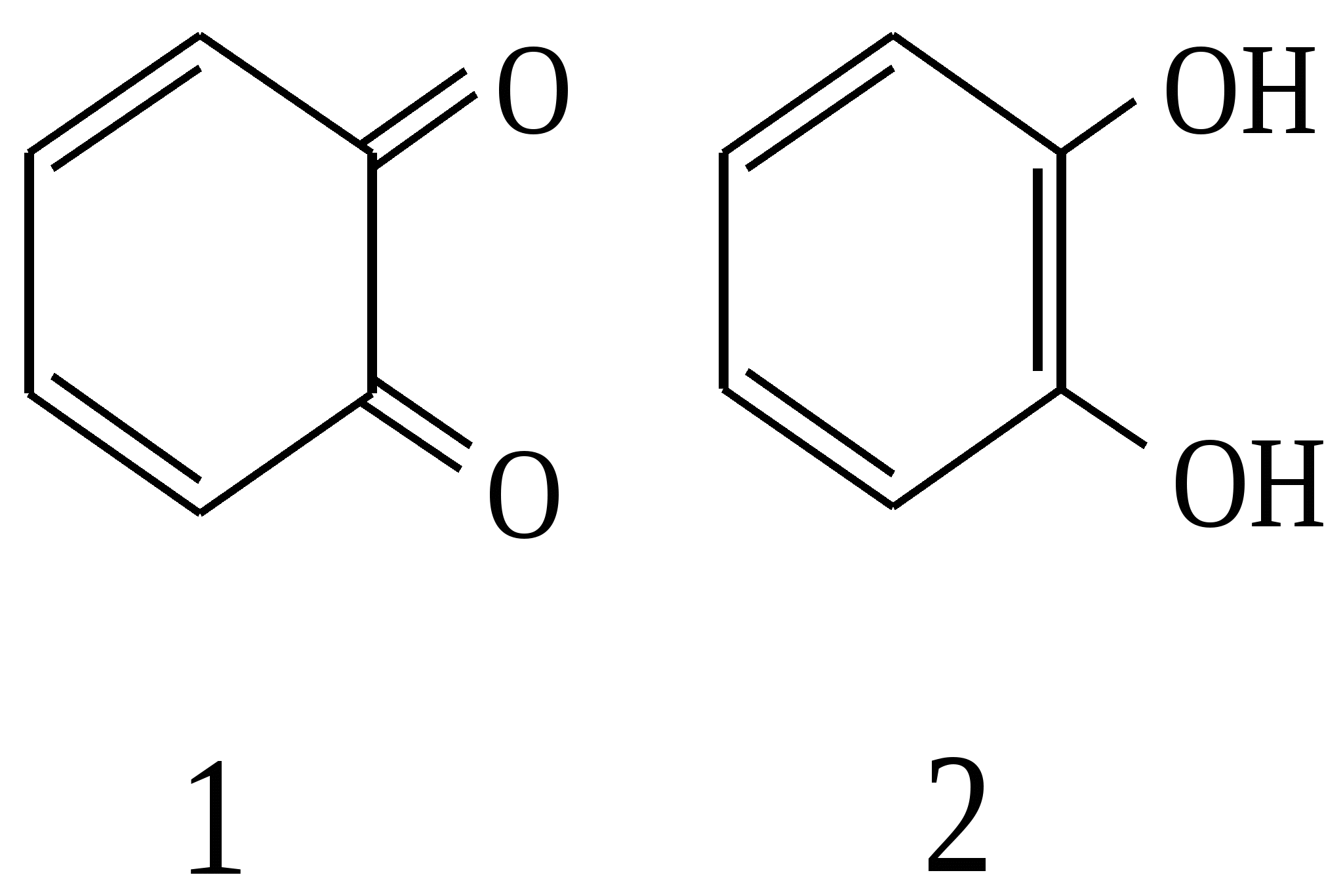
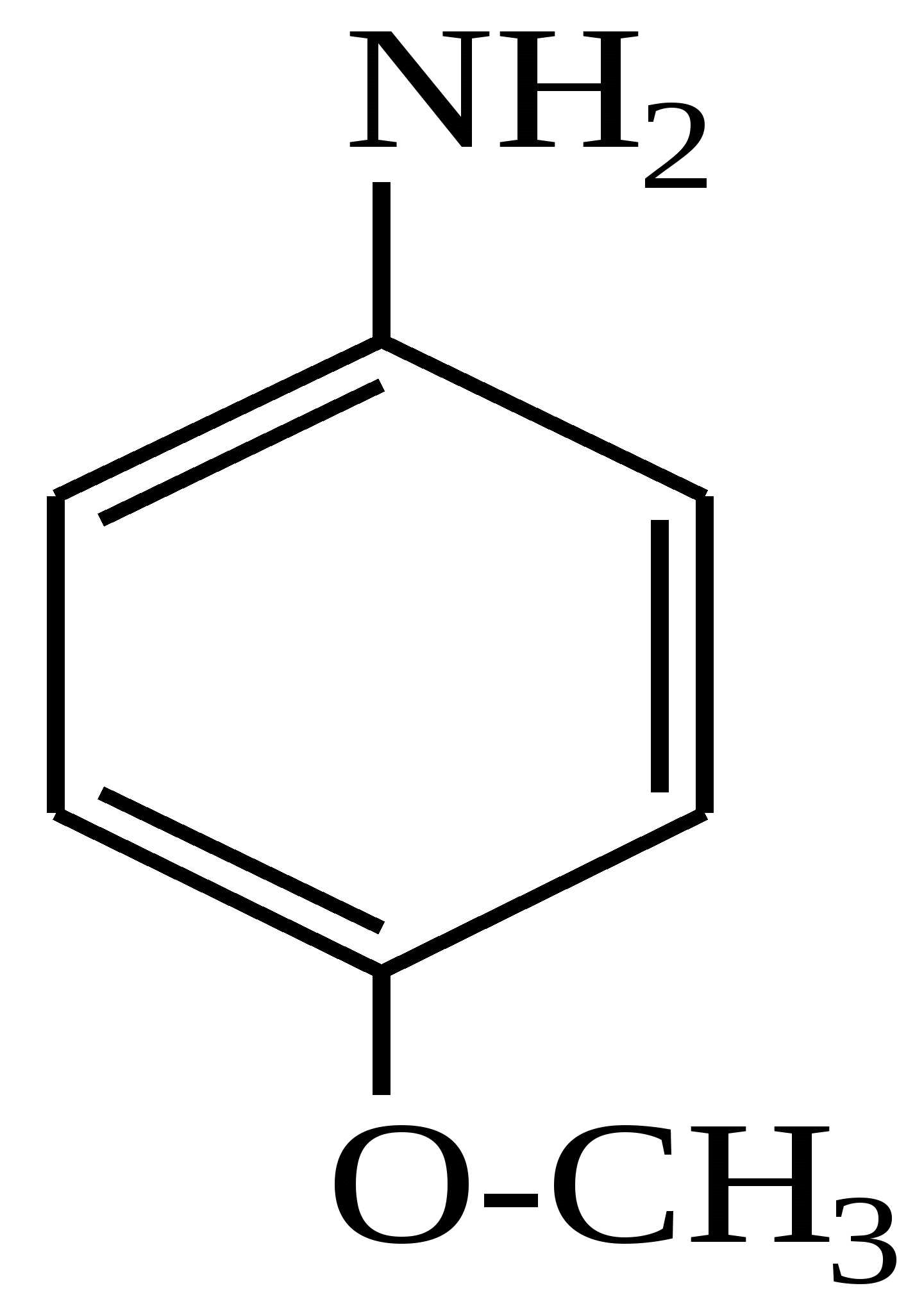
завдання для перевірки досягнення конкретних цілей навчання Тест 1 Яка з наведених структур не є фенолом
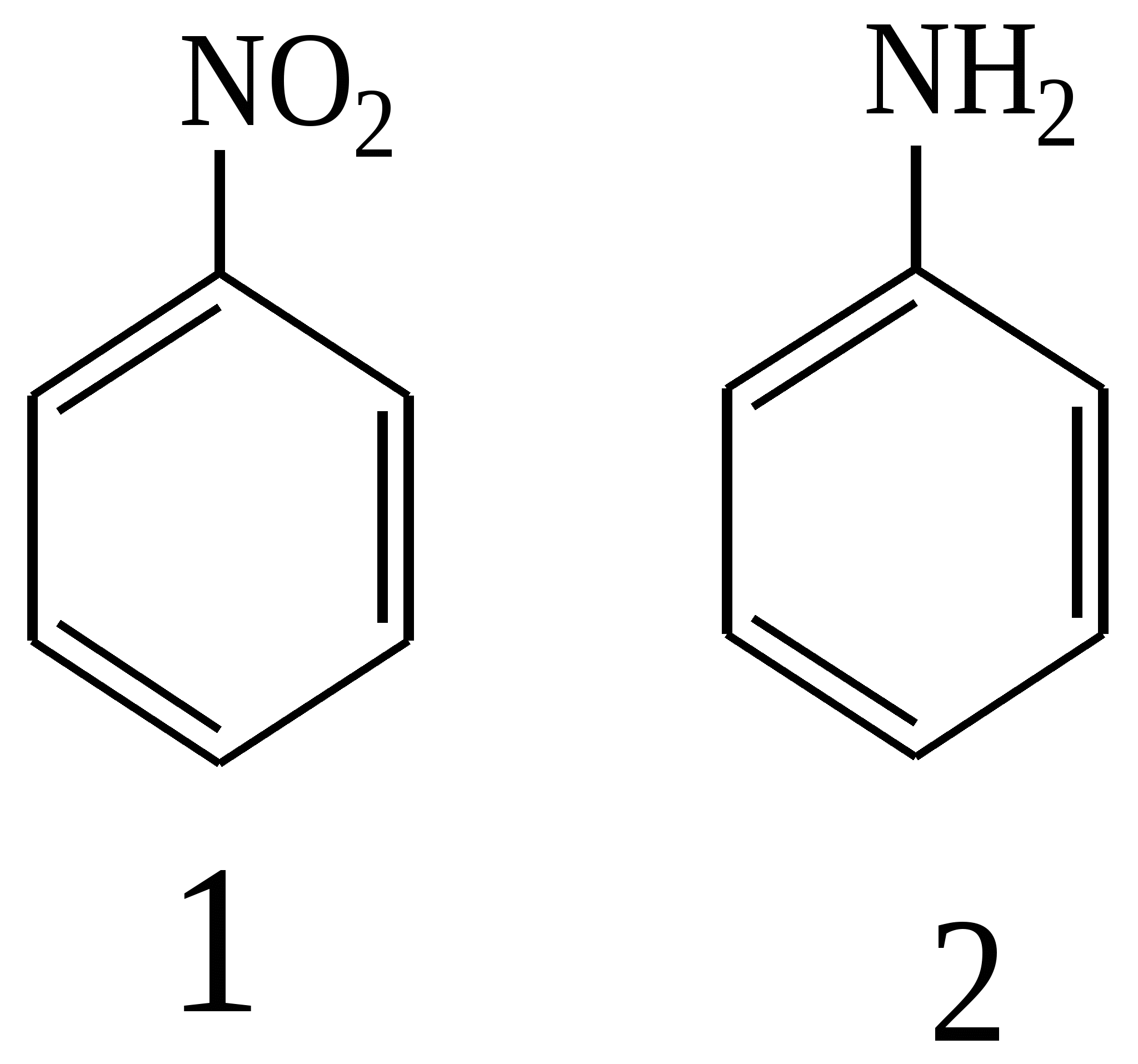
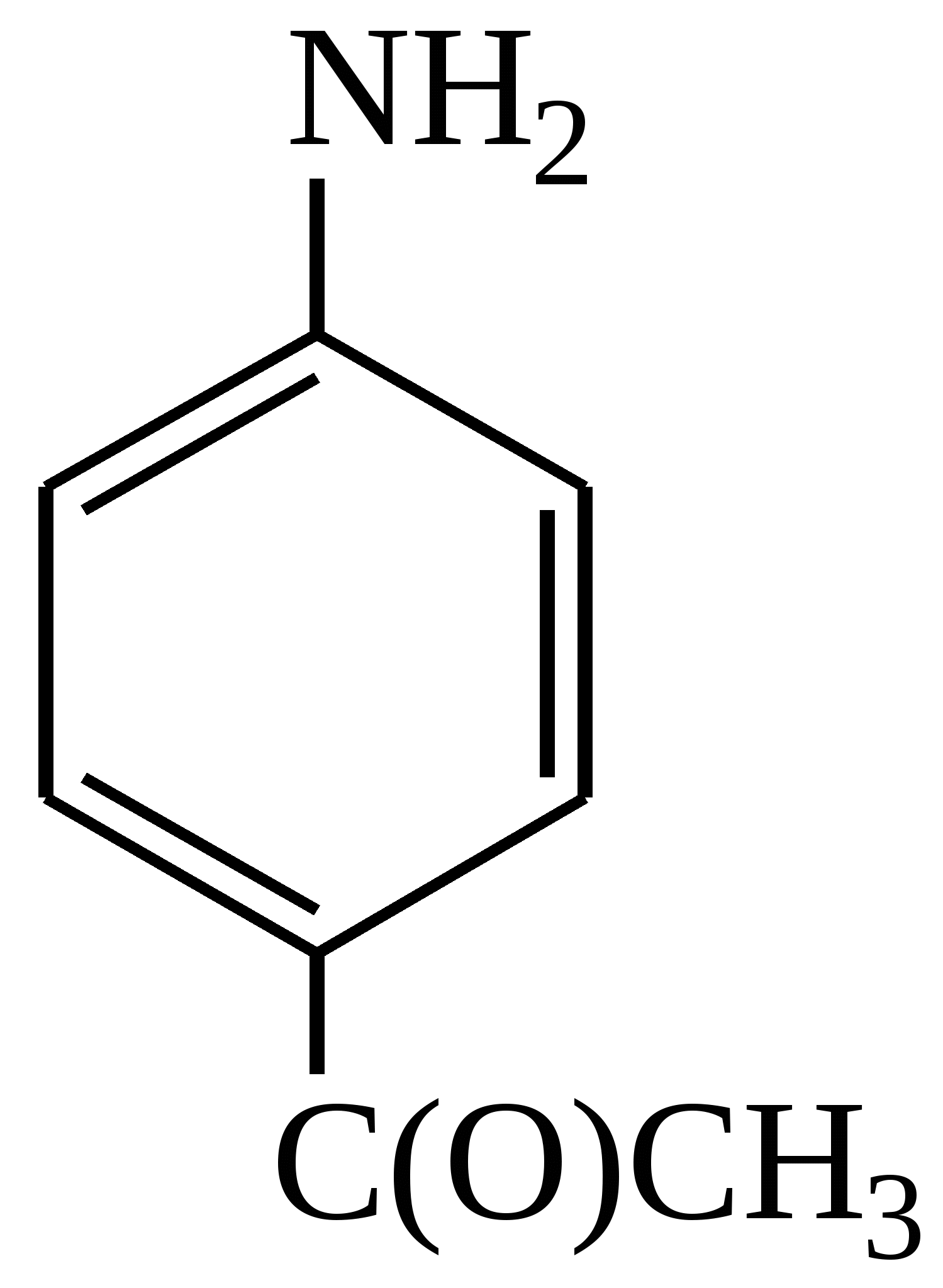
Тест 2 Який проміжний і кінцевий продукти утворюються при окисненні аніліну з подальшим його відновленням 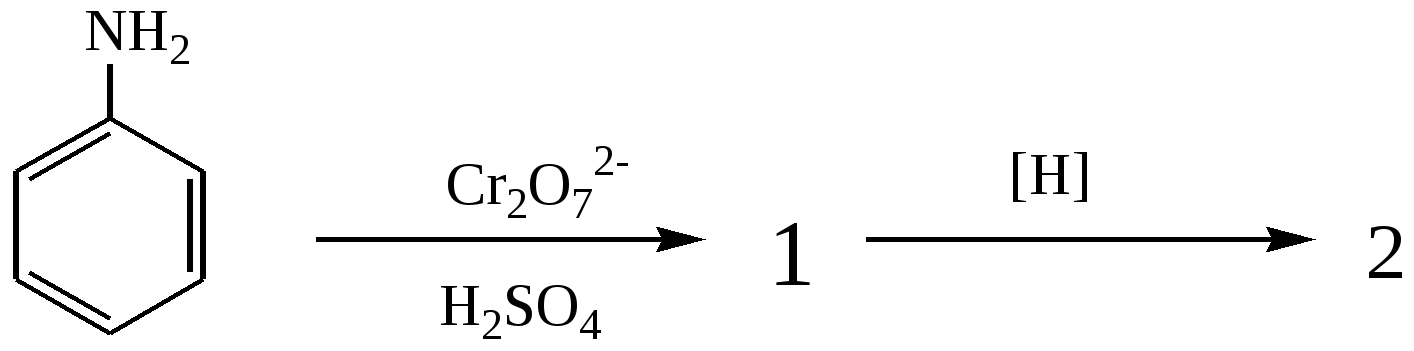
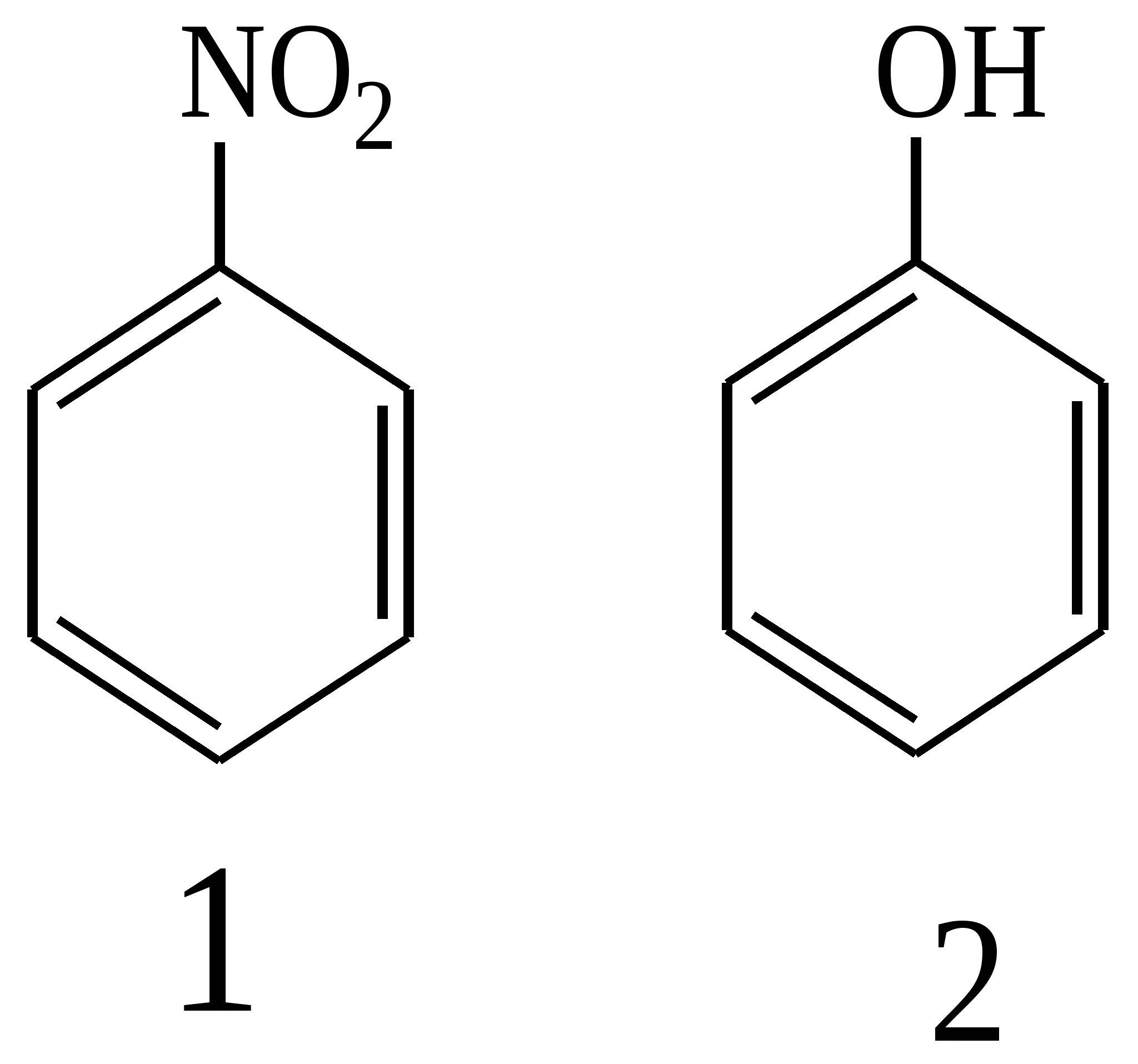
Тест 3 На кислотність фенолів значний вплив справляють замісники в ароматичному ядрі. Розташуйте в порядку зменшення кислотних властивостей фенольного гідроксилу наступні сполуки: 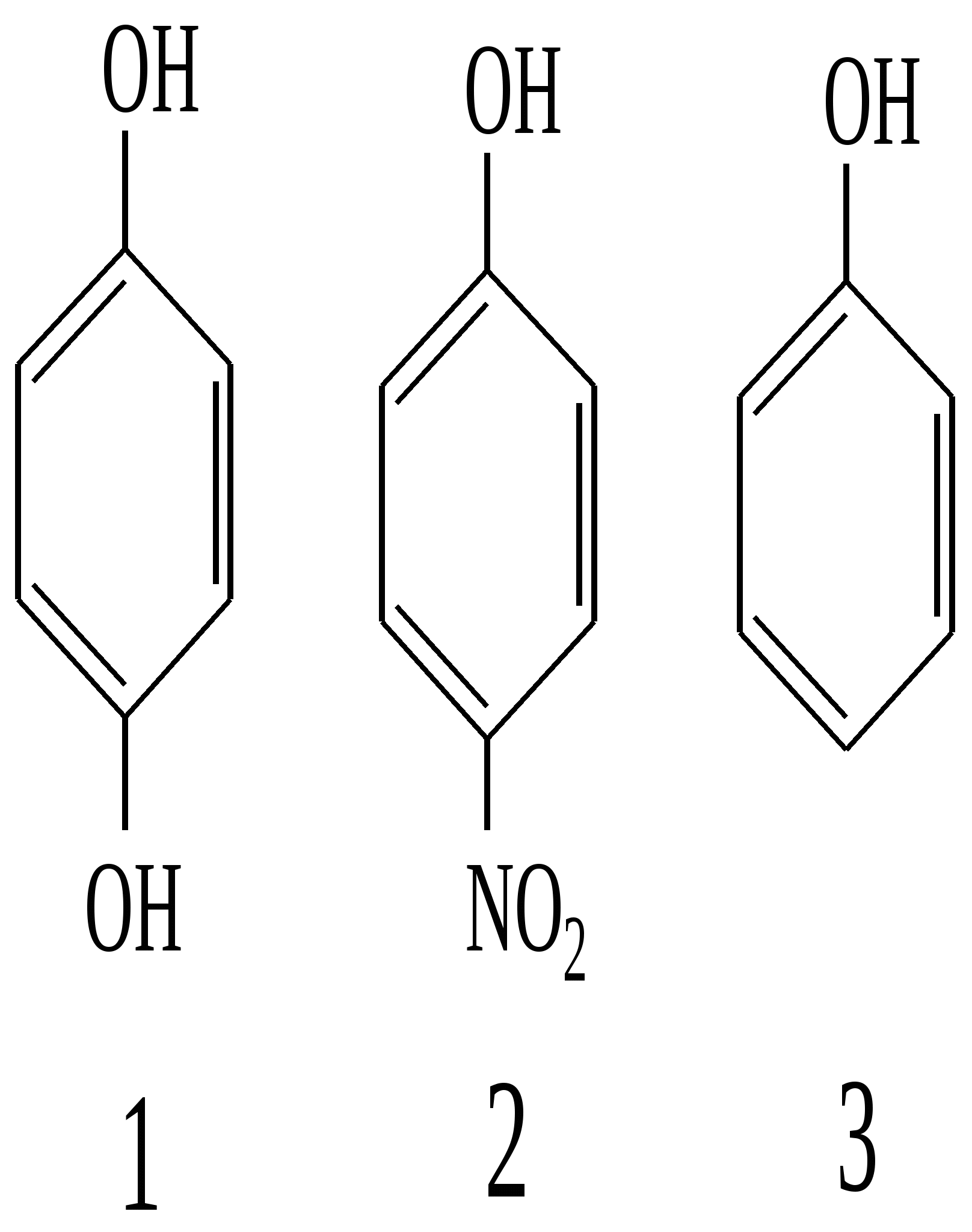
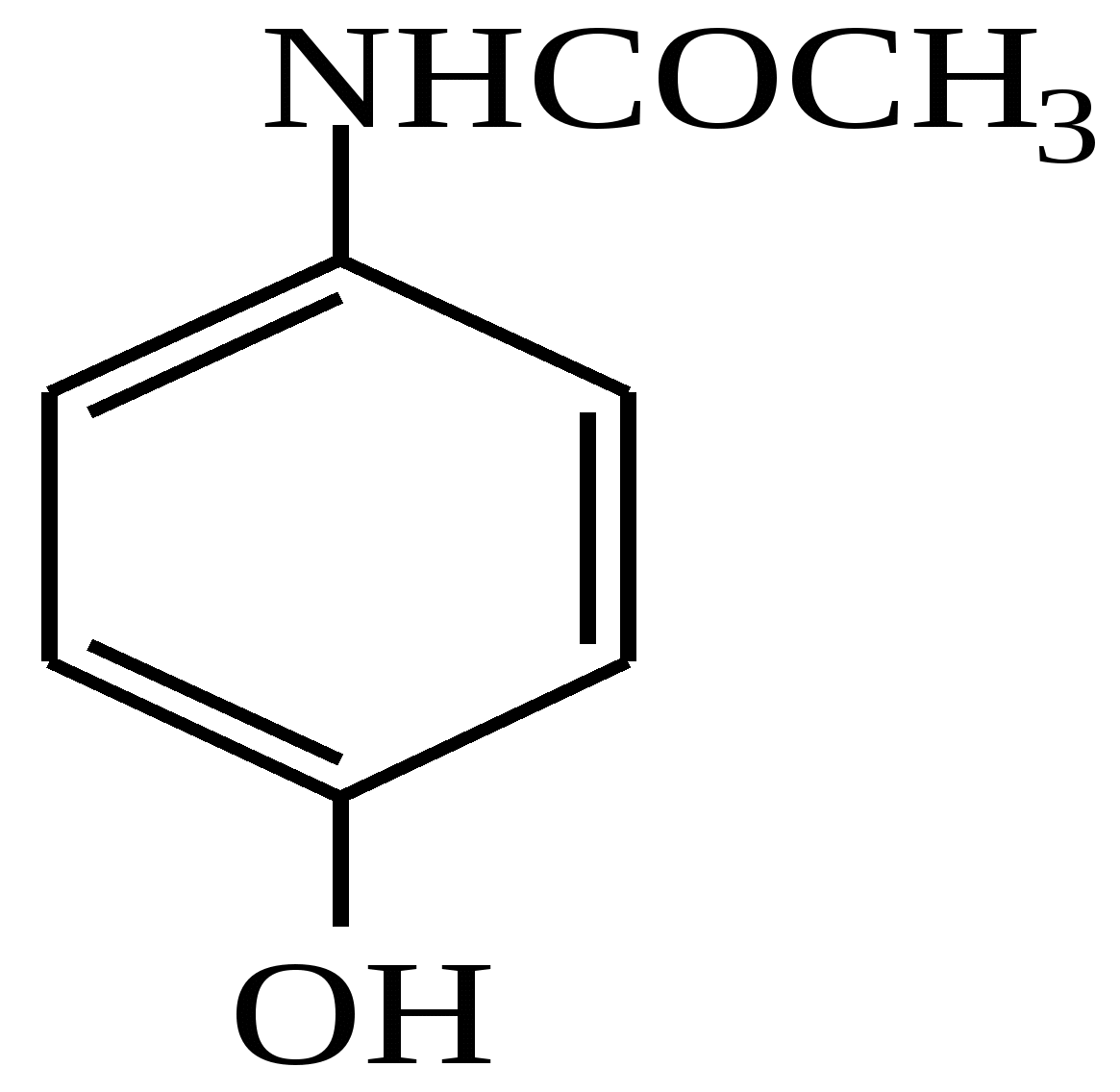
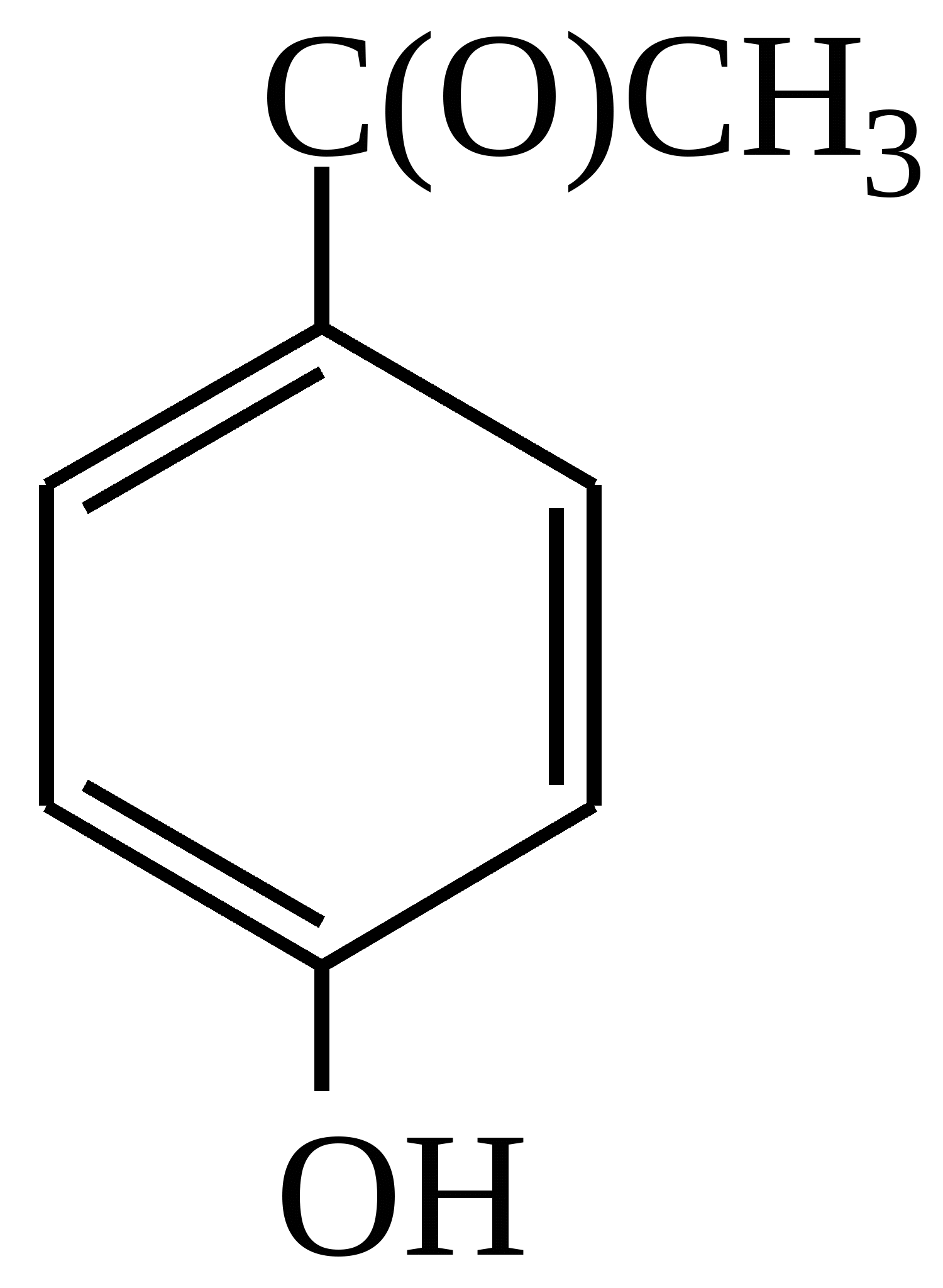
Тест 4 Амінофеноли мають властивості фенолів та ароматичних амінів. Який продукт утворюється в реакції ацилювання амінофенолу
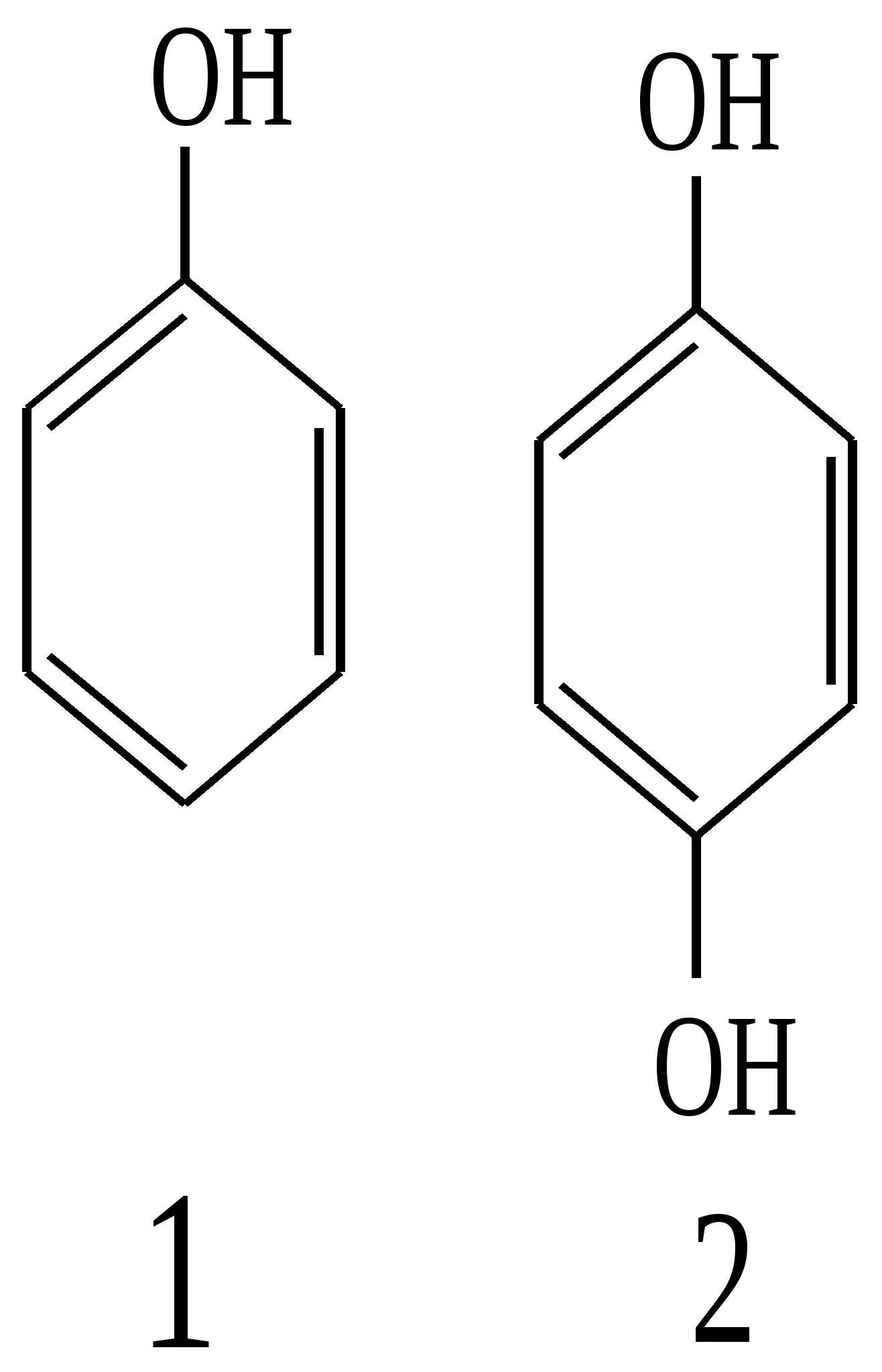
Тест 5 Яку якісну реакцію можна використати для виявлення фенолу, резорцину, пірокатехіну, гідрохінону
Еталони відповідей: 1.C, 2.B, 3.E, 4.A, 5.C. КОРОТКІ МЕТОДИЧНІ ВКАЗІВКИ ДО ПРОВЕДЕННЯ ПРАКТИЧНОГО ЗАНЯТТЯ На занятті перевіряється підготовленість студентів до проведення практичного заняття, проводиться інструктаж з техніки безпеки при роботі з хімічними реактивами. Перевіряється виконання домашнього завдання та під керівництвом викладача виконуються завдання для самостійної роботи. Потім студенти приступають до виконання лабораторної роботи, використовуючи при цьому інструкцію робочого журналу. Після виконання лабораторної роботи необхідно оформити протокол, зробити висновки до роботи, що перевіряє і контролює викладач. Проводиться підсумковий тестовий контроль за темою, підводяться підсумки роботи. |