Методичні вказівки для студентів 2 курсу фармацевтичного факультету
 Скачать 2.54 Mb. Скачать 2.54 Mb.
|
Заняття №14Аліфатичні альдегіди та Аліфатичні кетониАктуальність теми Альдегідами та кетонами називають похідні вуглеводнів, які містять у своєму складі карбонільну групу С=О. Це великий клас органічних сполук, вони знайшли своє застосування у різних галузях. Формальдегід в великих кількостях використовують у виробництві фенолоформальдегідних, сечовиноформальдегідних та інших смол, необхідних в електропромисловості та машинобудуванні; він є вихідною речовиною у виробництві синтетичного каучука, фарб, лікарських речовин та ін. 37 - 40 % водний розчин формальдегіду застосовується під назвою "формалін" як дезінфікуючий та дубильний засіб, консервант для анатомічних препаратів. Представник аліфатичних кетонів - ацетон - добре відомий як універсальний розчинник і як вихідна речовина для синтезу багатьох органічних сполук. Ацетон також використовують у виробництві штучного шовку, кіноплівки, лаків, лікарських речовин, наприклад, йодоформу. Уміння інтерпретувати хімічну будову і властивості аліфатичних альдегідів та кетонів необхідні студентові фармацевтичного факультету для вивчення таких дисциплін, як фармацевтична хімія, токсикологічна хімія, фармакологія, фармакогнозія. Вони дають змогу розробляти і удосконалювати нові методи синтезу лікарських речовин. ЦІЛІ НАВЧАННЯ Загальна ціль: Вміти визначати хімічні властивості аліфатичних альдегідів та кетонів для використання в фармацевтичній хімії, фармацевтичному та токсикологічному аналізі. Конкретні цілі Вміти:
ЗМІСТ НАВЧАННЯ Основні теоретичні питання:
5.Реакції ідентифікації аліфатичних альдегідів та кетонів. Значення в фармацевтичній хімії. Граф логічної структури 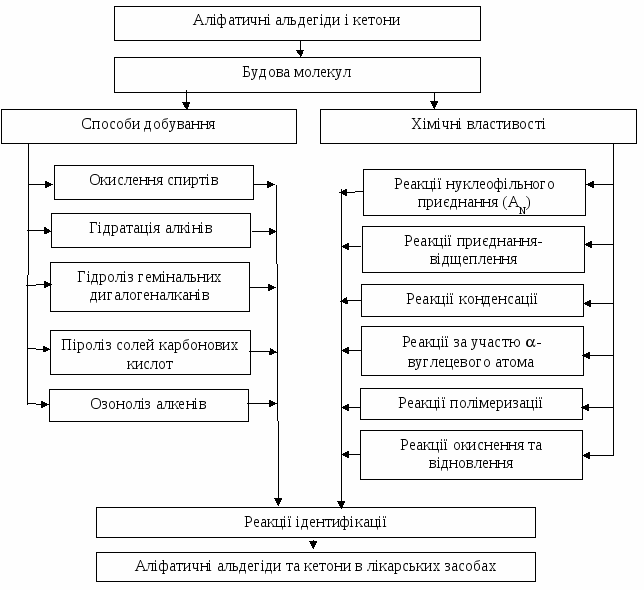 Джерела інформації Обов'язкова література:
Додаткова література:
ОРІЄНТОВНА ОСНОВА ДІЇ (ООД) Інструкція з виконання лабораторних дослідів Хімічні властивості аліфатичних альдегідів та кетонів Принцип методу: наявність в молекулах альдегідів та кетонів карбонильної групи може бути використана для реакцій ідентифікації сполук з відповідними функціональними групами. Ціль: за допомогою характерних реакцій практично довести хімічні властивості представників класу альдегідів та кетонів. Обладнання та реактиви: штатив з пробирками, склянки 25 мл, пальник, універсальний індикаторний папір, льодова суміш, оцтовий альдегід, бензальдегіду, ацетон, 40 %-ний р-н формальдегіду, 1 %-ний р-н аргентуму нітрату, 10 %-ний р-н натрію гідроксиду, 2 %-ний водн. р-н аміаку, 2 %-ний р-н купруму (II) сульфату, реактив Фелингу, фуксинсірниста кислота, гідроксиламіну гидрохлорид, натрію карбонат, р-н йоду в калію йодиді, 10 %-ний р-н натрію гідроксиду, індикатор метиловий червоний, р-н білку, 5 %-ного розчину натрію нітропрусиду. Методика виконання: Опит 71. Окислення альдегідів аміачним розчином аргентуму оксиду (реакція "срібного дзеркала") У чисто вимиту пробірку поміщають по 1 краплі 1 %-ного розчину аргентуму нітрату і 10 %-ного розчину натрію гідроксиду. Спостерігають виділення бурого осаду срібла оксиду. Потім в пробірку при постійному струшуванні додають по краплях 2 %-ний водний розчин аміаку до повного розчинення осаду (необхідно уникати надлишку аміаку, оскільки знижується чутливість реагенту). Реактив Толленсу [Ag(NH3)2]OH готують безпосередньо перед проведенням опиту. При зберіганні реактив Толленсу розкладається з утворенням чорного осаду – нітриду срібла Ag3N, який є вибухонебезпечним. До отриманого прозорого розчину реактиву Толленсу додають 2 краплі оцтового альдегіду. Спостерігають виділення вільного срібла у вигляді грудкуватого чорного (сірого) осаду або дзеркального нальоту на стінці пробірки. Реакція використовується для якісного виявлення альдегідної групи. Опит 72. Окислення альдегідів купруму (II) гідроксидом в лужному розчині (проба Троммеру) У дві пробірки поміщають по 5 крапель 10 %-ного розчину натрію гідроксиду, води і по 1 краплі 2 %-ного розчину купруму (II) сульфату. Спостерігають утворення синього осаду купруму (II) гідроксиду : Потім в одну з пробірок додають 3 краплі оцтового альдегіду, в іншу – 3 краплі 40 %-ного розчину формальдегіду. Вміст пробірок збовтують і нагрівають до початку кипіння. Альдегіди легко окислюються до карбонових кислот, відновлюючи сполуки двовалентної міді до одновалентної міді (чи до металевої міді). Усі вказані сполуки міді погано розчинні в лугах і виділяються у вигляді забарвлених осадів. У пробірці з оцтовим альдегідом осад блакитного кольору перетворюється на жовтий осад купруму (I) гідроксиду, а потім в червоно-коричневий осад купруму (I) оксиду. Формальдегід в цих умовах не лише окислюється, але у присутності каталізатора міді (I) оксиду взаємодіє з лугом. Водень, що утворюється при цьому, відновлює сполуки міді до вільного металу. При цьому спостерігають утворення червоно-коричневого осаду або мідного нальоту на стінках пробірки ("мідне дзеркало"). Опит 73. Взаємодія альдегідів з мідно-виннокислим комплексом (реактивом Фелингу) У дві пробірки поміщають по 2 мл реактиву Фелингу, отриманого шляхом змішування рівних об'ємів водного розчину купруму (II) сульфату (розчин А) і лужного розчину сегнетової солі – калієво-натрієвої солі винної кислоти (розчин Б). При зливанні розчинів виділяється осад купруму (II) гідроксиду, який утворює з сегнетовою сіллю водорозчинний комплекс синього кольору. Потім в одну пробірок додають 3 краплі формаліну (40 %-ного водного розчину формальдегіду), в іншу – 2 краплі бензальдегіду. Вміст пробірок нагрівають в полум'ї пальника до початку кипіння. У пробірці з формаліном спостерігають поступове знебарвлення розчину і виділення червоно-коричневого осаду купруму (I) оксиду або металевої міді у вигляді тонкого червонястого нальоту – "мідного дзеркала" : У пробірці з бензальдегідом видимих змін не відбувається, оскільки ароматичні альдегіди не взаємодіють з реактивом Фелинга. Опит 74. Взаємодія оксосполук з фуксинсірнистою кислотою (реакція Шиффа) Фуксинсірниста кислота є продуктом взаємодії фуксину (трифенилметановий барвник) з сірнистою кислотою. У дві пробірки окремо поміщають по 2 краплі фуксинсірнистої кислоти. В одну з них додають 2 краплі формаліну, в іншу - 2 краплі оцтового альдегіду. Вміст пробірок обережно струшують і впродовж 3-4 хв. спостерігають появу характерного пурпурово-фіолетового забарвлення. При стоянні розчини поступово знебарвлюються. Це пов'язано з тим, що продукт, що утворився, вступає в реакцію з надлишком сірнистого ангідриду, що знаходиться в розчині, відщепляючи альдегід у вигляді його гідросульфітного похідного і переходячи знову у вільну фуксинсірнисту кислоту: При додаванні до пробірок мінеральної кислоти забарвлення розчину з формаліном, на відміну від інших альдегідів, зберігається, хоча відтінок стає більш синім. Реакція з фуксинсірнистою кислотою в сильнокислому середовищі дозволяє відрізнити формальдегід від інших альдегідів. Реакція з розчином фуксинсірнистою кислотою позитивна для альдегідів, метилкетонів і простих аліциклічних кетонів. Опит 76. Отримання ацетоноксима У пробірку поміщають рівні кількості (на кінчику шпатилю) гідроксиламіну гидрохлориду і натрію карбонату. Суміш розчиняють в 15 краплях води і спостерігають бурхливе виділення газу – карбон (IV) оксиду. До охолодженого (у льоду!) розчину при струшуванні додають 15 крапель ацетону. Суміш розігрівається і відбувається утворення білого кристалічного осаду – ацетоноксиму. При наступному охолодженні реакційної суміші кількість осаду збільшується, оскільки знижується розчинність ацетоноксиму. Утворення оксимів є загальною реакцією на оксосполуки і використовується для їх ідентифікації. Опит 79. Йодоформна проба У пробірку поміщають 1 краплю розчину йоду в калію йодиді і додають до знебарвлення по краплях 10 %-ний розчин натрію гідроксиду. Після додавання в пробірку 1 краплі ацетону спостерігають утворення жовтуватого осаду йодоформу і відчувають характерний запах. Йодоформна проба позитивна для оцтового альдегіду і метилкетонів. Цю реакцію називають пробою Лібена і використовують для відкриття ацетону в сечі. Опит 80. Реакція дисмутації водних розчинів формальдегіду У пробірку поміщають 3 краплі 40 %-ного розчину формальдегіду і 1 краплю індикатору метилового червоного. Спостерігають появу червоного забарвлення розчину, що підтверджує кислу реакцію середовища. У водних розчинах формальдегід зазнає диспропорціонування (самоокислення-самовідновлення): одна молекула окислюється до мурашиної кислоти, а інша – відновлюється до метанолу. Опит 83. Осадження білку формаліном У пробірку до 1 мл розчину білку підливають 1 мл формаліну. Спостерігають утворення осаду. Формальдегід зв'язує первинні аміногрупи білкових молекул, що руйнує впорядковані структури білку і веде до його осадження. Опит 84. Утворення параформу і його властивості Пробірку з 1 мл 40 %-ного водного розчину формальдегіду охолоджують за допомогою льоду до 5оС. Спостерігають утворення білого осаду – параформу. При обережному нагріванні пробірки осад розчиняється (деполімеризація параформу). Газоподібний мономер формальдегіду має різкий запах. Він знову полімеризується, утворюючи наліт на холодних стінках пробірки. Опит 85. Кольорова реакція на кетони з натрію нітропрусидом У пробірку поміщають 3 краплі ацетону, 1 крапля 5 %-ного розчину натрію нітропрусиду Na2[Fe(CN)5NO] і 1 краплю 10 %-ного розчину натрію гідроксиду. Розчин забарвлюється в темно-червоний колір. При наступному додаванні 1 краплі оцтової кислоти з'являється карміново-червоне забарвлення розчину. Цю кольорову реакцію називають пробою Легалю і використовують в клінічній практиці для визначення ацетону в сечі (діабет). Хід роботи:
завдання для перевірки досягнення конкретних цілей навчання Тест 1 Назва кетонів утворюється від назви відповідного вуглеводню і додавання до неї суфікса -ОН. В якій з наведених реакцій утворюється бутанон?
OH
Тест 2 У присутності солей ртуті, як каталізатора, алкіни приєднують воду з утворенням альдегіду або кетону. Який з наведених алкінів за умов реакції Кучерова утворює альдегід?
Тест 3 Яка сполука утворюється в результаті термічного розкладання пропілату кальцію ?  A. B. C.  D. E. Тест 4 Синильна кислота (HCN) приєднується до карбонільних з'єднань з утворенням цианогідринів. Вкажіть сполуку, яка в реакції з HCN утворює наступну речовину : 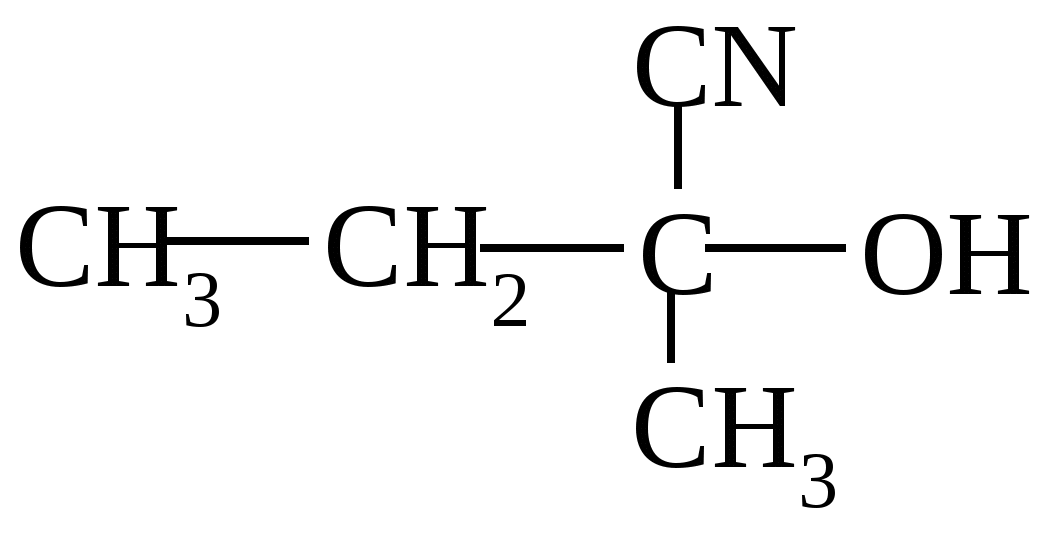
Тест 5 Карбонильну сполуку отримують за реакцією Кучерова згідно схеми:  СН3СН2ССН + Н2О HgSO4, H2SO4 ? СН3СН2ССН + Н2О HgSO4, H2SO4 ? Вкажите кінцевий продукт взаємодії. А   . СН3СН2СO D. СН3СН2СН2СO . СН3СН2СO D. СН3СН2СН2СO H Н B       . СН3ССН2СН3 E. СН3СССН2 . СН3ССН2СН3 E. СН3СССН2О О О C. СН3СНОНСН2СН3 Тест 6 Визначте речовину А та реагент в наступній схемі:
Тест 7 Виберіть реагент з яким альдегіди вступають в реакцію приєднання-відщеплення.C2H5OH
Тест 8 Виберіть реагент з яким у альдегідів проходять реакції заміщення в -положення.
Тест 9 Яка реакція альдегідів використовується в аналітичній практиці для виявлення альдегідної групи
Тест 10 Выберіть реагенти, за допомогою яких можна разрізнити метаналь та етаналь:
Тест 11 Яким реактивом можна відрізнити оцтовий альдегид від ацетону?
Тест 12 Яке похідне формальдегіду використовують у медицині як дезінфекційний засіб
Еталони відповідей: 1.C, 2.B, 3.E, 4.C, 5.B, 6.D, 7.A, 8.C, 9.A, 10.B, 11.A, 12.E. КОРОТКІ МЕТОДИЧНІ ВКАЗІВКИ ДО ПРОВЕДЕННЯ ПРАКТИЧНОГО ЗАНЯТТЯ На занятті перевіряється підготовленість студентів до проведення практичного заняття, проводиться інструктаж з техніки безпеки при роботі з хімічними реактивами. Під керівництвом викладача виконуються завдання для самостійної роботи. Потім студенти приступають до виконання лабораторної роботи, використовуючи інструкцію робочого журналу. Після виконання лабораторної роботи студенти оформляють протокол, роблять висновки до роботи, що перевіряється і контролюється викладачем. Проводиться підсумковий тестовий контроль за темою, підводяться підсумки заняття. |

 CH3–CH–CH2–CH3 + [O
CH3–CH–CH2–CH3 + [O