Методичні вказівки для студентів 2 курсу фармацевтичного факультету
 Скачать 2.54 Mb. Скачать 2.54 Mb.
|
Заняття №12CПИРТИ. АМІНОСПИРТИ. ЕТЕРИАКТУАЛЬНІСТЬ ТЕМИ Спирти та ефіри відносяться до класу гідроксильних похідних вуглеводнів, в яких один або декілька атомів водню заміщені на гідроксильну групу. Аміноспирти крім гідроксильної групи у своєму складі мають аміногрупу. Вивчення способів добування та хімічних властивостей гідроксильних похідних вуглеводнів дозволяє детально розглянути на конкретних прикладах механізми реакцій нуклеофільного заміщення, елімінування, окислення. Спирти та ефіри широко використовуються в органічному синтезі як вихідні сполуки, а також у ролі розчинників. Найважливішим представником одноатомних спиртів є етанол, який використовується в медицині та фармації для виготовлення настоянок, екстрактів, розчинів, як знезаражуючий засіб, для консервації різних анатомічних препаратів. Гліцерин відноситься до двоатомних спиртів і застосовується як основа для мазей та паст, добавка до мил, його нітропохідне - нітрогліцерин справляє судинно - розширюючу дію та застосовується в медицині при стенокардії. Діетиловий ефір знайшов застосування у медицині як препарат для загального наркозу. Представник аміноспиртів – холін – необхідний для життєдіяльності людини та тварин. Нестача холіну може викликати жирове переродження печінки та її цироз. Він відноситься до вітамінів групи В, бере участь у транспорті жирів і метаболізмі білків та вуглеводів. Таким чином, тема спиртів, ефірів сприяє подальшому вивченню та розумінню біохімічних процесів у нашому організмі. ЦІЛІ НАВЧАННЯ Загальна ціль: Вміти інтерпретувати властивості спиртів, ефірів та їх похідних, для застосування у фармацевтичних і токсикологічних дослідженнях. Конкретні цілі Вміти:
ЗМІСТ НАВЧАННЯ Основні теоретичні питання: 1. Класифікація, ізомерія і номенклатура спиртів, аміноспиртів, ефірів та їх похідних. 2. Способи добування спиртів, аміноспиртів, ефірів. 3. Кислотно-основні властивості спиртів. Міжмолекулярна асоціація спиртів. 4. Фізичні і хімічні властивості одно- та багатоатомних спиртів: - утворення алкоголятів; - утворення простих і складних ефірів; - внутрішньомолекулярна та міжмолекулярна дегідратація; - заміщення гидроксигруп; - окислення. 5. Хімічні властивості аміноспиртів. 6. Хімічні властивості ефірів. 7. Ідентифікація спиртів, аміноспиртів, ефірів. 8. Окремі представники, застосування. Граф логічної структури 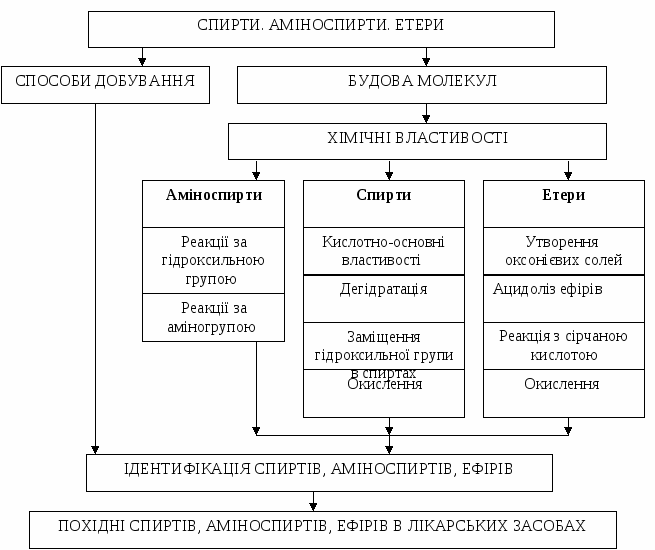 Джерела інформації Обов'язкова література:
Додаткова література:
ОРІЄНТОВНА ОСНОВА ДІЇ (ООД) Інструкція з виконання лабораторних дослідів Хімічні властивості спиртів, аміноспиртів та етерів Принцип методу: особливості хімічних властивостей спиртів, аміноспиртів та етерів витікають з особливостей будови, тобто наявності атому оксигену. Для сполук цього класу легко протікають реакції окислення, більшість з яких може бути використана для ідентифікації цих сполук. Відмінність властивостей в межах одного класу залежить від кількості гідроксигруп, а такод від будови вуглецевого скелету. Ціль: за допомогою характерних реакцій практично довести хімічні властивості представників класів спиртів, аміноспиртів та етерів . Обладнання та реактиви: штатив з пробирками, склянки 25 мл, пальник, універсальний індикаторний папір, мірний циліндр, трубка 75 і діаметром 1,5 см, запаяна з одного цінця, штатив, склограф, конц. H2SO4, 10 %-ний р-н H2SO4, 10%-ний р-н NaOH, NaOH сух., 10 %-ний р-н K2Cr2O7, 5 %-ний р-н KMnO4, 3 %-ний р-н CuSO4, безводний натрію ацетат, етанол, ізопропиловий спирт, трет-бутиловий спирт, реактив Лукаса (еквімолекулярні кількості цинку хлориду і концентрованої хлороводородной кислоти), розчин фуксинсерністої кислоти, розчин йоду в калію йодиді, діетиловий ефір, сірковуглець, калію гідросульфіт безводний, гліцерин. Методика виконання: Опит 38. Зміна об'єму спирту при змішуванні з водою (контракція) У скляну трубку завдовжки 75 і діаметром 1,5 см, запаяну з одного кінця і закріплену в штативі, наливають 48 мл води і обережно по стінці трубки додають 52 мл спирту-ректифікату (спирт утворює шар над водою). Верхній рівень розчину відмічають гумовим кільцем або склографом. Закривають верхній отвір трубки пробкою, енергійно збовтують вміст і знову відмічають верхній рівень розчину. Відчувається розігрівання водно-спиртової суміші і відмічають зменшення сумарного об'єму розчину приблизно до 96 мл Опит 42. Реакція спиртів з цинку хлоридом в хлоридній кислоті (проба Лукаса) У три пробірки окремо поміщають по 3-4 краплі етилового, ізопропилового і трет-бутилового спирту, додають по 6 крапель реактиву Лукаса (еквімолекулярні кількості цинку хлориду і концентрованої хлороводородной кислоти). Вміст пробірок збовтують і спостерігають за змінами, що проходять в пробірках впродовж 5 хв. Первинні, вторинні і третинні спирти, що містять менше 6 атомів вуглецю, з різними швидкостями утворюють з реактивом Лукаса хлоралкани. Цю особливість використовують для ідентифікації спиртів. Третинні спирти реагують майже відразу ж з виділенням шару хлоралкану, що не змішується з водою. Вторинні спирти – повільніше, приблизно через 5 хв, з виділенням крапель хлоралкану і помутнінням розчину. Первинні спирти, за винятком алілового і бензилового спиртів, не взаємодіють з реактивом Лукаса. Третинні і вторинні спирти можна розрізнити пробою з концентрованою хлоридною кислотою без присутності цинку хлориду. У цих умовах третинні спирти реагують протягом 3-5 хв, вторинні – не реагують. Опит 43. Отримання складного ефіру У суху пробірку поміщають на висоту близько 2 мм безводний натрію ацетат, 3 краплі етанолу і 2 краплі концентрованої сульфатної кислоти. Вміст пробірки обережно нагрівають в полум’ї пальника. Відчувають характерний приємний освіжаючий запах етилового ефіру оцтової кислоти. Ця реакція використовується для ідентифікації спиртів і карбонових кислот. Опит 46. Окислення спиртів А. Окислення етанолу хромовою сумішшю в кислому середовищі. У пробірку поміщають 2 краплі етанолу, 1 краплю 10 %-ного розчину сульфатної кислоти і 2 краплі 5 %-ного розчину калію дихромату. Вміст пробірки нагрівають в полум'ї пальника і через декілька секунд спостерігають перехід помаранчевого забарвлення розчину в синьо-зелений, що обумовлено зміною ступеню окислення хрому. Відчувають характерний запах оцтового альдегіду, що нагадує запах антонівських яблук. Ця реакція може бути використана для відкриття етилового спирту. За допомогою піпетки відбирають 1 краплю отриманого розчину і додають в пробірку, що містить 3 краплі розчину фуксинсерністої кислоти. Спостерігають появу рожево-фіолетового забарвлення розчину, що підтверджує утворення оцтового альдегиду (див. опит 74). Б. Окислення етанолу калію перманганатом. У пробірку поміщають 2 краплі етанолу, 2 краплі 5 %-ного розчину калію перманганату і 3 краплі 10 %-ного розчину сульфатної кислоти. Спостерігають знебарвлення рожево-фіолетового забарвлення розчину і вже при слабкому нагріванні відчувають запах оцтового альдегіду, що нагадує запах антонівських яблук : За допомогою піпетки відбирають 1 краплю отриманого розчину і додають в пробірку, що містить 3 краплі розчину фуксинсерністої кислоти. Спостерігають появу рожево-фіолетового забарвлення розчину, що підтверджує утворення оцтового альдегіду (див. опит 74). Опит 47. Утворення йодоформу із спирту (йодоформна проба) У пробірку поміщають 3 краплі ізопропилового спирту, 3 краплі розчину йоду в калію йодиді і 1-2 краплі 10 %-ного розчину натрію гідроксиду (до знебарвлення розчину). Вміст пробірки нагрівають в полум'ї пальника і спостерігають помутніння або появу осаду свлабо-жовтого кольору з характерним запахом йодоформу. Опит 48. Взаємодія багатоатомних спиртів з купруму (II) гидроксидом У пробірку поміщають 6 крапель 3 %-ного розчину купруму (II) сульфату і 6 крапель 10 %-ного розчину натрію гідроксиду. Вміст пробірки збовтують і спостерігають виділення осаду блакитного кольору – міді (II) гідроксиду. Частину осаду переносять в пробірку, що містить 1-2 краплі гліцерину. Спостерігають розчинення осаду і появу синього забарвлення розчину, обумовленого утворенням купруму (II) гліцерату. Обидві пробірки нагрівають в полум'ї пальники до кипіння. У пробірці з купруму (II) гліцератом видимих змін не відбувається, на відміну від пробірки з купруму (II) гідроксидом. При нагріванні купруму (II) гідроксид розкладається з утворенням осаду чорного кольору – купруму (II) оксиду : Ця реакція є якісною реакцією на багатоатомні спирти, що містять у своїй структурі -глікольний фрагмент. Вони утворюють з купруму (II) гідроксидом в лужному середовищі хелатний комплекс інтенсивно-синього кольору, що не розкладається при кип'ятінні. Опит 49. Ксантогенова проба У пробірку поміщають 1 краплю етилового спирту (ректификату) і 1 мл діетилового ефіру. Вміст пробірки перемішують, додають 1 краплю сірковуглецю і декілька крупинок натрію гідроксиду. Реакційну суміш злегка підігрівають на водяній лазні, а потім додають 1 краплю 2 %-ного розчину купруму (II) сульфату. Спостерігають появу коричневого осаду купруму (I) этилксантогената : Ксантогенова проба є найбільш чутливою реакцією на первинні і вторинні спирти. Опит 50. Утворення акролеїну з гліцерину У суху пробірку поміщають декілька кристалів калію гідросульфіту безводного і 2-3 краплі гліцерину. Вміст пробірки нагрівають в полум'ї пальника і спостерігають появу парів акролеїну, які відчувають по їдкому характерному запаху. При внесенні в пробірку смужки фільтрувального паперу, змоченою фуксинсерністою кислотою, спостерігають появу рожево-фіолетового забарвлення, що підтверджує утворення акролеїну (див. опит 74). Опит 67. Міжмолекулярна дегідратація У суху пробірку поміщають 2 краплі етанолу і 2 краплі концентрованої сульфатної кислоти. Суміш обережно нагрівають в полум'ї пальника до початку кипіння. Видаливши від полум'я пальника пробірку, в реакційну суміш додають ще 2 краплі етанолу. Відчувають характерний запах діетилового ефіру. Міжмолекулярна дегідратація спиртів здійснюється при нагріванні спиртів у присутності каталітичних кількостей мінеральної кислоти при температурі 140-160 °С. Хід роботи:
завдання для перевірки досягнення конкретних цілей навчання Тест 1 Спиртами називаються сполуки, що мають у своєму складі одну або декілька гідроксильних груп. Виберіть правильну хімічну назва для цієї сполуки:   СН3 СНСНССН2СН3 СН3 СНСНССН2СН3ОН СН3
Тест 2 За розміщенням гідроксильної групи у вуглецевому ланцюзі спирти класифікують на первинні, вторинні і третинні. Який з наведених спиртів є вторинним?
Тест 3 Найбільш розповсюджений метод одержання спиртів – це відновлення карбонільних сполук. Відновленням якої сполуки можна одержати пропанол-2?
Тест 4 Кислотні властивості спиртів зумовлені рухливістю атома водню гідроксильної групи. Розташуйте в ряд за зменшенням кислотних властивостей етанол, етиленгліколь, гліцерин:
Тест 5 Чим зумовлена контракція спирту?
Тест 6 При тривалому стоянні па повітрі прості ефіри утворюють вибухонебезпечні гідро пероксиди і пероксиди. За механізмом це є реакція:
Тест 7 Виберіть реакцію, за допомогою якої можна розрізнити первинні, вторинні і третинні спирти:
Тест 8 До лабораторії надійшли етиловий та метиловий спирти. За допомогою якої реакції їх можна розрізнити
Тест 9 У фармацевтичній промисловості гліцерин застосовується для одержання судинно-розширюючого препарату – нітрогліцерину. За допомогою якої реакції можна ідентифікувати гліцерин?
Еталони відповідей: 1.C, 2.D, 3.B, 4.C, 5.A, 6.C, 7.B, 8.E, 9.B. КОРОТКІ МЕТОДИЧНІ ВКАЗІВКИ ДО ПРОВЕДЕННЯ ПРАКТИЧНОГО ЗАНЯТТЯ На занятті перевіряється підготовленість студентів до проведення практичного заняття, проводиться інструктаж з техніки безпеки при роботі з хімічними реактивами. Перевіряється виконання домашнього завдання, та під керівництвом викладача виконуються завдання для самостійної роботи. Потім студенти приступають до виконання лабораторної роботи, використовуючи при цьому інструкцію робочого журналу . Після виконання лабораторної роботи необхідно оформити протокол, зробити висновки до роботи, що перевіряє і контролює викладач. Проводиться підсумковий тестовий контроль по темі, підводяться підсумки роботи. . |
