Физика лекции Юнусова (1). Минимальный курс физики. Составлен доц. Юнусовым Н. Б
 Скачать 3.72 Mb. Скачать 3.72 Mb.
|
|
О 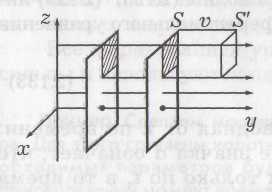 бъемную плотность энергии w упругой волны получим, если рассмотрим в какой-либо области пространства колебание частиц среды объемом dV и массой dm=ρ·dV. Полная энергия колебаний этих частиц, согласно (7), будет равна: бъемную плотность энергии w упругой волны получим, если рассмотрим в какой-либо области пространства колебание частиц среды объемом dV и массой dm=ρ·dV. Полная энергия колебаний этих частиц, согласно (7), будет равна: где ρ – плотность вещества среды; ω – частота колебаний, А0 – амплитуда колебаний. Откуда следует, что : . В самом общем случае энергия волны, заключенная в некотором объеме V, согласно (21), рассчитывается по формуле: 1.8. ОСНОВЫ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ ВЕЩЕСТВА Молекулярная физика – раздел физики, изучающий строение и свойства вещества, исходя из молекулярно-кинетической теории (МКТ) . Основные положения МКТ: – все тела состоят из мельчайших частиц – молекул, атомов и ионов; – молекулы находятся в состоянии непрерывного хаотического движения, которое не прекращается ни при каких условиях; – молекулы взаимодействуют между собой. Взаимодействие это зависит от типа молекул и от расстояний между ними. Косвенным подтверждением этих положений является броуновское движение и диффузия. Система (тело), состоящая из очень большого числа молекул, называется макроскопической или статистической. Величины, характеризующие свойства системы, – параметры состояния. Это давление p, температура Т, объем V. Размеры и масса молекул. Количество вещества. Все тела состоят из атомов и молекул. Размеры атомов и молекул малы (порядка 10-10м), а их число в теле обычных размеров огромно. Масса простейшего атома – атома водорода – порядка 1,67·10-27 кг. Количество вещества ν выражается в молях. По определению 1 моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 (С12) массой 0,012 кг. В 1 моле содержится NA=0,012/(19,9·10-27)=6,02·1023атомов. (19,9·10-27кг– масса атома С12). Это число называют числом Авогадро NA и оноявляется масштабным множителем между микро- и макромиром. Таким образом, количество вещества тела определяется как ν=N/NA, где N– число структурных элементов (атомов, молекул и т.д.), содержащихся в теле. Количество вещества можно записать и по другому, если числитель и знаменатель умножить на массу молекулы Основное уравнение МКТ идеального газа Идеальным называется газ, молекулы которого не взаимодействуют друг с другом на расстоянии и имеют исчезающе малые размеры. Взаимодействие молекул осуществляется только при столкновениях. Следствием многочисленных столкновений молекул газа со стенками сосуда, в котором он находится, является давление, оказываемое им на эти стенки. Это давление p можно рассчитать, если учесть, что давление численно равно силе, действующей на единицу площади стенки сосуда, или, согласно 2 закону Ньютона, среднему импульсу, передаваемому молекулами при соударениях в единицу времени единице площади: где S – площадь стенки, n – число молекул газа в единице объема (концентрация), Уравнение Температура. Уравнение состояния идеального газа. Понимание того, что такое температура пришло много позже введения единиц для измерения температуры как степени нагретости тела. Шкалу температур от точки таяния льда (0°С) до точки кипения воды разделили на 100 частей и одну такую часть назвали 1 градус Цельсия(10С). От 0°С шкалу температур такими же шагами (градусами) продлили вниз до точки, где кинетическая энергия поступательного движения молекул равна нулю, и назвали эту температуру абсолютным нулем. По Цельсию это – минус 273,150С. Кельвин предложил отсчитывать температуру от этой точки, а размер градуса сохранить. Тогда – 273,15°С будет соответствовать 0 градусов по Кельвину (0 К), а 0°С будет соответствовать 273,15 К. Под Т в дальнейшем понимается абсолютная температура в К. Изучая разреженные газы Клапейрон открыл для них связь между термодинамическими параметрами в виде: p·V=C·T. Д.И.Менделеев показал, что коэффициент С в этом уравнении равен: С = ν·R=(m/μ)·R, где универсальная газовая постоянная R = 8,314 Дж/(моль·К) была определена опытным путем. Уравнение p·V=ν·R·T=(m/μ)·R·T = (N/NA)·R·T (4) называется уравнением состояния идеального газа или Клапейрона-Менделеева. Умножим обе части уравнения (3) на объемV, занимаемый в данных условиях газом: где n·V = N– число молекул в объеме V . Сравнивая уравнения (4) и (5) получим: где к = R/NAпредставляет собой газовую постоянную в расчете на одну молекулу. Она называется постоянной Больцманаи равна k = 8,314 /(6,02 · 1023 )= 1,38·10 -23Дж/К (7). Из (6) следует физический смысл температуры: она характеризует среднюю кинетическую энергию движения молекул. При приведении тел в соприкосновение молекулы сталкиваются друг с другом, обмениваясь энергией. В конце концов средние кинетические энергии молекул соприкасающихся тел выравниваются. Т.о., температура определяется как термодинамический параметр, который выравнивается у тел, приведенных в соприкосновение. На этом основано действие термометров – приборов для измерения температуры, которая после теплообмена становится одинаковой и у тела и у прибора. Поскольку N/V=n– концентрация, а m /V=ρ– плотность газа, то из (4) можно получить формулы: p=n·k·T и Явления переноса. Средняя длина свободного пробега молекул. Процессы, происходящие в неравновесных системах и сопровождающиеся пространственным переносом массы, энергии или импульса, называются явлениями переноса. Законы для них были установлены сначала опытным путем, а затем теоретически были получены на основе МКТ. Перенос происходит до тех пор, пока сохраняется пространственный градиент dA/dx какой-либо физической величины A (плотности ρ, температуры Т или скорости потока u ) 1. Диффузия – перенос массы dm – подчиняется закону Фика: 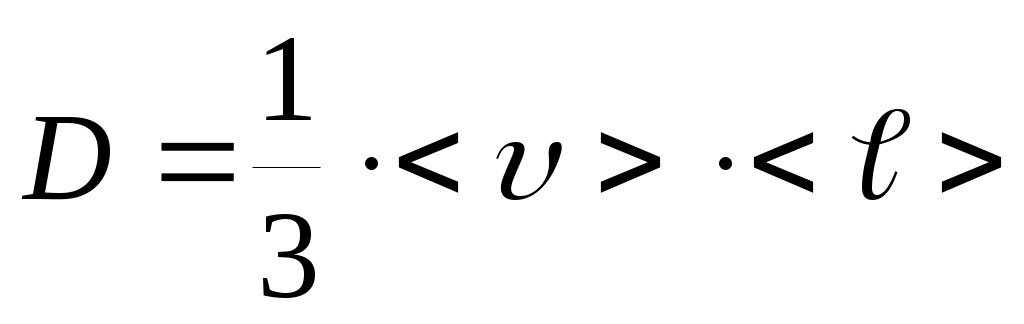 – коэффициент диффузии, – коэффициент диффузии, 2. Теплопроводность – перенос энергии в виде тепла – подчиняется закону Фурье: где 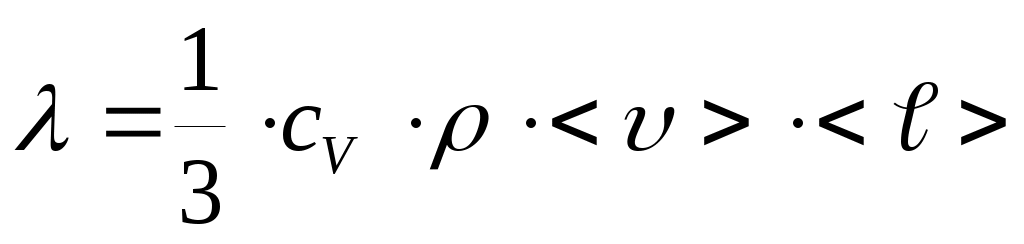 – коэффициент теплопроводности. – коэффициент теплопроводности.3. Внутреннее трение (вязкость) – перенос импульса направленного движения dp при обмене молекулами между двумя соприкасающимися потоками жидкости или газа, движущимися с разными скоростями u , – подчиняется закону Ньютона: где 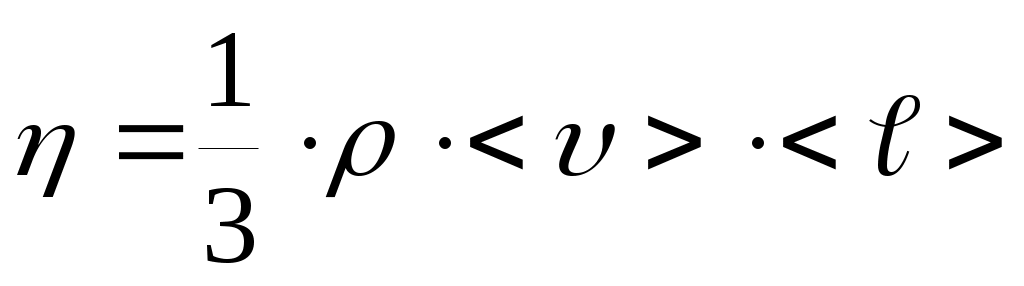 – коэффициент динамической вязкости. – коэффициент динамической вязкости.1.9. ФУНКЦИИ РАСПРЕДЕЛЕНИЯ МАКСВЕЛЛА И БОЛЬЦМАНА. Распределение молекул по скоростям. Среднюю квадратичную скорость молекул газа при температуре Т можно оценить по (2) и (6): О 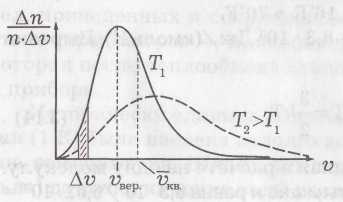 днако, отдельные молекулы даже в случае одного типа газа имеют разные скорости. Разброс по скоростям может быть весьма велик. Это отражено на рисунке, на котором по вертикали отложена доля от общего числа молекул в единице объема Δn/n, имеющих скорости в некотором интервале от υдо υ+ Δ υ, в расчете на единицу этого интервала, т. е. Δn/(n·Δυ). днако, отдельные молекулы даже в случае одного типа газа имеют разные скорости. Разброс по скоростям может быть весьма велик. Это отражено на рисунке, на котором по вертикали отложена доля от общего числа молекул в единице объема Δn/n, имеющих скорости в некотором интервале от υдо υ+ Δ υ, в расчете на единицу этого интервала, т. е. Δn/(n·Δυ). Кривая на рисунке имеет максимум, т. е. молекул со скоростью Для нахождения положения максимума, т. е. наиболее вероятной скорости При повышении температуры кривая деформируется, 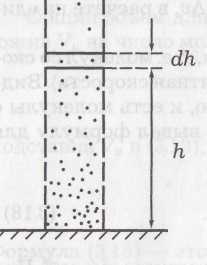 Распределение Больцмана Распределение БольцманаМолекулы газа, находящиеся в поле тяготения, участвуют в тепловом движении и испытывают действие силы тяжести. Это приводит к стационарному состоянию, при котором наблюдается уменьшение концентрации n и давления p газа с возрастанием высоты над Землей. К этому выводу можно прийти путем таких рассуждений. На рисунке показан столб газа. На высоте hвыделим слой толщиной dh. Слой dhдавит своей тяжестью dm·g = ρ·S·dh·gна нижний слой. В результате давление (сила на единицу площади) над слоем будет на dp= ρ·g·dhменьше, чем под слоем и связь между ρ и hбудет такой: –dp= ρ·g·dh. Перед dpпоставлен знак «минус», так как с увеличением hдавление р не возрастает, а убывает, приращения dhи dpимеют разные знаки. Если заменим, использовав (8), dpна k·T·dnи плотность ρ наm0·n, то получим: 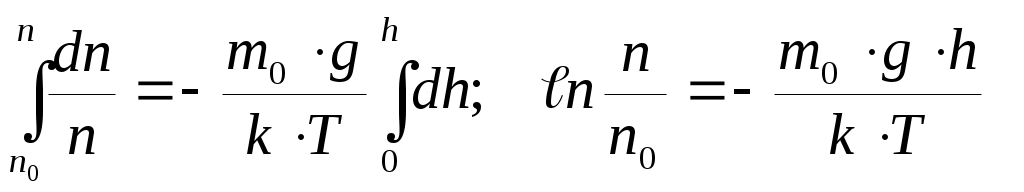 (16) получим выражение (16) получим выражение где n0–концентрация молекул у поверхности (h=0), εП– потенциальная энергия молекулы (в общем случае не только в поле силы тяжести). (17) справедливо, если Т с высотой не меняется, что не всегда так. Это очень важное не только для этого раздела выражение – формула Больцмана – распределение числа частиц по энергии. |
