|
|
Физика лекции Юнусова (1). Минимальный курс физики. Составлен доц. Юнусовым Н. Б
1.10. ОСНОВЫ ТЕРМОДИНАМИКИ
Термодинамика– учение о превращениях одного вида энергии в другой, о передаче энергии от тела к телу. Термодинамика изучает свойства макроскопических тел без рассмотрения их молекулярной структуры. Термодинамическая система (ТС) –макроскопические тела, которые могут обмениваться энергией как друг с другом, так и с внешней средой.Равновесное состояние ТС - состояние, при котором термодинамические параметры (давление, температура и объем) остаются постоянными сколь угодно долго при неизменных внешних условиях. Термодинамический процесс – изменение состояния ТС, характеризующееся изменением ее параметров. Состояние ТС характеризуют также внутренней энергией, которая равна сумме кинетических энергий беспорядочного движения всех молекул и потенциальных энергий взаимодействия молекул друг с другом.
Система тел называется изолированной, или замкнутой, если нет обмена энергией с окружающей средой.
Первое начало термодинамики
Тела и системы могут обмениваться энергией друг с другом. Существует два вида обмена энергией. Это может быть работа, произведенная одним телом (системой) над другим телом (системой). Примером может служить перемещение тела или его частей под действием упругих, электрических или других сил.
Другой способ обмена энергией – путем передачи энергии неупорядоченного, хаотического движения молекул. Тогда говорят о передаче тепла. Например, передача энергии от нагретого тела к холодному происходит за счет передачи кинетической энергии хаотически движущихся молекул одного тела хаотическому движению молекул другого тела. В обоих этих случаях изменяется внутренняя энергия U.
Сказанное выше можно записать как: ΔU = Q+А’, где Q – энергия,
поступающая в систему при теплообмене, а А’– работа, совершаемая внешними
телами над системой. Исторически принято это соотношение записывать как:
Q = ΔU + А (18),
где А = – А’ –работа, совершаемая самой системой.
(18), представляющее собой закон сохранения энергии, получило название первого начала термодинамики: «Подведенное к телу количество теплоты идет на увеличение внутренней энергии тела и на работу, которую тело производит».
Очень важно отметить различие между величинами U с одной стороны, и А и Q – с другой. Внутренняя энергия U– это функция состояния системы. Если в состоянии 1 внутренняя энергия равна U1 , то что бы ни происходило с системой, какую бы работу она ни совершала, какие бы количества теплоты к ней ни подводились, если система вернулась в то же состояние 1 (т. е. процесс оказался круговым, совершен цикл), ее внутренняя энергия будет снова U1 (ΔU=0).
В то же время Q и А – это только передаваемые телу или получаемые от тела порции энергии. Они связаны с передачей энергии, а не с каким-то запасом их в теле. Бессмысленно говорить о запасе работы в теле. И так же бессмысленно говорить о запасе теплоты в теле. Работа и теплота не являются функциями состояния тела.
Переходя к бесконечно малым порциям энергии, запишем первое начало в дифференциальной форме: δQ = dU + δA. (19).
Здесь специально даны разные обозначения бесконечно малых («d...» и «δ…»), чтобы отразить то обстоятельство, что U – функция состояния, a Qи А – нет.
Работа расширения идеального газа при различных процессах
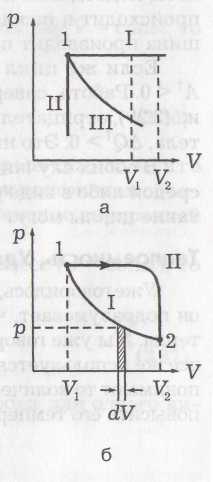 На рисунке а приведена зависимость давления газа от его объема. Точка 1 означает состояниегаза, так как указывает его давление и объем в данный момент. Температуру при этом можно найти из (4). Линии означают процессы, так как показывают, через какие состояния система проходит. Процесс может быть без изменения давления (прямая I на рисунке а). Такой процесс называется изобарическим. Изохорическийпроцесс (прямая II) – это процесс без изменения объема. Процесс без изменения температуры (изотермический)будет примерно таким, как показано кривой III. Это гипербола, так как при Т = const давление обратно пропорционально объему: p На рисунке а приведена зависимость давления газа от его объема. Точка 1 означает состояниегаза, так как указывает его давление и объем в данный момент. Температуру при этом можно найти из (4). Линии означают процессы, так как показывают, через какие состояния система проходит. Процесс может быть без изменения давления (прямая I на рисунке а). Такой процесс называется изобарическим. Изохорическийпроцесс (прямая II) – это процесс без изменения объема. Процесс без изменения температуры (изотермический)будет примерно таким, как показано кривой III. Это гипербола, так как при Т = const давление обратно пропорционально объему: p
1/V (см. уравнение (4)). Расширяясь, газ производит работу. Пусть в цилиндре поршень площадью S под действием постоянной силы F передвинулся вследствие расширения газа на расстояние dx. Работа газа будет равна:
δA = F·dx= p·S·dx= p·dV(20).
Если Fизменяется, то:  (21). На рис.б p·dV– это площадь заштрихованной полоски, a  – это сумма площадей всех полосок от V1 до V2. T. о., работа газа измеряется площадью под кривой на диаграмме p–V.Очевидно, что работа зависит от процесса, т. е. от того, происходит ли расширение газа по кривой I или по кривой II (видно, что – это сумма площадей всех полосок от V1 до V2. T. о., работа газа измеряется площадью под кривой на диаграмме p–V.Очевидно, что работа зависит от процесса, т. е. от того, происходит ли расширение газа по кривой I или по кривой II (видно, что на рис. б под кривой II площадь больше, чем под кривой I). При изобарическом процессе ( рис. а, кривая I) работа газа:  (22). При изохорическом процессе ( рис. а, кривая II) объем не меняется, т. е. dV= 0 и, следовательно, А = 0. При изотермическом процес се меняются и р, и V ( рис. б). Заменив давление через объем и температуру, согласно уравнению (4), получим работу газа при T=const : (23). Проведем процесс расширения газа из состояния 1 (рис. б) в состояние 2 по кривой II (А>0), а сжатие обратно в состояние 1 – по кривой I (А<0). Процесс с возвращением в ту же точку называется циклом. Тогда общая работа будет равна разности площадей под кривыми II и I, т. е. пло щади цикла.Если цикл на диаграммах p–V совершается по часовой стрелке (см. рис. б), то работа при расширении больше, чем при сжатии и полная работа А > 0. Поскольку мы возвращаемся в ту же точку, ΔU = 0. Из (18) следует, что при таком процессе и теплота, подводимая к телу, должна быть больше нуля (Q> 0). Так происходит в тепловой машине, когда тепло подводится, а машина производит положительную работу.Если же цикл совершается против часовой стрелки, то А < 0. Соответственно и Q < 0, т. е. энергия не подводится к телу, а отводится от него. Это имеет место в холодильнике.В обоих случаях происходит обмен энергией с окружающей средой либо в виде работы, либо в виде обмена теплотой. Теплоемкость. Молярная теплоемкость газа. Степени свободы.Под теплоемкостью С тела понимают то количество тепла, которое надо сообщить телу, чтобы повысить его температуру на один градус Кельвина: ( Дж /К ) (24) Если передается энергия не всему телу, а одному килограмму, то говорят об удельной теплоемкости с = С/m( Дж/(кг·К)). Если речь идет об одном моле, то говорят омолярной теплоемкости  , измеряемой в Дж/(моль·К). О ней мы и будем говорить далее.Поскольку при переходе тела из одного состояния в другое δQзависит от процесса, по которому производится этот переход, теплоемкость тоже зависит от процесса. Если процесс изохорический (V = const), то теплоемкость обозначается СV. Если процесс изобарический, то – Ср , измеряемой в Дж/(моль·К). О ней мы и будем говорить далее.Поскольку при переходе тела из одного состояния в другое δQзависит от процесса, по которому производится этот переход, теплоемкость тоже зависит от процесса. Если процесс изохорический (V = const), то теплоемкость обозначается СV. Если процесс изобарический, то – Ср. При изотермическом процессе dT = 0, a δQне равно нулю и соответствующая теплоемкость устремляется к бесконечности СТ → ∞.Определим СV (теплоемкость 1 моля при постоянном объеме), использовав первое начало термодинамики в дифференциальной форме (19). Поскольку V = const, тоdV = 0 и δA= 0 и для СVполучаем: 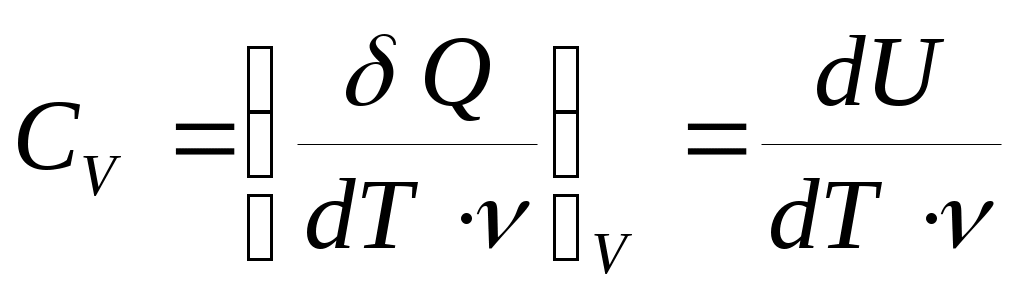 (25) .Значок вне скобок указывает на тип процесса, т. е. что V= const. Соотношение (25) означает, что при постоянном объеме все подводимое тепло идет только на изменение внутренней энергии U. При изобарическом процессе (р = const), для теплоемкости Ср получаем: (25) .Значок вне скобок указывает на тип процесса, т. е. что V= const. Соотношение (25) означает, что при постоянном объеме все подводимое тепло идет только на изменение внутренней энергии U. При изобарическом процессе (р = const), для теплоемкости Ср получаем: 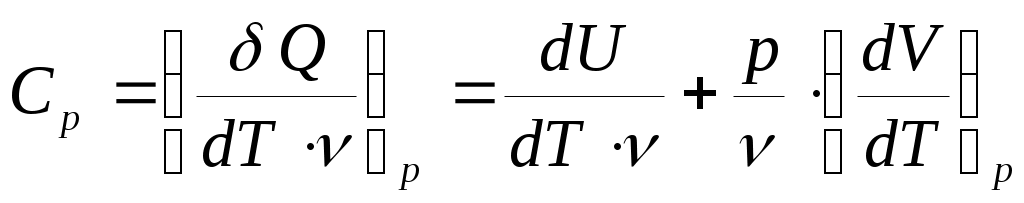 (26).Найдем (dV/dT)pиз уравнения Клапейрона (4): (26).Найдем (dV/dT)pиз уравнения Клапейрона (4):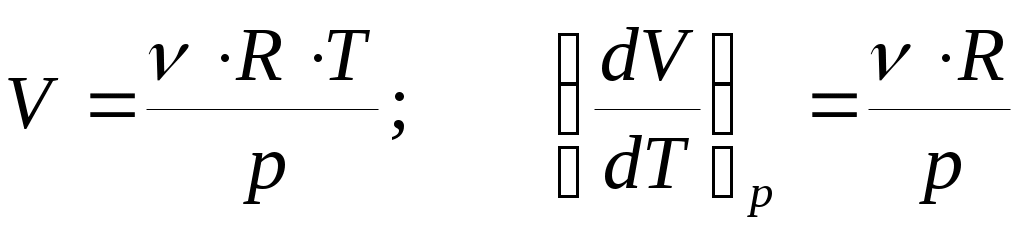 (27) и подставив в (26), получим уравнение Майера:  (28).Cp больше, чем СV , так как подведенная теплота идет не только на увеличение внутренней энергии, но и на работу расширения газа.Определим dU/dT, так как эта производная входит в (25) и (26). Для идеального газа внутренняя энергия равна сумме средних кинетических энергий всех N молекул: (28).Cp больше, чем СV , так как подведенная теплота идет не только на увеличение внутренней энергии, но и на работу расширения газа.Определим dU/dT, так как эта производная входит в (25) и (26). Для идеального газа внутренняя энергия равна сумме средних кинетических энергий всех N молекул:  (29). Тогда  ; 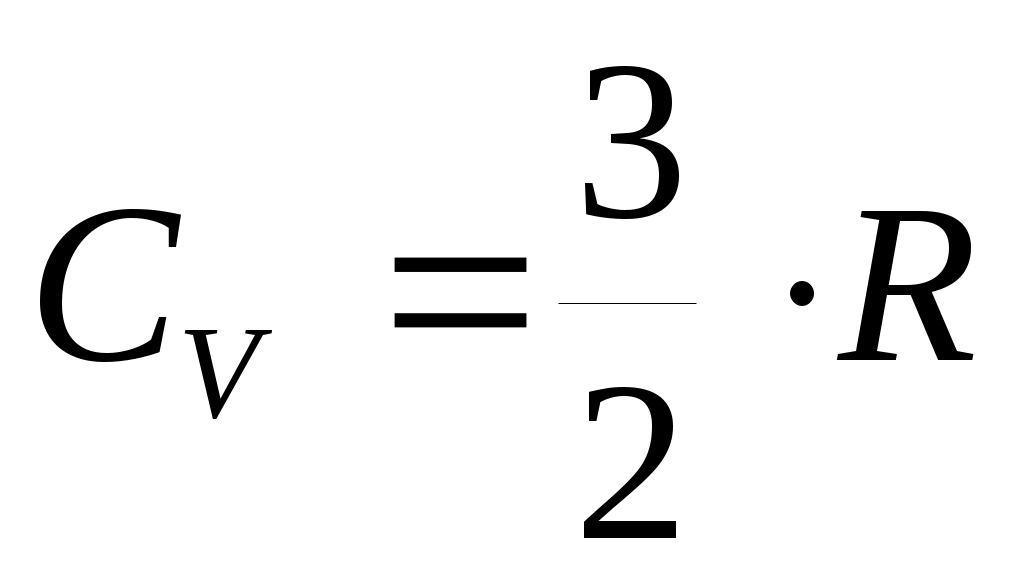 ;  (30). В выражении для (30). В выражении для  учитывалась только кинетическая энергия поступательного движения в трехмерном пространстве. Число независимых координат, необходимых, чтобы полностью определить положение тела в пространстве, называется числом степеней свободы i. Будем считать атомы, из которых состоит молекула, материальными точками, тогда одноатомная молекула имеет три степени свободы поступательного движения i= 3. И т.о., на каждую степень свободы приходится энергия по (1/2)kТ. учитывалась только кинетическая энергия поступательного движения в трехмерном пространстве. Число независимых координат, необходимых, чтобы полностью определить положение тела в пространстве, называется числом степеней свободы i. Будем считать атомы, из которых состоит молекула, материальными точками, тогда одноатомная молекула имеет три степени свободы поступательного движения i= 3. И т.о., на каждую степень свободы приходится энергия по (1/2)kТ. 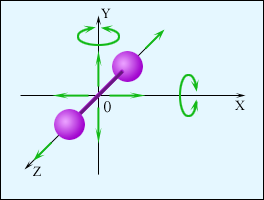 Если молекула двухатомная (рис.), то, кроме поступательного движения, она может еще вращаться вокруг осей xи y. Вращение вокруг оси zне дает вклада в энергию, так как энергия вращательного движения равна J·ω2/2 = m·r2·ω2/2, а двухатомная молекула не имеет пространственной протяженности вдоль осей xи y.Надо не только задать три координаты, чтобы определить положение центра масс молекулы в пространстве, но и задать еще две (вращательные) координаты, чтобы определить ее ориентацию в пространстве. Т.о., число степеней свободы для двухатомной молекулы i = 5. Для трех- и более атомной молекулы вклад в энергию даст и вращение вокруг оси z . Для них i= 6 .Молекулы мы считали жесткими; колебательные степени свободы не Если молекула двухатомная (рис.), то, кроме поступательного движения, она может еще вращаться вокруг осей xи y. Вращение вокруг оси zне дает вклада в энергию, так как энергия вращательного движения равна J·ω2/2 = m·r2·ω2/2, а двухатомная молекула не имеет пространственной протяженности вдоль осей xи y.Надо не только задать три координаты, чтобы определить положение центра масс молекулы в пространстве, но и задать еще две (вращательные) координаты, чтобы определить ее ориентацию в пространстве. Т.о., число степеней свободы для двухатомной молекулы i = 5. Для трех- и более атомной молекулы вклад в энергию даст и вращение вокруг оси z . Для них i= 6 .Молекулы мы считали жесткими; колебательные степени свободы не
учитывались. Если их учесть, результат будет немного иной, но колебательные степени свободы становятся существенными только при высоких температурах.Итак, для жестких молекул внутренняя энергия и молярные теплоемкости равны:  ; ;  (31).Все это сильно упрощенные рассуждения, непригодные, например, при очень низких или высоких температурах. Более последователь (31).Все это сильно упрощенные рассуждения, непригодные, например, при очень низких или высоких температурах. Более последовательная теория теплоемкости строится на основе квантовой физики. |
|
|
 Скачать 3.72 Mb.
Скачать 3.72 Mb.

 (21).
(21). 
 (22).
(22). (23).
(23).  Если молекула
Если молекула