зайко. Н. Н. Зайко Патологическая физиология Введение Предмет и задачи патологической физиологии Патологическая физиология есть наука, изучающая жизнедеятельность больного организма. Программа
 Скачать 7.32 Mb. Скачать 7.32 Mb.
|
|
Нарушения обмена фенилаланина. Фенилаланин в норме необратимо окисляется в тирозин. Если же в печени нарушается синтез необходимого для этого фермента фенилаланингидроксилазы (схема 14, блок а), то окисление фенилаланина идет по пути образования фенилпировиноградной и фенилмолочной кислот – развивается фенилкетонурия. Однако этот путь обладает малой пропускной способностью и поэтому фенилаланин накапливается в большом количестве в крови, тканях и цереброспинальной жидкости, что в первые же месяцы жизни ведет к тяжелому поражению центральной нервной системы и неизлечимому слабоумию. Из-за недостаточного синтеза тирозина снижается образование меланина, что обусловливает посветление кожи и волос. Кроме того, при увеличенной выработке фенилпировиноградной кислоты тормозится активность фермента (дофамингидроксилазы), необходимого для образования катехоламинов (адреналина, норадреналина). Поэтому тяжесть наследственного заболевания определяется комплексом всех этих нарушений. Установить болезнь можно с помощью следующей пробы: при добавлении к свежей моче нескольких капель 5% раствора трихлоруксусного железа появляется оливково-зеленая окраска. Больные погибают в детстве, если не проводится специальное лечение, которое заключается в постоянном, но осторожном (контроль за аминокислотным составом крови) ограничении поступления фенилаланина с пищей. Нарушения обмена тирозина. Обмен тирозина осуществляется несколькими путями. При недостаточном превращении образовавшейся из тирозина парагидроксифенилпировиноградной кислоты в гомогентизиновую (см. рис. 14.9, блок 6) первая, а также тирозин выделяются с мочой. Это нарушение носит названиетирозиноза. Если же задержка окисления тирозина происходит в момент превращения гомогентизиновой кислоты в малеилацетоуксусную (см. рис. 14.9, блок в), развиваетсяалкаптонурия. Фермент, окисляющий гомогентизиновую кислоту (оксидаза гомогентизиновой кислоты), образуется в печени. В норме он настолько быстро разрывает ее гидрохиноновое кольцо, что кислота "не успевает" появиться в крови, а если и появляется, то быстро выводится почками. При наследственном дефекте этого фермента гомогентизиновая кислота в большом количестве обнаруживается в крови и моче. Моча при стоянии на воздухе, а также при добавлении к ней щелочи становится черной. Это объясняется окислением гомогентизиновой кислоты кислородом воздуха и образованием в ней алкаптона ("захватывающий щелочь"). Гомогентизиновая кислота из крови проникает в ткани – хрящевую, сухожилия, связки, внутренний слой стенки аорты, вследствие чего появляются темные пятна в области ушей, носа, щек, на склерах. Иногда развиваются тяжелые изменения в суставах. 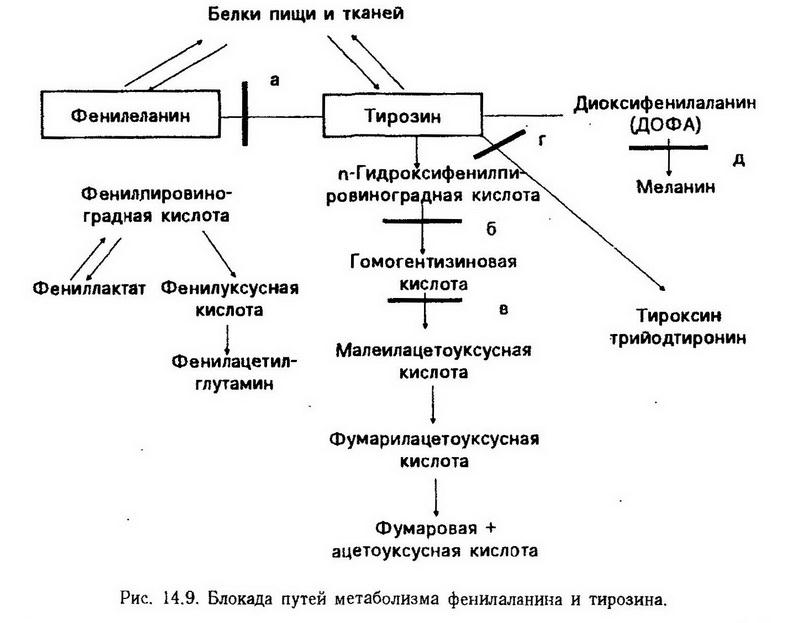 Тирозин, кроме того, является исходным продуктом для образования красящего вещества кожи и волос – меланина. Если превращение тирозина в меланин уменьшено из-за наследственной недостаточности тирозиназы (см. рис. 14.9, блок д), возникает альбинизм. Наконец, тирозин является предшественником тироксина. При недостаточном синтезе фермента, катализирующего процесс йодирования тирозина свободным йодом (см. рис. 14.9, блок г), нарушается образование гормонов щитовидной железы. Нарушения обмена триптофана. Основной путь метаболизма триптофана приводит к синтезу амида никотиновой кислоты, который играет очень важную роль в жизнедеятельности организма, являясь простетической группой ряда окислительных ферментов – никотинамидадениндинук-леотида (НАД) и его восстановленной формы никотинамидаденин-динуклеотидфосфата (НАДФ). Поэтому при недостаточности никотиновой кислоты и ее амида нарушаются многие обменные реакции, а при значительном дефиците этих веществ развивается пеллагра. Нарушение обмена триптофана может проявиться также в изменении количества образующегося из него серотонина. Нарушения конечных этапов белкового обмена Патофизиология конечных этапов белкового обмена включает в себя патологию процессов образования азотистых продуктов (мочевина, аммиак, мочевая кислота) и выведения их из организма. Основным показателем нарушения образования и выделения мочевины и других азотистых продуктов обмена является изменение содержания и состава остаточного (небелкового) азота в крови (норма – 20 – 30 мг%). Остаточный азот на 50% состоит из азота мочевины, около 25% его приходится на долю аминокислот, остальная часть – на другие азотистые продукты. Немочевинная часть его получила название резидуального азота. Увеличение остаточного азота в крови – гиперазотемия – может быть следствием нарушения образования мочевины в печени (продукционная, или печеночная, гиперазотемия) и нарушения выделительной функции почек (ретенционная, или почечная, гиперазотемия). Нарушения образования мочевины наблюдаются при ряде заболеваний (дистрофические изменения в печени, гипоксия), а также могут быть наследственно обусловленным дефектом. Наследственные нарушения мочевинообразования проявляются при недостаточном синтезе аргинин-сукцинатлиазы (аргининсукцинатурия), карбамоилфосфатсинтетазы и орнитинкарбамоилтрансферазы (аммонийемия) и аргининсукцинат-синтетазы (цитруллинурия). Наиболее частым следствием нарушения синтеза мочевины является накопление аммиака в крови. Количество его может увеличиваться при резко выраженном нарушении выделительной функции почек. Токсическое действие аммиака обусловлено прежде всего его влиянием на центральную нервную систему. Оно может быть прямым и опосредованным. Последнее заключается в усиленном обезвреживании аммиака вследствие связывания его глутаминовой кислотой. Выключение вследствие этого глутаминовой кислоты из обмена проявляется ускорением переаминирования аминокислот с а-кетоглутаровой кислотой, которая тем самым отвлекается от участия в цикле трикарбоновых кислот (цикл Кребса). Торможение цикла Кребса приводит к задержке утилизации ацетил-СоА, который, превращаясь в кетоновые тела, способствует развитию коматозного состояния. Нарушения образования и выделения мочевой кислоты. Мочевая кислота – это конечный продукт обмена пуриновых оснований, входящих в структуру нуклеиновых кислот. Нарушения образования и выделения мочевой кислоты могут наблюдаться при заболеваниях почек, при лейкозах. Однако наиболее ярко эти нарушения проявляются при подагре. Подагра была известна еще в древнем мире и описана Гиппократом. Изучение заболевания началось в 1860 г., когда Гаррод, сам страдавший подагрой, дал ее классическое описание и обнаружил в крови у больных увеличение содержания мочевой кислоты (гиперурикемия). К подагре существует предрасположение в виде доминантно наследуемого повышения уровня мочевой кислоты в крови и, возможно, изменения факторов, поддерживающих мочевую кислоту в растворенном состоянии. Факторами риска возникновения подагры могут быть избыточное поступление пуринов в организм (употребление в пищу большого количества мяса, особенно с вином и пивом); избыточное поступление в организм молибдена, который входит в состав ксантиноксидазы, переводящей ксантин в гипоксантин, который затем превращается в мочевую кислоту; пол (чаще болеют мужчины); пожилой возраст, для которого характерна возрастная гиперурикемия. Механизм повышения уровня мочевой кислоты в крови у больных не совсем ясен. Определенная роль в этом отводится как нарушению выделения мочекислых соединений почками, так и усиленному образованию их из глицерина и других предшественников. Гиперурикемия может сопровождаться отложением солей мочевой кислоты в суставах и хрящах, где в силу слабого кровоснабжения всегда имеется тенденция к закислению среды, что способствует выпадению солей в осадок (особенно при дефекте факторов, поддерживающих их в растворенном состоянии). Отложение солей вызывает острое подагрическое воспаление, сопровождающееся болью, лихорадкой, а также аллергическими проявлениями и заканчивающееся образованием подагрических узлов и деформацией суставов. Нарушения белкового состава крови Изменения в количественном и качественном соотношении белков крови наблюдаются почти при всех патологических состояниях, которые поражают организм в целом, а также при врожденных аномалиях синтеза белков. Нарушение содержания белков плазмы крови может выражаться изменением общего количества белков (гипопротеинемия, гиперпротеинемия) или соотношения между отдельными белковыми фракциями (диспротеинемия) при нормальном общем содержании белков. Гипопротеинемия возникает главным образом за счет снижения количества альбуминов и может быть приобретенной (при голодании, заболеваниях печени, нарушении всасывания белков) и наследственной. К гипопротеинемии может привести также выход белков из кровеносного русла (кровопотеря, плазмопотеря, экссудация, транссудация) и потеря белков с мочой (протеинурия). Гиперпротеинемия чаще бывает относительной (сгущение крови). Абсолютная гиперпротеинемия обычно связана с гиперглобулинемией, как правило, с увеличением уровня у-глобулинов (как компенсаторная реакция при пониженном содержании альбуминов в крови, усилении синтеза антител). Диспротеинемии имеют как приобретенный, так и наследственный характер. Условно они делятся на дисглобулинемии, дисгаммаглобулинемии и дисиммунноглобулинемии. При последних белковый состав крови является лишь отражением общей перестройки в иммунной системе, включающей и клеточную реакцию. Примерами наиболее часто встречающихся диспротеинемии могут служить увеличение содержания ?2-глобулинов, уменьшение ?- и ?-липопротеидов при нарушениях функций печени, изменение количества и структуры фибриногена. Последнее имеет большое практическое значение. Изменения ?-глобулинов могут быть количественными и качественными. Количественно измененные ?-глобулины называются парапротеинами. Они относятся к иммуноглобулинам и являются обычно продуктами единичных клонов антителопродуцирующих клеток. Увеличение их количества в крови называется моноклональными гипергаммаглобулинемиями и наблюдается обычно при пролиферации соответствующих клонов, чаще всего обусловленной опухолевой природой патологического процесса (миеломная болезнь, макроглобулинемия Вальденстрема). Разновидностью парапротеинов являются также криоглобулины – патологические протеины с особенностями иммуноглобулинов, которые преципитируют при охлаждении. Нарушение кислотно-основного состояния Постоянство рН внутренней среды является необходимым условием существования высших организмов. Оно обеспечивается определенным соотношением кислот и оснований (кислотно-основное состояние – КОС) в биологических средах, при нарушении которого (выход рН за пределы 6,8 – 7,8) организм погибает. Нарушения КОС наблюдаются при многих заболеваниях, отягощают их течение и подлежат коррекции (рис. 14.10). В зависимости от направления сдвига рН (водородного показателя) крови, нарушения кислотно-основного состояния подразделяются на ацидоз и алкалоз. Если рН крови не выходит за пределы нормы (7,35 – 7,45), ацидоз или алкалоз называется компенсированным. Если же регуляторные механизмы недостаточны и отклонения рН становятся выраженными, то такие состояния называются декомпенсированными. 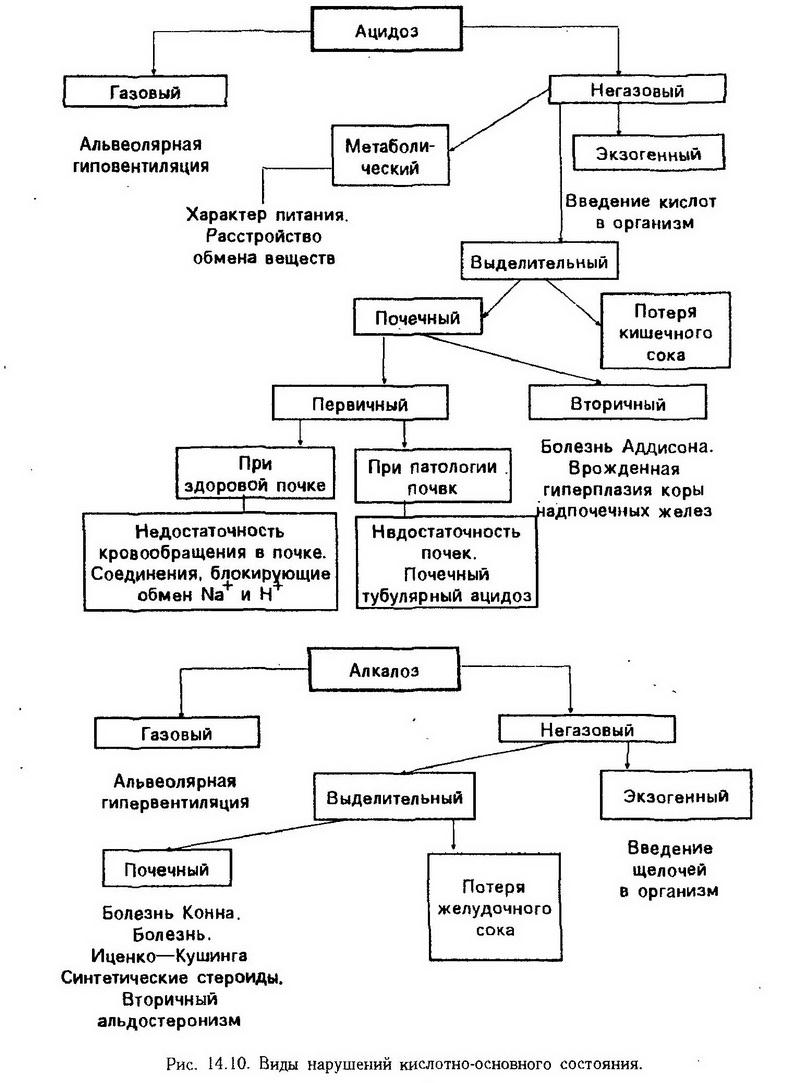 По механизму развития ацидоз или алкалоз бываетгазовым (респираторным), развивающимся при нарушении обмена и транспорта СО2, и негазовым (метаболическим), который возникает при накоплении в организме нелетучих продуктов кислого и основного характера. Устранение сдвига рН в организме осуществляется с помощью физико-химических и физиологических механизмов регуляции. Первыми, наряду с разведением кислот и оснований внеклеточной жидкостью, включаются буферные системы крови. Биологический буфер состоит из кислого (донор Н-) и основного (акцептор Н+) компонентов, соотношение между которыми при нормальном рН является величиной постоянной. Исходя из этого, соляная кислота, например, является более сильной, чем угольная, а анион Сl- по сравнению с НСО3- обладает менее выраженными основными свойствами, так как слабее удерживает возле себя ионы водорода. Основными буферами организма являются четыре: гидрокарбонатный Н2СО3/NaHCO3 = 1/19, который действует в основном в крови; фосфатный NaH2P04/Na2HPO4 = 1/4 – в почках и других тканях; белковый (NH2 – R – СООН) и гемоглобиновый НвО2/Нв. В зависимости от того, где функционирует буфер – в жидкой среде или клетках, в состав его компонентов будет соответственно входить Na или К. Гидрокарбонатный буфер не обладает большой емкостью, однако является самым лабильным из буферов. Поэтому определение его компонентов в качестве индикаторов КОС (напряжение СО2в крови, отражающее концентрацию угольной кислоты, и содержание гидрокарбоната) имеют большое диагностическое значение. Буферные свойства белков связаны с их амфолитностью. В щелочной среде белки функционируют как кислоты, отдавая (взамен на Na- и К-) ионы водорода от своих карбоксильных групп. В кислой среде, выполняя роль оснований, они работают наоборот; ионы водорода при этом могут также связываться группой NH2, превращая ее в NH3-. Самым емким буфером является гемоглобиновый. На его долю приходится до 75 % всей буферной емкости крови. Гемоглобин, как известно, является белком – амфолитом, буферные свойства которого в основном связаны с существованием двух его форм: окисленной и восстановленной. В окисленной форме гемоглобин проявляет свои кислотные свойства (т. е. способность диссоциировать с отдачей Н-ионов) и в 70 – 80 раз сильнее, чем восстановленный. Вместо отданных ионов водорода он связывает соответственно больше, чем восстановленный, ионов калия из КНСО3, находящегося в эритроцитах. Восстановленный Нв, выполняющий роль основания, наоборот, присоединяет ионы водорода и отдает ионы калия. Кроме того, 10 – 15 % углекислого газа из тканей гемоглобин транспортирует в виде нестойкого соединения карбогемоглобина. При необходимости этот процент может увеличиваться до 30. Главные клеточные буферы – это белковый и фосфатный. Буферная система способна нейтрализовать избыток как кислот, так и оснований в организме, переводя их в форму, удобную для выведения. Так как продукты этих реакций тоже являются кислотами и основаниями, хотя и более слабыми, сдвиг рН только смягчается, но не ликвидируется. Полная нормализация кислотно-основного состояния происходит только с помощью физиологических механизмов компенсации, которые выводят кислоты и основания из организма и восстанавливают нормальное соотношение компонентов буферных систем. Это происходит в основном вследствие быстрого включения дыхательного механизма (обеспечивается выделение летучих продуктов) и почек (выводятся нелетучие вещества). Значительно меньшую роль в этом играют желудок, кишки, кожа. Участие легких в восстановлении рН выражается в изменении их вентиляции, интенсивность которой регулируется рСО2 и рН крови. Почки осуществляют регуляцию содержания кислот и оснований в организме с помощью трех основных процессов: 1. Ацидогенез (секреция Н-ионов эпителием канальцев нефрона и выведение их с мочой путем преобразования основных фосфатов в кислые, а также экскреция слабых органических кислот). Секреция Н-ионов обеспечивается сложной работой эпителия канальцев нефрона, где постоянно с участием угольной карбоангидразы из СО2 и воды происходит образование угольной кислоты, которая затем диссоциирует на ионы водорода, активно секретируемые в просвет канальцев, и анионы НСО3-. Интенсивность секреции Н-ионов зависит от количества СО2 в клетках, а следовательно, от рСО2 в крови. Для предотвращения значительного снижения рН мочи (ниже 4,5 наступает гибель эпителия почечных канальцев) свободные Н-ионы в ней связываются. Если связывание происходит с помощью Na2HPO4 (основного компонента фосфатного буфера), то превращение его в NaH2PO4 вызывает некоторое подкисление мочи, но в меньшей степени, чем свободные ионы водорода. Освобожденные при этом катионы натрия реабсорбируются и уходят в кровь в составе NaHCO3. Количество кислого фосфата и слабых органических кислот (кетоновые тела, молочная, лимонная и другие кислоты) определяет титрационную кислотность мочи. 2. Аммониогенез. Усиление аммониогенеза наблюдается при значительном снижении рН мочи. Этот процесс заключается в образовании аммиака из глутамина и других аминокислот в эпителии канальцев нефрона и последующем связывании им Н-ионов (рис. 14.11). Образовавшийся ион аммония реагируете анионом сильной кислоты (обычно с хлором). Аммиачная соль NH4C1 выводится с мочой, не снижая значение ее рН. Аммонийный катион способен замещать значительное количество катионов натрия в моче, которые реабсорбируются в кровь взамен на секретируемые ионы водорода, и это является одним из путей сохранения гидрокарбоната в организме. 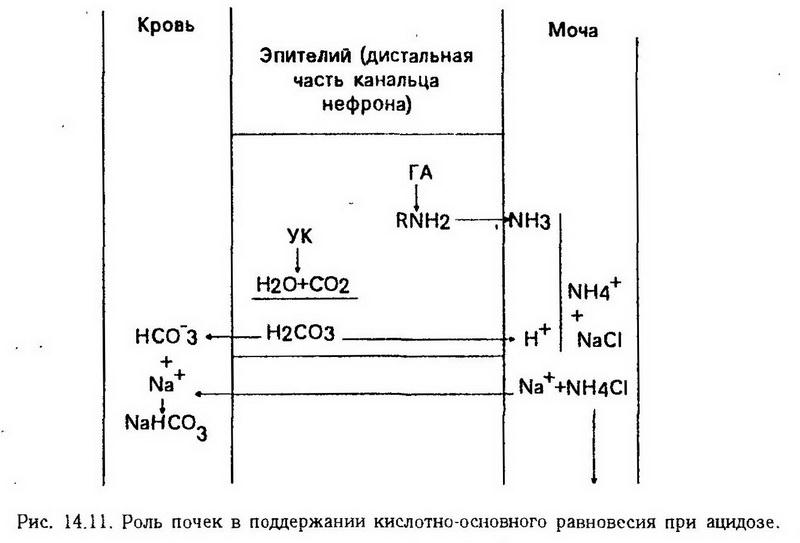 3. Реабсорбция гидрокарбоната. Фильтрующийся в нефроне гидрокарбонат обычно не появляется во вторичной моче. Проходя через канальцы, он отдает катион натрия взамен на секретируемые ионы водорода и превращается в угольную кислоту, расщепляющуюся до СО2 и воды. Моча при этом не меняет своей реакции. Источником образования H2CO3, отдающей свои Н-ионы в обмен на Na, является СО2 крови в случае повышения его напряжения и СО2, диффундирующий из мочи. Оставшийся в клетках после отщепления ионов водорода НСО3- присоединяет реабсорбированный Na+ и в виде NaHCO3 восполняет количество гидрокарбоната крови, ушедшего в мочу при фильтрации. Как видно, при реабсорбции гидрокарбоната анион НСО3- не транспортируется, а обратно в кровь поступает только Na+. Современные научные представления о регуляции рН жидкостей организма основываются главным образом на результатах исследования крови и плазмы. О концентрации Н-ионов внутри клеток сведений недостаточно из-за отсутствия совершенных методов ее определения. Известно, что активная реакция внутриклеточной жидкости менее щелочная (рН 6,9), чем внеклеточной. При патологических состояниях может изменяться величина рН внутри клетки и вне ее, причем изменения эти нередко бывают различными. Ацидоз. Газовый ацидоз развивается при избытке в организме углекислоты вследствие нарушения ее выведения легкими. Причиной этого чаще всего является снижение альвеолярной вентиляции при заболеваниях легких или угнетении дыхательного центра наркотиками, барбитуратами. Кроме того, газовый ацидоз возникает при вдыхании газовых смесей с высоким содержанием СО2 Избыток СО2 в крови обусловливает повышение концентрации Н2СО3, которая образуется в эритроцитах. Соотношение H2CO3/NaHCОЗстановится более 1/19. Компенсация в данном случае будет заключаться в восстановлении этого соотношения вследствие уменьшения содержания угольной кислоты и увеличения содержания гидрокарбонатов. Решающая роль в компенсации газового ацидоза принадлежит гемоглобиновому (в меньшей степени белковому) буферу и почкам. Избыток Н- -ионов, образующихся при диссоциации угольной кислоты, в значительной степени удерживается в эритроцитах восстановленным гемоглобином, выполняющим роль основания. Освободившийся анион НСО3- частично связывается с К+ гемоглобина, а в основном, отчасти в обмен на Сl-, поступает в плазму, где соединяется с ионами натрия (из NaCl, белков и фосфатов). В результате этого повышается содержание гидрокарбоната. Некоторое количество ионов водорода при газовом ацидозе связывается белками,- которые ведут себя в данном случае как основания. Таким образом, большая часть избытка СО2 в крови преобразуется в гидрокарбонат вследствие действия угольной ангидразы эритроцитов и гемоглобинового буфера (в меньшей степени белкового). Роль почек в компенсации газового ацидоза заключается в усилении секреции Н-ионов. Кислотность мочи повышается. Аммониогенез может быть несколько увеличен. Если газовый ацидоз долго не ликвидируется, выраженная гиперкапния может привести к вторичным явлениям повреждения. Так, возникающий в периферических тканях спазм артериол вызывает повышение артериального давления и тем самым затрудняет работу сердца. Спазм почечных сосудов снижает образование мочи. Сосуды головного мозга под влиянием СО2, напротив, расширяются, вследствие чего увеличивается внутри¬черепное давление. Значительная концентрация СО2 в крови повышает возбудимость блуждающего нерва, а это в свою очередь может привести к остановке сердца, а также спазму бронхиол и усилению секреции слизи в них, что дополнительно затрудняет дыхание. Иногда газовый ацидоз осложняется негазовым, так как нарушение дыхания обычно приводит к недостаточному поступлению кислорода в организм и накоплению в тканях недоокисленных продуктов обмена. Негазовый ацидоз является самой грозной и наиболее часто встречающейся формой нарушений кислотно-основного равновесия. Развивается он при накоплении в крови нелетучих кислых продуктов обмена вследствие избыточного образования, недостаточного выведения или избыточного введения их в организм (глубокая гипоксия, сахарный диабет, голодание, тяжелые поражения печени и почек и др.). Причиной негазового ацидоза может быть также значительная потеря гидрокарбонатов в составе щелочного кишечного сока. Наиболее быстро и тяжело развивается негазовый ацидоз при кислородном голодании вследствие глубоких нарушений кровообращения (остановка сердца, шок, коллапс и др). Неизбежным осложнением при этом является ослабление выведения из крови СО2 и присоединение газового ацидоза. Нейтрализация высокой концентрации Н+-ионов, имеющая компенсаторное значение при негазовом ацидозе, осуществляется прежде всего путем связывания их NaHCO3 – основным компонентом гидрокарбонатного буфера. В результате реакции наблюдается уменьшение количества вступающего в реакцию NaHCO3, образование угольной кислоты и натриевой соли нейтрализованной кислоты. При этом изменяется соотношение между числителем и знаменателем в формуле гидрокарбонатного буфера в сторону преобладания числителя. Восстановление их нормального соотношения в результате увеличения концентрации NaHCO3 и уменьшения Н2СО3 происходит по мере дальнейшего включения компенсаторных реакций. Недостаток гидрокарбоната в плазме, являющийся главным показателем негазового ацидоза, компенсируется в значительной степени за счет обмена ионов между эритроцитами и плазмой: избыток угольной кислоты реагирует с NaCl и образует NaHCO3, H- и Сl-; анионы хлора уходят в эритроциты. Восстановление гидрокарбоната происходит отчасти за счет взаимодействия угольной кислоты с основаниями других буферных систем (белковой, фосфатной), а также "реабсорбции" его в почках. Главным механизмом ликвидации избытка угольной кислоты в организме является гипервентиляция легких. Будучи нестойкой, угольная кислота под влиянием карбоангидразы эритроцитов распадается на СО2 и Н2О. Высокая концентрация СО2 (как и снижение рН) возбуждает дыхательный центр, вызывая гипервентиляцию легких. Этому механизму, как и гидрокарбонатному буферу, принадлежит решающая роль в компенсации негазового ацидоза. В связывании избытка ионов водорода, вызвавших ацидоз, кроме гидрокарбонатного буфера, определенную роль играет и белковый. Частично излишки Н-ионов в обмен на К+перемещаются из плазмы в эритроциты и клетки тканей, что приводит к гиперкалиемии. Ионы водорода уходят также в костную ткань, обмениваясь на Na и Са2+. В плазме крови увеличивается концентрация катионов К+, Na+, Ca2+. Выделительная функция почек при негазовом ацидозе имеет меньшее значение, чем гипервентиляция легких. Поскольку рСО2 в крови при этом понижено, снижается и активность зависимых от этого процессов в эпителии канальцев нефрона – секреции Н-ионов и сопряженной с ней реабсорбции гидрокарбоната. Значительно повышается титрационная кислотность вследствие выделения фильтрацией нелетучих органических кислот, вызвавших, ацидоз (кетоновые тела, молочная кислота и др.); возрастает выделение аммиачных солей. Поддержание кислотно-основного равновесия при негазовом ацидозе достигается ценой изменения показателей других систем. Так, уменьшение в крови напряжения СО2может вызвать нарушение дыхания, а также снижение тонуса сосудов, приводящее к уменьшению почечного кровотока, а следовательно, и мочеобразования. Выделение в плазму ионов К+, Na+ и Са2+ из клеток и костной ткани в обмен на Н-может явиться причиной аритмии сердца, угнетения нервно-мышечной возбудимости, декальцинации костей и т. д. Алкалоз. Газовый алкалоз развивается при снижении напряжения СО2 в крови вследствие гипервентиляции легких. Причинами этого могут быть вдыхание разреженного воздуха при подъеме на высоту, поражения мозга, сопровождающиеся возбуждением дыхательного центра, чрезмерная искусственная вентиляция легких с помощью аппарата. Компенсаторные реакции при газовом алкалозе направлены на снижение концентрации гидрокарбонатов в крови и восстановление содержания угольной кислоты. Это обеспечивается за счет белков, которые в обмен на катионы натрия (из NaHCO3) отдают свои ионы водорода. Пополнение плазмы Н-ионами происходит также за счет ионов водорода из клеток крови и костной ткани в обмен на К+, Na+ и Са2+. Освободившиеся из депо ионы водорода, присоединяя НСО3- в плазме, восполняют утраченное при гипервентиляции легких количество Н2СО3-. Однако решающая роль в компенсации газового алкалоза принадлежит почкам. Вследствие снижения рСО2 при этой форме алкалоза в почках уменьшается секреция Н-ионов и реабсорбция гидрокарбонатов. Поэтому профильтровавшиеся гидрокарбонаты в значительном количестве появляются во вторичной моче. Реакция мочи щелочная, содержание титруемых кислот и аммиачных солей незначительно. Ионное равновесие в плазме при потере анионов НСО3- отчасти восстанавливается за счет ионов Сl-, поступающих из клеток и способствующих увеличению содержания хлоридов в плазме. Если при этом гипокапния резко выражена, может наблюдаться снижение тонуса сосудов и соответственно артериального давления. Выделение с мочой большого количества натрия гидрокарбоната способствует обезвоживанию организма. Снижение в крови концентрации ионизированного кальция вследствие ионообмена может привести к тетании. Негазовый алкалоз (метаболический) встречается реже ацидоза, хотя и не является редким патологическим состоянием. Причинами его могут быть избыточное поступление щелочей в организм (введение содовых растворов), рвота, когда вместе с желудочным соком теряется Сl- – слабое основание. Так как сумма оснований в организме имеет определенную величину и представлена в основном НСО3- и Сl-, то восстановление ионного равновесия при потере С1- происходит за счет НСО3- (сильное основание). Это вызывает сдвиг реакции в щелочную сторону. Негазовый алкалоз может развиться также при повышении секреции или избыточном введении в организм минералокортикоидов, которые вызывают потерю калия с мочой вследствие угнетения его реабсорбции в почках. Снижение концентрации К+ в клетках возмещается поступлением ионов натрия и водорода из плазмы крови. Концентрация Н- -ионов в плазме уменьшается, рН ее возрастает. Основным показателем негазового алкалоза является увеличение содержания гидрокарбонатов в крови. Компенсация, направленная на восстановление соотношения между компонентами гидрокарбонатного буфера, как и при негазовом ацидозе, осуществляется в определенной степени вследствие изменения функции дыхательной системы. Низкая концентрация Н-ионов вызывает угнетение дыхательного центра, что ведет к гиповентиляции легких (насколько это вообще возможно). Накопление вследствие этого в крови СО2 частично компенсирует первичное увеличение содержания NaHCO3. В компенсации негазового алкалоза принимает участие белковый и фосфатный буферы, которые отдают в плазму свои Н-ионы, связывая при этом катионы Na+ из NaHCO3. Освобожденные анионы НСО3-, соединяясь с ионами водорода, частично восполняют дефицит угольной кислоты, а частично переходят в эритроциты в обмен на Сl-, что снижает щелочность плазмы. Плазменные белки, кальций – связывающие свойства которых при алкалозе усиливаются, могут также отдавать свои Н-ионы в обмен на Са2+ плазмы. Кроме того, количество Н-ионов в плазме может увеличиваться в результате поступления из костной ткани и эритроцитов в обмен на ионы Na+, К+, Са2+. Участие почек в компенсации негазового алкалоза выражается в выведении избытка гидрокарбонатов. В моче повышен уровень NaHCO3, реакция ее щелочная, титрационная кислотность снижена. Нарушения при негазовом алкалозе могут быть связаны прежде всего с выделением из организма большого количества Na+ в составе NaHCO3, способствующим снижению осмотического давления внеклеточной жидкости и потере большого количества воды. Потеря К+ может вызвать нарушение функции миокарда. При уменьшении в крови ионизированного Са2+ вследствие ионообмена повышается нервно-мышечная возбудимость, ведущая к развитию судорог. Принципы коррекции нарушений КОС заключаются в ликвидации сдвига рН внутренней среды организма путем нормализации состава буферных систем и устранения сопутствующих нарушений водно-электролитного обмена, ликвидации осложнений, а также лечении патологических процессов, вызывающих нарушения КОС или поддерживающих их. Нарушения водно-электролитного обмена Содержание воды в организме взрослого человека составляет в среднем 60% от массы тела, колеблясь от 45 (у тучных пожилых людей) до 70% (у молодых мужчин). Большая часть воды (35 – 45% от массы тела) находится внутри клеток (интрацеллюлярная жидкость). Внеклеточная (экстрацеллюлярная) жидкость составляет 15 – 25% от массы тела и подразделяется на внутрисосудистую (5%), межклеточную (12 – 15%) и трансцеллюлярную 1 (1 – 3%). В течение суток человек выпивает около 1,2 л воды, в его организм с пищей поступает около 1 л, около 300 мл воды образуется при окислении пищевых веществ. При нормальном водном балансе столько же воды (около 2,5 л) выделяется из организма: почками (1- 1,5 л), посредством испарения кожей (0,5 – 1 л) и легкими (около 400 мл), а также выводится с калом (50 – 200 мл). Постоянство объема и осмолярности внеклеточной жидкости поддерживается регуляторными механизмами, главным эффекторным органом которых являются почки. Раздражение осморецепторов гипоталамической области (при повышении осмолярности крови), а также волюморецепторов левого предсердия (при уменьшении объема крови) усиливает освобождениевазопрессина (АДГ) супраоптическим и паравентрикулярным ядрами гипоталамуса. Вазопрессин усиливает реабсорбцию воды в канальцах нефронов. Раздражение рецепторов приводящей артериолы почки (при уменьшении почечного кровотока, кровопотере) и натриевых рецепторов плотного пятна юкстагломерулярного комплекса (при дефиците натрия) усиливает синтез и освобождение ренина. Образующийся под влиянием ренина ангиотензин-II увеличивает выброс надпочечниками альдостерона, который повышает реабсорбцию натрия. Уменьшение объема внеклеточной жидкости и ангиотензин стимулируют также центр жажды, расположенный в латеральной области гипоталамуса. Антидиуретическим и антинатрийуретическим механизмам противостоят диуретические и натрийуретические. Главными действующими факторами этих механизмов являются реномедуллярные почечные простагландины и атриальный (из сердца) натрийуретический фактор (АНФ, атриопептид). АНФ вырабатывается в клетках предсердия и является пептидом из 28 аминокислот. Он повышает диурез и натрийурез, расслабляет гладкие мышцы сосудов и снижает артериальное давление. Содержание АНФ в предсердии и секреция его в кровь увеличивается под влиянием приема избытка воды и поваренной соли, растяжения предсердий, при повышении кровяного давления, а также при стимуляции а-адренорецепторов и рецепторов вазопрессина. Названные механизмы функционируют постоянно и обеспечивают восстановление водно-электролитного гомеостаза при кровопотере и обезвоживании, избытке воды в организме, а также при изменениях осмотической концентрации внеклеточной жидкости. Однако в больном организме эти приспособительные механизмы могут быть "введены в заблуждение", и тогда они включаются в патологический процесс как его важнейший патогенетический фактор (уменьшение массы крови в левом предсердии и артериальном русле при недостаточности сердца). Нарушения водно-электролитного обмена принято делить на обезвоживание (дегидратацию) и задержку воды в организме (гипергидратацию). В зависимости от изменения осмотической концентрации (соотношения воды и электролитов) де- и гипергидратацию в свою очередь подразделяют на три вида: изоосмолярную, гипоосмолярную и гиперосмолярную. Нормальная осмотическая концентрация крови и межклеточной жидкости составляет около 0,3 осмоль/л. Обезвоживание Обезвоживание (гипогидрия, гипогидратация, эксикоз) развивается в тех случаях, когда выделение воды превышает ее поступление в организм (отрицательный водный баланс). Это может быть при нарушении поступления воды в организм (водное голодание, нарушение глотания, атрезия пищевода, коматозное состояние и др.) или при повышенной ее потере (понос, рвота, кровопотеря, потеря жидкости с экссудатом – ожог и др.), а также при сочетании этих состояний. При обезвоживании теряется в первую очередь внеклеточная жидкость и ионы натрия, а при более тяжелой его степени – калий и внутриклеточная жидкость. Обезвоживание влечет за собой тяжелые последствия, связанные с уменьшением объема циркулирующей крови (гиповолемия) и повышением ее вязкости, что может вызвать тяжелое нарушение кровообращения и микроциркуляции, коллапс. Нарушение кровообращения приводит к развитию гипоксии тканей, от которой в первую очередь страдает центральная нервная система. Это может проявляться помрачением сознания, галлюцинациями, развитием коматозного состояния. При этом также нарушаются функции нервных центров, ритм дыхания, повышается температура тела. Выраженное снижение артериального давления может сопровождаться нарушением фильтрации в клубочках нефронов, олигурией, гиперазотемией и негазовым ацидозом. В ответ на развивающиеся нарушения возникают компенсаторные реакции. Так, гиповолемия и снижение почечного кровотока способствуют гиперпродукции вазопрессина и альдостерона. Под действием этих гормонов усиливается реабсорбция воды и натрия в канальцах нефронов. Снижение фильтрационного давления также обусловливает уменьшение диуреза. О большом значении почек при этом свидетельствует то, что уменьшение диуреза в пять раз (до уровня "обязательного количества мочи") не вызывает еще нарушения выведения азотистых шлаков. Особенно тяжело переносит обезвоживание детский организм. Это обусловлено высоким содержанием у детей экстрацеллюлярной жидкости, низкой концентрационной способностью почек, высокой относительной поверхностью кожи, большой частотой дыхания и несовершенством регуляции водно-электролитного гомеостаза. Вследствие этого обезвоживание у детей первых двух лет жизни (при кишечном токсикозе, гипервентиляции и др.) наступает чаще, чем у взрослых и является грозным осложнением, нередко ведущим к смерти. Изоосмолярная гипогидратация развивается в случаях эквивалентной потери воды и электролитов. Это наблюдается иногда при полиурии, кишечном токсикозе, а также в первое время после острой кровопотери. При этом уменьшается объем экстрацеллюлярной жидкости без изменения ее осмолярности (рис. 14.12, а). Гипоосмолярная гипогидратация наблюдается в случае преимущественной потери солей. Она развивается прежде всего при потере секретов желудка и кишок (понос, рвота), а также при повышенном потоотделении, если потеря воды возмещается питьем без соли. При этом снижение осмотического давления во внеклеточной среде приводит к переходу воды в клетки (рис. 14.12, б), вследствие чего гиповолемия, сгущение крови и нарушение кровообращения особенно выражены. Обезвоживание и потеря электролитов нередко ведут к нарушению кислотно-основного состояния. Так, обезвоживание при потере желудочного сока, сопровождаясь утратой хлоридов и ионов Н+, приводит к алкалозу. Потеря панкреатического или кишечного соков, содержащих больше натрия и гидрокарбонатов, наоборот, ведет к ацидозу. Гиперосмолярная гипогидратация развивается в тех случаях, когда потеря воды превышает потерю электролитов (прежде всего натрия), при гипервентиляции, профузном потоотделении, потере слюны (пот и слюна гипотоничны по отношению к крови), а также при поносе, рвоте и полиурии, когда возмещение потери поступлением воды в организм недостаточно. При этом наступает уменьшение объема к внеклеточной жидкости и нарастает ее осмотическая концентрация (рис. 14.12, в). Вступает в действие компенсаторный механизм организма – усиленная продукция вазопрессина, которая ограничивает потерю воды ренальным и экстраренальным путями. Иногда в результате увеличения секреции альдостерона происходит задержка натрия и еще большее нарастание гиперосмолярности. Увеличение осмотического давления внеклеточной жидкости ведет к перемещению в нее воды из клеток. Обезвоживание клеток вызывает мучительное чувство жажды, усиление распада белков, повышение температуры, а иногда – помрачение сознания, кому. Для восстановления водно-электролитного равновесия при гиперосмолярном эксикозе целесообразно вводить 5% раствор глюкозы или гипотонические солевые растворы. Повышенное выведение воды из организма наблюдается при несахарном (гипофизарном) диабете. Заболевание характеризуется полиурией – повышенным выделением мочи (5–10 л и более) низкой относительной плотности при отсутствии гликозурии. Основным фактором патогенеза несахарного диабета является уменьшение выработки вазопрессина, усиливающего реабсорбцию воды в канальцах нефрона. В результате потери воды наступает повышение осмотической концентрации во внеклеточном пространстве. Раздражение осморецепторов приводит к развитию жажды. При достаточном поступлении воды в организм дегидратация может быть нерезко выраженной. При некомпенсированной полиурии возникает обезвоживание организма. Причиной несахарного диабета могут быть опухоли (чаще метастатические), воспалительный процесс, саркоидоз или травма, поражающие нейрогипофиз, ножку гипофиза или ядра гипоталамуса, в которых вырабатывается вазопрессин. Вторая форма болезни – первичная полидипсия психогенного происхождения, которая сопровождается вторичной полиурией. Третьей формой болезни является нефрогенный несахарный диабет (обычно наследственный), в основе которого лежит недостаточность рецепторов вазопрессина на контралюминальной стороне дистальных канальцев нефронов. При этом отмечается снижение продукции в эпителии канальцев циклического 3,5-АМФ и снижение проницаемости канальцев для воды. Избыточное накопление воды в организме Положительный водный баланс (гипергидратация, гипергидрия) наблюдается при избыточном введении воды в организм, а также при нарушении выделительной функции почек и кожи, обмена воды между кровью и тканями, регуляции водно-электролитного обмена. В эксперименте на животных гипоосмолярную гипергидратацию (водное отравление) можно вызвать повторным введением воды в желудок. Однократная водная нагрузка у здоровых животных обычно не вызывает тяжелых последствий. Исследования, проведенные в лаборатории Е. С. Лондона, показали, что при избыточном введении воды в кровь даже в объеме, равном массе крови, процентное содержание воды в крови мало изменяется (Н. Н. Зайко). Это обусловлено задержкой воды в печени, мышцах, селезенке, коже, а также усиленным выведением ее из организма. Однако при нарушении регуляции водного обмена уже незначительная водная нагрузка может привести к гипергидратации. Так, экспериментальное водное отравление можно вызвать водной нагрузкой на фоне введения вазопрессина, альдостерона или удаления надпочечных желез. То обстоятельство, что адреналэктомированные животные, которые обычно погибают от потери солей натрия и обезвоживания, плохо переносят водную нагрузку, объясняется снижением артериального давления (а следовательно, и клубочковой фильтрации) после удаления надпочечных желез. При водном отравлении увеличивается количество воды и снижается осмотическое давление как вне, так и внутри клеток (рис. 14.12, д), но самое большое значение при этом имеет повышенное поступление воды внутрь клеток, возникающее в результате сдвига нормального соотношения между концентрациями ионов натрия и калия по обе стороны клеточной мембраны, что является следствием снижения уровня натрия в плазме крови. У больных водное отравление возможно при рефлекторной анурии, а также во второй стадии острой недостаточности почек. При этом наблюдается головная боль, тошнота, рвота, судороги и при явлениях комы может наступить смерть. Гиперосмолярная гипергидратация может развиваться при употреблении для питья соленой (морской) воды. В результате осмотическое давление в экстрацеллюлярной среде повышается и жидкость перемещается из клеток во внеклеточное пространство. Развиваются тяжелые нарушения, обусловленные дегидратацией клеток и сходные с таковыми при гиперосмолярном обезвоживании (рис. 14.12, е). Однако при строгом ограничении в питье постепенно развивается адаптация к соленой воде и серьезных нарушений водно-электролитного обмена может не быть. Изоосмолярная (изотоническая) гипергидратация встречается редко. Может наблюдаться в течение некоторого времени после введения избыточных количеств изотонических растворов (рис. 14.12, г). Задержка воды, связанная с нарушением регуляции водно-электролитного обмена, наблюдается при снижении продукции АНФ и гормонов щитовидной железы (микседема); увеличении выработки вазопрессина, инсулина, повышающего гидрофильность тканевых коллоидов, а также при вторичном гиперальдостеронизме (например, при недостаточности сердца, нефротическом синдроме). Избыточное количество жидкости обычно не задерживается в крови, а переходит в ткани, прежде всего во внеклеточную среду, что выражается в развитии скрытых или явных отеков. Отек (oedema) – скопление избыточного количества жидкости в тканях. Скопление внеклеточной жидкости в полостях тела называют водянкой (hydrops). Водянка брюшной полости получила название асцита (ascites), плевральной полости – hydrothorax, желудочков мозга – hydrocephalus, околосердечной сумки – hydropericardium. Скопившаяся невоспалительная жидкость называется транссудатом. Отек – типический патологический процесс, встречающийся при многих заболеваниях. Обмен жидкости между кровью и тканями происходит в микроциркуляторном русле через стенку капиллярных сосудов и венул. В артериальном капиллярном сосуде жидкая часть крови поступает в межтканевое пространство, а в венозном и в посткапиллярной венуле – возвращается в кровь. Это движение жидкости в том и другом направлении осуществляется в соответствии с уравнением Старлинга, приведенном в разделе XI ("Нарушения микроциркуляции"). Следовательно, развитие отека по Старлингу может быть обусловлено прежде всего повышением гидростатического давления крови или снижением ее онкотического давления (рис. 14.13). В механизме развития отека, кроме того, играют роль нарушения водного баланса (особенно сдвиг его в сторону накопления воды в организме), микроциркуляции, изменения гидростатического и коллоидно-осмотического (онкотического) давления ткани, повышение проницаемости капиллярных сосудов, нарушения лимфооттока, а также нервной и гуморальной регуляции водно-электролитного обмена. |
