зайко. Н. Н. Зайко Патологическая физиология Введение Предмет и задачи патологической физиологии Патологическая физиология есть наука, изучающая жизнедеятельность больного организма. Программа
 Скачать 7.32 Mb. Скачать 7.32 Mb.
|
|
Факторы патогенеза отека приведены ниже: 1. Положительный водный баланс (нарушение функции почек, прием большого количества осмотически активных веществ и др.). 2. Повышение гидростатического давления преимущественно в венозном отделе сосудистого русла (венозная гиперемия местная или при сердечной недостаточности, а также воспаление). 3. Понижение коллоидно-осмотического давления крови (гипопротеинемия при голодании, нефротическом синдроме, недостаточности печени и др.). 4. Повышение коллоидно-осмотического давления в ткани в результате накопления осмотически активных веществ: электролитов, белков, продуктов метаболизма (при воспалении, аллергии, гипоксии). 5. Повышение проницаемости капиллярных сосудов: • под действием гуморальных факторов (гистамин, серотонин, кинины, простагландины и др.); • при нарушении трофики стенки капиллярных сосудов (расстройство нервно-трофического обеспечения, голодание, гипоксия и др.). 6. Нарушение оттока лимфы [механическая или динамическая лимфатическая недостаточность]. 7. Нарушение нервной и гуморальной регуляции водно-электролитного обмена ("ошибочное" включение антидиуретической и антинатрийуретической систем, нарушение чувствительности волюмо- и осморецепторов, вторичный альдостеронизм, гипотиреоз и др.). Фильтрационное давление возрастает также при резко отрицательном давлении в межклеточном пространстве. Так, при ожоге кожи отрицательное давление межклеточной жидкости может достигать -30 мм рт. ст. (-4,0 кПа) вследствие испарения воды с поверхности и изменений коллоидов, ведущих к появлению разжимных сил. Этот механизм считают главным в развитии отека при ожоге кожи. Обычно усиление фильтрации по типу обратной связи вызывает компенсаторное повышение лимфооттока и снижение онкотического давления межтканевой жидкости вследствие удаления белков с лимфой (лимфа содержит в среднем 20 г/л белка). Поэтому онкотическое давление межтканевой жидкости наиболее заметно повышается при блокаде лимфооттока. Следует иметь в виду, что гидрофильность тканевых коллоидов зависит от концентрации Н+. Так, при сдвигах рН в кислую сторону происходит набухание паренхиматозных элементов и дегидратация соединительной ткани; при смещении рН в щелочную сторону гидратируется соединительная ткань. Накопление ионов натрия в межтканевом пространстве наблюдается при избыточном приеме натрия хлорида и при нарушении функций почек. Однако в патогенезе отека большее значение, чем избыточное потребление натрия хлорида, имеет активная задержка натрия в организме, которая является результатом срабатывания патологически измененных механизмов регуляции водно-электролитного обмена, усугубляющих процесс отека. Задержка натрия является одной из самых "сильных" приспособительных реакций организма, сложившихся в процессе эволюции животных, защищающих их от тяжелых последствий кровопотери. Как только от потери крови уменьшается ее общий объем в сосудах, чтобы удержать в организме натрий, воду и тем самым увеличить массу крови, рефлекторно включаются гипофиз, кора надпочечных желез и почки. Происходит это не только при кровотечении или дефиците натрия, но и тогда, когда артериальное давление снижается или количество циркулирующей крови уменьшается по другим причинам. Такая ситуация складывается, например, при декомпенсации сердца (застой крови), имитирующей дефицит крови, при склерозе сосудов почек (активация ренин – ангиотензин – альдостероновой системы) и других патологических состояниях. Так, возникает "ошибка регуляции", которая способствует развитию отека. Г. Селье называет такое явление "болезнями адаптации". Важная роль в развитии отека принадлежит повышению проницаемости сосудов, сопровождающемуся выходом белков из крови в интерстициальную среду, повышением онкотического давления в межклеточном пространстве. Со степенью проницаемости стенки капиллярных сосудов тесно связана интенсивность лимфообразования. Повышение лимфообразования и ускорение оттока лимфы играют важную компенсаторную роль при развившемся отеке: по лимфатическим сосудам возвращается в русло крови не только межтканевая жидкость, но и профильтровавшийся белок. Затруднение оттока лимфы, наоборот, способствует развитию отека.. Установлено, что венозный застой, сопровождающийся повышением давления в верхней полой вене (так же как и местный венозный застой, например, при тромбофлебите), вызывает рефлекторный спазм лимфатических сосудов. Кроме того, накапливающаяся при отеках - межтканевая жидкость сдавливает лимфатические сосуды, замыкая "порочный круг", способствующий прогрессированию отека. Гормональные факторы в регуляции нарушений водно-электролитного обмена выступают в тесной связи с нейрогенными. Эта взаимосвязь отчетливо видна в гипофизарно-адреналовом механизме, играющем важную роль в развитии сердечных и других видов отека. Тесная связь нервного (условно-рефлекторного) и гормонального (гормоны гипофиза) факторов была показана в исследованиях К. М. Быкова (1947), изучавшего корковые влияния на выведение воды почками. Установлено, что удаление у кошек верхних шейных узлов симпатического ствола, как и гипофизэктомия, предотвращает развитие токсического отека легких (А. В. Тонких). Показано также, что водная нагрузка, которая еще не вызывала отек легких, сопровождается гибелью животных от отека, если им нанести нервно-эмоциональную травму (Г. С. Кан). Перечисленные выше факторы принимают участие в механизме развития всех форм отека, однако роль их при отеках различного происхождения неодинакова. В зависимости от причин и механизма возникновения различают отек сердечный, почечный, печеночный, кахектический, воспалительный, токсический, нейрогенный, аллергический, лимфогенный и др. Сердечный, или застойный, отек возникает главным образом при венозном застое и повышении венозного давления, что сопровождается повышением фильтрации плазмы крови и уменьшением резорбции жидкости в капиллярных сосудах. Развивающаяся при застое крови гипоксия приводит к нарушению трофики и повышению проницаемости стенки сосудов. Большое значение в возникновении сердечных отеков при недостаточности кровообращения имеет также вторичный альдостеронизм, что показано на рис. 14.14. 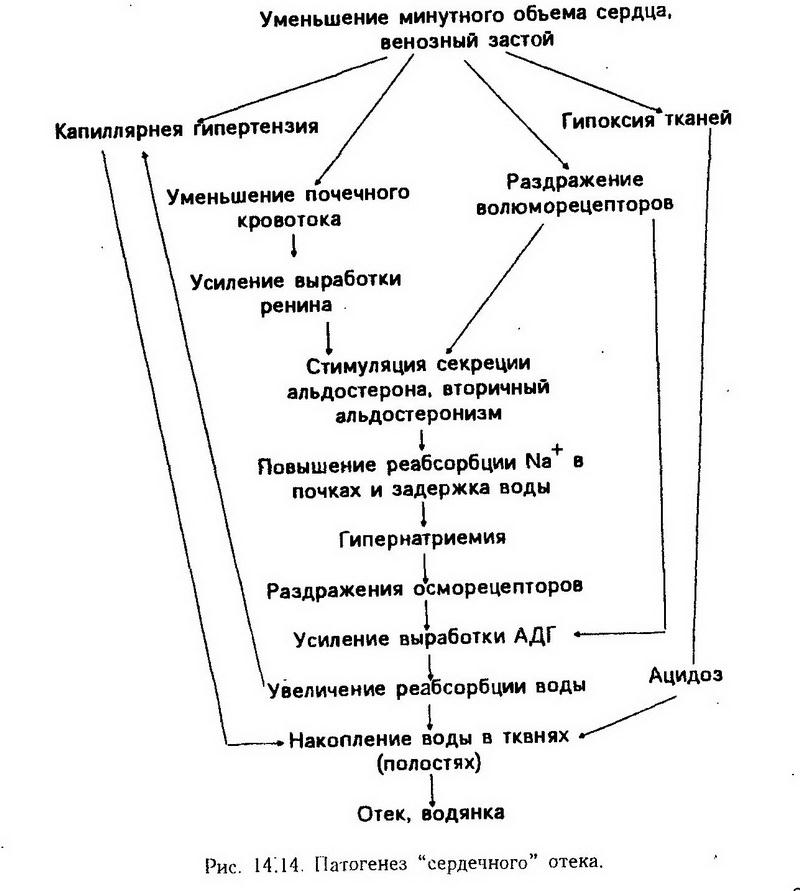 Почечный отек. В патогенезе отека при гломерулонефрите первичное значение придают уменьшению клубочковой фильтрации, что ведет к задержке воды в организме. При этом также повышается реабсорбция натрия в канальцах нефронов, в чем, по-видимому, известная роль принадлежит вторичному гиперальдостеронизму, так как антагонист альдостерона – спиронолактон (синтетический стероид) дает при гломерулонефрите диуретический и натрийуретический эффект. Известную роль в механизме развития отека при гломерулонефрите играет также повышение проницаемости стенки капиллярных сосудов. При наличии нефротического синдрома на первый план выступает фактор гипопротеинемии (вследствие протеинурии), сочетающейся с гиповолемией, которая стимулирует выработку альдостерона. В развитии печеночного отека при поражениях печени важную роль играет гипопротеинемия, обусловленная нарушением синтеза белков в печени. Определенное значение при этом имеет повышение продукции или нарушение инактивации альдостерона. В развитии асцита при циррозе печени решающая роль принадлежит затруднению печеночного кровообращения и повышению гидростатического давления в системе воротной вены. Кахектический, или голодный, отек развивается при алиментарной дистрофии (голодании), гипотрофии у детей, злокачественных опухолях и других истощающих заболеваниях. Важнейшим фактором его патогенеза является гипопротеинемия, обусловленная нарушением синтеза белков, и повышение проницаемости стенки капиллярных сосудов, связанное с нарушением трофики. В патогенезе воспалительного и токсического отека(при действии ОВ, укусе пчелами и другими ядовитыми насекомыми) первостепенную роль играют нарушение микроциркуляции в очаге поражения и повышение проницаемости стенки капиллярных сосудов. В развитии этих нарушений важная роль принадлежит освобождающимся вазоактивным веществам-посредникам: биогенным аминам (гистамин, серотонин), кининам (брадикинин и др.), аденозинфосфорным кислотам, производным арахидоновой кислоты (простагландины, лейкотриены) и др. Нейрогенный отек развивается в результате нарушения нервной регуляции водного обмена, трофики тканей и сосудов (ангиотрофоневроз). Сюда относятся отек конечностей при гемоплегии и сирингомиелии, отек лица при невралгии тройничного нерва и др. В происхождении нейрогенных отеков важная роль принадлежит повышению проницаемости стенки сосудов и нарушению обмена в пораженных тканях. Аллергический отек возникает в связи с сенсибилизацией организма и аллергическими реакциями (крапивница, отек Квинке, аллергический ринит, отек слизистой дыхательных путей при бронхиальной астме и др.). Механизм развития аллергического отека во многом сходен с патогенезом воспалительного и нейрогенного. В возникающих при этом нарушениях микроциркуляции и проницаемости стенки капиллярных сосудов ведущую роль играет освобождение биологически активных веществ. В развитии отека различного происхождения следует различать две стадии. В первой избыточная жидкость, поступающая в ткань, накапливается в основном в гелеподобных структурах (коллагеновые волокна и основное вещество соединительной ткани), увеличивая массу немобильной, фиксированной тканевой жидкости. Когда масса фиксированной жидкости увеличится примерно на 30%, а давление достигнет атмосферного, начинается вторая стадия, характеризующаяся накоплением свободной межклеточной жидкости. Эта жидкость способна перемещаться под действием силы тяжести и дает "симптом ямки" при надавливании на отечную ткань (рис. 14.15). Действие факторов, вызывающих отек, до известной степени может компенсироваться защитными механизмами, к которым относятся отрицательное давление межклеточной жидкости (0,80 кПа – 6 мм рт. ст.); повышение в 20 – 25 раз лимфооттока при подъеме давления межтканевой жидкости до уровня атмосферного (этот механизм способен компенсировать увеличение фильтрационного. давления на 0,93 кПа (7 мм рт. ст.)); вымывание белков при повышении лимфооттока, способное снизить онкотическое давление межклеточной жидкости на 0,53 кПа (4 мм рт. ст.). Суммарная величина этих механизмов составляет 2,27 кПа (17 мм рт. ст.). Считают, что отек развивается только тогда, когда суммарная величина патогенетических факторов превышает эту величину. Так, для развития отека под действием одного повышения фильтрационного давления необходимо его увеличение не менее чем на 2,27 кПа (17 мм рт. ст.). При сочетании повышения фильтрационного давления и снижения онкотического оба фактора в сумме должны превысить эту величину. Состояние, при котором резерв защитных факторов снижен, а видимый отек еще не развился, называется предотеком. Последствия отека зависят от его степени и локализации. Значительное накопление жидкости вызывает сдавление тканей, нарушение их трофики и функций. Особенно опасен отек мозга и легких. Скопление жидкости в полостях тела нарушает функцию соседних органов (затруднение дыхания при водянке плевральной полости и др.). Трансцеллюлярная жидкость – секрет пищевого канала, цереброспинальная жидкость, жидкость серозных полостей и др. Нарушения электролитного обмена Минеральные вещества организма составляют около 4% от массы тела. Они находятся в растворенном состоянии в виде электролитов в экстра- и интрацеллюлярной среде, в связи с белками, в составе различных органических соединений, а также в минеральной фазе обызвествленных тканей (скелета и зубов). Методом радиоактивной индикации установлено, что обызвествленные ткани являются важным депо минеральных элементов. Значительная часть кальция, фосфата, натрия и других минеральных веществ скелета образуют лабильную фракцию, которая может быть мобилизована для компенсации расстройств минерального обмена. Электролиты, растворенные в жидкостях организма, обеспечивают постоянство осмотического давления внутренней среды, а их соотношение во многом определяет кислотно-основное состояние. Поэтому нарушение обмена электролитов тесно связано с расстройством водного обмена и кислотно-основного баланса. Нарушение обмена натрия, калия, магния. Натрий – главный катион внеклеточной среды, который вместе с соответствующими анионами (прежде всего Сl-) представляет в ней более 90% осмотически активных веществ. Концентрация Na+ в экстрацеллюлярной жидкости достигает 140 ммоль/л, в то время как во внутриклеточной среде – лишь около 20 ммоль/л. Общее содержание натрия в организме человека превышает 100 г (примерно 0,14% от массы тела), причем более трети этого количества сосредоточено в скелете. Лабильная (мобилизуемая) фракция составляет около половины натрия обызвествленных тканей и по своей массе в 2 – 3 раза превышает натрий внутрисосудистой жидкости. В нормальных условиях суточный баланс составляет около 4 – 5 г натрия, поступающего в организм с пищей и питьем. Большая часть натрия выделяется из организма с мочой (75 – 95%) и потом (2 – 10%). Нарушение обмена натрия тесно связано с нарушением водного равновесия. Отрицательный баланс натриявозможен при повышенной потере его с мочой, потом, пищеварительными секретами (понос) или экссудатом (ожог) (см. выше – "Обезвоживание"). Особенно большое значение имеет нарушение реабсорбции натрия в канальцах нефронов, которое наблюдается при недостаточной выработке альдостерона (аддисонова болезнь), при избыточной продукции АНФ в предсердиях, простагландинов Е2 и I2(простациклина) в почках, а также под влиянием салуретиков: ингибиторов карбоангидразы (диакарб), производных бензотиадиазина (дихлотиазид), антраниловой кислоты (фуросемид) и др. Потеря организмом натрия приводит к выводу из клеток ионов К+, нарушению деятельности сердца, скелетных и неисчерченных мышц. Развивается мышечная адинамия и потеря аппетита. Дефицит натрия через натриевые рецепторы, локализующиеся в гипоталамусе и почках, стимулирует биосинтез и секрецию альдостерона, задерживающего натрий в организме. Положительный баланс натрия развивается в случае избыточного потребления соли, нарушения выведения натрия почками (гломерулонефрит, длительный прием гликокортикоидов), а также при избыточной продукции альдостерона, усиливающего реабсорбцию натрия в канальцах нефронов, пищевом канале, слюнных и потовых железах. Молекулярный механизм действия альдостерона связывают с генетической индукцией синтеза ферментов, участвующих в трансмембранном переносе Na+-и К+. Избыток солей натрия в организме способствует развитию воспалительных процессов, задержке воды, а также развитию гипертензии. Содержание калия во внеклеточной среде составляет 4 – 5 ммоль/л, во внутриклеточной – 110 – 150 ммоль/л. Суммарное содержание калия в организме составляет 4000 – 6000 ммоль (156 – 235 г). Две третьих этого количества Приходится на мышцы и свыше 5% – на скелет. Суточный баланс калия составляет примерно 110 ммоль (около 4 г). Нарушение Итого баланса тесно связано с нарушением обмена натрия. Так, избыток калия усиливает выведение натрия и воды из организма, а его недостаток вызывает Нарушения, сходные с эффектом избытка натрия. Отрицательный баланс калия может развиться при недостаточном поступлении его с пищей (овощи и молочные продукты), в случае потери его с рвотными массами или при поносе (концентрация калия в пищеварительных секретах примерно вдвое выше, чем в плазме крови), при длительном лечебном применении кортикотропина и гликокортикоидов, а также при гиперальдостеронизме. Отрицательный баланс калия приводит к гипокалиемии, которая сопровождается алкалозом, т. е. при дефиците К+повышается выведение почками Н+. Гипокалиемия может долго компенсироваться за счет перехода калия в кровь из клеток. Длительная гипокалиемия вызывает снижение содержания калия в клетках, мышечную слабость, понижение моторики желудка и кишок, снижение сосудистого тонуса, тахикардию. Изменение ЭКГ при гипокалиемии проявляется удлинением интервала Q-T и в снижении вольтажа зубца Т. Задержка калия в организме может наблюдаться при избытке его в пище, а также при нарушении выделения К+почками. В эксперименте выраженную задержку калия можно наблюдать у адреналэктомированных животных, в клинике – при гипофункции коры надпочечных желез (аддисонова болезнь) и при ацидозе. Задержка калия в организме может вести к гиперкалиемии, которая сопровождается брадикардией и мышечными парезами. На ЭКГ характерны высокий зубец Т и уменьшениеР. Возможна остановка сердца в диастоле. Гиперкалиемия наблюдается также при выходе калия из клеток (тканевый распад, инсулярная недостаточность и др.). Магний является вторым по концентрации катионом внутриклеточной среды (13 ммоль/л). Он необходим для действия некоторых ферментов, катализирующих распад углеводов, а также для действия фосфатаз и фосфофераз. В организме человека содержится около 1000 ммоль (24 г) магния, половина которого находится в скелете. Концентрация магния в плазме крови составляет 1 ммоль/л. Гипермагниемия возможна при потреблении пищи, богатой магнием (зеленые части растений, фасоль, горох, пшено и др.), при явлениях ацидоза и нарушении выделения магния почками (уремия). При этом развивается депрессия и сон (магнезиальный наркоз). Гипомагниемия иногда наблюдается при панкреатите, вследствие нарушения всасывания магния (образование нерастворимых солей с жирными кислотами). Клинически, как и гипокальциемия, она проявляется тетанией. Нарушение содержания хлоридов и гидрокарбонатов.Хлориды. Общее содержание хлора в организме составляет около 2400 ммоль (85 г). Хлор является главным анионом внеклеточной жидкости, где его концентрация составляет примерно 100 ммоль/л. Нарушение обмена хлоридов обычно развивается параллельно с нарушением баланса натрия и воды. Гидрокарбонат (НСО3-) является вторым по значению анионом внеклеточной среды, где его концентрация равна 25 – 30 ммоль/л (по внутриклеточной среде – около 10 ммоль/л). Содержание гидрокарбонатов изменяется при нарушениях кислотно-основного состояния. Нарушение обмена кальция и фосфора. Содержание кальция в организме взрослого человека составляет около 20 г на 1 кг массы тела, большая часть которого (свыше 98%) находится в скелете и зубах. В обызвествленных тканях фиксировано также около 3/4 всего фосфора организма. Тесная связь обмена кальция и фосфора обусловлена тем, что они образуют нерастворимые соединения типа оксиапатита [Ca10(PO4)6(OH2)], составляющие основу кристаллической структуры обызвествленных тканей (костей и твердых тканей зубов). Нарушения кальций-фосфорного обмена могут проявляться расстройством всасывания кальция и фосфатов в кишках; нарушением обызвествления скелета и зубов, а также отложением фосфорно-кальциевых солей в мягких тканях. В процессе переноса и отложения кальция важная роль принадлежит кальцийсвязывающим белкам (СаСвБ). В настоящее время описано более 70 СаСвБ: кальмодулин, парвальбумин, СаСвБ кишечника, белок S100 мозга, протромбин, амелогенин и энамелин эмали зубов, остеокальцин и др. Нарушения активности СаСвБ играют важную роль в расстройствах транспорта кальция через мембраны, сократительной функции сердечной, скелетных и неисчерченных мышц, свертывания крови, минерализации скелета и в механизме деструкции твердых тканей зубов при кариесе. Расстройство всасывания кальция и фосфора наблюдается в случаях изменения нормального соотношения этих элементов в диете (1:1,5), употребления пищи, богатой оксалатами и инозитфосфорной (фитиновой) кислотой, упорного поноса, а также при рахите (нарушение синтеза СаСвБ в энтероцитах). |
