зайко. Н. Н. Зайко Патологическая физиология Введение Предмет и задачи патологической физиологии Патологическая физиология есть наука, изучающая жизнедеятельность больного организма. Программа
 Скачать 7.32 Mb. Скачать 7.32 Mb.
|
|
1. Факторы роста. Онкоген sis вируса саркомы обезьян оказался аналогом нормального тромбоцитарного фактора роста человека (ТФР), который стимулирует размножение фибробластов. Обнаружено, что sis является геном, кодирующим ?-цепочку ТФР. В отличие от нормального ТФР, который активируется, соединяясь с рецептором на мембране клетки, продукт вирусного онкогена вырабатывается уже в активном состоянии и в соединении с рецептором клетки для активации не нуждается. 2. Рецепторы клеточных мембран. Аналогами рецепторов клеточных мембран являются продукты вирусных онкогенов SRC вируса саркомы Рауса, erb В-вирусов AEV, вызывающих у птиц саркомы и рак. Оказалось, что erb В является аналогом клеточного рецептора для эпидермального фактора роста (ЭФР), его внутриклеточной частью, по своему действию – протеиновой тирозиновой киназой (присоединяет к тирозиновым остаткам протеинов фосфатные группы, от чего функциональная активность фосфорилированных белков резко меняется). В отличие от нормального рецептора продукт вирусного онкогена вырабатывается в активном состоянии и имитирует для клетки воздействие ЭФР. 3. Передатчики сигналов. Примерами вирусных онкогенов, кодирующих аналоги передатчиков сигналов в клетках, являются ras и РКС. 4. Цитоплазматические и ядерные белки. В ядре обнаружены продукты онкогенов V-myc, V-myb вирусов, вызывающих у птиц миелоидный лейкоз, v-fos вируса остеосарком у мышей; широко распространен онкогенный индуктор Р53. Продукты многих онкогенов ДНК-содержащих вирусов обнаруживаются в ядрах трансформируемых клеток: продукт ELA – регулятор транскрипции в ядре и цитоплазме, большой белок Т-вируса SV-40 в ядре инициирует синтез ДНК, влияет на транскрипцию, стабилизирует Р53. По биохимической активности продуктов своего синтеза онкогены вирусов и соответствующие им клеточные протоонкогены могут быть разделены на следующие группы: 1. тирозиновые протеинкиназы: yes, fgr, fps, ros, fms, erbB, ser, abL; 2. серинтреониновые протеинкиназы (фосфорилируют белки по радикалам аминокислот серина и треонина): mos, mil, raf; 3. семейство ras онкогенов, происходящих от факторов роста дрожжей, являются активаторами аденилатциклазы и гуанилатциклазы; 4. индукция деления через ядерные белки: myc, myb, ios; 5. аналоги факторов роста: sis (аналог. ТФР). Стало известно, что myc может выполнять роль промотора, т. е. гена, активирующего работу рядом расположенного гена. Оказалось, если онкоген myc включается в геном вируса рака молочной железы, у лактирующих мышей, получивших такой вирус, интенсивно образуются опухоли молочной железы, но если онкоген myc присоединяют к генам, контролирующим производство иммуноглобулинов, то у мышей развивается лимфолейкоз. Наряду с онкогенами – активаторами клеточного размножения обнаружен ген, который в клетке выполняет роль репрессора и останавливает клеточное деление. Этот ген-репрессор имеется в клетках сетчатки глаза, а его наследственный дефект приводит у ребенка к обязательному развитию ретинобластомы в глазу. Этот ген Rb находится у человека в 13-й хромосоме, в фрагменте Н38 полосы 13gl4.1 и сцеплен с геном эстеразы Д. Но и механизмы индукции опухолей в сетчатке наряду с вышеприведенными механизмами наследственного развития опухолей оказались связанными с геном-репрессором Rb. При индукции ретинобластомы канцерогенными факторами в исходно здоровых клетках сетчатки, имеющих ген Rb, развитие опухоли происходит при прекращении функции гена Rb и связывании его продуктов. Каким образом формируются онкогены и опухолеродность вирусов? 1. Изменения структуры протоонкогенов, приводящие к их нерегулируемости, происходят при неполном захвате этих протоонкогенов вирусами, при котором совершается отрыв протоонкогена от его собственных регуляторных участков или регуляторных участков других клеточных генов. Как раз самым частым отличием вирусных онкогенов от протоонкогенов оказалось то, что проонкогены в геноме клетки представлены двумя генами – интроном и экзоном, а в вирусных геномах обнаруживаются только экзоны протоонкогенов, т. e. происходит потеря существенной регуляторной части клеточных генов. Обнаружено также, что вирусная обратная транскриптаза допускает ошибки при считывании генома. Наблюдали, что точковая мутация в онкогене вируса, вызывавшего доброкачественные опухоли, превратила вирус в индуктор злокачественных опухолей. Установлено, что точковые мутации в онкогенах вирусов существенно влияют на различные стороны онкогенеза. 2. Особым механизмом повышения онкогенности является супер-инфекция вирусом клеток, зараженных ранее слабым штаммом онкогенного вируса. Между вирусами может происходить обмен генетической информации, и дефектный вирус может получить недостающий геи или стимулятор своей активности. Суперинфекция может привести к размножению слабого онкогенного вируса или активизации функций его генов. Полагают, что инициация – процесс многостадийный, но первым звеном является иммортализация – обессмертивание, т. e. приобретение способности беспредельно размножаться, что видно по схеме Хьюгса (см. рис. 13.3). 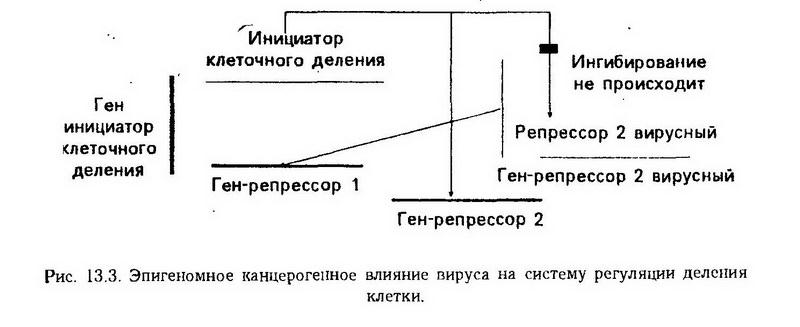 Между началом действия трансформирующего агента и появлением клинически выраженной опухоли имеет место латентный период, который у человека может длиться годами. Причиной возникновения латентного периода является необходимость выключения репрессора, подавляющего активность вирусного генома (в случае вирусного канцерогенеза); преобладание в начале роста опухоли медленно растущих типов опухолевых клеток, необходимость промоции скрытых трансформированных клеток. Промоция (активизация) является вторым этапом в механизме развития канцерогенеза. Трансформированные клетки могут оставаться в ткани длительное время в неактивной форме. Дополнительное воздействие коканцерогенным фактором, который сам не вызывает трансформацию, но стимулирует клетки к размножению, приводит к тому, что опухолевые клетки, находящиеся в латентном состоянии, начинают размножаться, образуя опухолевый узел. Большинство канцерогенов являются полными, т. e. вызывающими и трансформацию, и активацию. Однако в эксперименте канцерогенез можно превратить в двухэтапный процесс, когда трансформацию и промоцию можно изучать раздельно (опыт Беренблюма-Моттрама). Мышам наносили на кожу метилхолантрен в дозе 25 мкг, недостаточной для воспроизведения опухолей на протяжении жизни животного. Затем смазывали тот же участок кожи кротоновым маслом, которое само никогда опухолей не вызывает, но в условиях данного опыта активировало размножение клеток, трансформированных канцерогеном. У животных начинали образовываться опухоли. Существование латентных ("дремлющих") трансформированных клеток можно обнаружить и в опыте Фишера. В вену крысе ввели 50 опухолевых клеток карциномы Уокера. Эта доза недостаточна для индукции опухоли и на протяжении многих месяцев после инъекции у крыс опухоли не развивались. Но если этим крысам несколько раз произвести оперативное вскрытие брюшной полости и прикоснуться к печени, то в печени у них разовьется карцинома Уокера. Не все вещества, вызывающие воспаление, являются активаторами канцерогенеза. Так, разведенные растворы иприта и кантаридина, вызывающие только слабое раздражение кожи, оказывали явное антиканцерогенное действие в условиях опыта Беренблюма-Моттрама. Возможным молекулярным механизмом промоции является включение трансмембранной сигнальной системы, оканчивающееся активацией ее внутриклеточной части – протеинкиназы С. Сигнал от рецепторов этой системы, расположенных на поверхности клеточной мембраны, активирует обмен фосфатидилинозитола в мембране и генерацию диацилглицерола, который стимулирует протеинкиназу С. Промоторы опухолей – эфиры форбола – прямо стимулируют протеинкиназу С. Возможно, протеинкиназа С передает действие и других промоторов, в том числе промоторное действие факторов роста, продуктов онкогенов. В то же время в опухолях активность сигнальной системы другого типа – аденилатциклазной – снижается. Выше был описан механизм промоции, заключающийся в прямом встраивании промоторного гена в геном клетки, например, онкогена myc. Прогрессия – третий этап механизма канцерогенеза. Под прогрессией понимают стойкие качественные изменения свойств опухоли, преимущественно в сторону малигнизации, возникающие под действием нескольких факторов: 1. В первичный канцерогенез, как правило, вовлекается не одна клетка, а несколько, что способствует формированию в развивающейся опухоли нескольких сублиний клеток. В .растущей опухоли под воздействием изменяющихся условий (питание, кровоснабжение, иннервация) ее роста постоянно совершается отбор наиболее жизнеспособных клеток. Определенные клетки получают преимущество. При росте опухолевой ткани в организме изменяется гормональная регуляция, наконец, возможна выработка антител против клеток, имеющихся в какой-либо сублинии. В результате с течением времени получает преимущество какая-нибудь из сублиний опухолевых клеток, которая вначале составляла меньшинство. 2. Изменение генотипа и фенотипа клеток, приводящее к прогрессии, может быть связано с продолжением действия на геном опухолевых клеток канцерогенного фактора. 3. Спонтанные мутации опухолевых клеток при снижении в них активности репаративных ферментов. 4. Приобретение опухолевыми клетками новых свойств, связанных с суперинфекцией опухолеродными и неопухолеродными вирусами, облегченной в опухолевых клетках. С практической точки зрения важно, что прогрессия в большинстве случаев приводит к увеличению скорости роста опухоли. Вследствие гетерогенности опухолевых клеток при химиотерапии опухолей наблюдается отбор клеток, устойчивых к действию лекарственных средств. Особенности опухолевой ткани В процессе канцерогенеза и прогрессии клетки утрачивают свою дифференцировку, возвращаясь как бы к эмбриональному состоянию. Это явление называется анаплазией. Признаки анаплазии имеются в биохимических процессах опухолевых клеток (биохимическая анаплазия), в их физико-химическом состоянии (физико-химическая анаплазия), в строении и функции (морфологическая и функциональная анаплазия). Происходит также метаплазия – превращение в новые клеточные формы. При трансформации в клетке (см. рис. 13.4) наряду с нарушением регуляции клеточного деления происходят комплексы изменений: 1. Клетки начинают синтезировать новые разнообразные факторы роста, которые бывают различными в опухолях из разных тканей и даже в клетках опухолей из одной и той же ткани. Но во всех случаях факторы роста, индукция которых начинается клетками при превращении их в опухолевые, относятся к двум группам: • факторы роста, действующие на сами клетки-продуценты и поддерживающие в них размножение: гликопротеин р52, инсулиноподобные факторы роста ИПФР-I и ИПФР-II, аналог тромбоцитарного фактора роста ТФР и онкогена p28sis, V-ras и другие онкогены и протоонкогены. В клетках, претерпевших канцерогенез, устанавливается аутокринная секреция этих факторов роста, т. е. клетки оставляют их в себе и этим поддерживается беспрерывное размножение. Небольшая часть экскретируемых факторов роста действует на соседние клетки этой же ткани; • факторы роста, предназначенные для клеток другого типа, в первую очередь для клеток стромы и сосудов, которых растущая опухолевая ткань с помощью этих факторов роста заставляет врастать в опухолевый узел. Для фибробластов вырабатывается упомянутый ТФР или его вирусный аналог p28sis, особый фактор роста, стимулирующий синтез коллагена фибробластами CSSFs (от англ. collagen synthesis-stimulating growth factor). Для сосудов опухолевые клетки вырабатывают стимулятор роста ангиогенин, проявляющий активность в чрезвычайно малых дозах, инсулиноподобные факторы роста и другие. Продукцию этой группы факторов роста и других биологически активных веществ, предназначенных для прилежащих клеток, называют паракринной. 2. В опухолевых клетках резко увеличиваются синтез и экспрессия рецепторов, в первую очередь для факторов роста, например, V-erb В для эпидермального фактора роста ЭФР. 3. Синтез ферментов, разрушающих компоненты соединительной ткани и сосудов, что обусловливает миграцию опухолевых клеток и метастазирование; сюда относятся активатор плазминогена – очень активный фермент, который, кроме непосредственного действия на субстрат, активирует другие ферменты, коллагеназа IV типа (а именно из коллагена IV типа состоит базальная мембрана сосудов), другие коллагеназы. 4. Значительные изменения в опухолевых клетках претерпевает цитоскелет, входящие в него микротрубочки. Имеет место фосфорилирование белков цитоскелета – винкулина, вследствие чего изменяется функция этих белков, в опухолевых клетках резко уменьшается количество межклеточных контактов, благодаря чему облегчается метастазирование. Исчезает контактное торможение клеточного деления. 5. Опухолевые клетки способны также к образованию факторов, противоположных по направлению действия ферментам, отмеченным выше в п. 3: это факторы, индуцирующие синтез коллагенов различных типов, включая IV, синтез иных ингредиентов интерстиция и сосудистых стенок, а также в опухолевых клетках встречаются и собственные ферменты, синтезирующие компоненты интерстиция. Благодаря этой группе факторов опухолевые метастазы закрепляются и растут в других органах. На рис. 13.4 представлена трансформированная клетка эпителия молочной железы. Инициация произошла посредством вирусного онкогена erb В, продукт которого р65егЬВ является внутриклеточной частью рецептора эпидермального фактора роста – протеинкиназой, находящейся постоянно в активном состоянии, что побуждает клетку и ее потомков постоянно делиться. В клетке депрессируется синтез многих факторов роста, в том числе продукта протоонкогена р21ras, который является рецептором клеточной мембраны и через гуанилатциклазную систему становится дублером стимуляции деления и синтеза факторов роста. Часть факторов роста действует на самих продуцентов (аутокринная секреция), часть их молекул выделяется в окружающую ткань (паракринная секреция) и побуждает клетки стромы и сосудов врастать в опухоль, синтезировать коллаген и другие компоненты интерстиция. Индуцируется также синтез рецепторов эстрогенов и других гормонов, причем эстрогены усиливают синтез факторов роста, прогестерон тормозит, действие других гормонов вариабельно. Биохимические особенности опухолевой ткани. В основе биохимических особенностей опухолевой ткани лежат изменения генетической регуляции клетки. В результате репрессии одних генов прекращается синтез сопряженных с ними ферментов, структурных белков и др., дерепрессия других ведет к тому, что в клетке появляются новые типы белков, изоферментов. Как правило, репрессируется выработка ферментов и белков, позволяющих клетке выполнять специализированную функцию, и активируются путем дерепрессии ферменты, которые обеспечивают клеточное деление. Канцерогенные факторы потенциально способны вызывать не только поломку регуляции клеточного деления, но и нарушение функции других структурных и регуляторных генов. Поэтому в опухолевой клетке может наблюдаться неожиданная дерепрессия синтеза веществ, например гормонов, которые в норме не образуются в данной ткани. Так, в первичной карциноме легких может обнаруживаться синтез кортикотропина или гонадотропина, в опухолях почек – тироксина. По той же причине в опухолях может утрачиваться выработка какого-либо фермента или устанавливается выработка нового. Характерно, однако, что разные опухоли приближаются друг к другу по комплексу входящих в их состав ферментов, причем этот комплекс тем меньше, чем более выражена дедифференциация клеток. Важнейшей биохимической особенностью опухолевой клетки является активизация синтеза нуклеиновых кислот. В опухолевых клетках по сравнению с нормальными меняется набор ДНК-полимераз. Среди трех видов ДНК-полимераз в опухолях уменьшается количество ДНК-полимеразы 3, использующей в качестве матрицы нативную ДНК, и увеличивается количество ДНК-полимеразы 2, способной строить ДНК не только по нативной, но и по денатурированной матрице. В опухолевых клетках качественно и количественно меняется синтез белков. К белкам, синтез которых в опухолевых клетках резко увеличивается, относятся протеины митотического аппарата, в том числе крупномолекулярный белок веретена. В норме содержание белков в митотическом аппарате составляет до 11% их количества в клетке, в опухоли же их количество повышается до 30%. Меняется метаболизм белков. Снижается способность опухолевых клеток к переаминированию и дезаминированию аминокислот, иногда не образуются некоторые ферменты, участвующие в обмене аминокислот. В большинстве опухолей увеличиваются захват аминокислот из крови и синтез белка. Катаболизм белка снижается настолько, что даже в голодающем организме белок опухоли не участвует в общем межуточном обмене. Более того, методом изотопных индикаторов было установлено, что когда ткани "голодающего" хозяина теряют аминокислоты, опухоль "присваивает" их себе. Все это позволило охарактеризовать опухоль как "ловушку азота". Из-за потери ферментов может утрачиваться способность к синтезу ряда незаменимых аминокислот, например L-аспарагина. Особое место в биохимии опухолей занимает изучение обмена углеводов и выработки энергии. В опухолях нередко значительно увеличена скорость гликолиза. Интенсивный гликолиз не является специфической особенностью опухолей. Однако, если сравнить активность ферментов гликолиза в опухоли и исходной ткани, то наблюдается увеличение активности основных ферментов гликолиза – гексокиназы, фосфофруктокиназы и пируваткиназы. В опухолях происходит аэробный гликолиз, т. е. распад углеводов до пирувата и превращение его в молочную кислоту в присутствии кислорода (отрицательный эффект Пастера). В то же время в большинстве здоровых тканей наблюдается торможение превращения пирувата в молочную кислоту в присутствии кислорода и снижение интенсивности гликолиза. Варбург сформулировал гипотезу о том, что причиной злокачественной трансформации клеток являются факторы, препятствующие получению клетками энергии от окисления, вследствие чего последние вынуждены переходить на гликолиз. С современных позиций усиление гликолиза следует рассматривать не как причину возникновения опухолей, а как следствие канцерогенеза, сложной перестройки синтеза и регуляции функции ферментов. Опухоль интенсивно захватывает глюкозу из крови. Даже при повышении содержания глюкозы в крови до 16,7 ммоль/л (300 мг%) оттекающая из опухоли кровь не содержит глюкозы (В. С. Шапот). Эту способность опухоли связывают с изменением активности трансфераз гексоз: снижается активность регулируемой глюкокиназы и резко активируется гексокиназа, менее чувствительная к гормональной регуляции. Энергия, получаемая опухолевыми клетками от гликолиза, достаточна для обеспечения синтеза нуклеиновых кислот и клеточного деления. В опухолях также изменяется окисление (тканевое дыхание). В основном имеется тенденция к снижению дыхания пропорционально степени дедифференцировки клеток. При этом наблюдается эффект Крэбтри – подавление окисления при нагрузке глюкозой, что может быть результатом "борьбы" мощной гликолитической системы ферментов опухоли с ее окислительными ферментами за неорганический фосфат, другие субстраты и коферменты. Антигенные особенности опухоли. По своему антигенному составу опухолевая ткань отличается от нормальной ткани, из которой она произошла. Так, в опухолях могут обнаруживаться антигены, свойственные эмбриональным тканям (опухолево-эмбриональные антигены). Г. И. Абелев показал это на примере гепатомы, в которой он обнаружил фетальный белок ?-фетопротеин. По наличию этого белка в крови можно диагностировать опухоль печени до появления ее клинических признаков. В опухолях вирусного происхождения появляются индуцированные вирусами антигены; специфичные для данного вируса и одинаковые в разных опухолях и у разных индивидуумов. Случайные антигены возникают в индуцированных опухолях в результате мутаций. Если под влиянием одного канцерогена в организме возникает несколько первичных опухолей, то они могут вырабатывать разные случайные антигены так же, как и различные ферментные наборы. Появление в организме опухолевых клеток не обязательно приводит к развитию опухолевого процесса. Клоны опухолевых клеток попадают под контроль иммунологически компетентной ткани и в результате иммунологических реакций клон с какими-либо антигенными отличиями устраняется. Таким образом, рост опухолевой ткани наблюдается в результате ускользания опухолевых клеток от иммунологического контроля. Механизмы такого ускользания от иммунологического надзора следующие: 1. прогрессия опухоли сопровождается утратой части антигенов, имеющихся в нормальной ткани, – так называемым антигенным упрощением. Упрощение антигенной структуры может способствовать выживанию опухолевых клеток и достигать такой степени, когда полностью теряются тканевоспецифические и индивидуальные антигены. Остаются только видоспецифические антигены, к которым у каждого организма определенного вида существует толерантность; 2. появление в опухолевой ткани фетальных антигенов не вызывает иммунологической реакции вследствие того, что к этим антигенам имеется иммунологическая толерантность; 3. маскирование антигенов опухолей. Так, клетки хорионэпителиомы имеют нейтральную полисахаридную капсулу; 4. в некоторыхопухолях обнаружены антигенные детерминанты, которые упреждающе стимулируют Т-супрессоры, что приводит к торможению иммунной реакции против опухоли; 5. канцерогенные факторы могут вызывать иммунодепрессию; 6. создание перегрузки иммунологической системы и угнетение иммунного ответа опухолевой тканью после достижения определенной массы. Однако, несмотря на все пути ускользания опухоли от иммунологического надзора, трансформированные клетки разрушаются в организме и клиническое проявление опухолей происходит значительно реже трансформации. Физико-химические особенности опухолевой ткани. Изменение физико-химических свойств опухолевых клеток является главным образом результатом биохимической перестройки опухолевой ткани. Интенсивный гликолиз приводит к накоплению молочной кислоты. При нагрузке углеводами в опухолевой ткани может снизиться рН до 6,4. В опухоли повышено содержание воды, а иногда и некоторых электролитов, в частности солей калия. Количество кальция и магния снижено, соотношение К/Са возросло. Вследствие гидратации и увеличения содержания ионов водорода, а также некоторых электролитов, электропроводность опухолевой ткани повышена. Снижена при этом вязкость коллоидов. Наблюдается Увеличение отрицательного заряда клеток опухоли, величина которого приближается к величине заряда лимфоцитов. Было высказано предположение, что из-за сходства зарядов лимфоциты в меньшей степени способны контролировать опухолевую ткань, чем здоровую, а поэтому не атакуют опухолевые мутанты. Повышение отрицательного заряда опухолевых клеток происходит вследствие увеличения количества электроотрицательных радикалов нейраминовой кислоты в наружной мембране клеток. Степень физико-химической анаплазии соответствует степени дедифференциации и скорости роста. Функциональные особенности опухолевой ткани. Функциональная анаплазия проявляется потерей функций, которые клетки способны были выполнять до дедифференцировки. Например, в гепатоме прекращается синтез желчных пигментов, у быстро растущих и сильно дедифференцированных опухолей утрачиваются исходные специфические функции. Частично дедифференцированные опухоли, сохранившие способность осуществлять некоторые специфические для исходной ткани процессы, теряют контроль над ними. Так, в опухоли мозгового вещества надпочечных желез (феохромоцитома) наблюдается неконтролируемый синтез адреналина. В опухолях половых органов может частично сохраняться чувствительность к гормональной регуляции. Наряду с дедифференцировкой и снижением эффективности контроля в опухолевых клетках может совершаться необычный для исходной ткани процесс, например синтез гликозаминогликанов или гормонов. Злокачественность опухоли. Способность опухолевых клеток к беспредельному неконтролируемому размножению еще не определяет неизбежность гибели организма при росте опухоли, так как хирургическое удаление опухолевого узла обеспечивает полное излечение. Однако этому может препятствовать злокачественность опухоли, которая характеризуется инфильтративным (инвазивным) ростом и способностью метастазировать. Для злокачественных опухолей характерны также более выраженная, чем у доброкачественных, тканевая анаплазия и способность вызывать общее глубокое истощение организма – кахексию. Доброкачественные опухоли могут перерождаться в злокачественные. Инфильтративный рост и образование метастазов связаны с нарушением в опухолевой ткани межклеточных взаимодействий. В опухолях и культурах опухолевых клеток наблюдается снижение контактного торможения. Когда в культуре ткани здоровые клетки двух соседних участков, размножаясь по фронту роста, приходят в контакт друг с другом, рост ткани и деление клеток на этом участке приостанавливаются. Клетки опухоли, несмотря на соприкосновение друг с другом, продолжают расти, образуя многослойные участки. Отсутствие контактного торможения позволяет объяснить способность злокачественных опухолей к инфильтративному росту, т. е. прорастанию в здоровую ткань. В основе контактного торможения в норме, очевидно, лежит влияние со стороны мембран на регуляцию деления клеток. Этот механизм в опухолевых клетках утрачивается. Метастазирование состоит из следующих этапов: отрыв опухолевой клетки от соседних клеток, движение в ткани, расплавление при этом компонентов соединительной ткани и стенки сосуда, распространение с кровью или лимфой, прикрепление к стенке сосуда в новом месте, индукция роста соединительной ткани и сосуда в новообразующуюся опухолевую ткань. 1. Начальный этап – прекращение образования межклеточных контактов, изменение рецепторов мембраны и приобретение подвижности в значительной степени связаны с изменением белков цитоскелета, в частности с их фосфорилированием протеинкиназами, которыми являются многие продукты онкогенов и факторы роста. Происходят также изменения регуляции генов, кодирующих белки цитоскелета и рецепторы мембран. 2. В трансформирующихся клетках происходит синтез активатора плазминогена – фермента, который интенсивно разрушает компоненты основного вещества соединительной ткани и сосудистой стенки, а также активирует ферменты других биологически активных систем, в частности трипсиноген. В опухолевых клетках образуются коллагеназы, разрушающие коллагены различных типов, включая IV, из которого состоит базальная мембрана сосудов. Обнаружено, что опухолевые клетки, не обладающие плазминогеном, вырабатывают фактор, привлекающий моноциты, ферменты которых разжижают матрикс и создают возможность опухолевым клеткам метастазировать. Аналогичным образом опухолевые клетки привлекают тканевые базофилы, ферменты которых, в частности, сериновая протеаза и металлпротеиназа также способствуют расщеплению матрикса, а гепарин усиливает действие ангиогенина и врастание сосудов в опухолевую ткань. 3. Следует отметить, что катепсины имеются как встроенные в мембраны опухолевых клеток, так и в свободном состоянии в межклеточной жидкости опухолевой ткани. 4. Опухолевые клетки обладают набором факторов, активирующих функции соединительно-тканных клеток по синтезу коллагена, гликопротеинов и других компонентов основного вещества и размножение этих клеток, врастание в узел. 5. Как было отмечено выше, опухолевые клетки выделяют ангиогенин и другие факторы роста сосудов, что обеспечивает кровоснабжение опухолевой ткани. 6. В мембранах опухолевых клеток в отличие от здоровых радикалы нейраминовой кислоты, гликопротеидов, ?-Д-глюкопиранозида и N-ацетил-Д-галактозамина остаются открытыми. Белок конканавалин А, а также лектины, благодаря наличию открытых радикалов, агглютинируют опухолевые клетки. Если опухолевые клетки обработать расщепленным надвое конканавалином А, блокирующим открытые радикалы мембран, не вызывая агглютинации, то они некоторое время начинают расти как здоровые. Все это дает основание полагать, что нарушение мембран опухолевых клеток и появление в них открытых радикалов препятствует образованию плотных контактов между опухолевыми клетками и способствует инфильтративному росту и образованию метастазов. Одной из причин раскрытия в опухолях радикалов и нарушения мембран является увеличение содержания сиалтрансферазы, переносящей радикалы гликопротеидов. При смешивании в культуре ткани небольшого числа опухолевых клеток первые делятся и растут как нормальные. Вероятно, опухолевые клетки при этом теряют способность посылать сигналы о торможении деления другим клеткам, но сами способны, в определенной степени, воспринимать тормозящие сигналы, посылаемые здоровыми клетками. В раковом узле создаются условия для преобладания опухолевых клеток и их инвазивного роста. Влияние опухоли на организм В зависимости от локализации опухоли и ее метастазов могут возникать разнообразные патологические явления в организме. Так, опухоли органов пищеварительной системы вызывают тяжелые нарушения пищеварения и питания. Рак желудка сопровождается угнетением секреторной функции этого органа. В результате недостаточного поступления и усвоения пищи при этом развивается голодание. Кроме прямого поражения органов опухолью и ее метастазами, существуют и другие пути воздействия злокачественных опухолей на организм, например токсическими веществами, вызывающими нарушение общего обмена веществ, ведущее нередко к глубокому истощению организма – раковой кахексии. Известно, что в организме при опухолевом процессе снижена активность каталазы, фермента, катализирующего реакцию разложения перекиси водорода. Изучая причины этого явления, Накахара и Фукуока выделили из опухоли человека фракцию, которая при введении мышам вызывала снижение уровня каталазы в печени. Это вещество было названо токсогормоном. В дальнейшем был выделен высокоактивный кристаллический полипептид с относительной молекулярной массой 4000. Очищенный препарат токсогормона вызывает у больных опухолями снижение содержания каталазы в печени и почках; снижение содержания железа в крови, на которое токсогормон влияет в 200 – 500 раз сильнее, чем на активность каталазы; развитие анемии путем угнетения эритропоэза; гипертрофию надпочечных желез и инволюцию вилочковой железы; увеличение селезенки и печени. Из опухоли в организм поступают недоокисленные продукты обмена. В нейтрализованном виде они выводятся почками. В норме в моче соотношение количества углерода к азоту (C/N) составляет 0,7, при опухолевом процессе – 0,9 и выше. Это свидетельствует об увеличенном выделении с мочой недоокисленных продуктов и называется дизоксидативной карбонурией. Часть ферментов опухоли переходит в окружающую среду благодаря повышенной проницаемости клеточных мембран, а также вследствие некроза опухолевой ткани. При этом в крови или в других жидкостях организма появляются синтезируемые опухолью ферменты, а также другие белки, в том числе эмбриональные. Так, содержание щелочной фосфатазы в крови при остеогенной саркоме возрастает в 20 – 40 раз; повышение активности ее отмечается также при росте гепатомы. Увеличение уровня в крови кислой фосфатазы наблюдается при опухолях предстательной железы, а повышение активности глюкозофосфатизомеразы – при раке молочной железы. При различных опухолях увеличивается содержание в крови альдолазы, некоторых изоформ лактатдегидрогеназы, снижается активность холинэстеразы и рибонуклеазы. Следует подчеркнуть, что изменения ферментов крови не всегда специфичны тому или иному виду опухоли. Особые изменения в организме наблюдаются при опухолях, в которых происходит бесконтрольный синтез гормонов или других биологически активных веществ. При синдроме Золлингера-Эллисона в опухоли поджелудочной железы отмечается интенсивный синтез гастрина (гормона слизистой оболочки желудка, сильного стимулятора секреции желудочного сока). Синтез гастрина, несвойственный поджелудочной железе, является следствием аномальной функции соответствующего гена, функционирующего бесконтрольно, вне связи с естественными механизмами регуляции синтеза желудочного гастрина. Беспрерывная стимуляция желудочной секреции опухолевым гормоном приводит к развитию язвенной болезни. Аналогичным образом в феохромоцитоме секретируется адреналин, что в итоге приводит к гипертонической болезни. Роль организма в опухолевом процессе Организм оказывает влияние на опухолевый процесс на всех его этапах. С точки зрения канцерогенеза процессы, происходящие в организме, могут иметь двоякое назначение: либо облегчать, либо тормозить образование опухолей. Известны предраковые состояния – заболевания, при которых значительно возрастает частота развития опухолей, например рак шейки матки при эрозии ее слизистой оболочки. Наследственные свойства организма обусловливают особенности реакции на канцерогенные факторы и возникновение опухолей. Например, выведены инбредные линии животных, устойчивых к действию канцерогенов. Видовые, половые, тканевые, органные особенности организма определяют варианты метаболизма и действия химических канцерогенов, а также различия иммунных реакций против опухолеродных вирусов и мутантных клонов опухолевых клеток. В результате некоторые виды организмов нечувствительны к действию опухолеродного вируса, у других этот вирус вызывает развитие опухоли. У мужчин чаще наблюдается рак желудка, а у женщин – рак органов половой сферы. Значительное влияние на опухолевый процесс оказывает гормональная регуляция. Гормоны могут выступать в роли канцерогенов и индуцировать развитие опухоли или облегчать ее течение (см. выше). Растущие опухоли нередко обнаруживают особую чувствительность к гормональной регуляции. Так, рост различных опухолей тормозится при воздействии инсулином, недостатком гормона роста гипофиза, усиливается при гипофункции щитовидной железы, а также действием ряда половых гормонов. В силу вариабельности изменений в опухолевых клетках наблюдаются различные реакции их на действие или недостаток гормонов. В то время как при избыточном поступлении инсулина развитие многих опухолей подавляется, в эксперименте получена инсулинзависимая карцинома молочной железы, индуцированная ДМБА. Без инсулина эта опухоль расти не может. Ткань злокачественных опухолей в большинстве случаев не иннервируется. Нервные окончания располагаются в строме, представленной нормальной соединительной тканью. Однако и здесь иннервация недостаточна. Поскольку высшая нервная деятельность сопряжена с эндокринной регуляцией, нарушение ее может приводить к изменениям гормональной регуляции, сопровождающимся развитием опухолей. В связи с накоплением фактов об участии нервной системы в органогенезе и трофическом влиянии ее на тип строения иннервируемой ткани, например мышечной, можно предположить, что в ряде случаев нарушение функций нервной системы связано, прямо или опосредованно, с процессами канцерогенеза и прогрессии опухоли. Особое значение при этом имеет влияние симпатического медиатора адреналина на регуляцию митотической активности тканей. Было установлено, что число митозов в ткани находится под контролем репрессорных гормонов – кейлонов, которые вырабатываются в делящихся клетках. Чем больше в данной ткани делящихся клеток, тем выше концентрация кейлонов, тем сильнее тормозится митотическая активность остальных клеток. Предполагают, что таким способом в организме поддерживается постоянство количества клеток. Учитывая роль нервной системы в регуляции клеточного размножения и, следовательно, в механизмах канцерогенеза, важно, что активность кейлонов проявляется в сочетании с адреналином. В опухолевой ткани данный механизм регуляции деления клеток нарушается. Механизмы защиты организма от опухоли. Организм располагает средствами защиты от канцерогенных факторов. Они включают прежде всего работу органов и систем, захватывающих, обезвреживающих и выводящих канцерогены, защищающих клетки и макромолекулы от действия перекисей и продуктов радиолиза; иммунную систему и фагоцитоз. Кроме того, имеют место и особые механизмы защиты: система репаративных ферментов, ликвидирующая нарушения генов и восстанавливающая их нормальную структуру после мутации (эндонуклеазы); клеточные ингибиторы синтеза нуклеиновых и вирусных нуклеиновых кислот (интерферон); по-видимому, гены, репрессирующие вирусный геном, и др. Обнаружено, что, кроме классических иммунных реакций, осуществляемых клонами Т- и В-лимфоцитов против опухолевых клеток, если эти клетки несут распознаваемые в данном организме антигенные детерминанты, существует способ борьбы с опухолевыми клетками, основанный не на специфической иммунной реакции. В организме обнаружены лимфоциты, названные естественными киллерами, которые по отношению ко многим опухолевым клеткам обладают выраженной цитотоксической активностью. Естественные киллеры вместе с моноцитами и гранулоцитами образуют механизмы неадаптивного иммунитета, в первую очередь против вирусов и опухолевых клеток (адаптивный – приобретаемый в результате специфической иммунизации). Следует отметить, что естественные киллеры, как и моноциты, имеют рецепторы для Fc-фрагментов иммуноглобулинов, присоединяя которые, вовлекаются по мере иммунизации в иммунные реакции. Иммунные лимфоциты делятся на ограничиваемые главной системой антигенов гистосовместимости и не ограничиваемые. Антигены гистосовместимости класса I (это вещества группы HLA-A, -В и -С) управляют взаимодействием цитотоксических Т-лимфоцитов с клетками-мишенями. Антигены класса II (это группа HLA-D) контролируют распознавание антигенов, поступающих в организм, Т-лимфоцитами на клетках, выставляющих антигенные детерминанты (моноцитах, других лимфоцитах). Антигены класса III – это белки системы комплемента С2, С4, фактор В. Кроме того, для организации иммунного ответа важна также система Ir-генов (гены иммунного ответа). Анализ всех этих факторов необходим, поскольку все они влияют на возможность иммунной реакции против образующейся опухоли. При изучении цитотоксического действия лимфоцитов на опухолевые клетки выделен в чистом виде туморнекротизирующий фактор ТНФ, клинический эффект которого увеличивается при сочетанном действии его с иммунным интерфероном. Кроме того, обнаружен лимфоидный токсин (ЛТ) и цитотоксический фактор естественных киллеров (ЦФЕК). Введение ТНФ вызывает не только некроз опухолевых клеток, но и сосудов, вросших в опухолевую ткань. Лечение опухолевых заболеваний. С. А. Розенберг и соавт. (1982) применили для стимуляции аутологичных лимфоцитов интерлейкин-2, полученный в результате синтеза микроорганизмами, которым был введен ген этого лимфокина. Интерлейкин-2 (ИЛ-2) добавляли к лимфоцитам из крови больных с различными неоперабельными формами опухолей с метастазами и 1,8 – 18,4 • 1010 таких стимулированных лимфоцитов вводили этим же больным (каждому собственные), а также вводили ИЛ-2. Сочетанное введение активированных аутогенных лимфоцитов и лимфокина привело к регрессии опухолей, включая метастазы, у 11 из 25 больных, в одном случае у больной меланомой (рак кожи) достигнуто полное излечение, включая исчезновение метастазов в костях. Авторы открыли при этом новую субпопуляцию лимфоцитов, названную ими лимфокинактивируемые киллеры (ЛАК), воздействие на которые посредством ИЛ-2 вызывает эффективную противоопухолевую цитотоксическую активность по отношению к опухолям, которые оказались устойчивыми к естественным киллерам в обычных условиях. Эффективность лечения подтверждена в различных странах на многих неоперабельных больных (более многих сотен). Другой метод был применен группой Т. Таквориан при лейкозах. У больных брали костный мозг, против лейкозных клеток получали моноклональные антитела (отбирали больных, у которых лейкозные клетки экспрессировали антиген В1). С помощью антител костный мозг очищали от лейкозных клеток, облучали больного "выжигающей" дозой радиации и вводили каждому больному его костный мозг. У 34 из 45 больных была достигнута ремиссия без поддерживающей терапии до 52 мес (в среднем 11 мес). |
