зайко. Н. Н. Зайко Патологическая физиология Введение Предмет и задачи патологической физиологии Патологическая физиология есть наука, изучающая жизнедеятельность больного организма. Программа
 Скачать 7.32 Mb. Скачать 7.32 Mb.
|
|
Глава 11. Нарушения микроциркуляции В настоящее время в системе периферического кровообращения условно выделяют микроциркуляторное, или терминальное, сосудистое русло, которое, в свою очередь, в соответствии с делением сосудов на крове- и лимфоносные, делится на микроциркуляторное крове- и лимфоносное русло. Микроциркуляторное кровеносное русло состоит из сосудов, диаметр которых не превышает 100 мкм, т. е. артериол, метартериол, капиллярных сосудов, венул и артериоловенулярных анастомозов (рис. 11.1). В нем осуществляются доставка питательных веществ и кислорода к тканям и клеткам, удаление из них углекислоты и "шлаков", поддерживаются равновесие притекающей и оттекающей жидкости, оптимальный уровень давления в периферических сосудах и тканях. 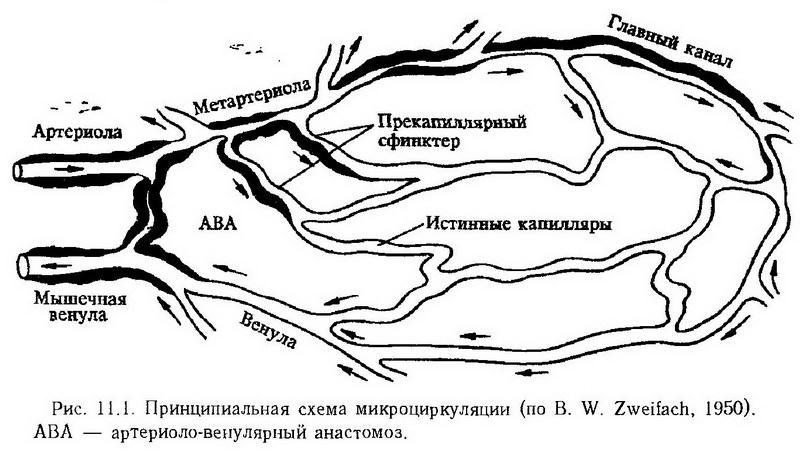 Микроциркуляторное лимфоносное русло представлено начальным отделом лимфатической системы, в котором происходят образование лимфы и поступление ее в лимфатические капилляры. Процесс образования лимфы имеет сложный характер и заключается в переходе жидкости и растворенных в ней веществ, в том числе белков, через стенку кровеносных капиллярных сосудов в межклеточное пространство, распространении веществ в периваскулярной соединительной ткани, резорбции капиллярного фильтрата в кровь, резорбции белков и избытка жидкости в лимфоносные пути и т. д. Таким образом, с помощью микроциркуляторного кровообращения осуществляется тесное гематоинтерстициальное и лимфоинтерстициальное взаимодействие, направленное на поддержание необходимого уровня метаболизма в органах и тканях в соответствии с их собственными потребностями, а также потребностями организма в целом. Типические нарушения микроциркуляции Внутрисосудистые нарушения Наиболее важными внутрисосудистыми нарушениями являются расстройства реологических особенностей крови в связи с изменением суспензионной стабильности клеток крови и ее вязкости. С ними частично связаны нарушение свертывания крови и образование гемокоагуляционных микротромбов, а также нарушение перфузии крови через микроциркуляторное русло в связи с изменением скорости кровотока. В нормальных условиях кровь имеет характер стабильной суспензии клеток крови в жидкой ее части. Сохранность суспензионной стабильности крови обеспечивается величиной отрицательного заряда эритроцитов и тромбоцитов, определенным соотношением белковых фракций плазмы (альбуминов, с одной стороны, глобулинов и фибриногена, с другой), а также достаточной скоростью кровотока. Антиадгезивные и антиагрегатные свойства тромбоцитов определяются специальными механизмами, рассмотренными в разделе X ("Патологическая физиология периферического кровообращения"). Уменьшение величины отрицательного заряда эритроцитов, причиной которого чаще всего является абсолютное или относительное увеличение содержания положительно заряженных макромолекул глобулинов и (или) фибриногена и их адсорбция на поверхности эритроцитов, приводит к снижению суспензионной стабильности крови, к агрегации эритроцитов и других клеток крови. Снижение скорости кровотока усугубляет этот процесс. Описанный феномен получил название "сладж" (от англ. sludge – густая грязь, тина, ил). Основными особенностями сладжированной крови являются прилипание друг к другу эритроцитов, лейкоцитов и тромбоцитов и повышение вязкости крови, что затрудняет ее перфузию через микрососуды. Внутрисосудистое образование агрегатов эритроцитов и других клеток крови наблюдается при перевязке сосудов; при повреждении тканей; при избытке в крови брадикинина, серотонина, тромбина, норадреналина; при внутривенном введении высокомолекулярных веществ – декстрана, метилцеллюлозы; при отравлении мышьяком, кадмием, бензолом, толуолом, анилином; при различных видах шока, олигурии, острой сосудистой недостаточности; при экстракорпоральном кровообращении; при гипотермии; при заболеваниях, сопровождающихся увеличением в крови содержания фибриногена и глобулинов и снижением содержания альбуминов (множественная миелома, макроглобулинемия и др.). В зависимости от характера воздействия сладж может быть обратимым (при наличии только агрегации эритроцитов) и необратимым. В последнем случае имеет место агглютинация эритроцитов. Размеры агрегатов при сладже колеблются от 10x10 до 100x200 мкм и больше. Процесс формирования агрегатов клеток крови имеет определенную последовательность. В первые минуты после повреждения, преимущественно в капиллярных сосудах и венулах, образуются агрегаты из тромбоцитов и хиломикронов (крупные липидные частицы, размером 0,1 – 1 мкм, содержащие в основном триглицериды; поступают в кровь из лимфы кишок и циркулируют в форме стабильной эмульсии). Они плотно фиксируются к стенке микрососудов, образуя "белый" тромб, или уносятся в другие отделы сосудистой системы к новым очагам тромбообразования. Эритроцитарные агрегаты образуются в первые часы после повреждения, первоначально в венулах, а затем в артериолах и обусловлено это снижением скорости кровотока. Спустя 12–18 ч развитие указанных нарушений прогрессирует как по выраженности проявлений, так и по распространенности. Возможно и обратное развитие процесса в направлении дезагрегации. Патофизиологические последствия агрегации эритроцитов проявляются нарушением микроциркуляции и последующими нарушениями метаболизма и функции органов и систем. Нарушения микроциркуляции обусловлены: 1. Парциальной обтурацией микрососудов вследствие оседания на их внутренней оболочке эритроцитарных агрегатов, обладающих массой, большей по сравнению с массой отдельных эритроцитов. Снижение скорости кровотока, увеличение размеров агрегатов, прилипание эритроцитов к стенке сосудов, повышение вязкости крови – факторы, ускоряющие процесс оседания агрегатных комплексов на внутренней оболочке микрососудов. 2. Полной обтурацией микрососудов агрегатами тромбоцитов и эритроцитов. При этом крупные агрегаты, состоящие из нескольких десятков и сотен эритроцитов, могут полностью перекрывать просвет артериол и венул. Агрегаты меньших размеров достигают более мелких сосудов, вплоть до капиллярных, вызывая их эмболию. 3. Резким замедлением кровотока, сепарацией (отделение) плазмы от эритроцитов, маятникообразным движением плазмы со взвешенными в ней агрегатами, стазом. В связи с закупоркой терминальных артериол большим количеством эритроцитарных агрегатов капиллярные сосуды пропускают только плазму. При этом повреждается стенка микрососудов (набухание и десквамация эндотелия). Усугубляют данный процесс кислая реакция среды, местные метаболиты, биологически активные вещества (серотонин, гистамин, гепарин), поступающие в кровь в связи с массовой дегрануляцией тканевых базофилов окружающей соединительной ткани. Возникающее в связи с этим повышение проницаемости венул и капиллярных сосудов способствует выходу жидкости за их пределы, сгущению крови, повышению ее вязкости. Создаются условия (повреждение сосудистой стенки, агрегация тромбоцитов и их повреждение, замедление кровотока) для образования множественных гемокоагуляционных микротромбов с дальнейшим нарастанием тяжести микроциркуляторных расстройств. Комплекс описанных выше патофизиологических нарушений микроциркуляции на заключительном этапе развития сладжа, характеризующийся выраженными нарушениями метаболизма и функций органов и тканей, а также недостаточным уровнем трофического обеспечения, называют капиллярно-трофической недостаточностью. Таким образом, сладж-феномен, возникающий первоначально как местная реакция ткани на повреждение, в дальнейшем своем развитии может приобрести характер системной реакции, генерализованного ответа организма. В этом заключается его общепатологическое значение. Нарушение проницаемости сосудов обмена Сосуды обмена (капиллярные сосуды и венулы) характеризуются двумя основными функциями: осуществлением движения крови и способностью пропускать в направлении кровь-ткань и обратно воду, растворенные газы, кристаллогидраты и крупномолекулярные (белковые) вещества. Регуляция кровообращения в системе сосудов обмена всецело подчиняется закономерностям пре- и посткапиллярного кровотока, а также местным гуморальным влияниям. Морфологической основой проницаемости капиллярных сосудов и венул является эндотелий и базальная мембрана. Различная по интенсивности и степени избирательности проницаемость капилляров и венул различных сосудистых областей объясняется особенностями их строения (толщиной эндотелиоцитов, базальной мембраны, наличием или отсутствием пор, пиноцитозных путей) и функционального состояния указанных структур. Механизм перехода вещества через сосудистую стенку может быть активным и пассивным. Если силы, которые обеспечивают транспорт веществ, находятся за пределами сосудистой стенки, а транспорт осуществляется в соответствии с. концентрационным и электрохимическим градиентами, такой вид транспорта называется пассивным. Существует он главным образом для переноса воды, растворенных газов и низкомолекулярных веществ, т. е. таких веществ, которые свободно проникают через сосуды обмена, в связи с чем изменение проницаемости существенно не сказывается на скорости их перехода. Активный характер транспорта веществ носит тогда, когда он осуществляется против концентрационного и электрохимического градиентов (транспорт "вгору") и для его осуществления требуется определенное количество энергии. Особенно велика роль данного механизма в транспорте белков и других, в том числе чужеродных, макромолекул. Пассивный механизм перехода веществ через стенку микрососудов в свою очередь может быть разделен на два вида: ультрафильтрацию и диффузию. Основная роль в этом процессе принадлежит диффузии, скорость которой зависит от характера вещества (размера молекулы, ее конфигурации, степени гидратации, расположения электрического заряда), проницаемости стенки капиллярных сосудов и тканей, количества функционирующих сосудов, степени их расширения и скорости кровотока в них. Чем крупнее молекула, тем меньше скорость ее диффузии через стенку капиллярного сосуда. Чем выше проницаемость стенки капиллярного сосуда, чем больше количество функционирующих микрососудов и скорость кровотока в них, тем больше скорость диффузии. Следовательно, в физиологических условиях изменение интенсивности транскапиллярного обмена осуществляется преимущественно вследствие изменений интенсивности кровотока без нарушения структур базальной мембраны, т. е. без нарушения сосудистой проницаемости в узком значении этого слова. При патологии часто наблюдается увеличение или уменьшение интенсивности перехода веществ через сосудистую стенку не только вследствие изменения интенсивности кровотока, но и в результате истинного нарушения сосудистой проницаемости, которое сопровождается изменением структуры стенки сосудов обмена. В морфологическом отношении повышение сосудистой проницаемости характеризуется увеличением промежутков между эндотелиоцитами вследствие их сокращения и усилением везикулярного транспорта (рис. 11.2), в функциональном – усиленным переходом крупномолекулярных веществ (белков). 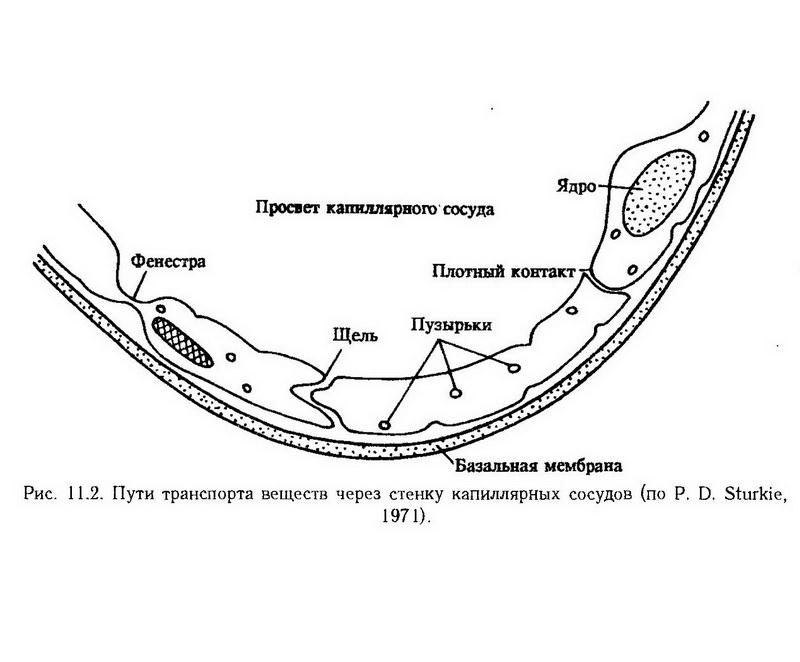 В механизме повышения сосудистой проницаемости при травме, ожоге, воспалении, аллергии большое значение придают кислородному голоданию тканей, ацидотическому сдвигу реакции среды, накоплению местных метаболитов, образованию биологически активных веществ, активным глобулинам плазмы крови (?-, ?-глобулины), катионным белкам и гистонам нейтрофильных гранулоцитов. При шоке различного происхождения возможно и генерализованное нарушение сосудистой проницаемости. По современным представлениям биологически активные амины (гистамин, серотонин) и их естественные либераторы, а также брадикинин оказывают кратковременное действие на проницаемость сосудистой стенки посредством влияния на контрактильные элементы сосудов, главным образом венул. При различных патологических процессах, особенно при. воспалении, вызванном слабыми агентами (тепло, ультрафиолетовые лучи, некоторые химические вещества), эти факторы воспроизводят раннюю фазу повышения сосудистой проницаемости (10 – 60 мин). Более поздние нарушения проницаемости сосудистой стенки (от 60 мин до нескольких суток) вызываются протеазами, каллидином, глобулинами (?-, ?-глобулины), катионными белками нейтрофильных гранулоцитов. Действие этих факторов направлено на стенку капиллярных сосудов – межклеточный цемент эндотелия и базальную мембрану – и заключается в физико-химических изменениях (в частности, деполимеризации) сложных белково-полисахаридных комплексов. При сильном повреждении тканей повышение проницаемости сосудистой стенки имеет монофазный характер и обусловлено влиянием протеаз и кининов. При некоторых патологических процессах (феномен Шварцмана, Артюса) и заболеваниях инфекционной природы (корь, скарлатина, грипп и др.), при воздействии сильных повреждающих факторов (термических, ионизирующей радиации и др.) наряду с признаками повышенной сосудистой проницаемости в виде увеличенного выхода макромолекулярных веществ можно наблюдать диапедез эритроцитов и даже микрокровоизлияния. Предполагают, что диапедез эритроцитов в околососудистую ткань осуществляется пассивно сквозь межэндотелиальные промежутки под давлением крови. Микрокровоизлияния являются следствием грубых структурных нарушений целости сосудистой стенки, повышающих ее хрупкость. Внесосудистые нарушения Наиболее важными являются два типа внесосудистых нарушений. Одни из них существенным образом влияют на состояние микроциркуляции, служат дополнительными патогенетическими механизмами ее нарушений в условиях патологии. Прежде всего – это реакция тканевых базофилов окружающей сосуды соединительной ткани на повреждающие агенты. При некоторых патологических процессах (воспаление, аллергическое повреждение тканей и др.) из тканевых базофилов при их дегрануляции в окружающее микрососуды интерстициальное пространство выбрасываются биологически активные вещества и ферменты. Доказана существенная роль некоторых из них в повышении противосвертывающей активности крови и в изменении ее реологических свойств (гепарин), в явлениях вазоконстрикции (серотонин) и вазодилатации (гистамин), в изменениях скорости кровотока и сосудистой проницаемости (гистамин, серотонин). Как уже было сказано, при действии гистамина и серотонина наблюдаются явления агрегации эритроцитов и тромбоцитов. Другой тип нарушений окружающей соединительной ткани включает в себя изменения периваскулярного транспорта интерстициальной жидкости вместе с растворенными в ней веществами, образования и транспорта лимфы. В соответствии с классической теорией Стерлинга (1909) переход жидкости и растворенных в ней веществ из крови в ткани осуществляется через полупроницаемую мембрану капиллярных сосудов под влиянием фильтрационного давления (ФД): ФД = (ГДК + ОДТ) – (ГДТ + ОДК), где ФД – фильтрационное давление; ГДК – гидродинамическое давление крови на стенку капиллярных сосудов (в артериальном капиллярном сосуде ГДК составляет – 32,5 мм рт. ст.); ОДТ – онкотическое давление ткани (4,5 мм рт. ст.); ГДТ – гидродинамическое давление ткани (3 мм рт. ст.); ОДК – онкотическое давление крови (25 мм рт. ст.). Следовательно, в артериальном капиллярном сосуде эффективное фильтрационное давление составляет 9 мм рт. ст., которое и определяет переход жидкости из крови в ткани. В венозном отрезке капилляров и в венулах гидродинамическое давление крови вследствие частичного перехода жидкости в интерстиций значительно снижается (до 17,5 мм рт. ст.). В результате этого ФД = (17,5 + 4,5) – (3 + 25) = -6 мм рт. ст., что и обусловливает частичную резорбцию жидкости из ткани в кровь. Кроме того, часть интерстициальной жидкости расходуется на образование лимфы и поступает в лимфатические сосуды. Эти представления Стерлинга о механизмах транспорта жидкости в последующем были существенным образом дополнены механизмами проницаемости стенки микрососудов (см. выше). С учетом описанных механизмов можно рассматривать нарушение процессов транссудации и резорбции межтканевой жидкости. Усиление транссудации жидкости наблюдается при увеличении гидродинамического давления крови на стенки микрососудов (наиболее частой причиной этого является застой крови местного характера или вызванный общей недостаточностью кровообращения); при уменьшении онкотического давления крови (основными причинами являются снижение продукции плазменных белков, прежде всего альбуминов, например, при голодании, при воспалительных и дистрофических изменениях в паренхиме печени, при расстройствах пищеварения и кишечного всасывания; значительная потеря белков при обширных ожогах, энтероколите, геморрагии, лимфоррагии, а также при заболеваниях почек воспалительной и дистрофической природы). При задержке ионов натрия в организме в связи с первичным или вторичным гиперальдостеронизмом (см. раздел XXIV – "Патологическая физиология эндокринной системы") накопление жидкости в интерстициальном пространстве обусловлено не только увеличенной транссудацией, но и перемещением ее из внутриклеточного пространства с целью выравнивания осмотической концентрации электролитов. Увеличение транссудации белков и межтканевой жидкости через стенку микрососудов бывает связано с резким повышением сосудистой проницаемости под действием воспалительных агентов (мембраногенный механизм). Особенностью последнего является более высокая концентрация белков в интерстициальной жидкости (1,5 – 2 %) по сравнению с нормой (0,3 – 1,5 %). Как следует из рис. 11.3, из 20 л фильтрата, образующихся из плазмы за сутки, 16 – 18 л резорбируется в венозных капиллярных сосудах и венулах, остальное количество фильтрата (2 – 4 л) и практически вся масса белков (80 – 200 г) расходуются на образование лимфы и возвращаются в кровь по лимфатической системе. Благодаря этому предотвращается накопление жидкости в тканях. 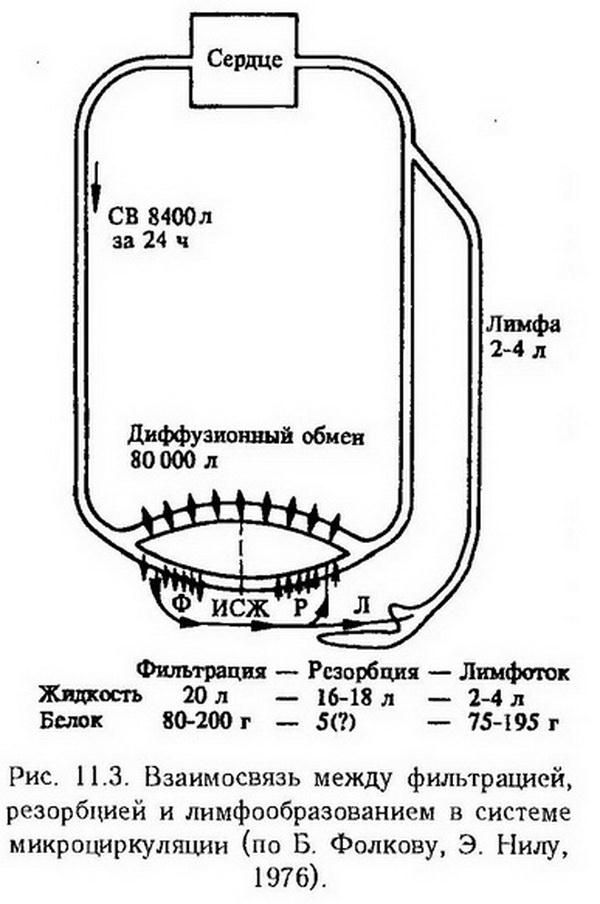 В условиях патологии, вследствие недостаточности механизмов резорбции межтканевой жидкости в кровь или вследствие уменьшения ее притока в лимфатические капилляры, определенная часть жидкости задерживается в тканях, способствуя развитию отека (см. раздел XIV, "Отек"). Нарушение резорбции жидкости в венозной части капилляра и посткапиллярной венуле чаще всего является следствием повышения тканевого коллоидно-осмотического давления, в меньшей степени обусловлено изменениями других параметров уравнения Старлинга. Кроме рассмотренного выше мембраногенного механизма, к повышению тканевого коллоидно-осмотического давления могут привести задержка белков в интерстиции вследствие нарушения выведения их в лимфатическую систему, а также расщепление крупных белковых молекул на более мелкие под действием протеолитических ферментов тканевого происхождения и высвобождающихся из лейкоцитов при воспалении. Наконец, регионарные особенности строения периваскулярной соединительной ткани, различные пространственные отношения между специализированными клетками и микрососудами могут существенным образом влиять на транспорт веществ, в том числе и белков, через интерстиции. Допускают, что коллагеновые волокна играют роль своеобразных "фибропроводов" в осуществлении преимущественного, или избирательного, транспорта веществ через интерстиции в направлении к специализированным клеткам и лимфатическим капиллярам, с одной стороны, и к посткапиллярным венулам, с другой. Очевидно, что в условиях патологии при повреждении тканей, для которого характерны дезорганизация волокнистых структур и нерегулируемое новообразование их, нарушение нормальных путей перикапиллярного и интерстициального транспорта веществ и уровня резорбции интерстициальной жидкости в целом может приобретать еще более выраженный характер. Описанные выше механизмы нарушения транссудации и резорбции межтканевой жидкости были положены в основу современных представлений о недостаточности лимфатической системы и ее классификации. Под недостаточностью лимфатической системы (лимфообращения) следует понимать состояние, при котором лимфатические сосуды не выполняют свою основную функцию – осуществление постоянного и эффективного дренажа интерстиция. В соответствии с классификацией И. Русньяк, М. Фелди и Д. Сабо (1957) различают следующие формы недостаточности лимфообращения. 1. Механическая недостаточность. При данной форме течение лимфы затруднено в связи с наличием органических (сдавление опухолью, рубцом, экстирпация лимфатических узлов и сосудов, облитерация лимфатических сосудов при их воспалении, тромбозе и др.) или функциональных причин (повышение давления в магистральных венозных сосудах, спазм лимфатических сосудов, недостаточность клапанов лимфатических сосудов, прекращение мышечных сокращений – "акинетическая недостаточность"). 2. Динамическая недостаточность (объем транссудации межтканевой жидкости превышает возможность лимфатической системы обеспечивать эффективный дренаж межуточной ткани). 3. Резорбционная недостаточность, обусловленная структурными изменениями межуточной ткани, накоплением белков и осаждением их патологических видов в интерстиции и др. Основными клиническими и патофизиологическими проявлениями недостаточности лимфообращения в острой стадии являются отек, накопление белков и продуктов их распада в межуточной ткани и развитие фиброза, склероза в хронической стадии. |
