зайко. Н. Н. Зайко Патологическая физиология Введение Предмет и задачи патологической физиологии Патологическая физиология есть наука, изучающая жизнедеятельность больного организма. Программа
 Скачать 7.32 Mb. Скачать 7.32 Mb.
|
|
Глава 12. Воспаление Воспаление – типический патологический процесс, который развивается при повреждении тканей и проявляется нарушением кровообращения, изменением крови и соединительной ткани в виде альтерации, экссудации и пролиферации. В этот, преимущественно местный, процесс в той или иной мере вовлекается весь организм и прежде всего такие системы, как иммунная, эндокринная и нервная. Возникнув на ранних этапах эволюции, этот процесс постепенно меняет свой характер, усложняется, но в нем всегда можно обнаружить два качества. С одной стороны – это повреждение с угрозой для органа и даже для всего организма, а с другой – это процесс благоприятный, помогающий организму в борьбе за выживание. Таким образом, воспаление в истории животного мира сформировалось как двуединый процесс, в котором имеются и всегда действуют элементы защитные и вредные элементы, опасные, требующие вмешательства врача. Основные признаки воспаления. Этот патологический процесс был известен врачам всегда. Описание его признаков можно найти в древних книгах. Цельс и Гален свели все разнообразие этих признаков к пяти кардинальным: tumor, rubor, calor, dolor, functio laesa (рис. 12.1). Хотя со времен Цельса и Галена прошли столетия, но ученые и сегодня стараются глубже понять, как и почему на месте воспаления образуется припухлость, каковы механизмы появления красноты и жара, почему возникает боль и как, в конце концов, нарушается функция воспаленного органа. 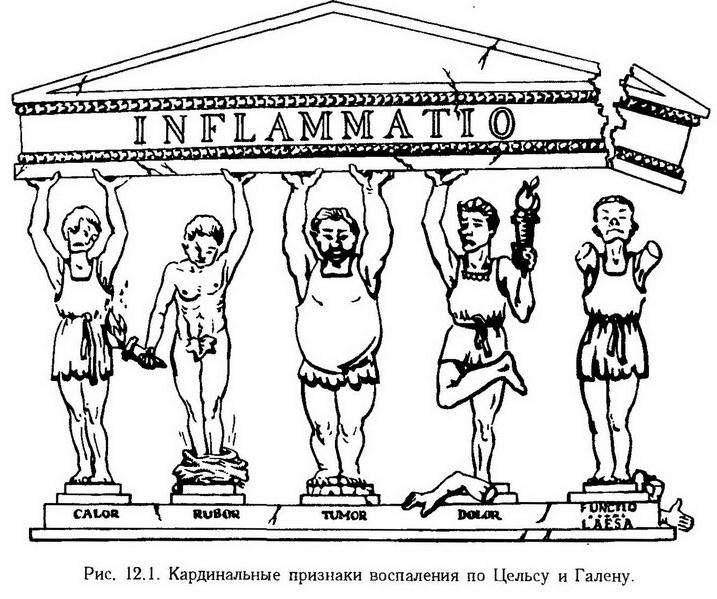 Экспериментальное моделирование воспаления. Воспаление является важной проблемой и предметом изучения всех отраслей медицины, различающихся лишь методами исследования. Например, врач-терапевт наблюдает течение воспаления легких (пневмонии) у постели больного, патологоанатом – при вскрытии трупа, а патофизиолог – в эксперименте на животном. Ученик Вирхова Конгейм (1867) впервые изучил в эксперименте на лягушке кровообращение в брыжейке при воспалении, установив при этом все стадии его от гиперемии до стаза. Он также описал процесс миграции лейкоцитов через сосудистую стенку. Экспериментальная модель, предложенная Конгеймом, широко используется и в настоящее время на практических занятиях со студентами (опыт Конгейма) и в научных исследованиях. В изучении воспаления особую роль сыграли эксперименты, поставленные И. И. Мечниковым. Особенность проведенных им исследований заключалась в том, что он рассматривал воспаление с эволюционных позиций. И. И. Мечников был первым, изучившим воспаление в филогенезе, т. е. у животных, стоящих на различных ступенях эволюционного развития. На прозрачной личинке морской звезды, представителе беспозвоночных, он открыл явление фагоцитоза и отвел ему основную роль в динамике воспаления. На основании этих наблюдений была построена теория воспаления, которая вошла в науку под названием сравнительно-патологической или эволюционной. В дальнейшем патологи стали широко использовать эволюционный принцип в экспериментальном моделировании, исходя из того, что патологические явления у низших животных, "представляя условия наиболее простые и первобытные, дают ключ к пониманию сложных патологических явлений, входящих в область медицины" (Мечников И. И., 1892). В 1920 г. Е. Л. Кларк и Е. Р. Кларк применили следующую методику. На двух противоположных участках кожи уха кролика удалили эпидермис и на его место вставили диски из слюды. Между дисками находился тонкий слой ткани. В такое прозрачное окошко можно было, непрерывно наблюдать за кровообращением, в том числе и при действии флогогенных (воспалительных) агентов. По этой же методике изучают кровообращение в мозговых оболочках. Позже Селье предложил изучать кровообращение в сосудах защечных мешков хомяка. Раздувая мешки воздухом, можно наблюдать микроциркуляцию крови в них с помощью микроскопа. Предложенная методика позволяет изучать этот процесс и в динамике. В настоящее время для этого сконструированы совершенные микрокинематографические приборы. Важнейшим этапом в изучении воспаления было применение биохимических методик. Одним из первых их применил Менкин (1948). В настоящее время выделены многие биологически активные вещества-медиаторы воспаления и детально изучено их действие. С помощью электронной микроскопии, ультрацентрифугирования и других методов получены сведения о биологических мембранах, способствующие раскрытию механизма воспалительного отека, проникновения лейкоцитов через сосудистую стенку, скопления их в очаге воспаления и т. д. Эксперимент имеет важное значение еще и потому, что с его помощью были детально изучены и внедрены в клинику многие противовоспалительные средства. Этиология Любой повреждающий агент, который по силе и длительности превосходит адаптационные возможности ткани, может вызвать воспаление. Все флогогенные факторы принято делить на внешние и внутренние (эндогенные). К внешним относятся микроорганизмы (бактерии, вирусы, грибы); животные организмы (простейшие, черви, насекомые), химические вещества (кислоты, щелочи), механические (инородные тела, давление, разрыв) и термические воздействия (холод, тепло), лучевая энергия (рентгеновские, радиоактивные, ультрафиолетовые лучи). К эндогенным относят факторы, возникающие в самом организме в результате другого заболевания. Например, воспаление может возникнуть как реакция на опухоль, желчные или мочевые камни, образовавшийся в сосудах тромб. Причиной воспаления могут стать комплексы антиген- антитело, если они фиксируются в каком-либо органе. Патогенез Из множества патогенетических механизмов воспаления можно выделить несколько, имеющих решающее значение, определяющих начало процесса, его развитие и исход: 1. повреждение от действия флогогенного агента (первичная альтерация); 2. выброс из клеток и образование биологически активных веществ – медиаторов воспаления, освобождение и активация лизосомальных ферментов, действие их на биологические макромолекулы (вторичная альтерация); 3. нарушение микроциркуляции, повышение проницаемости стенки сосудов, экссудация; 4. размножение клеток (пролиферация); 5. ликвидация дефекта. Стадии воспаления В классической патологии было принято выделять три стадии воспаления: 1. альтерацию, 2. экссудацию, 3. пролиферацию. Такое деление сохраняется и в настоящее время. Однако новые исследования и новые факты показали, что указанные стадии не монолитны, между ними нет четких границ (например, альтерация может быть максимально выражена на стадии гнойной экссудации, а нарушения микроциркуляции могут быть неодинаковыми в одно и то же время в различных участках очага воспаления). Поэтому в зависимости от процесса, преобладающего на определенном этапе воспаления, выделяют следующие стадии (рис. 12.2): 1. Стадия альтерации (повреждения): • Первичная альтерация • Вторичная альтерация 2. Стадия экссудации и эмиграции 3. Стадия пролиферации и репарации: • Пролиферация • Завершение воспаления. Первичная альтерация. Воспаление всегда начинается с повреждения ткани. После воздействия этиологического фактора в клетках происходят структурные, а также метаболические изменения. Они бывают разными в зависимости от силы повреждения, от вида клеток (степени зрелости) и т. д. Одни клетки гибнут, другие продолжают жить, третьи даже активируются. Последние будут играть особую роль в дальнейшем. Вторичная альтерация. Если первичная альтерация является результатом непосредственного действия воспалительного агента, то вторичная не зависит от него и может продолжаться и тогда, когда этот агент уже не оказывает влияния (например, при лучевом воздействии). Этиологический фактор явился инициатором, пусковым механизмом процесса, а далее воспаление будет протекать по законам, свойственным ткани, органу, организму в целом. Действие флогогенного агента проявляется прежде всего на клеточных мембранах, в том числе на лизосомах. Это имеет далеко идущие последствия. Заключенные в лизосомах ферменты реактивны. Но как только лизосомы повреждаются и ферменты выходят наружу, они активируются и усугубляют то разрушительное действие, которое оказал этиологический фактор. Можно сказать, что первичная альтерация – это повреждение, нанесенное со стороны, а вторичная альтерация – это самоповреждение. Здесь следует отметить, что вторичная альтерация представляет собой не только повреждение и разрушение. Некоторые клетки действительно гибнут, другие же не только продолжают жить, но и начинают вырабатывать биологически активные вещества, вовлекая в динамику воспаления иные клетки как в зоне воспаления, так и вне ее. Клетки воспаления. Макрофаги. Установлено, что активированные макрофаги синтезируют особое вещество, получившее название интерлейкин-1 (ИЛ-1). Оно выделяется макрофагами в среду и распространяется по всему организму, где оно находит свои мишени, которыми являются миоциты, синовиоциты, гепатоциты, костные клетки, лимфоциты, нейроциты. По-видимому, на мембранах этих клеток имеются специфические рецепторы, благодаря которым ИЛ-1 действует именно на них, а не на другие клетки. Действие это стимулирующее и более всего изучено применительно к гепатоцитам и лимфоцитам. Действие ИЛ-1 универсально, т. е. срабатывает при любом инфекционном (воспалительном) заболевании, причем в самом начале, и таким образом дает сигнал указанным органам включиться в воспалительный (инфекционный) процесс. Есть основание предполагать, что характерные для ранних этапов заболевания симптомы (головная боль, боль в мышцах и суставах, сонливость, лихорадка, лейкоцитоз и увеличение содержания белков, в том числе иммуноглобулинов) объясняется именно действием ИЛ-1 (рис. 12.3). 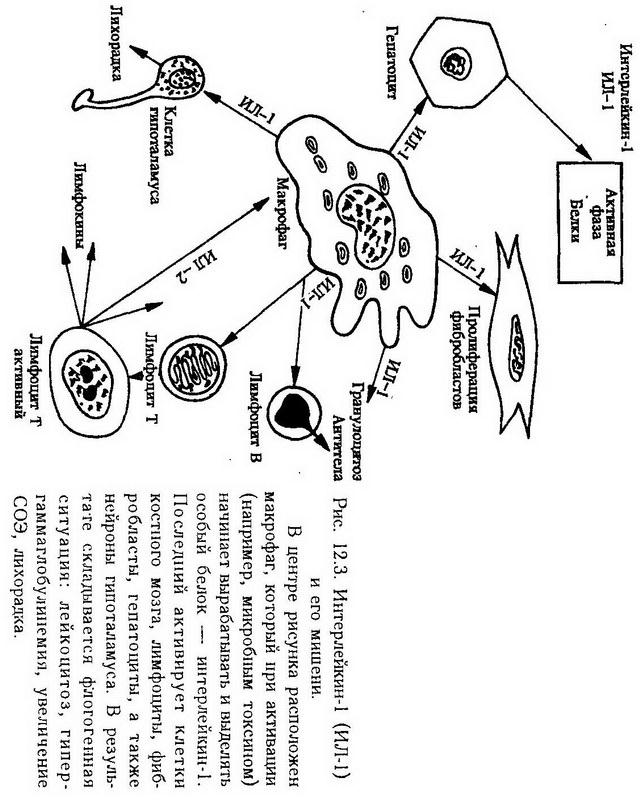 Роль макрофагов не ограничивается секрецией ИЛ-1. В этих клетках синтезируется еще целый ряд биологически активных веществ, каждое из которых делает свой вклад в воспаление. К ним относятся: эстеразы, протеазы и антипротеазы; лизосомальные гидролазы – коллагеназа, аластаза, лизоцим, ?-макроглобулин; монокины – ИЛ-1, колониестимулирующий фактор, фактор, стимулирующий рост фибробластов; антиинфекционные агенты – интерферон, трансферрин, транскобаламин; компоненты комплемента: С1, С2, СЗ, С4, С5, С6; дериваты арахидоновой кислоты: простагландин Е2, тромбоксан А2, лейкотриены. Не следует забывать также важнейшую функцию макрофагов – фагоцитоз. Тучные клетки. Роль этих клеток в воспалении заключается в том, что они при повреждении выбрасывают содержащиеся в их гранулах гистамин и гепарин. А так как эти клетки в большом количестве располагаются по краям сосудов, то и действие указанных веществ проявится прежде всего на сосудах (гиперемия). Макрофаги и лаброциты находятся в тканях постоянно (клетки-резиденты). Другие клетки воспаления проникают в зону воспаления со стороны (клетки-эмигранты). К ним относятся полиморфно-ядерные нейтрофилы, эозинофилы и лимфоциты. Нейтрофилы. Главная функция этих клеток – фагоцитоз. Они выселяются из костного мозга в кровь, эмигрируют из сосудов и в больших количествах скапливаются в воспаленной ткани. И активное их размножение, и миграция, и фагоцитоз подвержены регулирующему влиянию биологически активных веществ (тканевых, системных, организменных). Действие их проявляется, однако, только тогда, когда на клетках имеются рецепторы, специфически реагирующие с медиатором воспаления: гистамином, адреналином, глюкокортикоидами, гамма-глобулинами и т. д. В цитоплазме нейтрофилов имеется два типа гранул: первичные азурофильные (более крупные) – обычные лизосомы, вторичные, или специфические гранулы мельче, а главное, они содержат другой набор ферментных и неферментных веществ. В первичных гранулах содержатся кислые гидролазы, а кроме того, лизоцим, миелопероксидаза и катионные белки. Вторичные гранулы специфические; содержат щелочную фосфатазу, лактоферрин и лизоцим. Все это важно для понимания участия нейтрофилов в воспалении (см. ниже). Эозинофилы. Роль эозинофилов в воспалении определяется рецепторами, расположенными на поверхности, и ферментами, находящимися внутри. На наружных мембранах имеются рецепторы для комплемента, иммунных комплексов, содержащих IgE, IgG. Из ферментов следует упомянуть гистаминазу и арилсульфатазу В. Важную роль играет большой катионный белок, который способен нейтрализовать гепарин, повреждать личинки ряда паразитов. Миграция и активация эозинофилов происходит под влиянием комплемента (С5а и С5-С7), пептидов тучных клеток, ПГД, веществ, продуцируемых гельминтами. Тромбоциты. Роль тромбоцитов (кровяных пластинок) в воспалении состоит главным образом в том, что они имеют ближайшее отношение к микроциркуляции. Наверное, это самые постоянные и самые универсальные участники воспаления. В них содержатся вещества, влияющие на проницаемость сосудов, на их сократимость, на рост и размножение клеток, а главное – на свертываемость крови. Лимфоциты. Эти клетки играют роль при любом воспалении, но особенно при иммунном. Фибробласты. Действие фибробластов проявляется в последней стадии процесса, когда в очаге воспаления увеличивается число этих клеток, оживляется синтез в них коллагена и гликозамингликанов. В суммарном виде данные о клетках воспаления представлены в табл. 2. Таблица 2. Клетки воспаления
Медиаторы воспаления. Медиаторами воспаления называются биологически активные вещества, которые синтезируются в клетках или в жидкостях организма и оказывают непосредственное влияние на воспалительный процесс. Клеточные медиаторы были рассмотрены выше (см. табл. 2). Гуморальные медиаторы воспаления синтезируются в плазме и в тканевой жидкости в результате действия соответствующих ферментов. Первоначальной причиной появления (или увеличения количества) этих веществ является альтерация. Именно в результате повреждения клеток освобождаются и активируются лизосомальные ферменты, которые активируют другие ферменты, в том числе содержащиеся в плазме, в результате чего возникает целый ряд биохимических реакций. Поначалу они носят хаотический характер ("пожар обмена"), а продукты расщепления не имеют физиологического значения, нередко токсичны. Постепенно, однако, в этом процессе появляется определенный биологический смысл. Протеолитические ферменты расщепляют белки не до конца, а только до определенного этапа (ограниченный протеолиз), в результате чего образуются специфические вещества, действующие целенаправленно и ызывающие специфический патофизиологический эффект. Оказалось, что одни из них действуют преимущественно на сосуды, повышая их проницаемость, другие – на эмиграцию лейкоцитов, третьи – на размножение клеток. Первым обнаружил определенный "порядок" и закономерность в процессе воспаления В. Менкин. В воспалительном экссудате он выявил и индивидуализировал химические вещества и сопоставил с ними определенные слагаемые воспаления: гиперемию, лейкоцитоз, хемотаксис. Одним из клеточных медиаторов воспаления является гистамин. Он содержится в гранулах тканевых базофилов (тучные клетки или лаброциты) в комплексе с гепарином и химазой в неактивной форме. В. свободном состоянии он оказывает расширяющее действие на мелкие сосуды (капилляры, венулы), увеличивая проницаемость их стенки. В малых дозах гистамин расширяет артериолы, в больших – суживает венулы. Выброс гистамина осуществляется вместе с выбросом в окружающую среду всех или части гранул тканевых базофилов при их дегрануляции. Этому может способствовать воздействие тепла, ионизирующего или ультрафиолетового излучения, растворов солей, кислот, белков, синтетических полимеров и мономеров, поверхностно-активных веществ. Дегрануляция всегда наблюдается при иммунных реакциях, т. е. при взаимодействии антигена с антителом на поверхности тканевых базофилов. Другим клеточным медиатором воспаления является серотонин. У человека он содержится в тромбоцитах, хромаффинных клетках слизистой оболочки кишок, а также в некоторых нервных структурах. При разрушении клеток серотонин поступает в среду, вызывая повышение проницаемости сосудов. Тканевые базофилы вырабатывают также гепарин, роль которого при воспалении заключается в том, что он препятствует образованию фибрина на внутренней оболочке капилляров, способствуя также увеличению проницаемости их стенки. Лимфокины – вещества белковой природы, образующиеся в лимфоцитах, также относятся к медиаторам воспаления. Описано более десяти различных лимфокинов. При воспалении наибольшее значение имеют три из них: фактор, угнетающий эмиграцию макрофагоцитов, фактор, активирующий макрофагоциты, фактор хемотаксиса. В клетках крови (лейкоцитах, тромбоцитах и др.) образуется еще одна группа веществ, играющих важную роль в динамике воспаления. Это простагландины. Источником их образования являются фосфолипиды клеточных мембран. Нарушение строго упорядоченной структуры фосфолипидов в мембране делает их доступными действию фосфолипазы А2, в результате чего отщепляется арахидоновая кислота. С нее начинается каскад химических реакции, идущих в двух направлениях. Сели на арахидоновую кислоту действует фермент циклоксигеназа, то в итоге образуются простагландины (ПГЕ2, ПГФ2, ПГИ2) или простациклины (ПГИ2), если же свою активность проявляет прежде всего липоксигеназа, то получаются лейкотриены. Дальнейшее превращение простагландинов происходит под влиянием тромбоксансинтетазы, в результате чего образуется тромбоксан А. Последний вызывает сужение сосудов, агрегацию тромбоцитов, тромбоз, отек, боль. Другой путь биосинтеза простагландинов заключается в том, что под влиянием простациклинсинтетазы образуется простациклин (ПГИ2). Этот процесс совершается в эндотелиоцитах, где и находится указанный фермент. Он оказывает действие, противоположное тромбоксану: расширяет сосуды и подавляет агрегацию тромбоцитов. Таким образом, арахидоновая кислота дает начало двум веществам с противоположным действием, причем выбор одного из путей биосинтеза, по-видимому, связан с состоянием эндотелия. В неповрежденных эндотелиальных клетках содержится достаточно простациклинсинтетазы и весь ПГГ2 превращается в простациклин. Если же эндотелий поврежден, то этого фермента будет недоставать и потому часть ПГГ превращается в тромбоксан 2. Арахидоновый каскад представляет интерес еще и потому, что в ходе его образуются свободные радикалы, которые могут повреждать клеточные мембраны, в том числе и лизосом. Лейкотриены оказывают хемотаксическое и хемокинетическое (нецеленаправленное движение) действие, повышают проницаемость, вызывают сокращение гладких мышц, индуцируют образование тромбоксанов. К медиаторам воспаления относятся также циклические нуклеотиды, которые правильнее было бы назвать не медиаторами, а модуляторами, так как они не создают полной картины воспаления, а могут лишь в той или иной степени преобразовывать ее. Циклические нуклеотиды обусловливают эффект действия других медиаторов, выделение клетками лизосомальных ферментов и др. Отмечено противоположно направленное действие цАМФ и цГМФ. Так, первый подавляет выделение гистамина и лизосомальных ферментов, а второй, наоборот, способствует ему. Из гуморальных медиаторов воспаления наибольшее значение имеют кинины – группа вазоактивных полипептидов, образующихся в результате каскада биохимических реакций, начинающихся с активации фактора Хагемана (рис. 12.4). Соприкосновение с поврежденной поверхностью или изменение внутренней среды (температура, рН) приводит к тому, что этот фактор становится активным и действует на находящийся в плазме прекалликреин, превращая его в калликреин. Последний в свою очередь влияет на ?2-глобулины, отщепляя от них полипептидную цепочку, состоящую из 9 (брадикинин) или 10 аминокислотных остатков (каллидин). Плазменные кинины оказывают непосредственное влияние на тонус и проницаемость сосудистой стенки, вызывая расширение прекапиллярных артериол и увеличивая проницаемость стенки капилляров. Кроме того, они обусловливают типичные для воспаления зуд и боль. Медиаторы калликреин-кининовой системы при воспалении влияют на реологические свойства крови, т. е. на ее способность находиться в жидком и текучем состоянии. Из рис.12.4 видно, что активный фактор Хагемана может инициировать процессы кининообразования, гемокоагуляции и фибринолиза. Выпадение нитей фибрина и образование тромбов в зоне воспаления определенным образом связаны с состоянием калликреин-кининовой системы. 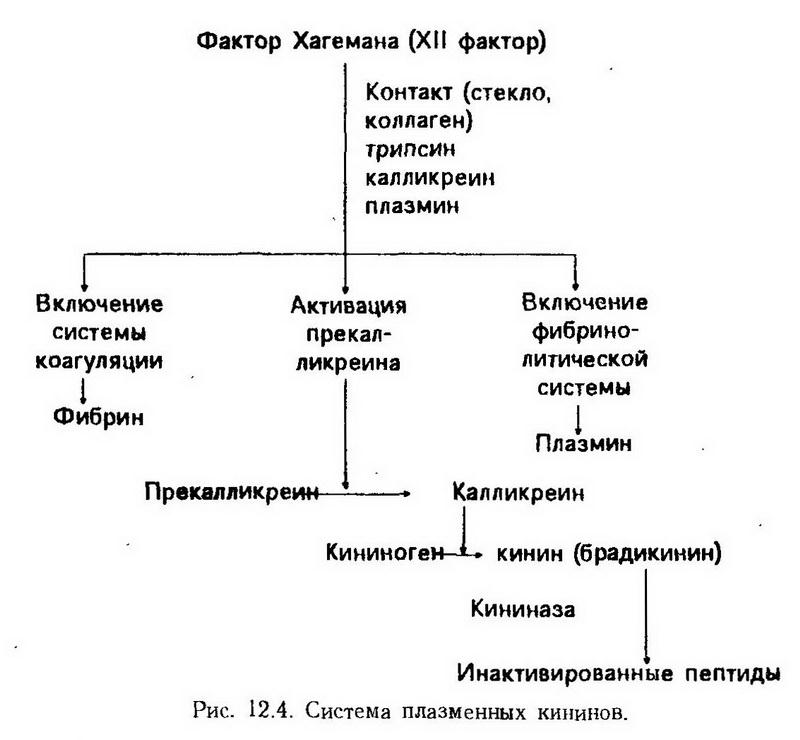 К гуморальным медиаторам воспаления относятся компоненты комплемента. Известно, что последний является важным защитным фактором организма, но вместе с этим он может способствовать повреждению собственных тканей, что бывает при воспалении, особенно иммунном. Объясняется это тем, что из 9 компонентов комплемента 3 имеют ближайшее отношение к рассматриваемому процессу. Так, комплемент С5 обладает способностью фиксироваться на сенсибилизированных и несенсибилизированных антителами клетках и разрушать их мембраны. Фрагменты СЗа и С5а, а также трехмолекулярный комплекс С567 вызывают хемотаксис лейкоцитов. Наконец, клетки, нагруженные фрагментами С36, становятся объектом активного фагоцитоза. Характеристика основных медиаторов воспаления приведена в табл. 3. Таблица 3. Медиаторы воспаления
Сосудистые расстройства. Экссудация и эмиграция. Воспаление характеризуется нарушением местного крово- и лимфообращения, прежде всего микроциркуляции. Микроциркуляцией принято называть движение крови в терминальном сосудистом русле (в артериолах, метартериолах, капиллярных сосудах и венулах), а также транспорт различных веществ через стенку этих сосудов. Микроциркуляцию удобно изучать с помощью опыта Конгейма (рис. 12.5). При микроскопическом исследовании можно наблюдать, как сразу же после действия раздражителя (травма при извлечении кишки) возникает спазм артериол, который носит рефлекторный характер и скоро проходит. 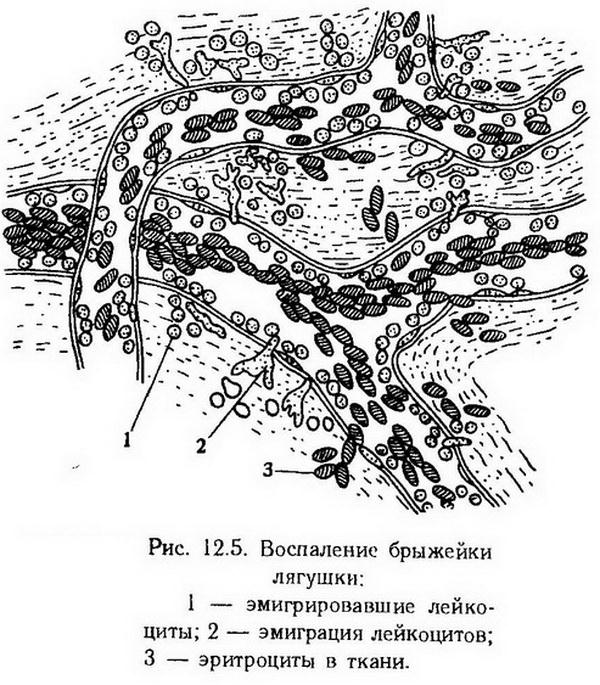 Артериальная гиперемия Вслед за этим развивается артериальная гиперемия. Она является результатом образования в воспаленном очаге большого количества вазоактивных веществ – медиаторов воспаления, которые расслабляют мышечные элементы стенки артериол и прекапилляров. Это приводит к увеличению притока артериальной крови, ускоряет ее движение, открывает ранее не функционировавшие капилляры, повышает в них давление. Кроме того, приводящие сосуды расширяются в результате паралича вазоконстрикторов, сдвига рН среды в сторону ацидоза, накопления ионов калия, снижения эластичности окружающей сосуды соединительной ткани. Венозная гиперемия Через 30 – 60 мин после начала эксперимента картина воспаления постепенно меняется: артериальная гиперемия сменяется венозной. При этом скорость движения крови уменьшается, меняется характер кровотока. Так, если при артериальной гиперемии клетки крови располагались главным образом в центре сосуда (осевой ток), а у стенок находились плазма и небольшое число лейкоцитов (плазматический ток), то теперь такое разделение нарушается. Изменяются реологические свойства крови. Она становится более густой и вязкой, эритроциты набухают, образуя агрегаты, т. е. беспорядочные скопления, которые медленно движутся или совсем останавливаются в сосудах малого диаметра. Развитие венозной гиперемии объясняется действием ряда факторов, которые можно разделить на три группы: 1. факторы крови, 2. факторы сосудистой стенки, 3. факторы окружающих тканей. К факторам, связанным с кровью, относится краевое расположение лейкоцитов, набухание эритроцитов, выход жидкой части крови в воспаленную ткань и сгущение крови, образование тромбов вследствие активации фактора Хагемана, уменьшения содержания гепарина. Влияние факторов сосудистой стенки на венозную гиперемию проявляется набуханием эндотелия, в результате чего просвет мелких сосудов еще больше сужается. Измененные венулы теряют эластичность и становятся более податливыми сдавливающему действию инфильтрата. И, наконец, проявление тканевого фактора состоит в том, что отечная ткань, сдавливая вены и лимфатические сосуды, способствует развитию венозной гиперемии. С развитием престатического состояния наблюдается маятникообразное движение крови – во время систолы она движется от артерий к венам, во время диастолы – в противоположном направлении. Наконец, движение крови может полностью прекратиться и развивается стаз, следствием которого могут быть необратимые изменения клеток крови и тканей. 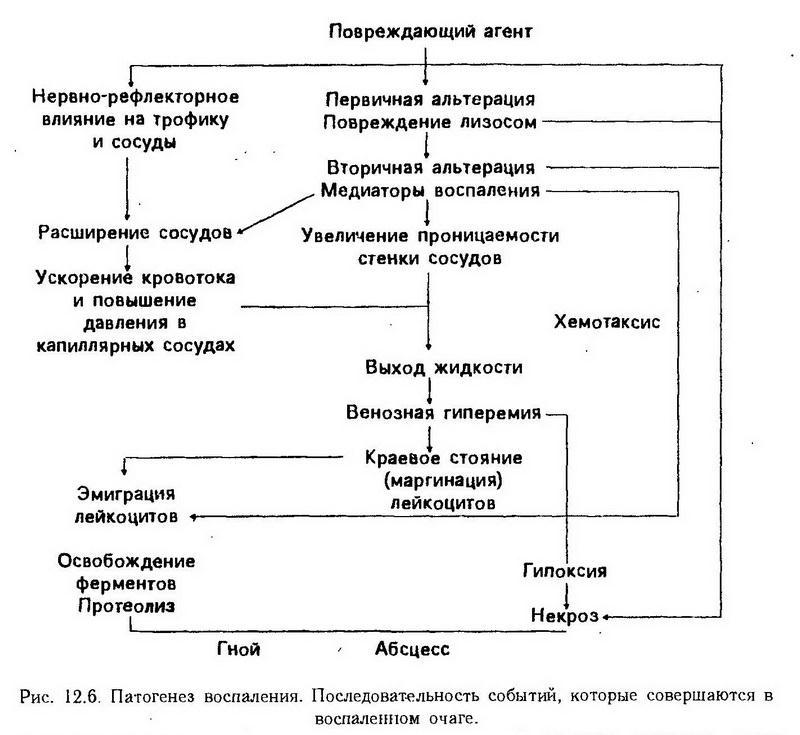 Значение воспаления для организма Как и всякий патологический процесс, воспаление по своей сущности процесс противоречивый. В нем сочетаются и мобилизация защитных сил организма, и явления повреждения ("полом"). Возникнув в филогенезе как явление приспособительное, воспаление сохранило это свойство и у высших животных. Организм защищается от воздействия чуждых и вредных ему факторов путем отграничения воспалительного очага от всего организма. Такое действие предотвращает распространение и генерализацию воспалительного процесса, сосредоточивая борьбу с вредным агентом в одном очаге. Воспаленная зона не только фиксирует все, что происходит в ней, но и поглощает токсические вещества, циркулирующие в крови. Это объясняется формированием вокруг очага воспаления своеобразного барьера с односторонней проницаемостью. В начале такой барьер создается путем закупорки отводящих лимфатических и кровеносных сосудов и блокады внесосудистого тканевого транспорта. Далее он окончательно формируется вследствие размножения соединительно-тканных клеток на границе между здоровой и пораженной тканью. Защитная роль воспалительного барьера наглядно демонстрируется в эксперименте со стрихнином, смертельная доза которого не приводит к гибели животного, если ее ввести в воспалительный очаг. В очаге воспаления создаются неблагоприятные условия для жизни микроорганизмов. В этом отношении главную роль играют фагоциты и специфические антитела, а также ферменты и основные белки. Целебные свойства воспаления особенно отчетливо проявляются в стадии пролиферации и регенерации. Однако все изложенное выше отражает только одну (положительную) сторону воспаления. Вторая, противоположная, заключается в том, что воспаление всегда несет в себе элемент разрушения. Борьба с "агрессором" а зоне воспаления неизбежно сочетается с гибелью собственных клеток. В некоторых случаях начинает преобладать альтерация, что приводит к гибели ткани или целого органа. Экссудация может вызвать нарушение питания ткани,ее ферментативное расплавление, гипоксию и общую интоксикацию. И. И. Мечников отмечал, что "целительная сила природы, главный элемент которой составляет воспалительная реакция, вовсе не есть еще приспособление, достигшее совершенства". Представление о воспалении, как о патологическом процессе, в котором "защитительное" и "собственно патологическое" находятся в единстве и борьбе, соответствует действительности. Оно же дает врачу и руководство к действию. 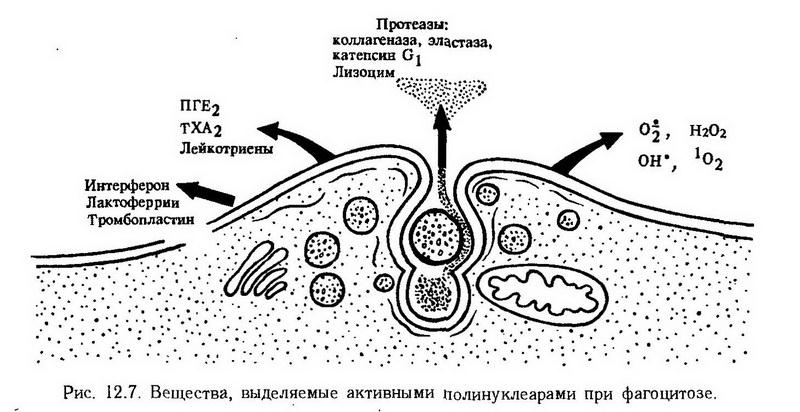 Воспаление и иммунная реактивность организма Между выраженностью основных признаков воспаления и силой раздражителя имеется- определенная зависимость: с повышением агрессивности флогогенного фактора усиливается и ответ. Однако известно, что такая зависимость наблюдается далеко не всегда. Один и тот же возбудитель у разных людей может вызывать совершенно разную реакцию. Так, например, из детей, заразившихся дифтерией из одного и того же источника, одни погибают от тяжелой интоксикации, а у других болезнь проявляется сравнительно слабыми воспалительными изменениями. В связи с этим возникло представление о том, что воспаление зависит не только от возбудителя, но и от реактивности организма. Если реакция организма не выходит за пределы наблюдаемой наиболее часто, то такое воспаление называют нормэргическим (Рессле). Если воспалительный агент вызывает лишь слабую затяжную реакцию с преобладанием альтерации, то воспаление является гипоэргическим. Это наблюдается, например, при голодании. Однако в некоторых случаях воспаление протекает настолько бурно, что возникает несоответствие между силой раздражителя и ответной реакцией (местной и общей) организма. Такое воспаление называют гиперэргическим. Его особенность заключается в том, что оно развивается на "иммунной (аллергической) основе" (А. И. Струков). Как было сказано выше, комплекс антиген-антитело может стать флогогеном. Это возможно в случаях, когда в сенсибилизированный организм попадает, казалось бы, индифферентный агент, например лошадиная сыворотка, которая может вызвать бурную ответную реакцию с явлениями некроза (см. раздел VII – "Аллергия"). Такое воспаление сочетается с индукцией гиперчувствительности немедленного или замедленного типа. Воспаление при гиперчувствительности немедленного типа возникает вследствие цитопатического и лейкотаксического действия, оказываемого комплексами антиген-антитело. Повреждение клеток и хемотаксис усиливаются еще из-за того, что под влиянием иммунных комплексов активируется система комплемента. В месте фиксации этих комплексов (чаще посткапиллярные венулы) активируются ферменты, происходит резкое нарушение микроциркуляции, возникают гипоксия и некроз. Воспаление на фоне гиперчувствительности замедленного типа развивается вследствие того, что в ткани, содержащей антиген (или аутоантиген), скапливаются Т-лимфоциты-киллеры, повреждающие клетки своими лимфокинами (см. раздел VII – "Аллергия"). 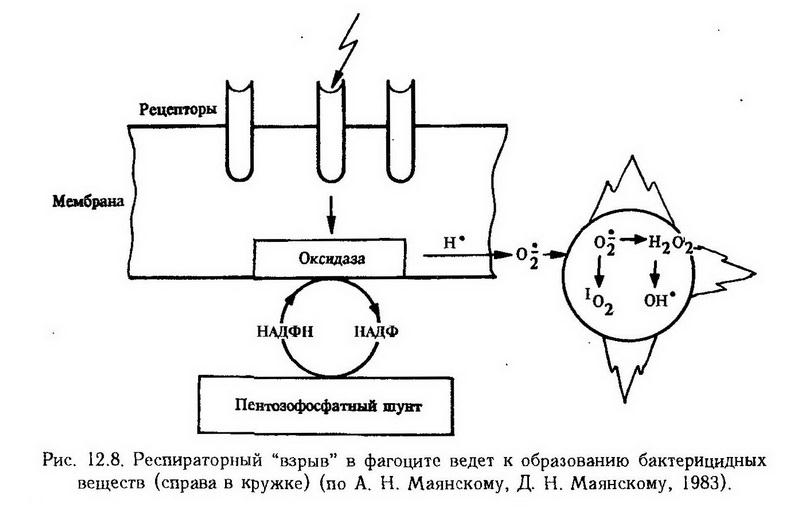 Классификация воспаления В зависимости от характера доминирующего местного процесса (альтерация, экссудация или пролиферация) различают три вида воспаления. При альтернативном воспалении преобладают повреждение, дистрофия некроз. Оно наблюдается чаще всего в паренхиматозных органах при инфекционных заболеваниях, протекающих с выраженной интоксикацией (творожистый распад надпочечных желез или легких при туберкулезе). Экссудативное воспаление характеризуется выраженным нарушением кровообращения с явлениями экссудации и эмиграции лейкоцитов. По характеру экссудата различают серозное, гнойное, геморрагическое, фибринозное, смешанное воспаление. Распространение воспаления на слизистые оболочки, например дыхательных путей или пищевого канала, и большое содержание слизи в экссудате свидетельствуют о катаральном воспалении. Пролиферативное, или продуктивное воспаление характеризуется доминирующим размножением клеток гематогенного и гистогенного происхождения. В воспаленной зоне возникают клеточные инфильтраты, которые В Зависимости от характера скопившихся клеток подразделяют на круглоклеточные (лимфоциты, гистиоциты), плазмоклеточные, эозинофильно-клеточные, эпителиоидно-клеточные, макрофагальные инфильтраты. При воспалении клетки с законченным циклом развития (зрелые) погибают, мезенхимальные же клетки претерпевают трансформацию и дифференциацию, в результате которых образуется молодая соединительная ткань. Она проходит все стадии созревания, вследствие чего орган или часть его пронизывается соединительно-тканными тяжами, что на поздних стадиях воспаления может привести к циррозу. Влияние на воспаление нервных и гуморальных факторов На воспалительный процесс оказывает влияние нервная система. Это подтверждается многочисленными опытами, а также клиническими наблюдениями. Так, после перерезки тройничного нерва у кролика развивается кератит. При повреждений верхних узлов симпатического ствола может возникнуть пневмония (А. В. Тонких). Повреждение инородным телом области серого бугра мозга приводит к обширным воспалительным поражениям кожи и слизистой оболочки, что объясняется изменением трофики тканей, а вместе с этим снижением их устойчивости к действию повреждающих агентов (А. Д. Сперанский). Наконец, известны случаи, когда явные признаки воспаления наблюдались у людей, которым под гипнозом внушали, что к коже прикладывался раскаленный предмет. Разумеется, от внушения в полной форме воспалительный процесс не может развиться. Воспалительная реакция организма появилась на ранних этапах эволюционного развития и в дальнейшем совершенствовалась по мере его усложнения с образованием и развитием нервной системы. Кроме того, замечено, что воспаление интенсивнее протекает при гипертиреоидизме и отличается вялостью течения при микседеме. При сахарном диабете часто наблюдается фурункулез. Но особенно сильно влияют на течение воспаления гормоны гипофиза и надпочечных желез. При этом одни гормоны коркового вещества надпочечных желез оказывают противоположное воспалению действие, вследствие чего некоторые из них получили название противовоспалительных (гликокортикоиды), другие – провоспалительных (минералокортикоиды). Кортизол и аналогичные ему гормоны угнетают воспалительную реакцию и потому широко применяются в клинике. Такое действие гликокортикоидов объясняется тем, что они уменьшают число тканевых базофилов, снижают активность гистидин-декарбоксилазы и одновременно усиливают активность фермента, разрушающего гистамин (гистаминаза). Снижается также образование серотонина, вызванное ингибированием кортизолом 5-окситрип-таминдекарбоксилазы. Таким образом, под влиянием кортизола уменьшается выработка двух важных медиаторов воспаления. Противовоспалительное действие гликокортикоидов объясняется также стабилизирующим влиянием на лизосомы и инактивацией содержащейся в них кислой фосфатазы, рибонуклеазы и др. Ингибирующее действие на ферменты проявляется также снижением энергетического потенциала клеток, ограничением их деления и подвижности (эмиграция, фагоцитоз). В последнее время установлено, что гликокортикоиды индуцируют синтез специфических белков (липомодулин, макрокортин), которые действуют как ингибиторы фосфолипазы А2, т. е. блокируют синтез всей группы производных арахидоновой кислоты (простагландинов и лейкотриенов). Провоспалительное действие минералокортикоидов (альдостерон, дезоксикортикостерон) связано с тем, что они повышают проницаемость стенки сосудов, увеличивая экссудацию. Кроме того, под их влиянием ускоряются размножение клеток, образование новых капилляров, синтез основного вещества соединительной ткани. Формирование общей теории воспаления Первая теория воспаления была сформулирована Конгеймом (1887). Он считал, что все клинические признаки воспаления объясняются нарушением микроциркуляции. Расширение приводящих сосудов и прилив артериальной крови в очаг воспаления обусловливают появление жара и покраснения тканей, увеличение проницаемости капилляров – припухлость, образование инфильтрата – сдавление нервов и возникновение боли, а все вместе – нарушение функции. Сосудистая теория Конгейма благодаря своей ясности и простоте получила широкое распространение. Современные электронно- и биомикроскопические исследования дают новое подтверждение ряду положений этой теории. Вторая теория воспаления – биологическая выдвинута И. И. Мечниковым (1892). В его трактовке воспаление характеризуется широким биологическим подходом: оно рассматривается как реакция приспособления и защиты против вредных факторов. Большое значение в механизме борьбы с "агрессором" И. И. Мечников придавал фагоцитозу. Все предшественники И. И. Мечникова рассматривали воспаление как местный процесс. И. И. Мечников охарактеризовал воспаление как процесс, развивающийся на всех уровнях организации организма: клеточном (фагоцитоз), системном (иммунная система), организменном (эволюция воспаления с эволюцией организмов). Следующая обобщающая теория воспаления была выдвинута в связи с широкими физико-химическими и патохимическими исследованиями воспаления. Установив, что при воспалении наблюдаются тканевой ацидоз, осмотическая гипертензия и повышение онкотического давления, Шаде (1923) именно к ним применил знаменитую пентаду древних. Менкин (1948), применив все передовые для того времени методы биологической химии и препаративной техники, выделил специфические для развития воспаления вещества: лейкотаксин, экссудин, пирексин, некрозин, фактор лейкоцитоза и др. Не все из предположений Менкина подтвердились, но он и Шаде заложили основу современной теории воспаления, известной под названием физико-химической или биохимической. В настоящее время патогенез воспаления рассматривается значительно шире. Предпринимается попытка обобщить накопленные данные по этому вопросу и выстроить современную теорию воспаления, необходимую для практического врача (Флори, Цвейфах, А. М. Чернух). | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
