зайко. Н. Н. Зайко Патологическая физиология Введение Предмет и задачи патологической физиологии Патологическая физиология есть наука, изучающая жизнедеятельность больного организма. Программа
 Скачать 7.32 Mb. Скачать 7.32 Mb.
|
|
Глава 13. Опухоли Опухоль – это типический патологический процесс, представляющий собой нерегулируемое беспредельное разрастание ткани, не связанное с общей структурой пораженного органа и его функциями. Опухоль образуется в организме в результате превращения нормальных клеток в опухолевые, в которых нарушается регуляция деления. В таких клетках отсутствует или недостаточно эффективно подавляется клеточное деление, что обусловливает неудержимое размножение опухолевых клеток, или в них начинается самоподдерживающаяся стимуляция деления (аутокринный механизм – деление клетки стимулирует фактор, производимый ею самой). Опухолевая ткань отличается беспредельным ростом. Этот процесс заканчивается только со смертью организма. В культуре ткани рост поддерживается бесконечно долго в отличие от нормальной ткани, в связи с тем, что отсутствует "лимит Хейфлика" (см. 155). Способность опухолевых клеток беспредельно размножаться передается по наследству как доминантный признак соматической наследственности и проявляется не только в организме, но и в культуре опухолевой ткани, а также при трансплантации опухоли. Опухоль растет "сама из себя", т. е. увеличивается в результате размножения даже одной единственной малигнизированной клетки. Опухолевая ткань отличается от исходной ткани, из которой она произошла, по структуре, биохимическим, физико-химическим и другим признакам. Эти изменения выражаютанаплазию – возврат к эмбриональному состоянию, а такжеметаплазию – приобретение свойств другой ткани. Рост опухоли может быть экспансивным и инфильтративным. При экспансивном росте окружающая здоровая ткань по мере роста опухоли раздвигается, при инфильтративном – опухолевые клетки прорастают между нормальными клетками и через сосудистую стенку. Попадая в лимфу или кровь, они переносятся в другие органы и могут образовывать новые очаги опухолевого роста (метастазы). Экспансивный рост характерен для доброкачественных опухолей, а инфильтрирующий с образованием метастазов – для злокачественных опухолей. Экспериментальное воспроизведение опухоли Несмотря на то что опухоль, как заболевание, известна давно, ее экспериментальное воспроизведение долго не удавалось. Вот почему воспроизведение в эксперименте этого патологического процесса стало в начале нынешнего века крупным научным достижением. Экспериментальные модели опухоли дают возможность выяснить причины, изучить патогенез опухолевого процесса, разработать методы его профилактики и лечения. Методами экспериментального моделирования опухоли являются ее индукция, эксплантация и трансплантация ее. Индукция опухоли химическими веществами. В 1775 г. хирург лондонского госпиталя Персиваль Потт описал профессиональное злокачественное заболевание – рак кожи мошонки у трубочистов. Однако, несмотря на очевидную связь рака у трубочистов с загрязнениями кожи сажей и смолой, попытки воспроизвести подобную опухоль в эксперименте долгое время заканчивались неудачей. В 1916 г. японские ученые Ишикава и Ямагива впервые смогли вызвать опухоль у животных. На протяжении 6 мес они смазывали кожу кроликов каменноугольной смолой и только после этого у животных развился рак кожи. Позже канцерогенные вещества были получены в чистом виде, установлена канцерогенность веществ, относящихся к различным классам химических соединений. Индукция опухоли вирусами. В 1908 г. Эллерман и Банг впервые вызвали лейкоз у кур с помощью бесклеточного фильтрата из лейкозных лейкоцитов. Бесклеточный фильтрат получают, пропуская экстракт измельченной опухолевой ткани через фарфоровые фильтры. В 1910 г. Раус с помощью бесклеточного фильтрата, полученного из саркомы курицы, вызвал развитие саркомы у здоровых кур. Так впервые были получены доказательства вирусной этиологии лейкозов и опухолей. Однако в последующие десятилетия выявить опухолеродные вирусы у млекопитающих не удавалось, за исключением папилломы Шоупа и фактора молока Биттнера. Шоуп обнаружил у диких кроликов бородавчатые разрастания на коже (папилломы), которые удалось перевить здоровым животным посредством бесклеточного фильтрата. Фактор молока был открыт Биттнером (1936). Имеются линии мышей с высокой степенью заболеваемости раком молочной железы (высокораковые) и низкой степенью (низкораковые). Однако, если у самки высокораковой линии забрать новорожденных мышат до первого кормления и отдать для кормления самке низкораковой линии, частота появления рака у них будет резко снижена. И наоборот, при кормлении высокораковой самкой мышат низкораковой самки частота опухоли у них значительно повышается. Биттнер доказал, что в молоке высокораковых мышей имеется фактор, вызывающий у потомства рак молочной железы. В 1950 г. Л. Гросс после многих безуспешных попыток вызвать лейкоз у взрослых мышей ввел бесклеточный фильтрат из лейкозных клеток крови новорожденным мышам и получил у них лейкоз. Таким образом, еще раз было получено подтверждение гипотезы о вирусной этиологии развития опухоли у млекопитающих и установлено значение при этом индукции опухоли онкогенными вирусами, в которых теперь открыты онкогены. Индукция опухоли физическими факторами. Опухоль удается воспроизвести с помощью ионизирующей радиации, в том числе рентгеновских лучей, радиоактивных изотопов, а также ультрафиолетовых лучей. Эксплантация опухоли. Выращивание опухоли в культуре ткани вне организма. Этот метод успешно применял проф. А. Д. Тимофеевский. Культура ткани, полученная непосредственно из опухоли животного или человека, называется первичной. Кроме того, в лабораториях имеется большое количество постоянно пассируемых штаммов опухолевых клеток, свойства которых хорошо изучены, что позволяет проводить опыты на одинаковом материале. Культура тканей дает возможность индуцировать опухоли вне организма химическими канцерогенами и онкогенными вирусами. Данный метод особенно ценен тем, что позволяет изучать индукцию опухолей и опухолеродных вирусов на человеческих тканях. Пассируемые или индуцированные в культуре ткани опухолевые клетки при подсадке здоровому животному растут в его организме и образуют злокачественную опухоль. Трансплантация опухоли. Впервые отечественный ученый М. А. Новинский в 1876 г. успешно трансплантировал опухоль взрослой собаки щенкам. Фактически данным опытом было положено начало экспериментальной онкологии. Метод трансплантации широко используется и в настоящее время. Имеются штаммы пассируемых опухолей с хорошо изученными свойствами: асцитная карцинома Эрлиха у мышей, куриная саркома Рауса, крысиная саркома Иенсена, кроличья карцинома Брауна – Пирс и др. Аллогенная трансплантация опухолей (т. е. пересадка опухоли между неинбредными животными того же вида) бывает успешной, в то время как такая же трансплантация здоровых тканей без иммунодепрессии не удается. Причиной удачных пересадок аллогенных опухолей является антигенное упрощение опухолей по мере их малигнизации, маскирование антигенов в опухолях, а также их иммунодепрессивное воздействие. Введение в небольшом количестве (400 000) опухолевых клеток вызывает угнетение иммунной системы и рост опухоли (вспомним, что в 1 мм3 крови содержится 5 млн эритроцитов). Только инъекция опухолевых клеток в еще меньшем количестве может привести к иммунизации и последующему отторжению трансплантируемой опухоли. Этиология Причинами развития опухоли являются различные факторы, способные вызывать превращение нормальной клетки в опухолевую. Они называются канцерогенными или бластомогенными. Химические, физические и биологические факторы, различные по своей природе и способу воздействия на организм, но одинаковые по способности к нарушению регуляции клеточного деления, составляют одну этиологическую группу. Канцерогенные факторы отличаются следующими свойствами: 1. Мутагенностью – способностью прямо или косвенно влиять на геном клетки, что в итоге приводит к мутациям. Таким свойством обладают химические вещества (углеводороды, нитрозамины и др.), физические (ионизирующая радиация) и биологические (вирусы) факторы, но вирусы могут вызывать опухоли еще и эпигеномным путем. Местом взаимодействия химических канцерогенов с нуклеиновыми кислотами является, по-видимому, гуанин. 2. Способностью проникать через внешние и внутренние барьеры. Так, при попадании на кожу развитие опухоли вызывают только те потенциальные химические канцерогены, которые проникают через ороговевающий эпидермис. Поскольку биологические мембраны состоят из липопротеидов, через них проникают прежде всего липидорастворимые вещества, к которым относятся и канцерогенные углеводороды. 3. Дозированностью действия, обеспечивающей незначительное повреждение клетки, что позволяет ей выжить. В связи с этим для получения канцерогенного эффекта имеют значение доза воздействия и токсичность канцерогенного фактора. Небольшое повышение дозы приводит к увеличению числа возникающих опухолей, количества заболевших животных и сокращения сроков развития опухолей. Дальнейшее повышение дозы сопровождается преобладанием токсического эффекта и гибелью животных до образования опухоли. Снижение дозы канцерогена позволило установить следующее: 1.. Субпороговых канцерогенных доз не существует (в опытах обнаруживается канцерогенность очень малых доз, но при этом увеличивается время образования опухолей). 2.. Действие канцерогенов необратимо. 3.. Для канцерогенов характерен эффект суммации и кумуляции. Сходная зависимость наблюдается при действии ионизирующей радиации: высокие дозы ионизирующей радиации вызывают лучевой ожог и гибель ткани и только относительно небольшие дозы облучения создают возможность появления опухолей. Действие вирусов при абортивном течении, а не в случае острой инфекции (гибель клеток), наиболее часто вызывает канцерогенез. Вероятность канцерогенеза повышается по мере увеличения времени воздействия канцерогенного фактора. 4. Возможностью создавать в органах и тканях, с различными особенностями их проницаемости и метаболизма, условия, благоприятные для проявления канцерогенности одних факторов и неблагоприятные для других. Этим можно объяснить существование органотропных канцерогенов. 5. Способностью подавлять тканевое дыхание и иммунные реакции. 6. Усилением образования опухолей (синканцерогенез) при воздействии нескольких канцерогенных факторов. Иногда факторы, сами не являющиеся канцерогенными, способны усиливать действие канцерогенов. Такое явление называется коканцерогенезом, а факторы, вызывающие его, – коканцерогенами. Химические канцерогены. Через 15 лет после опытов Ямагива и Ишикава в 1930 г. Кук, Хьюитт и Хайджер из 2 т каменноугольной смолы получили 50 г химически чистого 3,4-бензпирена, оказавшегося сильным канцерогеном. Еще ранее, в 1929 г. Кук синтезировал очень активный канцероген 1,2,5,6-дибензантрацен (ДВА). С тех пор началось изучение химически чистых канцерогенных веществ. Была установлена канцерогенность многих соединений, относящихся к самым различным классам. Полициклические ароматические углеводороды (ПАУ). К ним относятся 3,4-бензпирен, ДВА и 9,10-диметил-1,2-бензантрацен (ДМБА). Путем обработки желчных кислот был получен сильный канцероген – метилхолантрен. Синтез этого канцерогена впервые навел на мысль о возможной канцерогенности некоторых биологических продуктов, вырабатываемых самим организмом, что впоследствии и подтвердилось. Канцерогенные ПАУ оказывают в основном местное канцерогенное действие: при введении под кожу они вызывают саркому, при нанесении на кожу – рак. При введении, обеспечивающем распространение канцерогена по организму, ПАУ вызывают образование опухоли в органах, в которых они накапливаются: при выделении их с молоком образуются опухоли молочных желез, с мочой – опухоли почек и лоханок, сальными железами кожи – опухоли кожи. Некоторые ПАУ являются очень сильными канцерогенами: 0,2 – 0,5 мг ДМБА при подкожном введении мышам практически у всех животных вызывали развитие опухолей. Более сильным канцерогеном является 20-метилхолантрен. Применяя методы квантовой органической химии, Пюльман определял плотность электронного облака в молекулярных структурах ПАУ. Оказалось, что если какое-нибудь производное антрацена или фенантрена обладает канцерогенной активностью, то возле определенного радикала в одном и том же месте основной циклической структуры наблюдается повышенная плотность электронного облака, достигающая 1,2е. Эта зона в молекуле углеводорода получила название К-района (от нем. Krebs – рак). В дальнейшем теоретически было вычислено, в каких производных антраценового ряда электронная плотность в К-районе имеет значение, соответствующее канцерогенности. Экспериментально этот расчет подтвердился в основном для антраценового и фенантренового рядов. Канцерогенные ПАУ широко распространены в среде обитания человека, поскольку они зачастую являются продуктами неполного сгорания. ПАУ образуются при температуре 400 – 600°С (температура горения табака в сигарете), содержатся в дыме и смоле табака, в пережаренном масле, в выхлопных газах, в копченых продуктах, а также в нефти, битуме, асфальте. У крыс, находившихся во время эксперимента на асфальтированной магистрали, опухоли легких развились в большем числе случаев по сравнению с мышами, помещенными на проселочной дороге. Во время длительных наблюдений за курящими людьми было установлено, что частота развития рака легких и верхних дыхательных путей пропорциональна числу выкуренных папирос и латентный период составляет в среднем 10 лет. Вероятность заболевания таким раком в несколько десятков раз выше у курящих по сравнению с некурящими. Канцерогенные аминоазосоединения и аминыобладают выраженной органотропностью. Диметиламиноазобензол (ДАБ) в эксперименте вызывает рак печени в 80% случаев независимо от пути введения этого вещества в организм. Аналогичным действием обладает ортоаминоазотолуол. ?-Нафтиламин у человека и животных вызывает рак мочевого пузыря. Органотропность канцерогенных веществ объясняют образованием в пораженном органе активных веществ из менее активных предшественников. Канцерогенное действие ?-нафтиламина проявляется действием его метаболитов – 2-аминонафтол-1 и 2-нафтилоксиамина. В дальнейшем была открыта новая группа канцерогенов -нитрозамины. Особенностью этих веществ также является органотропность, которая может изменяться вследствие относительно небольших Перестроек в молекуле. Так, диэтилнитрозамин вызывает преимущественно рак печени и пищевода, метилнитрозомочевина – образование опухолей Головного мозга, триметилнитрозомочевина – развитие опухолей головного мозга и периферической нервной системы. Установлено, что нитрозамины образуются в желудке человека из неканцерогенных предшественников (нитритов и аминов) в присутствии соляной кислоты. Нитриты, например нитрит натрия, и амины (аминокислоты, амидопирин), попадая в организм с пищей, образуют нитрозамины, вызывая у 80 – 100% подопытных животных развитие опухолей. Биологические канцерогены В последнее время обнаружено много канцерогенов биологического происхождения. Они вырабатываются в организме, встречаются в составе пищи и среди веществ, используемых в медицине и на производстве. Гриб Aspergillus flavum синтезирует афлатоксин – вещество, которое обладает резко выраженными канцерогенными свойствами. Дозы афлатоксина, вызывающие развитие опухолей печени, очень малы – ниже, чем дозы азокрасителей, таких как ДАБ. В дождливое лето весь урожай земляных орехов (арахиса) бывает заражен грибом, продуцирующим афлатоксин. Гриб паразитирует также на кукурузе, рисе, яйцах, порошковом молоке. Еще более распространен Aspergillus nidulans, который вырабатывает канцерогенный стеригматоцистин. Поскольку механизм канцерогенеза связан с нарушением регуляции клеточного деления, можно предположить, что вещества или факторы, стимулирующие в нормальных условиях клеточное деление, в условиях патологии способны нарушать его регуляцию. Это относится прежде всего к гормонам. Гонадотропные гормоны гипофиза вызывают в яичнике пролиферацию клеток фолликула. Продуцируемые этими клетками эстрогены по принципу обратной связи тормозят выработку фоллитропина. После пересадки яичника в селезенку с одновременным удалением второго яичника пересаженный яичник постоянно подвергается интенсивной стимуляции фоллитропином, вызывающим в нем в 80% случаев развитие опухоли. Это свидетельствует о том, что собственные гормоны, образующиеся в повышенном количестве и сильнее обычного атакующие орган-мишень, могут вызвать образование в нем опухоли. Установлено, что причиной развития спонтанных опухолей, обнаруженных у животных, являются опухолеродные вирусы,причем в основном содержащие РНК. При классификации онкогенных вирусов учитываются следующие признаки: тип нуклеиновой кислоты, входящей в состав вируса (РНК или ДНК), место и способ размножения вируса в клетке, форма. Различают 4 группы вирусов. 1. РНК-содержащие вирусы спиралевидной формы, которые размножаются в цитоплазме. К ним относятся вирусы лейкоза мышей и кур, саркомы Рауса, вирус молока, открытый Биттнером и др. 2. РНК-содержащие вирусы полиэдральной формы. Вирусы всех групп, содержащих РНК, называют онкорнавирусами (онкогенными, содержащими РНК) или ретровирусами (из-за способности передавать информацию в обратном направлении – от РНК к ДНК). 3. ДНК-содержащие вирусы полиэдральной формы, они размножаются в ядрах клеток. К ним относятся вирусы папилломы кроликов, полиомы, бородавки человека, вакуолизирующий вирус обезьян-SV40. Свойства этих вирусов настолько типичны для всей группы, что их объединяют под общим названием papova (папова), происходящим от начальных букв названий опухолей и функциональных изменений (papilloma, polioma, vacuolisation). 4. Крупные ДНК-содержащие вирусы. Они размножаются в цитоплазме, образуя характерные клеточные включения. Из опухолеродных в данную группу входят вирус фибромы Шоупа, вирус Яба, вирус контагиозного моллюска. Все они очень похожи на вирус оспы и вызывают чаще всего доброкачественные опухоли. Большой интерес представляет вирус полиомы, детально изученный Стюартом и Эдди. Этот вирус содержит одну молекулу ДНК в виде двойного кольца или двойной линейной молекулы. Он может вызывать до 27 типов опухолей в различных тканях у семи видов млекопитающих (мыши, крысы,. кролики, хомяки и др.). При введении вируса новорожденным животным заболеваемость достигает 100%. С возрастом чувствительность к вирусу снижается: если вирус вводят мышам старше 14 дней, то опухоль не развивается. Из крови инфицированных животных можно выделить вирусную ДНК, способную к индукции опухолей. Среди опухолей, образующих у человека и вызываемых, по-видимому, вирусом, большой интерес представляет лимфома Беркитта, которая поражает подчелюстные лимфатические узлы у детей и распространена среди населения низменных районов Африки. Такая эпидемиологическая особенность обычно бывает связана с зоной обитания какого-либо переносчика инфекции, в данном случае, вероятно, одного из видов москитов. Установлена связь вирусов с возникновением и развитием ряда распространенных опухолей человека: вируса герпеса и рака шейки матки; вируса гепатита В и гепатоцеллюлярной карциномы (рак печени, происходящий из гепатоцитов), аденовирусов и опухолей эпителия верхних дыхательных путей, с которыми оказался связанным также вирус Эпштейна- Барр (назофарингеальные опухоли), идентифицированный ранее как возбудитель В-клеточной лимфомы Беркитта. Впервые выделен ретровирус (онко-РНК С типа) из лейкозных клеток людей, страдающих кожной формой Т-лимфоцитарного лейкоза – лимфомы человека. Вирус назван HTLV (от англ. Human T Lymphoma Virus). Этот Т-клеточный лейкоз представляет собой инфекционное заболевание людей, заражение которых происходит при переливании крови. Имеется явная связь между онкогенными ДНК-содержащими вирусами папиллом и опухолями половых органов человека. Р. Хюбнер и Д. Тодаро экспериментально показали, что онкорнавирусы в ДНК-форме имеются в хромосомах нормальных клеток. Но они не проявляют свое действие, возможно, благодаря функции генов-репрессоров клетки, подавляющих вирусный геном. При воздействии, например, химических канцерогенов эта неактивная ДНК (провирус) начинает функционировать как часть генома клетки, вызывая преобразование здоровой клетки в опухолевую (рис. 13.1). Физические канцерогены. Канцерогенным действием обладают такие физические факторы, как ионизирующая радиация, ультрафиолетовые лучи, возможно, тепловая энергия, ультразвук. Кроме того, физические факторы могут играть роль син- или коканцерогенов. Канцерогенное действие ультрафиолетовых лучей наблюдали в опыте на животных. Ежедневное 5-часовое пребывание лабораторных крыс на ярком солнце привело через 10 мес после этого к развитию у многих животных опухолей кожи. Опухоли развиваются часто под действием рентгеновских лучей и при введении в организм радиоактивных изотопов. У человека наблюдаются профессиональные опухолевые заболевания, вызванные действием ионизирующей радиации: рак рентгенологов, рак легких у горняков, работающих в копях с радиоактивными рудами. Трагичны последствия атомных взрывов в Хиросиме и Нагасаки. Среди 18 тыс. жителей Хиросимы, находившихся вблизи от эпицентра взрыва и оставшихся в живых, существенно увеличилась заболеваемость лейкозом. Интерес представляет сочетанное действие физических канцерогенных факторов с другими – химическими, биологическими. Обнаружено, что сочетанное действие ионизирующей радиации и химических канцерогенов в низких дозах обусловливает необычно сильную индукцию опухолей, непропорциональную дозам этих факторов, в которых они вызывают только небольшое количество опухолей, если действуют врозь. Установлена также канцерогенная роль длительного механического воздействия на ткань. В 1948 г. Б. Оппенгеймер, Э. Оппенгеймер и Стоун обнаружили, что у крыс, которым для создания почечной гипертензии почки обернули целлофаном, развилась саркома. Имплантация пластмассовых пластинок показала, что возле пластинок размером 0,5x0,5 см и выше индуцируются злокачественные соединительно-тканные опухоли, тогда как введение порошка из этой же пластмассы не вызывало образование опухолей. Вероятно, металлические или пластмассовые пластинки препятствуют завершению пролиферативной стадии воспаления, что приводит к избыточному накоплению индукторов размножения, вызывающих образование опухоли. Патогенез В патогенезе опухолевого роста различают три этапа: трансформацию здоровой клетки в опухолевую (инициация), промоцию ("подстрекательство") и прогрессию опухоли. Трансформация заключается в приобретении исходной здоровой клеткой способности беспредельно размножаться и передаче ее дочерним клеткам по наследству. Трансформация может происходить, по-видимому, двумя путями – мутационным и эпигеномным. Оба пути представляют механизм нарушения регуляции клеточного деления. Поэтому понимание механизмов канцерогенеза прямо связано с центральной проблемой современной биологии клетки – сущностью клеточного деления и регуляции этого процесса. Ведущим биохимическим процессом, обеспечивающим клеточное деление, является репликация ДНК всего генома клетки в фазе "S" митотического цикла. Этот процесс осуществляется мультиферментным комплексом и начинается с появлением в клетке в фазе G1 специального инициатора клеточного деления. Инициация клеточного деления и начало редупликации ДНК зависят от синтеза белка в фазе G1. Введенный в этот период ингибитор синтеза белка циклогексимид блокирует начало синтеза ДНК, а введенный позже – не влияет на начавшуюся редупликацию. Появление в клетке инициатора и начало клеточного деления являются результатом дерепрессии гена, кодирующего этот инициатор. Следовательно, обеспечение регуляции функции гена-инициатора клеточного деления дает возможность регулировать включение и выключение размножения данной клетки. Ограничение нормальной клетки в числе и скорости делений объясняется тем, что в каждой клетке существует своя собственная система регуляции деления, состоящая из специальных регуляторных генов. По гипотезе Хьюгса, генная регуляция деления осуществляется в каждой клетке системой, состоящей из трех регуляторных генов (рис. 13.2). В норме отсутствует избыточное деление клеток, так как система генов, регулирующих деление клетки, обеспечивает торможение активности гена, кодирующего инициатор деления клетки. Клетка не делится, ибо появление инициатора клеточного деления при включении гена, кодирующего этот инициатор, тормозит функцию регуляторного гена-репрессора 2, что ведет к дерепрессии регуляторного гена-репрессора 1 и синтеза на его основе репрессора 1, который тормозит функцию гена, кодирующего инициатор клеточного деления (направление стрелок на схеме обозначает тормозящее влияние). 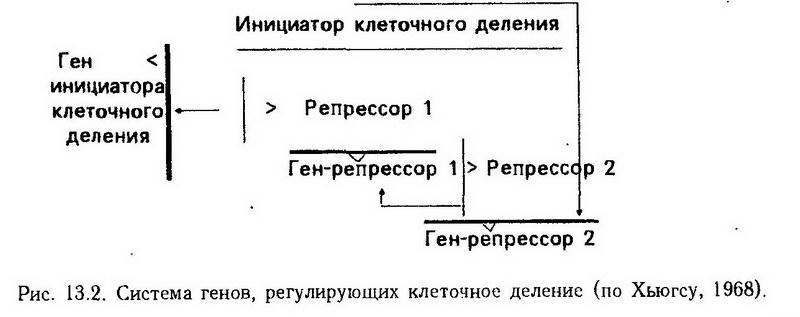 Таким образом, система регуляции имеет обратную связь, которая обеспечивает ее автономность и благодаря ей в норме регуляция установлена на предупреждение клеточного деления. Для размножения клетки необходимо наличие в геноме фактора, который предупреждает репрессию гена-репрессора 2 компонентом инициатора клеточного деления или репрессию гена-инициатора клеточного деления репрессором 1. Если этого фактора нет, система регуляторных генов выключает ген-инициатор. Размножение клетки приостанавливается. На основе схемы регуляции клеточного деления Хьюгса можно представить сущность канцерогенеза. Мутационный канцерогенез. Предположим, что мутагенный фактор вызвал нарушение в гене-репрессоре 1 и активный репрессор 1 не может быть синтезирован. В этом случае растормаживается ген инициатора клеточного деления и начинается репликация ДНК. Образовавшиеся в результате деления клетки не располагают геном-репрессором 1, вследствие чего клетки продолжают репликацию ДНК и при делении образуется семейство клеток, способных к беспредельному неконтролируемому делению. Очевидно, они и являются опухолевыми клетками. Аналогичным образом к беспредельному клеточному делению могут привести мутации и других генов данной регуляторной системы, например мутация гена, кодирующего инициатор клеточного деления, в результате которой он становится недоступным тормозящему влиянию гена-репрессора 1. Наряду с мутационным возможен и эпигеномный канцерогенез, который предполагает приобретение здоровой клеткой опухолевых свойств путем воздействия на геном клетки факторов, которые не принадлежат к геному данной клетки и не вызывают мутацию, но создают устойчивое нарушение нормальной регуляции генома, приводящее к беспредельному росту. Передающееся из поколения в поколение эпигеномное влияние может сформироваться, например, под действием вируса, инфицирующего исходную и попадающего в каждую новообразовавшуюся клетку в митозе (рис. 13.3). Допускается, что в геноме вируса имеется ген типа клеточного гена-репрессора. 2. С появлением вируса в клетке начинается синтез вирусного репрессора 2, который тормозит работу гена-репрессора 1, и репрессор 1 не синтезируется. В отсутствие репрессора 1 активизируется . ген, кодирующий инициатор деления клетки, и синтезируется данный инициатор. Появление инициатора деления клетки приводит к началу репликации ДНК, имеющейся в геноме клетки, т. e. к делению клетки. При этом инициатор деления выключает ген-репрессор 2 клетки, но не может выключить онкогенную часть генома вируса – вирусный ген-репрессор типа клеточного гена-репрессора 2 в силу особенностей строения вирусного гена-репрессора 2. Таким образом, пока вирус находится в клетке, постоянно поддерживается синтез репрессора 2 на основе вирусного гена. Это приводит к репрессии регуляторного гена-репрессора 1 клетки, в связи с чем дерепрессируется ген, кодирующий инициатор деления клетки и клетка продолжает размножаться. Образовавшиеся клетки содержат в себе вирусный геном, который попадает к ним во время митоза от исходной клетки и поддерживает нарушение регуляции клеточного деления в последующих поколениях клеток. Получены доказательства, что онкогены опухолеродных вирусов действительно идентичны клеточным факторам роста. Более того, в клетках сетчатки найден ген-репрессор клеточного деления, названный Rb, наследственный дефект которого приводит у ребенка к развитию злокачественной опухоли сетчатки глаза – ретинобластомы. Мутационный и эпигеномный механизмы канцерогенеза не исключают друг друга, а могут быть сопряженными. В клетке имеются специальные регуляторные гены, репрессирующие геном опухолеродного вируса (см. рис. 13.1). Следовательно, мутация может произойти с репрессорным геном клетки, в результате чего активируется вышедший из-под контроля онкоген опухолеродного вируса и происходит эпигеномная трансформация клетки. Таким образом, химические и физические факторы могут не сами по себе вызывать трансформацию, а способствовать активизации вирусного канцерогенеза. 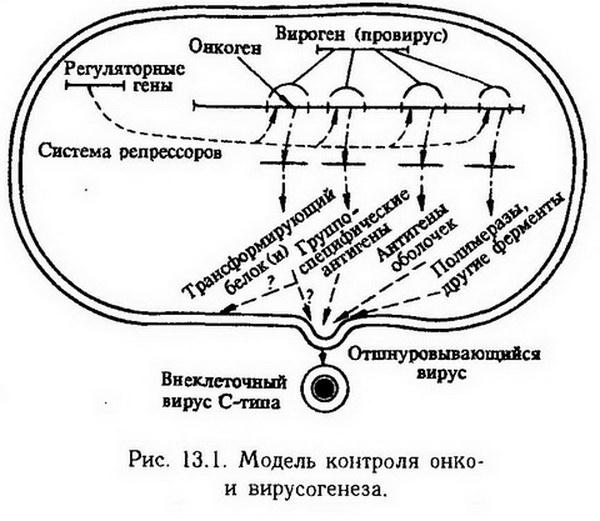 Опыты Гердона по пересадке ядер дифференцированных клеток в цитоплазму зиготы были использованы для изучения регуляции деления в ядрах опухолевых клеток. Если из оплодотворенных яйцеклеток лягушки удаляют ядро и вместо него подсаживают ядро из специализированной клетки с двойным набором хромосом, например клетки кишечного эпителия, то развивается головастик со всеми дифференцирующимися органами. Следовательно, в ядрах специализированных клеток организма сохраняется весь набор генов, который был в ядре зиготы. Когда в цитоплазму зиготы подсадили ядро раковой клетки из почечной опухоли Люкке лягушки, также развился головастик, а не опухолевая ткань. После пересадки ядра клетки такого головастика в цитоплазму клетки опухоли Люкке образовалась нормальная почечная ткань. Таким образом, здоровая цитоплазма зиготы обусловила полное восстановление регуляции в пересажённом ядре опухолевой клетки и закрепление его как наследуемое свойство. Поскольку опухоль Люкке лягушек имеет вирусное происхождение, следовательно, речь идет о восстановлении функции генов, репрессирующих вирусный геном. Роль вирусов в канцерогенезе. В 1945 г. профессор Л. А. Зильбер предложил вирусно-генетическую теорию возникновения опухолей, согласно которой механизм опухолевой трансформации заключается в том, что геном вируса внедряется в геном клетки. В дальнейшем Хюбнер и Тодаро показали, что онкогенные вирусы С-типа определяются в здоровых тканях животных различных видов и передаются по вертикали, т. e. через зиготу. Однако опухоли при этом не возникают, по-видимому, вследствие того, что в процессе эволюции организм выработал гены, репрессирующие вирусный геном. Для встраивания в геном клетки генома онкорнавирусов имеет значение "обратная передача генетической информации". М. С. Гершензон (1960) и Темин (1964) показали, что передача наследственной информации возможна не только от ДНК на РНК, но и в обратном направлении. Был найден особый фермент, который по РНК, как по матрице, осуществлял синтез комплементарной ДНК. Фермент был назван обратной транскриптазой, или РНК-зависимой ДНК-полимеразой. В РНК- содержащих опухолеродных вирусах была обнаружена вирусная обратная транскриптаза, а в геномах клеток – ДНК-копии этих вирусов. Таким образом, возникла идея профилактики и лечения опухолей, вызываемых онкорнавирусами, путем подавления обратной транскриптазы. Установлено, что в геноме опухолеродных вирусов имеется онкоген, обусловливающий трансформацию нормальных клеток в опухолевые. Эти онкогены вирусы захватили в геноме ранее инфицированных ими клеток, в которых эти нормальные гены участвуют в регуляции клеточного деления. Вирусы, захватывая в свой геном нормальные клеточные гены-регуляторы деления, нарушают регуляторные участки нормальных генов, так что вирусные онкогены не подчиняются в клетке нормальным регуляторным взаимоотношениям. Чтобы отличать вирусные онкогены и клеточные протоонкогены, а также белки, синтезируемые на этих генах, используется следующая система обозначений: V-вирусный онкоген, С – клеточный протоонкоген; если продукт онкогена – простой белок, его обозначают р, если он находится в фосфорилированием состоянии – рр, далее обозначают молекулярную массу сокращенно в килодальтонах и в показателе степени пишут именное название онкогена, включающее три буквы, например: V-pp60SRC – белок – продукт онкогена из вируса саркомы Рауса в фосфорилированной форме с молекулярной массой 60 кД. Если продукт онкогена представляет собой сложный белок, состоящий из двух и более полипептидов, его обозначают как Р, остальные обозначения те же. Нормальная индукция клеточного деления включает в себя следующие механизмы и вещества: внеклеточный фактор роста соединяется на мембране клетки со специфическим для него рецептором, от рецептора сигнал передается молекулой проводника, идущей через мембрану, внутрь клетки, где активирует внутриклеточную часть рецептора. От последней сигнал поступает в ядро клетки, где активирующиеся специализированные молекулы включают работу одних генов и ингибируют другие гены. Оказалось, что в качестве онкогенов вирусы используют все описанные выше виды молекул, осуществляющие в норме включение клеточного деления: |
