гормоны. Гормоны-2-1. Нейроэндокринные взаимосвязи
 Скачать 484.5 Kb. Скачать 484.5 Kb.
|
|
Гормоны паращитовидных желез Паращитовидные железы – 4 небольшие железистые образования, расположенные на задней поверхности щитовидной железы. Паращитовидные железы секретируют два – паратгормон (паратирин) и кальцитонин (как и в щитовидной железе). Оба гормона совместно с витамином Д регулируют обмен кальция и фосфатов в организме. Паратгормон. Синтез и секреция Паратгормон представляет собой одноцепочечный полипептид, состоящий из 84 аминокислотных остатков (М.м. 9500). Секреция паратгормона находится в обратной зависимости от концентрации Ca2+ в сыворотке крови и быстро реагирует на изменения последней. Подобно Ca2+ может действовать и Mg2+, но в гораздо больших концентрациях. Существует прямая зависимость между секрецией паратгормона и уровнем цАМФ в клетках паращитовидных желез и обратная – между концентрациями Ca2+ и цАМФ. Ионы Ca2+ активируют фосфодиэстеразу или ингибируют аденилатциклазу. При этом аденилатциклаза паратиреоидных клеток гораздо более чувствительна к ингибирующему действию Ca2+, чем фермент, содержащийся в клетках других тканей. Ионы Ca2+ регулируют не только скорость секреции, но и количество паратгормона, изменяя скорость его распада. У человека период полужизни циркулирующего паратгормона составляет 20–30 минут. Действие паратгормона Паратгормон оказывает влияние на костную ткань, почки и желудочно-кишечный тракт. Действуя на эти ткани, гормон повышает содержание Ca2+ и снижает содержание неорганических фосфатов в крови. При достаточном содержании Ca2+ в пище паратгормон поддерживает его необходимый уровень во внеклеточной жидкости, регулируя всасывание Ca2+ в кишечнике путем стимуляции образования в почках активной формы витамина Д – 1,25-дигидроксикальциферола, или кальцитриола. В случае недостаточного поступления в организм Ca2+ его нормальный уровень в сыворотке восстанавливается сложной системой регуляции, включающей прямое воздействие паратгормона на почки и кости и опосредованное (через стимуляцию синтеза кальцитриола) на слизистую кишечника. Влияние паратгормона на почкипроявляется в его прямом воздействии на транспорт ионов, а также через регуляцию синтеза кальцитриола. Гормон увеличивает канальцевую реабсорбцию Ca2+ и Mg2+ и резко тормозит реабсорбцию фосфатов, усиливая их экскрецию с мочой (фосфатурию); кроме того он повышает экскрецию ионов K+, Na+ и бикарбонатов. Другой важный эффект паратгормона на почки заключается в стимуляции синтеза в этом органе кальцитриола, который также регулирует обмен Ca2+: усиливает всасывание Ca2+ и фосфатов в кишечнике, мобилизует Ca2+ из костной ткани и увеличивает его реабсорбцию в почечных канальцах. Все эти процессы способствуют повышению уровня Ca2+ и снижению уровня фосфатов в сыворотке крови. На почки паратгормон оказывает наиболее быстрый эффект, но самый сильный – на костную ткань. Влияние гормона на костную ткань проявляется в увеличении высвобождения из костного матрикса Ca2+, фосфатов, протеогликанов и гидроксипролина, важнейшего компонента коллагена костного матрикса, что служит показателем его распада. Суммарный эффект паратгормона проявляется в деструкции кости. Однако в низких концентрациях паратгормон оказывает анаболический эффект. Он повышает уровень цАМФ и (на очень ранних этапах своего действия) поглощение Ca2+. Рецепторы паратгормона находятся на остеобластах, которые под влиянием гормона начинают вырабатывать активатор остеокластов, изменяющий морфологию и биохимию последних таким образом, что они приобретают способность разрушать кость. Из кости выделяются протеолитические ферменты и органические кислоты (лактат, цитрат). Таким образом, резорбции кости предшествует вход Ca2+ в резорбирующие кость клетки. Действие паратгормона на костную ткань опосредовано также кальцитриолом. В кишечнике паратгормон усиливает транспорт Ca2+ и фосфатов через его слизистую оболочку и поступление их в кровь. Этот эффект связан с образованием активной формы витамина Д. Нарушения функции паращитовидных желез Гипофункция желез, или гипопаратиреоз(обусловленный дефицитом паратгормона) встречается у людей относительно редко. Она может быть следствием различного рода оперативных вмешательств в области шеи или (реже) заболеваний паращитовидных желез. В крови наблюдается низкий уровень Ca2+ и повышенный уровень фосфатов. Сниженный уровень Ca2+ в крови и межклеточной жидкости способствует деполяризации мембран, вызванной поступлением Na+ внутрь клетки. Это приводит к повышенной нейромышечной возбудимости, вызывающей судороги и тетанические сокращения мышц. Тяжелая гипокальциемия приводит к параличу дыхательных мышц и смерти. Эти нарушения можно устранить введением препаратов кальция и паратгормона, а также витамина Д. Гиперфункция, или гиперпаратиреозт.е. избыточное образование паратгормона возникает при гипертрофии и гиперплазии паращитовидных желез или вследствие возникновения опухоли. В крови повышается содержание Ca2+ и уменьшается содержание фосфатов. В результате нейромышечная возбудимость снижается, что приводит к глубоким расстройствам функций нервной системы – психозам и даже коме. При гиперпаратиреозе происходит мобилизация Ca2+ из кости, и в тяжелых случаях наблюдается резорбция отдельных участков кости, легко возникают самопроизвольные переломы. Кальций вследствие плохой растворимости оседает во внутренних органах, наблюдается кальцификация мягких тканей и образование камней в почках, нефрокальциноз. Однако могут существовать компенсированные состояния гиперпаратиреоза, при которых патологически повышенный уровень Ca2+ в сыворотке не сопровождается видимым снижением плотности костей. Кальцитонин. Структура и секреция По химической природе кальцитонин является одноцепочечным полипептидом, содержащим 32 аминокислотных остатка (М.м. 4500). У человека он секретируется К-клетками (парафолликулярными) щитовидной железы. Период полужизни кальцитонина составляет 2–15 мин. Уровни секреции кальцитонина и паратгормона связаны обратной зависимостью и регулируются кальцием противоположным образом. Секреция кальцитонина возрастает только при значительном увеличении уровня Ca2+ в крови. Физиологические концентрации Ca2+ не являются сигналом секреции гормона. Кроме того, секрецию кальцитонина стимулирует глюкагон – гормон поджелудочной железы и гастрин – гормон желудочно-кишечного тракта. Действие кальцитонина Основная функция кальцитонина состоит в предотвращении гиперкальциемии, потенциально возможной при поступлении в организм кальция. Кальцитонин снижает концентрацию Ca2+ и фосфатов в крови. Основной орган-мишень для кальцитонина – кость, где гормон тормозит резорбцию и тем самым подавляет высвобождение Ca2+, фосфата и органических веществ из костного матрикса. Это приводит к снижению уровня Ca2+, фосфата и гидроксипролина в крови. Кальцитонин обладает небольшим фосфатурическим эффектом, что, вероятно, является вторичным процессом, связанным с изменением концентрации Ca2+ в плазме. При этом уменьшается экскреция Ca2+ и оксипролина с мочой. Указанные эффекты являются следствием тормозящего действия гормона на активность остеокластов – кальцитонин является мощным ингибитором остеокластов. Уровень кальцитонина повышается при беременности и у кормящих женщин, что свидетельствует о физиологической роли гормона в защите организма матери от избыточных потерь Ca2+. Проявления недостаточности кальцитонина не обнаружены. Повышенное образование гормона наблюдается при медуллярной тиреокарциноме. Несмотря на значительное возрастание уровня кальцитонина, гипокальциемия возникает очень редко. Практическое применение гормонов паращитовидных желез В медицинской практике используют как природные, так и синтетические препараты гормонов паращитовидных желез. Препарат паратиреоидин применяют при гипопаратиреозе для предупреждения тетании, обусловленной гипокальциемией. Препараты кальцитонина (кальцитрин, миакальцик) используют в терапии больных с гиперкальциемией различной природы, например, при деформирующем остите (болезни Педжета); при климактерическом, стероидном, паратиреоидном и других видах остеопороза, фиброзной дисплазии, а также при осложненном течении травматического поражения костей (замедленном сращивании переломов). Гормоны поджелудочной железы Поджелудочная железа – непарный эндокринный орган, расположенный в брюшной полости, под желудком. Она является железой смешанной секреции. Ацинарная часть железы выполняет экзокринную функцию, секретируя в просвет двенадцатиперстной кишки ферменты и ионы, участвующие в процессах пищеварения. Эндокринная часть представлена островками Лангерганса, состоящими из клеток разных типов, которые осуществляют синтез и секрецию ряда гормонов. -Клетки секретируют глюкагон, -клетки (составляющие 70% островковой ткани) вырабатывают инсулин, -клетки – соматостатин и F-клетки секретируют панкреатический полипептид. Инсулин Инсулин представляет собой простой глобулярный белок с молекулярной массой 5700. Молекула инсулина содержит 51 аминокислотный остаток и построена из двух полипептидных цепей, соединенных между собой двумя дисульфидными мостиками. Цепь А содержит 21 аминокислотный остаток, а цепь В – 30 (см. ниже). 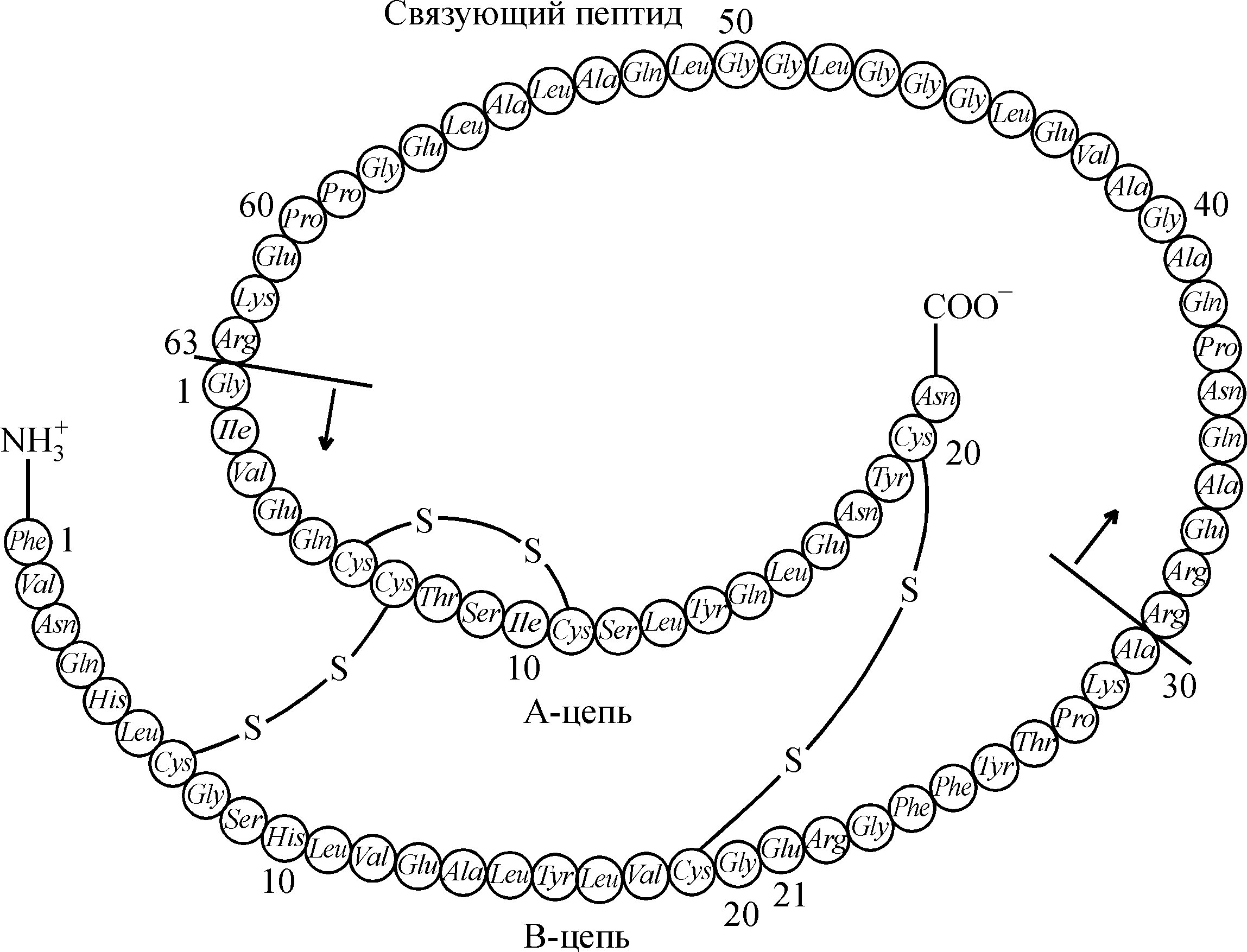 Структура молекулы проинсулина свиньи Синтез и секреция инсулина Главным сигналом для синтеза и секреции инсулина является повышение уровня глюкозы в крови. Секреция инсулина в ответ на повышение концентрации глюкозы (4–6 ммоль/л) носит двухфазный характер: в первые 2–5 мин после стимуляции отмечается резкое повышение секреции гормона, затем скорость секреции падает и наступает вторая более медленная фаза, при которой длительная стимуляция глюкозой приводит к постепенному увеличению уровня инсулина в крови. Это отражает наличие в -клетках двух пулов инсулина – легко и трудно мобилизуемого. Наряду с глюкозой в стимуляции секреции инсулина могут участвовать и образующиеся в -клетках промежуточные метаболиты ее окисления. Синтез и секреция инсулина, кроме того, стимулируется аминокислотами (особенно лейцином и аргинином), глюкагоном, соматотропином. Глюкагон повышает синтез и секрецию инсулина только в присутствии глюкозы через цАМФ-зависимый механизм. В то же время адреналин подавляет образование и секрецию гормона даже в присутствии глюкозы. Инсулин не имеет специфического белка-переносчика в плазме. Часть гормона связывается с глобулинами, и поэтому в крови он находится в двух формах – свободной и связанной. Период его полужизни составляет 3–5 минут. Действие инсулина Наиболее чувствительные к инсулину ткани – мышечная, соединительная ткань (в частности жировая ткань) и в меньшей степени печень. Нечувствительна к инсулину нервная ткань. Свободный инсулин влияет на метаболизм всех инсулинчувствительных тканей, а связанный – только на жировую ткань. Во многих тканях обнаружены мембранные рецепторы к инсулину, но их количество значительно увеличено в клетках инсулинчувствительных тканей. Все биологические эффекты инсулина можно объединить в 4 группы: 1) очень быстрые (секунды): гиперполяризация мембран некоторых клеток, изменения мембранного транспорта глюкозы, аминокислот, ионов; 2) быстрые (минуты): активация или торможение многих ферментов (путем их химической модификации); 3) медленные (от минут до часов): индукция или репрессия синтеза ферментов; 4) самые медленные (от часов до суток): репликация ДНК, пролиферация клеток. Инсулин влияет на множество процессов в клетках органов-мишеней (табл. 2), но наиболее важную роль он играет в регуляции углеводного обмена. Влияние гормона на метаболизм углеводовпроявляется прежде всего в снижении уровня глюкозы в крови. Инсулин – единственный гормон гипогликемического действия, в то время как адреналин, глюкагон, кортизол являются антагонистами инсулина в отношении их влияния на концентрацию глюкозы в крови. Этот эффект гормона реализуется как на мембранном уровне, так и путем усиления внутриклеточной утилизации глюкозы. Взаимодействие инсулина с рецепторами увеличивает проницаемость мембран мышечных и жировых клеток для глюкозы, которая проникает в клетки путем облегченной диффузии с помощью белков-переносчиков.. В результате происходит снижение уровня глюкозы в крови. Гормон стимулирует поглощение клетками аминокислот, К+, Ca2+, а также увеличивает проницаемость мембран для Na+; вызывает гиперполяризацию мембран чувствительных к инсулину клеток в результате активации Na+, K+-насоса, который повышает Na+/K+-градиент на мембране, облегчая вторичный активный транспорт аминокислот в клетки. Таблица 2 Основные метаболические эффекты инсулина
Инсулин повышает внутриклеточную утилизацию глюкозы различными путями. В норме примерно половина поглощенной глюкозы включается в путь Эмбдена-Мейергофа (гликолиз) и превращается в энергию, другая половина запасается в виде липидов и гликогена. Инсулин усиливает интенсивность гликолиза в печени и мышцах, повышая активность и количество молекул его ключевых ферментов – глюкокиназы (в мышцах гексокиназы), фосфофруктокиназы и пируваткиназы. При этом в печени подавляется активность фермента глюкозо-6-фосфатазы, в результате чего тормозится высвобождение глюкозы печенью, так как плазматическая мембрана непроницаема для глюкозо-6-фосфата. Влияние инсулина на внутриклеточную утилизацию глюкозы проявляется в стимуляции другого анаболического процесса – синтеза гликогена. Усиление гликогенеза в печени и мышцах обусловлено снижением уровня цАМФ в результате активации инсулином фосфодиэстеразы. Это приводит к повышению активности фосфатазы, которая дефосфорилирует гликогенсинтетазу, переводя ее в активную форму, и фосфорилазу, превращая ее в неактивную форму. Таким образом стимулируется синтез гликогена и тормозится его распад. Описанные выше эффекты инсулина относятся к быстрым, однако гормон может оказывать и продолжительное влияние на уровень глюкозы в крови путем ингибирования глюконеогенеза. Это осуществляется за счет репрессии синтеза ключевого фермента этого процесса – фосфоенолпируваткарбоксикиназы (ФЕПКК) на уровне транскрипции гена. На метаболизм липидов, как и на обмен гликогена, инсулин также оказывает анаболическое действие, которое (как указывалось выше) проявляется в усилении липогенеза в жировой ткани и печени и в подавлении липолиза. Такой эффект гормона – следствие инактивации липазы, вызванной снижением уровня цАМФ. В результате снижается содержание глицерина и жирных кислот в крови. Влияние инсулина на обмен белковхарактеризуется стимуляцией процесса их синтеза и замедлением распада белков. Этим обеспечивается положительный азотистый баланс, снижается концентрация аминокислот в крови и уменьшается их выведение с мочой. Известно, что инсулин влияет на количество и активность, по крайней мере, 50 белков в различных тканях. Индукция синтеза белка обусловлена повышением скорости синтеза мРНК, а также стимуляцией инициации синтеза полипептидных цепей. Инсулин оказывает стимулирующее влияние на рост и пролиферацию клеток, повышая синтез РНК и ДНК. Кроме того, он усиливает действие ряда ростовых факторов – эпидермального, тромбоцитарного, фактора роста фибробластов, соматомедина. Таким образом, в целом действие инсулина на обмен веществ можно охарактеризовать как анаболическое. Глюкагон. Синтез и секреция Глюкагон представляет собой одноцепочечный полипептид (М.м. 3485), содержащий 29 аминокислотных остатков. Гормон синтезируется в a-клетках поджелудочной железы в виде неактивного предшественника препроглюкагона, который после отщепления N-концевой сигнальной последовательности превращается в проглюкагон и затем после действия протеаз – в глюкагон. В плазме глюкагон находится в свободной форме, поэтому период его полужизни около 5 минут. Секреция глюкагона стимулируется аминокислотами, гастрином, катехоламинами и подавляется глюкозой, инсулином, жирными кислотами и Ca2+. Действие глюкагона Основным органом-мишенью для глюкагона является печень, однако к гормону чувствительна также жировая ткань и в меньшей степени мышцы. Эффекты глюкагона противоположны эффектам инсулина. В отличие от инсулина глюкагон стимулирует катаболические процессы в тканях-мишенях – гликогенолиз и липолиз, вызывая мобилизацию источников потенциальной энергии. Влияние глюкагона, как и других полипептидных гормонов, осуществляется через вторичные посредники, основным из которых является цАМФ. Гормон связывается со своими рецепторами на плазматической мембране клеток-мишеней и активирует аденилатциклазу. В результате повышается содержание внутриклеточного цАМФ, который усиливает распад гликогена, активируя фосфорилазу, и тормозит его синтез вследствие ингибирования гликогенсинтетазы. Глюкагон активирует гликогенолиз только в печени в отличие от адреналина, который стимулирует этот процесс и в мышцах и в печени. Повышенное содержание цАМФ индуцирует синтез ферментов глюконеогенеза в печени, усиливая превращение аминокислот в глюкозу. Таким образом, центральный эффект глюкагона – гипергликемия – обеспечивается двумя механизмами: быстрым – гликогенолизом и медленным – глюконеогенезом. Глюкагон оказывает мощное липолитическоедействие. Повышая содержание цАМФ в клетках жировой ткани, он активирует липазу, увеличивая в крови уровень жирных кислот и глицерина. Образующиеся жирные кислоты используются в качестве источника энергии, а также превращаются в кетоновые тела. В этом проявляется кетогенное действие гормона. В печени глюкагон угнетает синтез белков и облегчает их катаболизм. Образованные аминокислоты используются в глюконеогенезе и после дезаминирования – в синтезе мочевины. Соматостатин Соматостатин был первоначально выделен из гипоталамуса как фактор, ингибирующий секрецию соматотропина. Соматостатин – циклический пептид, который синтезируется в виде прогормона в d-клетках островков Лангерганса и затем превращается в активную молекулу, содержащую 14 аминокислотных остатков (М.м. 1640). Помимо гипоталамуса и поджелудочной железы соматостатин был обнаружен в слизистой желудка и кишечника, а также в различных участках ЦНС. Гормон подавляет секрецию инсулина, глюкагона и панкреатического полипептида. Кроме того, он тормозит секрецию гастрина, секретина, паратгормона, кальцитонина, иммуноглобулинов, ренина. Установлено, что соматостатин угнетает образование соляной кислоты в желудке, подавляет секрецию пищеварительных ферментов и всасывание глюкозы в кишечнике. Пептид обладает выраженным влиянием на ЦНС: введение его человеку вызывает седативный эффект. Клеточные механизмы многочисленных биологических эффектов соматостатина пока не выявлены. Однако их общей чертой является участие в них Ca2+. Предполагается, что торможение освобождения различных гормонов соматостатином связано с его блокирующим действием на вход Ca2+ в чувствительные к гормону клетки. Соматостатин, оказывая антигипергликемическое действие и снижая кетоз (путем торможения секреции глюкагона), может уменьшать потребность в инсулине при диабете. Панкреатический полипептид Панкреатический полипептид состоит из 36 аминокислотных остатков (М.м. 4200). Он синтезируется в F-клетках поджелудочной железы. Стимулирует секрецию полипептида богатая белками пища, голод, острая гипогликемия. Функция панкреатического полипептида окончательно не установлена. Известно, что он увеличивает секрецию желудочных и панкреатических ферментов, влияет на содержание гликогена в печени, расслабляет желчный пузырь. Нарушения гормональной функции поджелудочной железы Инсулиновая недостаточностьприводит к сахарному диабету – одному из самых распространенных заболеваний. При сахарном диабете наблюдаются глубокие нарушения обменных процессов, которые обусловлены истинной или ложной недостаточностью инсулина. Соответственно этому различают два типа сахарного диабета: диабет I типа, или инсулинзависимый, и диабет II типа, или инсулиннезависимый. При диабете I типа нарушается синтез и секреция инсулина, тогда как при диабете II типа концентрация инсулина в сыворотке крови остается на уровне нормы, однако имеются нарушения других звеньев инсулиновой регуляции. Сахарный диабет II типа может развиться вследствие снижения чувствительности тканей к инсулину, которое обусловлено уменьшением количества мембранных инсулиновых рецепторов либо их модификацией. Возможно развитие сахарного диабета вследствие изменения соотношения свободной и связанной форм инсулина плазмы крови в сторону связанной формы, когда глюкоза поступает только в жировую ткань и превращается в жир. Наконец, еще одной причиной может быть повышение активности инсулиназы. Во всех случаях при сахарном диабете изменения в метаболизме характеризуются значительным преобладанием катаболических процессов над анаболическими. При дефиците инсулина снижается утилизация глюкозы инсулинчувствительными тканями (мышечной и жировой), взамен которой в организме мобилизуются липиды и повышается окисление жирных кислот. В результате нарушений обмена веществ в тканях у больных наблюдается гипергликемия и глюкозурия (если концентрация глюкозы превышает почечный порог – 9,9 ммоль/л), возникает осмотический диурез, аминоацидемия и аминоацидурия, повышенное содержание жирных кислот, глицерина и холестерина в крови, а в тяжелых случаях – кетонемия и кетонурия. Для лечения больных инсулинзависимым диабетом используют различные препараты инсулина, а при инсулиннезависимом диабете используют пероральные сахароснижающие средства – производные сульфонилмочевины и бигуаниды. Избыток инсулинаможет наблюдаться при инсулиноме – опухоли островковых клеток: это приводит к гиперинсулинизму. При этом состоянии возникает гипогликемия, обусловленная не только увеличением потребления глюкозы тканями, чувствительными к инсулину, и уменьшением образования глюкозы в печени, но также снижением притока к печени субстратов для глюконеогенеза. Быстрое снижение уровня глюкозы в крови приводит к активации симпатической нервной системы и выделению адреналина. У человека наблюдается дрожь, беспокойство, слабость и чувство голода. Если гипогликемия оказывается продолжительной, то уменьшение поступления глюкозы в мозг приводит к различным неврологическим нарушениям. При частых и продолжительных состояниях гипогликемии могут наблюдаться выраженные нарушения психического или неврологического характера. Устранить гиперинсулинизм можно введением глюкозы и гормонов, вызывающих гипергликемию, например, глюкагона или адреналина. |
